蓝圆鲹蛋白酶解物的螯合矿物离子活性研究
杨伊然,胡 晓,杨贤庆,*,李来好,陈胜军,吴燕燕,林婉玲,黄 卉,马海霞
(1.中国水产科学研究院南海水产研究所,农业部水产品加工重点实验室,国家水产品加工技术研发中心,广东 广州 510300;2.大连海洋大学食品科学与工程学院,辽宁 大连 116023)
蓝圆鲹蛋白酶解物的螯合矿物离子活性研究
杨伊然1,2,胡 晓1,杨贤庆1,*,李来好1,陈胜军1,吴燕燕1,林婉玲1,黄 卉1,马海霞1
(1.中国水产科学研究院南海水产研究所,农业部水产品加工重点实验室,国家水产品加工技术研发中心,广东 广州 510300;2.大连海洋大学食品科学与工程学院,辽宁 大连 116023)
以蓝圆鲹为原料,采用胰蛋白酶、木瓜蛋白酶及碱性蛋白酶对其进行水解,研究酶解产物与钙、亚铁、锌离子的螯合活性。结果表明:蓝圆鲹经胰蛋白酶水解,水解度为23.14%时其产物具有较高螯合铁、锌离子的活性,其螯合率分别高达96.63%和94.28%;蓝圆鲹经木瓜蛋白酶水解,水解度为22.00%时,其产物具有较高螯合钙离子的活性,其螯合率高达96.78%;同时研究表明上述两种酶解物还具有较好的抗氧化活性,其1,1-二苯基-2-三硝基苯肼半抑制浓度值分别为3.74 mg/mL和3.64 mg/mL。此外,氨基酸分析表明蓝圆鲹高螯合矿物离子活性的酶解物中天冬氨酸、谷氨酸、赖氨酸含量较高。
蓝圆鲹;酶解物;螯合活性;矿物离子;抗氧化
蓝圆鲹(Decapterus maruadsi)为暖水性中上层鱼,主要分布在我国海南省东部近海岸、福建沿岸等地,产量大、分布广,是一种重要的经济鱼类。蓝圆鲹的蛋白含量在18%左右,但由于其出肉率低,直接食用价值不高,多用于生产饲料,其精深加工水平及高值化利用水平低,造成一定程度的资源浪费。
生物活性肽是对生物机体的生命活动有益或具有特定生理作用的肽类化合物,其对保健食品及生化药物的开发具有极其重要的作用[1],近些年受到研究学者们的广泛关注。酶解法水解食源性蛋白,是获得生物活性肽最高效的方法之一[2]。水产蛋白的肽链中大多含有以特定氨基酸序列通过肽键连接而成的肽段,该肽段经酶解释放后将具有一定的生物活性[1,3]。研究表明,具有矿物元素结合活性的肽,可以有效增强人体对矿物元素的吸收率[4],并可从多种食物蛋白水解物中获取此类多肽,这种新型的生物活性肽已得到国内外专家的广泛认可。
为提高蓝圆鲹精深加工和综合利用水平,本实验以蓝圆鲹鱼肉为原料,采用胰蛋白酶、木瓜蛋白酶、碱性蛋白酶水解制备蓝圆鲹蛋白酶解物,研究其与钙、亚铁、锌离子的螯合活性与抗氧化特性,以期为制备分离矿物离子结合肽的研究与开发提供参考。
1 材料与方法
1.1 材料与试剂
蓝圆鲹市售,去除头和内脏,清洗干净后绞成鱼糜,冷冻备用。
木瓜蛋白酶(6 000 U/mg)、胰蛋白酶(250 U/mg)、透析袋 齐云试剂公司;2.4 L碱性蛋白酶 丹麦诺维信公司;甲醛、三氯乙酸、硫酸亚铁、氯化锌、氯化钙广州化学试剂厂;三氯化铁、铁氰化钾 天津市福晨化学试剂厂。
1.2 仪器与设备
3K30台式高速冷冻离心机 德国Sigma公司;Alphal-4冷冻干燥机 德国Christ公司;Delta320精密pH计 瑞士梅特勒-托利多仪器有限公司;809Titrando自动电位滴定仪 瑞士Metrohm公司;KjeltecTM2300蛋白自动分析仪 丹麦Foss公司;MARS-5高压高通量微波消解系统 美国CEM公司;7900 ICP-MS电感耦合等离子体质谱 美国安捷伦公司;METER SUNRISE酶标仪 奥地利TECAN公司。
1.3 方法
1.3.1 酶解液的制备
参照王婷婷[5]的方法并加以修改。取一定质量鱼肉,按1∶2(m/V)料液比加水,按总加酶量0.3%(m/m),分别加入木瓜蛋白酶、胰蛋白酶、2.4 L碱性蛋白酶,在其各自最佳反应pH值和最适反应温度条件下对蓝圆鲹鱼糜进行酶解(表1)。酶解结束后,酶解液经高温灭酶15 min,4 ℃、10 000 r/min离心20 min、过滤,得到澄清酶解液。
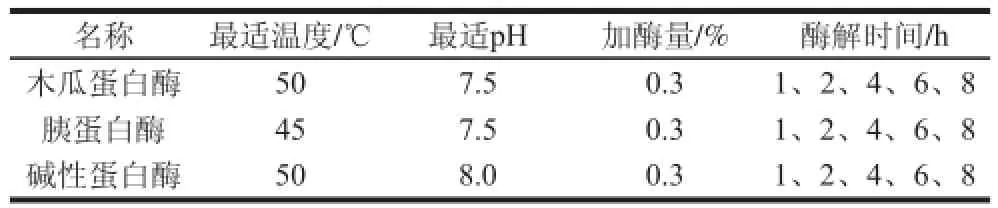
表1 酶解最适条件Table1 Optimal conditions for enzymatic hydrolysis
1.3.2 水解度的测定
氨态氮含量采用双指示剂甲醛滴定法[7]测定;总氮含量采用GB 5009.5—2010《食品中蛋白质的测定》。
蛋白质水解度(degree of hydrolysis,DH)如式(1)计算[6]。
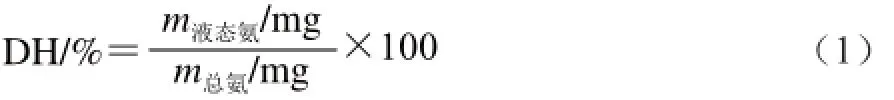
1.3.3 蛋白回收率的测定
酶解液中总氮含量及原料中总氮含量的测定:采用GB 5009.5—2010方法。蛋白回收率按式(2)计算。

式中:m1为酶解液中总氮质量/mg;m2为原料中总氮质量/mg。
1.3.4 酶解物螯合活性的测定
参考范鸿冰等[8]方法并加以修改,将酶解物分别与3 种矿物离子在中性条件下螯合1 h。螯合后将溶液移入透析袋透析(截留分子质量:100 D),透析24 h,共换超纯水6 次。透析结束后记录膨胀体积V,取5 mL透析后溶液于消化管内,加10 mL浓硝酸进行微波消解。将消解后溶液用超纯水定容至100 mL,采用电感耦合等离子体质谱(inductively coupled plasma mass spectrometry ,ICP-MS)检测出金属离子质量浓度ρ,并通过式(3)计算得出矿物离子与多肽的螯合率。
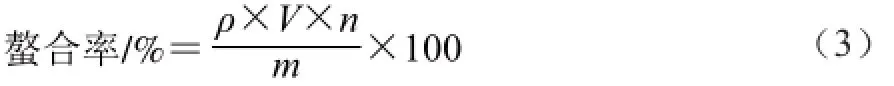
式中:ρ为检测出金属离子的质量浓度/(mg/L);V为膨胀后体积/mL;n表示稀释倍数:m为金属离子添加量/mg。
1.3.5 酶解物抗氧化活性鉴定
选择分别与钙、亚铁、锌3 种离子具有较高螯合活性的蓝圆鲹蛋白酶解物,测定其1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除率、总还原力。
1.3.5.1 DPPH自由基清除率的测定
采用Chen Huaming等[9]的方法略做修改。0.007 9 g DPPH溶于100 mL无水乙醇,取0.5 mL样品加0.5 mL无水乙醇作为空白记Aj,取0.5 mL无水乙醇加0.5 mL DPPH作为对照,记为A0,再取0.5 mL样品与0.5 mL DPPH溶液混合,记为Ai。摇匀,室温避光20 min,10 000 r/min离心10 min,在517 nm波长处测吸光度。按照公式(4)计算DPPH自由基清除率。
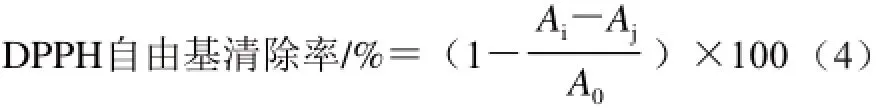
1.3.5.2 总还原力的测定
参照Ahmadi等[10]方法,略做改动,取1 mL样品加入1 mL 0.1 mol/L的磷酸盐缓冲液和1 mL质量浓度为1 g/100 mL铁氰化钾溶液,50 ℃水浴振荡20 min,再加入1 mL 10%(质量分数,下同)三氯乙酸,摇匀离心(10 000 r/min,10 min),取1 mL上清液,加入1 mL去离子水和0.2 mL 0.1%三氯化铁溶液,50 ℃水浴10 min,在700 nm波长处测其吸光度,吸光度越大证明还原力越强。
1.3.6 氨基酸分析
参考GB/T 5009.124—2003《食品中氨基酸的测定》。
2 结果与分析
2.1 酶解时间对蛋白水解度的影响
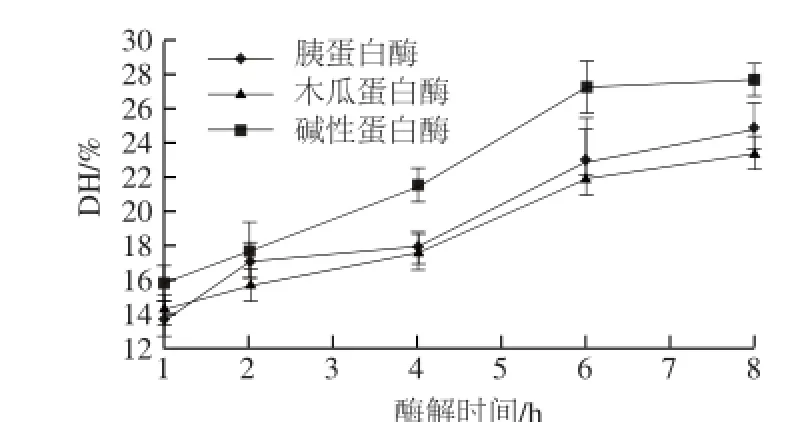
图1 不同酶解时间对蛋白水解度的影响Fig.1 Effect of hydrolysis time on hydrolysis degree
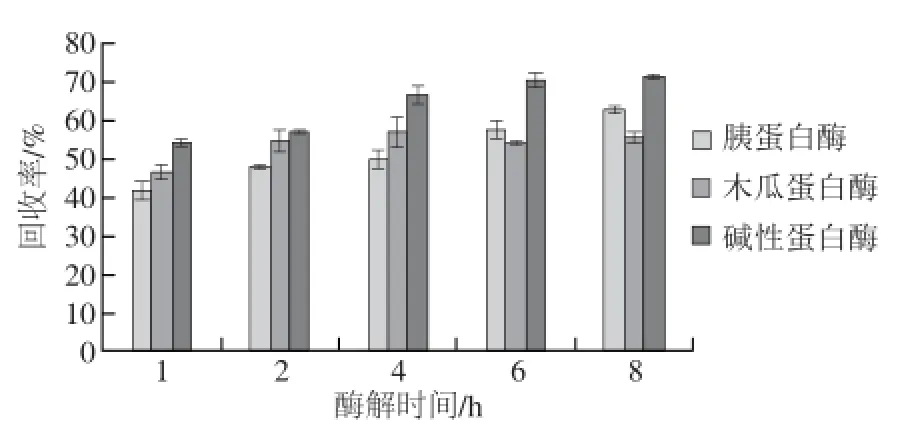
图2 不同酶解时间对蛋白回收率的影响Fig.2 Effect of hydrolysis time on protein recovery
用木瓜蛋白酶、胰蛋白酶、碱性蛋白酶3 种蛋白酶对蓝圆鲹鱼肉进行酶解,酶解时间为1、2、4、6、8 h,灭酶后进行蛋白水解度的测定。由图1可知,蓝圆鲹蛋白的水解度随酶解时间的延长逐渐增大,胰蛋白酶、木瓜蛋白酶、碱性蛋白酶酶解8 h后水解度分别为24.71%、23.50%、27.80%。前6 h之内,水解度增幅明显,在4~6 h之间,可能由于酶切位点较多,水解度的增幅较大,酶解6 h与8 h的水解度差异不明显。由图2可知,蛋白回收率也随酶解时间的延长逐渐增大,前6 h增长明显,之后增长缓慢。因此选择6 h为本实验最佳酶解时间。由图1、2结果可知,碱性蛋白酶水解能力大于胰蛋白酶和木瓜蛋白酶。故对蓝圆鲹鱼肉水解效果由大到小依次为碱性蛋白酶>胰蛋白酶>木瓜蛋白酶。
Nalinanon等[11]在鲣鱼胃蛋白酶水解的鱼肉的研究中,以2,2’-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐自由基(2,2’-azinobis-(3-ethylbenzthiazoline-6-sulphonate) free radical,ABTS+·)、DPPH自由基清除率、亚铁离子螯合率为抗氧化指标,发现抗氧化活性与水解度存在密切关系。在不同的水解度条件下,蛋白酶解物中的多肽对自由基的清除率存在差异。所以,对蛋白水解度的研究必不可少。
2.2 酶解时间对螯合率的影响
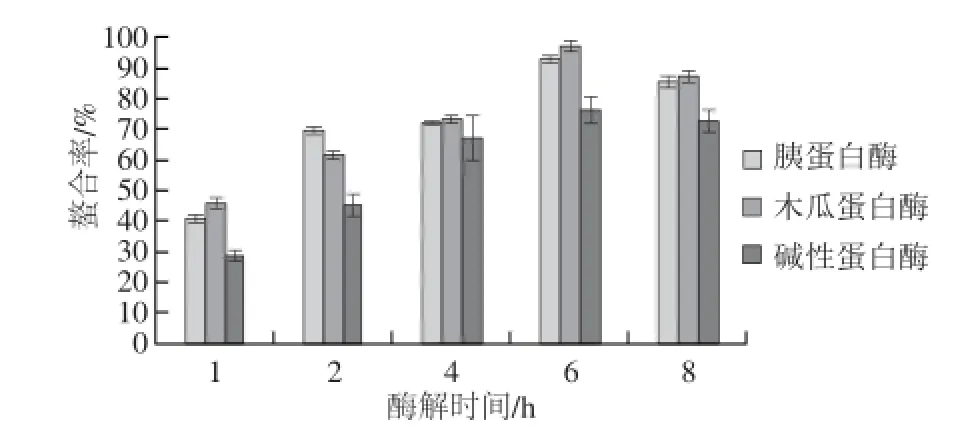
图3 钙离子螯合率的测定Fig.3 Calcium ion chelating rates of different enzymatic hydrolysates at different hydrolysis times

图4 亚铁离子螯合率的测定Fig.4 Ferrous ion chelating rates of different enzymatic hydrolysates at different hydrolysis times
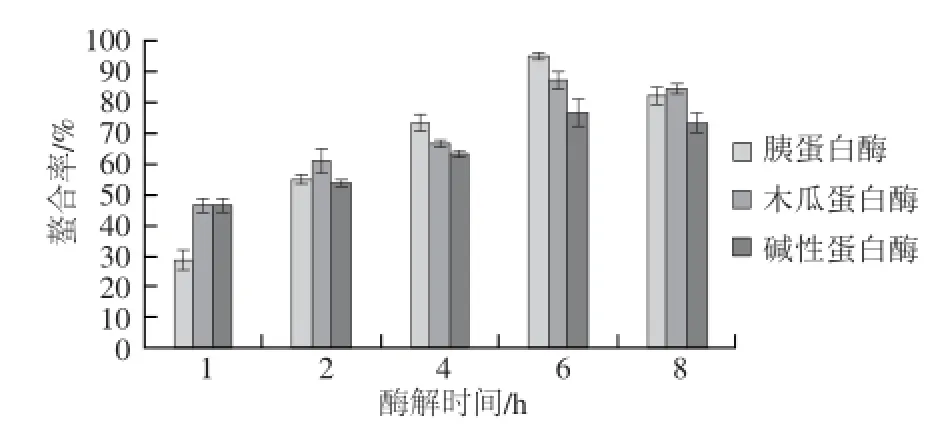
图5 锌离子螯合率的测定Fig.5 Zinc ion chelating rates of different enzymatic hydrolysates at different hydrolysis times
采用3 种酶水解蓝圆鲹蛋白,分别与钙、亚铁、锌3 种离子进行螯合反应,透析去掉未螯合的矿物离子,检测并计算3 种矿物离子与酶解物的螯合率。
由图3可知,当酶解时间达到6 h,木瓜蛋白酶解物与钙离子的螯合率达到最大值96.78%,略高于胰蛋白酶解物,但明显高于碱性蛋白酶解物。由图4、5可知,在胰蛋白酶水解6 h条件下,亚铁离子和锌离子与胰蛋白酶解物具有最大螯合率96.63%和94.28%。当酶解时间达到8 h,3 种金属离子的螯合率反而略有下降,原因可能是蓝圆鲹蛋白被水解为小肽或更小的氨基酸,降低了其螯合活性。
尽管多肽结构与金属元素螯合活性的关系尚未被完全确定,但肽的分子质量大小,氨基酸组成和种类确实影响多肽的金属螯合活性。研究显示,不同原料中肽的分子质量在一定范围内与金属离子的螯合活性存在关联,但不能简单确定分子质量大小与螯合活性的关系。Wang Chan等[12]从水解的芝麻蛋白中分离纯化出6 种锌离子结合肽,分子质量均小于500 D。Seth等[13]在铁螯合物不溶性鸡肌肉蛋白消化组氨酸残基作用的研究中发现,螯合物中只有10%的铁离子与小分子肽或氨基酸结合,多数铁离子结合的肽分子质量都大于10 kD。Torres-Fuentes等[14]在水解鹰嘴豆蛋白中多肽与铁螯合活性的研究中发现,含有组氨酸的肽段与铁离子具有螯合活性。Lee等[15]从猪血中分离出铁离子结合肽,主要由天冬氨酸、谷氨酸、赖氨酸组成。所以经过不同酶,不同水解时间处理后的蓝圆鲹蛋白多肽,具有不同的金属离子螯合率,主要原因是由于酶切位点不同,形成不同分子质量和氨基酸组成的肽链,以至于不同多肽与金属离子的配位键存在差异。王子怀等[16]综述了金属离子与肽的螯合反应机理,影响金属离子与肽螯合活性的因素包括:氨基、亚氨基、羧基,及某些特殊种类的氨基酸,除此之外,有些肽类对金属离子还具有吸附作用。
2.3 抗氧化活性

表2 DPPH自由基清除率、总还原力的测定Table2 DPPH radical scavenging activity and total reducing power
DPPH自由基是一种稳定的自由基,其乙醇溶液呈紫色,在517 nm波长处具有最大吸光度,当存在可供氢的抗氧化剂时,DPPH溶液颜色变浅吸光值变小[17]。由表2可知,3 种酶解物DPPH自由基半清除率(half maximal inhibitory concentration,IC50)值,木瓜蛋白酶、胰蛋白酶的清除能力大于碱性蛋白酶,而前两者相差较小。曹荣等[18]在刺参肠、性腺酶解多肽体外抗氧化作用研究中发现,刺参肠酶解多肽对DPPH自由基IC50为3.31 mg/mL。张风等[19]在虾头虾壳蛋白质酶解制备抗氧化肽的研究中,在最佳酶解工艺条下酶解液DPPH自由基清除率为96.58%,还原力为0.77,均与本实验得到结果相似。
胰蛋白酶解物与木瓜蛋白酶解物抗氧化能力与矿物离子螯合活性显著高于碱性蛋白酶,表明物离子螯合活性与其抗氧化特性存在关联,这与Carrasco-Castilla等[20]的研究结果一致。
蛋白酶解物的抗氧化活性与其氨基酸序列有关,而这取决于所用酶的种类[21]。由于蛋白酶的酶切位点不同,所以经不同蛋白酶处理后的蛋白可以获得不同氨基酸序列和长度的活性肽[22]。为研究氨基酸组成与蓝圆鲹酶解物金属螯合活性与抗氧化活性的关系,对鱼肉及胰蛋白酶解物进行氨基酸分析,结果如表3所示。

表3 蓝圆鲹酶解液与鱼肉中的氨基酸组成及含量Table3 Amino acid compositions ofDecapterus maru a dsi muscle aanndd its enzymatic hydrolysates %
研究表明,当多肽中天冬氨酸、谷氨酸、赖氨酸、组氨酸含量较高时,多肽与一些矿物离子表现出较强的螯合能力[23,27],由本实验中氨基酸分析的结果可以知,经胰蛋白酶和木瓜蛋白酶酶解的蓝圆鲹蛋白酶解物中,天冬氨酸、谷氨酸、赖氨酸在总氨基酸中所占比例较大。从氨基酸组成的角度来看,蓝圆鲹鱼肉适合作为制备矿物元素结合肽的原料。造成螯合活性和抗氧化活性差异的主要原因除氨基酸组成差异外,还包括多肽的分子质量和结构的不同,需要对酶解物进行分离纯化,进一步确定矿物元素结合肽的结构和分子质量大小。
有研究表明,肽的氨基酸序列与组成决定了其抗氧化活性,一级结构是构成活性肽抗氧化特性的因素之一。在肽链中氨基酸残基会参与抗氧化的反应,通常是因为它们与过渡金属元素螯合具有清除自由基的能力[28]。在半胱氨酸和蛋氨酸的残基中,亲核的含硫氨基酸侧链和色氨酸、苏氨酸、苯丙氨酸的芳香侧链可以很容易地提供氢原子,因此这些氨基酸残基被认为具有潜在的抗氧化活性,尽管它们在一定条件下也可能促进氧化反应的进行[29]。大多数分离得到的抗氧化肽的N末端含有疏水性氨基酸(如亮氨酸和缬氨酸),并且多肽序列中含有赖氨酸、天冬氨酸、组氨酸、脯氨酸、酪氨酸、色氨酸、甲硫氨酸和胱氨酸[30]。
3 结论与讨论
本实验以蓝圆鲹为原料,期望通过水解度对酶解物螯合活性影响的研究,为制备矿物离子结合活性肽提供参考。实验通过3 种蛋白酶对蓝圆鲹鱼肉进行酶解,在不同时间、水解度条件下研究酶解物的矿物离子结合活性。结果表明:酶解时间在6 h以内,3 种酶解物的矿物离子螯合活性随着水解度的增大而增大,当酶解时间达到8 h,3 种酶解物螯合活性略微下降。蓝圆鲹胰蛋白酶水物与亚铁、锌离子具有较高的螯合活性,螯合率高达96.63%、94.28%;木瓜蛋白酶解物与钙离子具有较高的螯合活性,螯合率为96.78%。
研究同时发现,蓝圆鲹酶解物的矿物元素螯合活性与抗氧化活性之间存在相关性,矿物离子螯合活性较高的胰蛋白酶解物与木瓜蛋白酶解物的抗氧化活性也高于碱性蛋白酶解物。对酶解产物的氨基酸分析表明:具有较高螯合活性和抗氧化活性的酶解物中几种特定的氨基酸含量占总氨基酸的比例较大。综合以上分析,在特定水解度条件下,经胰蛋白酶和木瓜蛋白酶酶解得到的蓝圆鲹酶解物可具备较好的矿物离子螯合能力与抗氧化能力。
[1] 胡晓, 孙恢礼, 李来好. 我国酶解法制备水产功能性肽的研究进展[J].食品工业科技, 2012, 33(24): 411-413.
[2] KHANTAPHANT S, BENJAKUL S. Comparative study on the proteases from fishpyloric caeca and the use for production of gelatin hydrolysate with antioxidative activity[J]. Comparative Biochemistry and Physiology, 2008, 151(4): 410-419. DOI:10.1016/ j.cbpb.2008.08.011.
[3] AHN C B, KIM J G, JE J Y. Purif i cation and antioxidant properties of octapeptide from salmon byproduct protein hydrolysate by gastrointestinal digestion[J]. Food Chemistry, 2014, 147: 78-83. DOI:10.1016.foodchem.2013.09.136
[4] COSENTINO S, GRAVAGHI C, DONETTI E, et al. Caseinphosphopeptide-induced calcium uptake in human intestinal cell lines HT-29 and Caco-2 is correlated to cellular differentiation[J]. Journal of Nutritional Biochemistry, 2010, 21(3): 247-254. DOI:10.1016/j. jnutbio.2008.12.016.
[5] 王婷婷. 蓝圆鲹蛋白酶解物的制备及其抗氧化活性研究[D]. 上海:上海海洋大学, 2015: 16-17.
[6] 朱俭. 生物化学实验[M]. 上海: 上海科学技术出版社, 1987: 100-159.
[7] 张意静. 食品分析技术[M]. 北京: 中国轻工业出版社, 2001: 186-194.
[8] 范鸿冰, 汪之颖, 刘鹏, 等. 鲢鱼骨胶原多肽螯合钙的制备研究[J]. 南方水产科学, 2014, 10(2): 72-71. DOI:10.3969/ j.issn.2095-0780.2014.02.011.
[9] CHEN H M, MURAMOTO K, YAMAUCHI F, et al. Antioxidative properties of histidine-containing peptides designed from peptide fragments found in the digest of a soybean protein[J]. Journal of Agricultural and Food Chemistry, 1998, 46(1): 49-53. DOI:10.1016/ j.jff.2013.12.024.
[10] AHMADI F, KADIVAR M, SHAHEDI M. Antioxidant activity of Kelussia odoratissima Mozaff. in model and food systems[J]. Food Chemistry, 2007, 105(1): 57-64. DOI:10.1016/ j.foodchem.2007.03.056.
[11] NALINANON S, BENJAKUL S, KISHIMURA H, et al. Functionalities and antioxidant properties of protein hydrolysates from the muscle of ornate threadf i n bream treated with pepsin from skipjack tuna[J]. Food Chemistry, 2011, 124(4): 1354-1362. DOI:10.1016/ j.foodchem.2010.07.089.
[12] WANG C, LI B, AO J. Separation and identif i cation of zinc-chelating peptides from sesame protein hydrolysate using IMAC-Zn2+and LCMS/MS[J]. Food Chemistry, 2012, 134(2): 1231-1238. DOI:10.1016/ j.foodchem.2012.02.204.
[13] SETH A, MAHONEY R R. Iron chelation by digests of insoluble chicken muscle protein: the role of histidine residues[J]. Journal of the Science of Food and Agriculture, 2001, 81(2): 183-187. DOI:10.1002/1097-0010(20010115)81:2<183::aid-jsfa799>3.0.co;2-1. [14] TORRES-FUENTES C, ALAIZ M, VIOQUE J. Iron-chelating activity of chickpea protein hydrolysate peptides[J]. Food Chemistry, 2012, 134(3): 1585-1588. DOI:10.1016/j.foodchem.2012.03.112.
[15] LEE S, SONG K. Purif i cation of an iron-binding nona-peptide from hydrolysates if porcine blood plasma protein[J]. Process Biochemistry, 2009, 44: 378-381. DOI:10.1016/j.procbio.2008.12.001.
[16] 王子怀, 胡晓, 李来好. 肽-金属离子螯合物的研究进展[J]. 食品工业科技, 2014, 35(8): 359-362. DOI:13386/j.issn1002-0306.2014.08.074.
[17] BAE S, SUH H. Antioxidant activities of five different mulberry cultivars in Korea[J]. LWT-Food Science and Technology, 2007, 40(6):955-962. DOI:10.1016/j.lwt.2006.06.007.
[18] 曹荣, 李冬燕, 刘淇, 等. 刺参肠、性腺酶解多肽体外抗氧化作用研究[J]. 南方水产科学, 2013, 9(6): 47-51. DOI:10.3969/ j.issn.2095-0780.2013.06.008.
[19] 张风, 夏旭, 周爱梅, 等. 头虾壳蛋白质酶解制备抗氧化肽的研究[J]. 南方水产科学, 2015, 11(6): 80-87. DOI:10.3969/ j.issn.2095-0780.2015.06.011.
[20] CARRASCO-CASTILLA J, HERNÁNDEZ-ÁLVAREZ A J, JIMÉNEZ-MARTÍNEZ C, et al. Antioxidant and metal chelating activities of peptide fractions from phaseolin and bean protein hydrolysates[J]. Food Chemistry, 2012, 135: 1789-1795. DOI:10.1016/ j.foodchem.2012.06.016.
[21] DONG S Y, ZENG M Y, WANG D F, et al. Antioxidant and biochemical properties of protein hydrolysates prepared from Silver carp (Hypophthalmichthys molitrix)[J]. Food Chemistry, 2008, 107(4):1485-1493. DOI:10.1016/j.foodchem.2007.10.011.
[22] KLOMPONG V, BENJAKUL S, KANTACHOTE D, et al. Antioxidative activity and functionalproperties of protein hydrolysate of yellow stripe trevally (Selaroides leptolepis) as inf l uenced by the degree of hydrolysis and enzyme type[J]. Food Chemistry, 2007, 102(4): 1317-1327. DOI:10.1111/j.1365-2621.2007.01555.x.
[23] GLAHN R P, van CAMPEN D R. Iron uptake is enhanced in Caco-2 cell monolayers by cysteine and reduced cysteinyl glycine[J]. The Journal of Nutrition, 1997, 127(4): 642-647.
[24] TORRES-FUENTES C, ALAIZ M, VIOQUE J. Aff i nity purif i cation and characterisation of chelating peptides from chickpea protein Hydrolysates[J]. Food Chemistry, 2011, 129(2): 485-490. DOI:10.1016/j.foodchem.2011.04.103.
[25] LEE S, SONG K. Isolation of a calcium-binding peptide from enzymatic hydrolysates of porcine blood plasma protein[J]. Journal of the Korean Society for Applied Biological Chemistry, 2009, 52(3):290-294. DOI:10.3839/jksabc.2009.051.
[26] de la HOZ L, PONEZI A N, MILANI R F, et al. Iron-binding properties of sugar cane yeast peptides[J]. Food Chemistry, 2014, 142:166-169. DOI:10.1016/j.foodchem.2013.06.133.
[27] XIA Y C, BAMDAD F, GANZLE M, et al. Fractionation and characterization of antioxidant peptides derived from barley glutelin by enzymatic hydrolysis[J]. Food Chemistry, 2012, 134(3): 1509-1518. DOI:10.1016/j.foodchem.2012.03.063.
[28] LAAKSO S. Inhibition of lipid peroxidation by casein. Evidence of molecular encapsulation of 4,4-pentadienefattyacids[J]. Biochimicaet Biophysica Acta, 1984, 792(1): 11-15. DOI:10.1016/0005-2760(84)90276-5.
[29] CHEN H M, MURAMOTO K, YAMAUCHI F, et al. Antioxidant activity of designed peptides based on the antioxidative peptide isolated from digests of a soybean protein[J]. Journal of Agricultural and Food Chemistry , 1996, 44(9): 2619-2623. DOI:10.1021/ jf950833m.
[30] KO J Y, LEE J H, SAMARAKOONK K, et al. Purification and determination of two novel antioxidant peptides from flounder fish (Paralichthys olivaceus) using digestive proteases[J]. Food Chemistry Toxicol, 2013, 52: 113-120. DOI:10.1016/j.fct.2012.10.058.
Mineral Ion Chelating Activity of Enzymatic Protein Hydrolysates from Decapterus maruadsi Muscle
YANG Yiran1,2, HU Xiao1, YANG Xianqing1,*, LI Laihao1, CHEN Shengjun1, WU Yanyan1, LIN Wanling1, HUANG Hui1, MA Haixia1
(1. Key Laboratory of Aquatic Producut Processing, Ministry of Agriculture, National R&D Center for Aquatic Product Processing, South China Sea Fisheries Research Institute, Chinese Academy of Fishery Sciencces, Guangzhou 510300, China; 2. College of Food Science and Engineering, Dalian Ocean University, Dalian 116023)
In this research, we studied the chelating activity of Decapterus maruadsi muscle hydrolyzed by three different proteases, trypsin, papain and alcalase, towards Ca2+, Fe2+and Zn2+. The results showed that the hydrolysates produced by trypsin (DH = 23.14%) had the highest chelating activity towards Fe2+and Zn2+with chelating rates of 96.63% and 94.28%, respectively. The hydrolysates by papain (DH = 22.0%) had the highest Ca2+chelating activity with a chelating rate of 96.78%. It was also shown that both enzymatic hydrolysates had good antioxidant activity. The half maximal inhibitory concentration (IC50) values of the trypsin and papain hydrolysates for 1,1-diphenyl-2-picrylhydrazyl (DPPH) radical scavenging activity were 3.74 and 3.64 mg/mL, respectively. In addition, the amino acid sequence analysis showed that the hydrolysates with higher contents of Glu, Asp and Lys had higher mineral ion chelating activity.
Decapterus maruadsi; hydrolysate; chelating activity; mineral ions; antioxidant
10.7506/spkx1002-6630-201703015
A
1002-6630(2017)03-0088-06
杨伊然, 胡晓, 杨贤庆, 等. 蓝圆鲹蛋白酶解物的螯合矿物离子活性研究[J]. 食品科学, 2017, 38(3): 88-93. DOI:10.7506/ spkx1002-6630-201703015. http://www.spkx.net.cn
YANG Yiran, HU Xiao, YANG Xianqing, et al. Mineral ion chelating activity of enzymatic protein hydrolysates from Decapterus maruadsi muscle[J]. Food Science, 2017, 38(3): 88-93. (in Chinese with English abstract)
10.7506/ spkx1002-6630-201703015. http://www.spkx.net.cn
2016-06-30
国家海洋公益性项目(201305018);国家自然科学基金青年科学基金项目(31301454);农业部财政重大专项(NFZX2013);广东省海洋渔业科技与产业发展专项(A201401C02;Z2015008);“十二五”国家科技支撑计划项目(2015BAD17B03-02)
杨伊然(1991—),女,硕士研究生,研究方向为食品加工与功能食品。E-mail:yanyiran123@126.com
*通信作者:杨贤庆(1963—),男,研究员,本科,研究方向为水产品加工与质量安全。E-mail:yxqgd@163.com

