广东省部分地区禽源和猪源沙门菌血清型与耐药性及Ⅰ类整合子分析
林嘉特,任行星,符 颖,王伟芳,詹泽强,张红霞,梁德媚,廖 明,张建民*
(1.华南农业大学兽医学院人兽共患病防控制剂国家地方联合工程实验室,广东省动物源性人兽共患病预防与控制重点实验室,广东广州 510642;2.广州市白云区江高镇畜牧兽医站,广东广州 510450)
广东省部分地区禽源和猪源沙门菌血清型与耐药性及Ⅰ类整合子分析
林嘉特1,任行星1,符 颖1,王伟芳2,詹泽强1,张红霞1,梁德媚1,廖 明1,张建民1*
(1.华南农业大学兽医学院人兽共患病防控制剂国家地方联合工程实验室,广东省动物源性人兽共患病预防与控制重点实验室,广东广州 510642;2.广州市白云区江高镇畜牧兽医站,广东广州 510450)
为了解广东省禽场和猪场沙门菌的血清型和耐药性情况,本研究2015年从广东省多个养殖场共采集样品126份,分离出沙门菌24株,分离率为19.04%。采用Kauffmann-White法、Kirby-Bauer法和PCR方法对分离株进行了血清型鉴定、药敏试验和Ⅰ类整合子检测。血清型鉴定结果显示,24株沙门菌共鉴定出4种血清型,分别是鼠伤寒沙门菌(14株)、印第安纳沙门菌(8株)、科瓦利斯沙门菌(1株)和阿尔巴尼沙门菌(1株)。药敏试验结果显示,分离株对四环素(83.33%)、氨苄西林(70.83%)、磺胺异恶唑(70.83%)、萘啶酸(66.67%)、复方新诺明(58.33%)、卡那霉素(54.17%)、阿米卡星(54.17%)、庆大霉素(50.00%)的耐药率较高,有54.17%(13/24)的菌株对8种及8种以上抗菌药物耐药。Ⅰ类整合子检测结果显示,Ⅰ类整合酶阳性率为29.17%(7/24),整合酶阳性菌株中仅有1株扩增到携带耐药基因aadA2的基因盒。上述结果表明,广东省禽场和猪场沙门菌分离率较高,耐药情况严重,菌株的耐药性与其血清型和Ⅰ类整合子的携带有一定的相关性。
沙门菌;血清型;耐药性;Ⅰ类整合子
沙门菌(Salmonella)是一种危害人和动物健康的重要致病菌,菌属的型别繁多,抗原复杂[1]。沙门菌对人类能产生多种危害,如伤寒、急性肠胃炎、败血症和菌血症等,最常见的是胃肠炎,其发病多呈急性经过,患者表现畏寒、发热,伴有恶心、呕吐、腹痛、腹泻、头晕、头痛,偶见脓血便等症状,严重者脱水及电解质紊乱。在畜禽养殖业中,沙门菌病是威胁养殖安全的重要传染病,可侵害幼、青年动物,使之发生败血症、胃肠炎及其他组织局部炎症,对怀孕母畜可致流产[2]。在食品安全方面,沙门菌经常是食物中毒事件的罪魁祸首,据统计,在我国致病菌引起的食物中毒70%~80%是由沙门菌引起的[3]。近年来,随着各种抗菌药物的滥用,沙门菌的耐药性不断增强,这不仅给养殖场带来沙门菌病暴发流行的隐患,还给公共卫生带来严重的威胁。本研究对从广东省养殖场采集的样本进行沙门菌的分离鉴定,并对分离株进行血清分型、药敏试验和整合子检测,为预防和控制沙门菌病提供数据支持和理论依据。
1 材料与方法
1.1 材料
1.1.1 动物样品 2015年从广东省内多个养殖场共采集动物样品(盲肠和肝脏)126份,其中67份来自鸡,18份来自猪,31份来自鸭,10份来自鹅。
1.1.2 主要试剂及血清等 缓冲蛋白胨水(BPW)、RV增菌液、TTB增菌液、XLD培养基、XLT4培养基、沙门菌显色培养基、TSI培养基、尿素琼脂、M-H琼脂等,青岛海博生物技术有限公司产品;沙门菌诊断血清,泰国S&A公司产品;药敏纸片,杭州微生物试剂有限公司产品。
1.2 方法
1.2.1 分离鉴定 无菌条件下取动物肝脏和盲肠于BPW增菌液中,37℃、100 r/min培养6 h后,分别取1 mL和10 mL BPW增菌液转入100 mL灭菌的RV增菌液和TTB 增菌液中,42℃恒温培养24 h,再分别取适量RV增菌液和TTB增菌液接种于XLD和XLT4培养基上,37℃恒温培养24 h ,挑取疑似沙门菌菌落接种于沙门菌显色培养基上进行纯化,取纯化后的沙门菌疑似菌落分别穿刺接种TSI和尿素琼脂(Urea)斜面,37℃培养过夜,培养结果H2S阳性,尿酶阴性者即被认定为沙门菌[4]。
1.2.2 血清分型 使用泰国S&A公司的沙门菌诊断血清对分离株进行血清分型,按照沙门菌血清诊断操作步骤进行,根据测定得到的抗原式,参照White- Kauffmann-Le Minor(WKLM)抗原表,检索沙门菌的血清型[5]。
1.2.3 药敏试验 选用15种常见的抗菌药物药敏纸片包括氨苄西林(10 μg/片)、奥格门汀(20 μg/片)、头孢西丁(30 μg/片)、头孢曲松(30 μg/片)、链霉素(10 μg/片)、庆大霉素(10 μg/片)、卡那霉素(30 μg/片)、阿米卡星(30 μg/片)、四环素(30 μg/片)、磺胺异恶唑(300 μg/片)、复方新诺明(磺胺甲恶唑23.75 μg/片+甲氧苄啶1.25 μg/片)、萘啶酸(30 μg/片)、环丙沙星(5 μg/片)、左氟沙星(5 μg/片)、加替沙星(5 μg/片)。按美国临床实验室标准化协会(CLSI)推荐的Kirby-Bauer法进行操作,质控菌株为大肠埃希菌ATCC25922,结果参照CLSI制定的药敏试验抑菌环执行标准判断[6-7]。
1.2.4 整合子检测 根据Ⅰ类整合子的整合酶基因(intI)序列设计引物,用PCR和凝胶电泳检测分离株的Ⅰ类整合子。对整合酶阳性的基因片段进行胶回收纯化,再进行测序,测序结果通过 Blastn检索GenBank数据库(www.ncbi.nlm.nih.gov),得到同源的信息 ,分析基因可能的功能。
2 结果
2.1 分离鉴定
本研究通过分离鉴定从126份样品中分离到24株沙门菌,分离率为19.04%,其中鸡源沙门菌16株,猪源沙门菌2株,鸭源沙门菌5株,鹅源沙门菌1株。
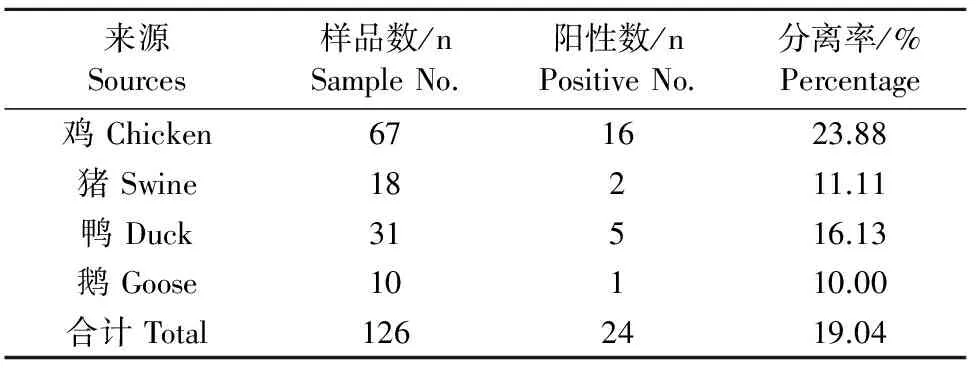
表1 126份样品中沙门菌分离鉴定结果
2.2 血清分型
血清分型结果见表2。结果显示,鼠伤寒沙门菌14株(58.33%),印第安纳沙门菌8株(33.33%),科瓦利斯沙门菌1株(4.17%),阿尔巴尼沙门菌1株(4.17%)。
2.3 药敏试验
药敏试验结果见表3。结果显示,24株沙门菌对15种抗菌药物的耐药率从高到低分别是四环素(83.33%)、氨苄西林(70.83%)、磺胺异恶唑(70.83%)、萘啶酸(66.67%)、复方新诺明(58.33%)、卡那霉素(54.17%)、阿米卡星(54.17%)、庆大霉素(50.00%)、奥格门汀(45.83%)、链霉素(29.17%)、环丙沙星(29.17%)、头孢曲松(20.83%)、左氟沙星(8.33%)、头孢西丁(0)和加替沙星(0)。
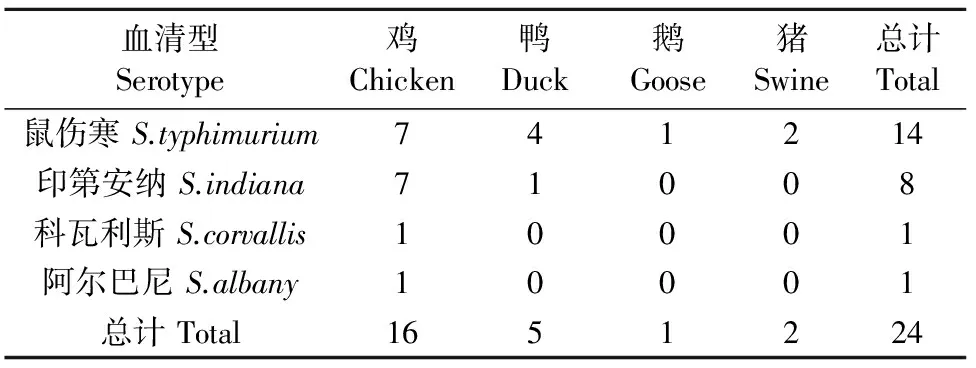
表2 24株沙门菌血清分型结果
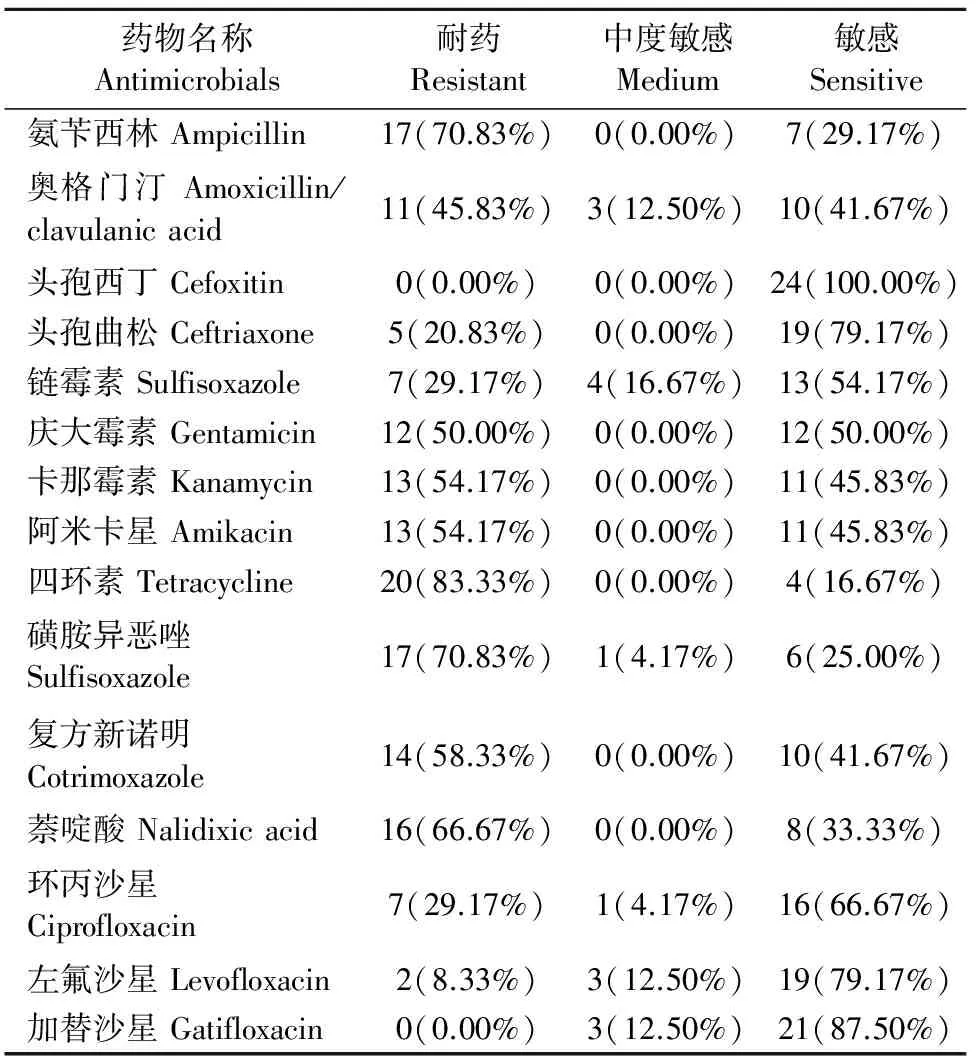
表3 24株沙门菌药敏试验结果
24株沙门菌中仅有1株对15种药物均表现敏感,绝大部分菌株表现出多重耐药,主要的耐药表型包括STR+TET+S3、AMP+AMC+GEN+KAN+AMI、AMP+GEN+KAN+AMI+TET+S3+SXT+NA等(表4)。同时耐8种及8种以上抗菌药物的沙门菌有13株,耐11种抗菌药物的沙门菌有2株。只耐1种抗菌药物的沙门菌有1株,分离自鸡,血清型为鼠伤寒。不耐药的沙门菌有1株,分离自鸡,血清型为科瓦利斯。
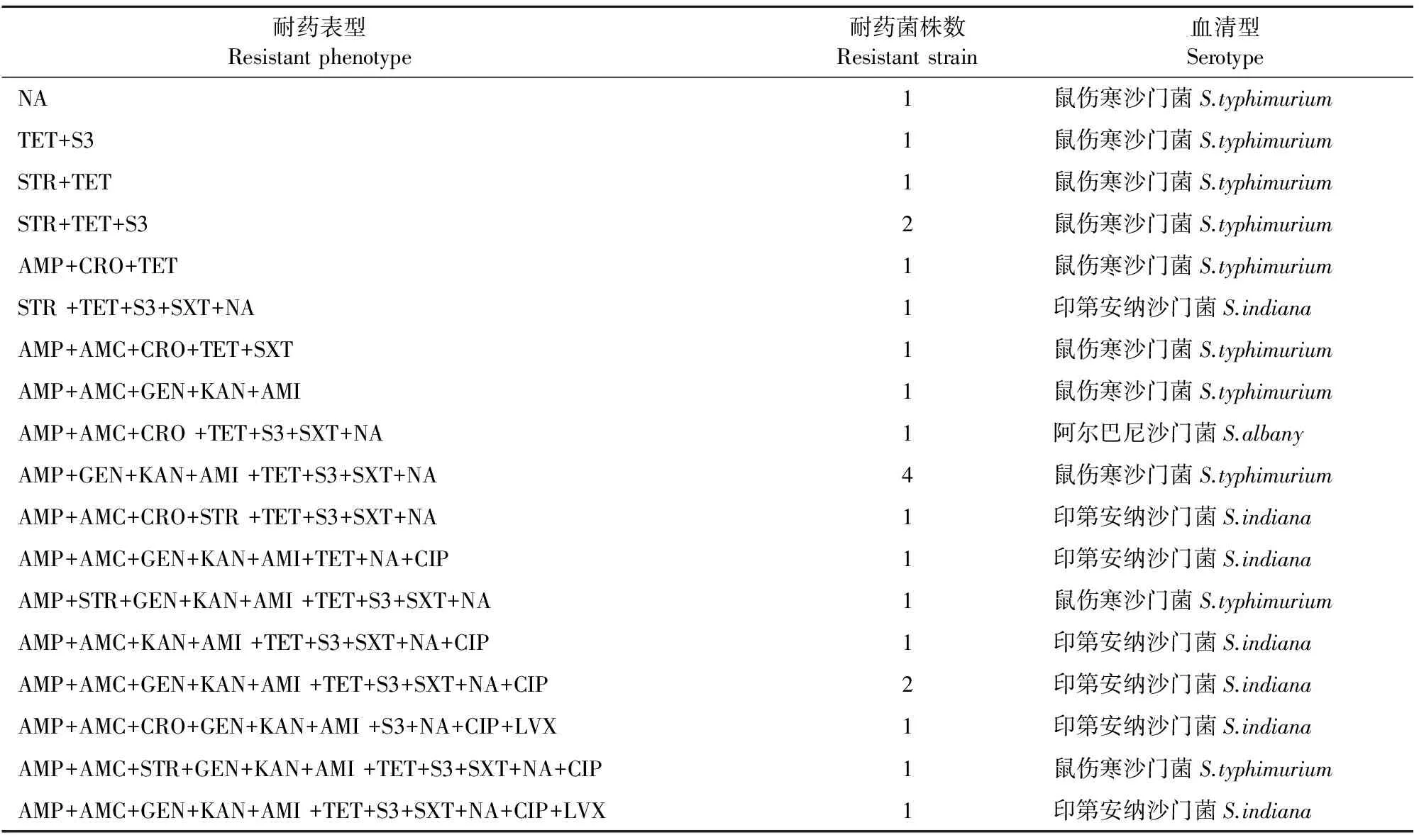
表4 24株沙门菌多重耐药情况
注:AMP.氨苄西林;AMC.奥格门汀;FOX.头孢西丁;CRO.头孢曲松;STR.链霉素;GEN.庆大霉素;KAN.卡那霉素;AMI.阿米卡星; TET.四环素;S3.磺胺异恶唑;SXT.复方新诺明;NA.萘啶酸;CIP.环丙沙星;LVX.左氟沙星;GAT.加替沙星。
Note:AMP.ampicillin;AMC.amoxicillin/clavulanic acid;FOX.cefoxitin;CRO.ceftriaxone;STR.sulfisoxazole;GEN.gentamicin ;KAN.kanamycin;AMI.amikacin; TET.tetracycline;S3.sulfisoxazole; SXT.cotrimoxazole; NA.nalidixic acid;CIP.ciprofloxacin;LVX.levofloxacin;GAT.gatifloxacin.
2.4 整合酶检测
24株沙门菌中有7株(29.17%)检测到Ⅰ类整合酶活性,但只有1株(4.17%)扩增到整合子基因盒,基因盒为aadA2(编码氨基糖苷类抗菌药物耐药相关的基因盒)。该菌株分离自鸡,血清型为鼠伤寒,耐药表型为AMP+STR+GEN+KAN+AMI+TET+S3+SXT+NA。
3 讨论
沙门菌是全球性的传染病病原菌,可感染多种动物,常常给畜禽生产带来严重的经济损失,人往往通过食物和饮水等途径感染,2000年以来,全球由沙门菌引起的食源性疾病呈现不断上升的趋势,且出现耐抗菌药物的DT104鼠伤寒沙门菌病的暴发,对于沙门菌造成的健康危害和经济损失,世界卫生组织和美国、丹麦等极为重视,相继建立沙门菌监测系统,开展了一系列相关的监测与研究工作,近年来,我国对沙门菌的监测和研究也日益重视。本研究通过对禽场和猪场沙门菌血清型、耐药性和Ⅰ类整合子的分析,为研究和防控沙门菌,保障畜禽生产和食品安全提供了部分参考依据。
本研究从126份样本中共分离到24株沙门菌,检出率为19.04%,其中鸡源沙门菌检出率最高,为23.88%,鹅源沙门菌检出率最低,为10.00%,平均检出率高于崔可琦等[8]的研究(7.00%),提示这些养殖场沙门菌感染率较高,存在沙门菌病暴发的风险,建议养殖场应该重视沙门菌病,做好防控,消灭养殖安全隐患。24株沙门菌中主要是鼠伤寒沙门菌(58.33%)和印第安纳沙门菌(33.33%)这2两种血清型,其分离率均明显高于杨保伟等[9]报道的陕西省鼠伤寒沙门菌(13.00%)和印第安纳沙门菌(12.00%)的分离率,说明在广东省这两种血清型比较流行。在危害性方面,鼠伤寒是沙门菌中最为普遍的血清型之一,能带来严重的食品安全问题,威胁人类健康,还能引起多种动物发病。目前美国发生食用鼠伤寒沙门菌污染花生酱的食源性暴发病例已有600多人,死亡病例9人[10]。印第安纳沙门菌是一种高致病的血清型,它的暴发能引起禽类的急性肠炎、下痢,最后导致死亡,给畜禽养殖业带来巨大经济损失[11]。在临床,鼠伤寒沙门菌和印第安纳沙门菌属于最容易引起人类患病的血清型[9]。可见,从流行性和危害性来看,这2种沙门菌都给广东省的养殖生产甚至公共卫生带来较大的安全隐患,应该引起养殖场及监控部门的注意。
本研究选择15种临床常用抗菌药物进行药敏试验,试验结果表明分离株对四环素(83.33%)、氨苄西林(70.83%)、磺胺异恶唑(70.83%)、萘啶酸(66.67%)等传统抗菌药物产生了相当高的耐药性,这与有关报导基本一致[12]。因为这些抗菌药物长期以来被广泛应用于我国的畜禽养殖中,抗菌药物的选择压力让细菌产生了相当高的耐药性。分离株对复方新诺明(58.33%)、卡那霉素(54.17%)、阿米卡星(54.17%)、庆大霉素(50.00%)、奥格门汀(45.83%)等的耐药性也较高,这可能与近年来养殖业中较多的使用有关,故建议养殖场应谨慎选用这些药物。分离株对左氟沙星(8.33%)的耐药性很低,对加替沙星和头孢西丁无耐药性,说明头孢类药物和第3、4代喹诺酮类抗菌药物是临床抗沙门菌感染首选治疗用药,这与现有的报导相一致[13],但是对左氟沙星和加替沙星均有12.50%的中度敏感率,说明沙门菌对这两种抗菌药物的耐药率可能有升高的趋势,应该引起重视,24株沙门菌都对头孢西丁敏感,因此推荐养殖场选用头孢西丁对抗沙门菌。本次药敏试验中,有95.83%(23/24)的菌株存在不同程度的耐药,有54.17%(13/24)的菌株对8种及8种以上抗菌药物耐药,有2株菌株的耐药种类甚至高达11种,而且出现对3代喹诺酮类耐药的情况,这意味着多种抗菌药物都不能对其生效,如果此类菌株在养殖场引起疾病流行,按照常规的抗菌药物治疗控制很可能不见效果,这将引起疾病的全面暴发流行,给养殖场带来巨大的经济损失,甚至导致地区的养殖业严重受挫。
根据血清分型和药敏试验结果,印第安纳沙门菌耐药相当严重,有87.5%(7/8)耐药种类在8种及8种以上,而且对萘啶酸(100%)、环丙沙星(75.00%)等喹诺酮类药物耐药性很高,24株分离株中对左氟沙星耐药的2株都是印第安纳沙门菌,这与现有的研究显示印第安纳沙门菌对喹诺酮类药物有高耐药性相符[10]。养殖场在使用喹诺酮类药物时应注意印第安纳沙门菌的免疫逃避。有3株鼠伤寒沙门菌的耐药谱与国际暴发流行的超级耐药鼠伤寒沙门菌DT104的耐药谱(氨苄青霉素+磺胺+链霉素+四环素+壮观霉素)相似,由于本研究没有使用壮观霉素,因此缺乏数据,其他4种(氨苄青霉素、磺胺、链霉素、四环素)都对菌株不起作用。
整合子是细菌产生耐药性的一种重要机制,能导致细菌耐药性的水平广泛传播[14]。整合子可以整合几乎所有抗菌药物如氨基糖苷类、β内酰胺类、磺胺类、甲氧苄啶、大环内酯类及利福平等的耐药基因[15]。在本研究中,采用PCR检测Ⅰ型整合酶活性,29.17%检测到整合酶活性,但只有1株(4.17%)扩增到整合子基因盒,携带的基因盒为aadA2,该菌株明显对氨基糖苷类抗菌药物(STR+GEN+KAN+AMI)耐药,对照其他菌株,发现不携带aadA2基因盒的菌株对氨基糖苷类抗菌药物(STR,GEN,KAN,AMI)存在不同程度的敏感性,提示其耐药表型与携带的耐药基因盒有关。这24株沙门菌来源可以追溯到广东省内多个养殖场,包括猪场、鸡场、鸭场和鹅场,耐药相当严重,整合子的存在可造成耐药性的水平传播,带来巨大隐患,虽然整合子检出率不高,但不应忽视。各养殖场应加强生物安全防控,同时注意合理使用抗菌药物,注意轮换用药、穿梭用药,政府应该对沙门菌做好风险评估工作,为地区的养殖安全保驾护航。
[1] 王 杰,陈颖钰,彭清洁,等.沙门菌检测方法研究进展[J].动物医学进展,2016,37(4):94-98.
[2] 陆承平.兽医微生物学[M].北京:中国农业出版社,2013:104.
[3] 刘鲜鲜,黄秀梅,周 波,等.猪肉产品中沙门菌的风险评估[J].动物医学进展,2015,36(8):97-100.
[4] 李静怡,崔可琦,冯赛祥,等.鸡白痢沙门菌的分离鉴定、耐药性及分子分型研究[J].动物医学进展,2014,35(2):29-33.
[5] 冯彩峰,林居纯,张 飞,等.食品动物源沙门氏菌血清型及对β-内酰胺类耐药性调查[J].食品科学,2015,36(7):101-104.
[6] 杨筱薇,旷 代,张建民,等.上海市禽源阿贡纳沙门氏菌耐药性及脉冲场凝胶电泳分型研究[J].中国畜牧兽医,2014,41(2):213-217.
[7] 唐 攀,崔恩慧,刘万华,等.鸡源沙门菌PFGE分型及耐药性研究[J].动物医学进展,2013,34(11):1-5.[8] 崔可琦,李静怡,冯赛祥,等.冰鲜鸡生产链中沙门氏菌的分离鉴定及PFGE分型研究[J].中国畜牧兽医,2014,41(12):62-66.
[9] 杨保伟,张秀丽,曲 东,等.2007-2008陕西部分零售畜禽肉沙门氏菌血清型和基因型[J].微生物学报,2010,50(5):654-660.[10] 许学斌,金汇明,肖文佳,等.上海市鼠伤寒沙门菌流行特征及分子分型研究[J].上海预防医学杂志,2010,22(2):57-62.
[11] 陆 彦,赵红玉,刘 宇,等.鸡源印第安纳沙门氏菌对喹诺酮类药物耐药性分析[J].中国人兽共患病学报,2013,29(6):605-608.
[12] 沈海燕,郭慧霞,许学斌,等.上海市零售禽肉制品和活禽中沙门氏菌血清型与耐药性研究[J].中国畜牧兽医,2014,41(11):263-266.
[13] 黄福标,卢冰霞,刘 磊,等.屠宰猪肠道沙门氏菌的分离鉴定、耐药性分析及致病性试验[J].疾病防治,2012,39(1):172-177.
[14] Yang Deng,Xuerui Bao,Lili Ji,et al.Resistance integrons:class 1,2 and 3 integrons[J].Annals Clini Microbiol Antimicrob,2015,14:45. doi: 10.1186/s12941-015-0100-6.
[15] 陆 彦,赵红玉,张中文,等.鸡源沙门氏菌多重耐药和Ⅰ型整合子的流行调查[J].中国农学通报,2013,29(32):39-43.
Analysis on Serotypes,Drug Resistance and ClassⅠ Integron ofSalmonellafrom Poultry and Swine Sources in Some Areas of Guangdong Province
LIN Jia-te1,REN Xing-xing1,FU Ying1,WANG Wei-fang2,ZHAN Ze-qiang1, ZHANG Hong-xia1,LIANG De-mei1,LIAO Ming1,ZHANG Jian-min1
(1.NationalandRegionalJointEngineeringLaboratoryforMedicamentofZoonosisPreventionandControl,KeyLaboratoryofZoonosisPreventionandControlofGuangdong,CollegeofVeterinaryMedcine,SouthChinaAgricultureUniversity,Guangzhou,Guangdong, 510642,China;2.AnimalHusbandryandVeterinaryStationofHighRiverTown,BaiyunDistrict,Guangzhou,Guangdong,510450,China)
In order to understand the serotypes,antimicrobial resistance and the prevalence of classⅠintegron ofSalmonellaisolates,126 animal samples were collected from poultry farms and pig farms in Guangdong province in 2015.Twenty-four (19.04%)Salmonellastrains were isolated from the samples.The Kauffmann-White method,the Kirby-Bauer test and PCR were used respectively for serotype identification,drug susceptibility test and classⅠintegron test.In result,serotype identification showed that 4Salmonellaserotypes were detected,includingS.typhimurium(14),S.indiana(8),S.corvallis(1),S.albany(1).Among 24Salmonellastrains,83.33%,70.83%,70.83%,66.67%,58.33%,58.33%,54.17%,54.17% and 50.00% were resistant to tetracycline,ampicillin,sulfisoxazole,nalidixic acid,cotrimoxazole,kanamycin,amikacin and gentamicin,respectively,and displayed different resistance rates to the rest drugs.54.17%(13/24) of the isolates resistant to eight or more antimicrobials.29.17%(7/24) of the isolates were positive for intI,and only one isolate carry resistance gene cassette(aadA2).These results indicated thatSalmonellahas a high isolation rate in farms of Guangdong and performs serious drug resistance which is related to the serotypes and classⅠintegron to a certain extent.
Salmonella; serotype; drug resistance; classⅠintegron
2016-06-29
公益性行业(农业)科研专项(201403054);广东省大学生科技创新培育专项(pdjh2016a0072);国家自然科学基金项目(31402193)
林嘉特(1993-),男,广东汕头人,学士,主要从事细菌传染病学研究。*通讯作者
S852.612
A
1007-5038(2017)02-0032-05