分别转染TBX18后乳鼠成纤维细胞对心肌细胞搏动频率的影响*
权大君,曹 政,李 奇,孔 彬,王光记
1武汉大学人民医院心内科,武汉大学心血管研究所,湖北省心血管重点实验室,武汉430060 2湖北省十堰市太和医院心内科,十堰442008
分别转染TBX18后乳鼠成纤维细胞对心肌细胞搏动频率的影响*
权大君1,曹 政2△,李 奇1,孔 彬1,王光记1
1武汉大学人民医院心内科,武汉大学心血管研究所,湖北省心血管重点实验室,武汉4300602湖北省十堰市太和医院心内科,十堰442008
目的 用TBX18分别转染成纤维细胞(CFs)与心肌细胞(NRVMs),探究转染的成纤维细胞对整个共培养系统的影响。方法 用TBX18分别转染乳鼠心脏CFs与NRVMs,并分成5组:NRVMs组,TBX18-NRVMs组,TBX18-NRVMs+CFs组,TBX18-NRVMs+GFP(绿色荧光蛋白)-CFs组与TBX18-NRVMs+TBX18-CFs组。培养7 d后观察并比较各组细胞的搏动频率。结果 共培养7 d后发现TBX18可显著提高心肌细胞的自发搏动[(94.20±7.38)b/minvs.(62.10±11.67)b/min,P<0.01],且相比TBX18-NRVMs组,GFP-CFs或CFs与TBX18-NRVMs共培养并没有明显改变搏动频率,但CFs具有减缓心肌自发搏动的趋势,经TBX18转染后的CFs与TBX18-NRVMs共培养可显著提高心肌细胞的搏动频率[(118.50±7.25)b/minvs.(82.80±15.82)b/min,P<0.01]。结论 在分别转染TBX18的成纤维细胞与心肌细胞共培养系统中,成纤维细胞可显著提高心肌细胞的搏动频率。
TBX18; 成纤维细胞; 乳鼠心肌细胞; 生物起搏
生物起搏作为未来电起搏器的替代疗法逐渐得到了人们的重视。Kapoor等[1]通过把转录因子TBX18转染到乳鼠心肌细胞(neonatal rat ventricular myocytes,NRVMs)中,成功使其重编程为类窦房结细胞并构建了稳定且高频率的自发搏动,从而为生物起搏的研究开辟了新的道路。但正常窦房结组织中除了起搏细胞外还有大量的心肌成纤维细胞(cardiac fibroblasts,CFs),起着电偶联与物质交换的作用[2]。当大部分研究者把重点放在如何改造心肌细胞从而提高其搏动频率时,成纤维细胞对心肌细胞的影响却不得而知。本实验将分别用TBX18转染CFs和NRVMs,探究转染的成纤维细胞对整个共培养系统的影响。
1 材料与方法
1.1 实验材料
实验动物:1~2 d的新生SD乳鼠,由武汉大学实验动物中心提供。试剂:DMEM/F12(1∶1)培养液(Gibco),胎牛血清(FBS,Gibco),胰蛋白酶(Sigma),Ⅱ型胶原酶(Sigma);载体pHBAd-MCMV-GFP(Hanbio),DH5α(Tiangen),质粒DNA抽提试剂盒(康为世纪),BamH Ⅰ(碧云天),NotⅠ(碧云天);心肌肌钙蛋白(cTn-I)羊抗兔一抗(Abcam),α-横纹肌肌动蛋白(α-SA)羊抗兔一抗(Abcam),肌球蛋白重链(MHC)小鼠单克隆抗体(武汉三鹰),波形蛋白(Vimentin)羊抗兔一抗(CST)。仪器:荧光显微镜(德国Leica公司,TCS SP2MP),PCR仪(杭州博日科技),电泳仪(北京市六一仪器厂),扫描仪(Canon)。
1.2 方法
1.2.1 乳鼠CFs与NRVMs的分离与培养 本实验每次取1~2 d的SD乳鼠5只,雌雄不限,共重复5次。固定后用75%乙醇消毒皮肤,开胸取心脏并去除心底部软组织与大血管,剪成1 mm×1 mm×1 mm小组织块,用0.125%胰酶消化,直至心肌组织完全消化为止,37℃、5%CO2环境中贴壁培养90 min,吸出尚未贴壁的细胞,即NRVMs,贴壁细胞即为CFs。NRVMs培养时加入含1%双抗与15%FBS的F12培养液,并在培养液中加0.1 mmol/L 5-溴脱氧尿嘧啶核苷(Brdu)以抑制CFs生长,培养CFs则用含10%FBS的F12培养液。将纯化后的NRVMs悬液(2.5×105/mL)接种于6孔板,每孔2 mL。待细胞长满皿壁后用0.25%胰酶消化传代,实验采用2~5代的CFs。
1.2.2 Western blot检测CFs与NRVMs中的特异性蛋白 TBS缓冲液润洗贴壁细胞2~3次,加入100 μL的总蛋白提取试剂(使用前数分钟内加入蛋白酶抑制剂)于培养板内裂解3~5 min。用细胞刮刀将细胞及试剂刮下,冰浴30 min。4℃下以12 000 r/min离心5 min,收集上清,即为总蛋白溶液。使用BCA蛋白质浓度测定试剂盒测定样品蛋白浓度。按照每泳道40 μg总蛋白进行12%聚丙烯酰胺凝胶(SDS-PAGE)电泳。一抗cTn-I、α-SA、MHC及Vimentin以1∶500稀释,GAPDH以1∶10 000稀释。二抗采用HRP-山羊抗鼠/ HRP-山羊抗兔以1∶10 000稀释。按照化学发光法在暗室中曝光,根据不同的光强度调整曝光条件显影和定影。各条带扫描后采用图像分析系统分析平均灰度值,各蛋白的表达以GAPDH校正计算相对表达量。
1.2.3 重组腺病毒载体的构建 pHBAd-MCMV-GFP载体用BamHⅠ和NotⅠ双酶切,载体酶切完成后回收胶;PCR扩增TBX18的开放阅读框,酶切完成后回收胶;将酶切后的片段和酶切后的载体(BamHⅠ和NotⅠ位点)连接,转化至感受态细胞DH5α;转化后的TBX18平板挑菌,菌液进行PCR鉴定,将阳性克隆菌测序;大量制备重组质粒,将重组腺病毒载体质粒TBX18过表达,用LipofiterTM转染试剂进行转染,转染至293细胞;每天观察细胞出毒迹象,当细胞变大变圆呈葡萄状,开始出现明显噬斑,并从底部脱落时进行收毒;将所收毒液在液氮及37℃水浴中反复冻融3次,3 000 r/min离心5 min,所收集的上清即为Ad-TBX18过表达第1代毒种,大量病毒扩增,最后获得的Ad-TBX18滴度为1×1010空斑形成单位(pfu)/mL,-80℃保存。
1.2.4 Ad-GFP-TBX18和Ad-GFP转染CFs与NRVMs 取第2~4代生长良好的CFs接种到6孔板,更换为无双抗、无血清的DMEM培养液,当细胞大约70%融合时分别以不同的感染复数(MOI)值(0、10、30、50、70、100)加入Ad-TBX18进行转染。荧光显微镜下观察转染率,选择转染率高且死细胞少的MOI值转染CFs,对照组加入对应量的Ad-GFP。NRVMs同样接种于6孔板,高糖培养液培养1 d,按照Kapoor等[1]的实验方法,以1pfu/细胞加入Ad-GFP-TBX18转染NRVMs,在培养箱培养2 h后,更换新鲜完全培养液,并继续培养2~5 d。
1.2.5 转染的CFs与NRVMs直接共培养 转染Ad-TBX18和Ad-GFP以及未转染的乳鼠CFs培养48 h后,用0.25%胰蛋白酶消化成细胞悬液。转染Ad-TBX18的NRVMs培养48 h后,加入细胞悬液直接共培养,转染的CFs与NRVMs的共培养比例控制在1∶5~1∶10。共培养细胞总共分成5组:NRVMs,TBX18-NRVMs,TBX18-NRVMs+CFs,TBX18-NRVMs+GFP-CFs,TBX18-NRVMs+TBX18-CFs组。每次取3处不同视野进行观察及记录搏动频率。
1.2.6 免疫荧光法检测观察转染和共培养后的CFs与NRVMs 培养皿中提前放入明胶覆盖的玻璃片,CFs与NRVMs分别接种在6孔板中,按上述方法转染后在第2天经免疫荧光法检测CFs中的TBX18-GFP和TBX18中的α-SA;共培养后第7天分别检测共培养系统中的细胞核、TBX18转染细胞和α-SA。细胞用40 g/L多聚甲醛固定,20 min后用PBS冲洗;之后用3 g/L聚乙二醇辛基苯基醚(Triton X-100)室温封闭,30 min后用PBS冲洗;200 μL FBS室温封闭1 h,滴加1∶500稀释200 μL α-SA一抗,室温孵育1.5 h后用PBS冲洗;然后加1∶100 TRITC标记的羊抗大鼠IgG二抗200 μL,室温避光孵育,1 h后用PBS冲洗;最后用DAPI染核,室温避光孵育5 min。抗荧光淬灭封片剂封片,荧光显微镜下观察并拍照。
1.2.7 显微镜观察共培养细胞形态和搏动频率 在倒置显微镜和荧光显微镜下观察共培养体系中转染TBX18的CFs与NRVMs细胞形态和搏动频率,共培养第7天每组3个培养单位,每个培养单位随机取5个视野,计数视野中搏动细胞的搏动频率,并用显微镜软件进行拍照。
1.3 数据分析与统计
用SPSS 20.0软件进行数据分析,所有计量资料都以均数±标准差表示,两组间均数比较用配对t检验,多组间均数比较用单因素方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1 鉴别乳鼠CFs与NRVMs
光学显微镜下差速贴壁后的乳鼠CFs呈梭形,培养2~3 d后增殖明显且有伪足样突起,70%的细胞呈融合状态,细胞排列紧密,无自发性搏动;NRVMs培养2~3 d后成簇状生长,增殖不明显,视野中多数细胞有自发搏动。培养2 d后用Western blot法分别检测CFs与NRVMs中的特异性蛋白(图1),CFs中Vimentin蛋白[(0.634±0.117)vs.(0.222±0.017),P<0.01]表达高,而NRVMs中α-SA[(0.497±0.043)vs.(0.250±0.02),P<0.01]、MHC[(0.621±0.079)vs.(0.247±0.026),P<0.01]与cTn-I[(0.692±0.125)vs.(0.103±0.008),P<0.01]蛋白表达高,说明成功分离出CFs与NRVMs。
2.2 观察转染后的乳鼠CFs与NRVMs
转染的CFs与NRVMs各自培养48 h后经免疫荧光染色,并在荧光显微镜下观察其形态变化和病毒转染情况。GFP-CFs与TBX18-CFs呈多边型或片状并有突触,70%细胞发生融合,无自发性搏动;TBX18-NRVMs呈梭形,体积较小,部分细胞发生自发搏动并成簇状生长。各组病毒转染率均达到70%并且转染细胞分布均匀。α-SA为心肌特异性蛋白,TBX18-NRVMs经α-SA蛋白染色后观察到NRVMs占总细胞90%以上,为接下来的共培养实验提供了条件(图2)。

①α-SA;②MHC;③cTn-I;④Vimentin;**P<0.01图1 α-SA、MHC、cTn-I与Vimentin在CFs与NRVMs中的表达情况Fig.1 The expression of α-SA,MHC,cTn-I and Vimentin in CFs and NRVMs

A:绿色荧光为GFP-CFs中的GFP;B:绿色荧光为TBX18-CFs中的TBX18;C:红色荧光为TBX18-NRVMs中的α-SA图2 荧光显微镜下观察转染后的乳鼠CFs与NRVMsFig.2 Observation of CFs and NRVMs of neonatal rats under fluorescence microscope
2.3 观察共培养系统中的乳鼠CFs与NRVMs
543 nm激发光波长下,细胞可见红色荧光;在488 nm激发光波长下,细胞可见绿色荧光。TBX18-NRVMs+TBX18-CFs组细胞共培养第7天后转染TBX18的CFs与转染TBX18的NRVMs形成合胞体,且进行同步搏动。培养到第7天荧光细胞明显减少,结合图3B与3C发现NRVMs中绿色荧光细胞主要集中在合胞体中。40倍光镜下单视野中绿色荧光合胞体数量在5个左右,分布比较分散。单个合胞体中心部α-SA红色荧光较强说明TBX18-NRVMs主要集中在中心,而外周红色荧光较弱说明CFs主要分布于外周(图3)。
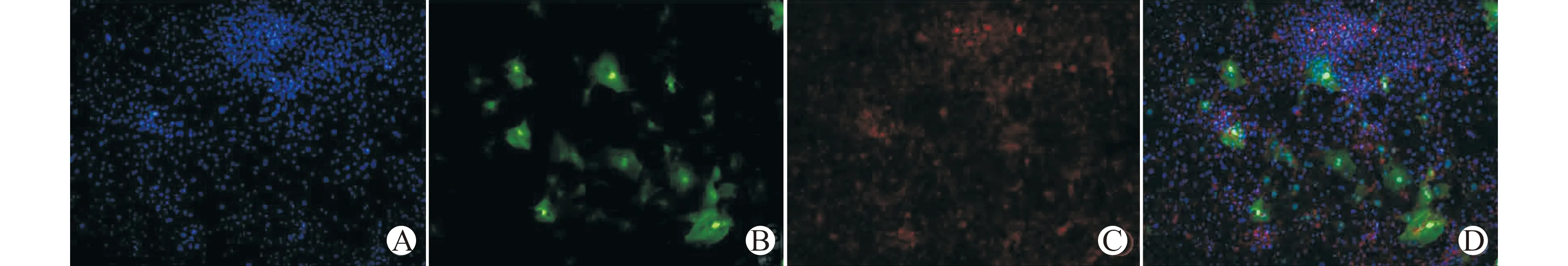
A:蓝色荧光为细胞核(DAPI);B:绿色荧光为合胞体(CFs+NRVMs);C:红色荧光(α-SA)为NRVMs;D:CFs与NRVMs的融合图图3 荧光显微镜下观察TBX18-CFs与TBX18-NRVMs的共培养Fig.3 Observation of co-culture of TBX18-CFs and TBX18-NRVMs under fluorescence microscope
2.4 观察共培养细胞的搏动频率
共培养第7天观察各组搏动频率(表1)。TBX18-NRVMs组的搏动频率明显快于NRVMs组[(94.20±7.38)b/minvs.(62.10±11.67)b/min,P<0.01](图4),说明TBX18可以显著提高心肌细胞的搏动;CFs与GFP-CFs共培养组之间搏动频率并无差异(P=0.71),说明单纯腺病毒转染CFs并不影响共培养系统中的频率变化;与未共培养组之间也无统计学差异(P=0.52),但与CFs共培养有降低搏动频率的趋势。TBX18-NRVMs与TBX18-CFs共培养时搏动频率(118.50±7.25)b/min,提高近40 b/min,且最高可达132 b/min,说明TBX18转染CFs可解除CFs对共培养系统的抑制作用并显著提高搏动频率。

表1 各组共培养细胞搏动频率的比较(b/min)Table 1 Comparison of beating frequency of co-cultured cells in each group(b/min)

①NRVMs;②TBX18-NRVMs;③TBX18-NRVMs+CFs;④TBX18-NRVMs+GFP-CFs;⑤TBX18-NRVMs+TBX18-CFs;**P<0.01图4 各组共培养细胞平均搏动频率的比较Fig.4 Comparison of mean beating frequency of co-cultured cells in each group
3 讨论
胚胎时期促进中胚层细胞表达起搏基因并抑制工作心肌基因的表达可诱导心脏窦房结的发育成熟。通过研究基因敲除小鼠初步确定Shox2、TBX18、TBX3与IsI1是窦房结发育及产生起搏功能的重要转录因子。而TBX18在心脏发育中对窦房结头部的发育至关重要,TBX18基因的缺失会导致窦房结发育不全并影响其功能[3]。传统的生物起搏研究,如基因治疗或细胞治疗虽然可以产生自发搏动,但不具有良好的可控性和传导性。最近有研究发现特定转录因子表达的提高可使心肌细胞转化成具有起搏特性的类窦房结细胞。研究表明TBX18转染NRVMs可转变成起搏样细胞,Cox43蛋白及内向整流钾通道蛋白表达的减低促使最大舒张电位升高到-47 mV,易于4相去极化。同时起搏细胞HCN4蛋白表达增高,自发搏动也明显加快[4],这与本实验的研究结果相似。起搏细胞还发生了其他特征的改变,如cAMP表达增加和局部钙释放事件的增多,这些都有利于搏动频率的提高。更有研究将TBX18直接注入心室肌,发现可以产生持续14 d左右的稳定异位搏动[5]。说明转录因子TBX18对生物起搏的研究具有重要的意义。
窦房结是心脏的自发起搏位点及节律的控制中枢。窦房结的功能取决于其复杂的结构,主要包含起搏细胞(P细胞)和大量连接组织(如胶原纤维和成纤维细胞)[6]。起搏细胞体积较小且成锥形样生长,而成纤维细胞成一簇一簇样分布并与P细胞比邻。成纤维细胞主要表达Cox40和Cox45两种缝隙连接蛋白,在缺乏P细胞的区域中主要表达Cox40,而在与P细胞混合的部位主要表达Cox45,窦房结外围的心房肌则主要表达Cox43[7]。窦房结中成纤维细胞与P细胞通过Cox45形成电偶联(如体外共培养时成纤维细胞两侧的肌细胞可同步收缩)并进行物质交换(染料耦合实验发现共培养系统中肌细胞可通过成纤维细胞把染料扩散到较远的肌细胞)。而这种偶联对心脏电生理有重要影响,如成纤维细胞可以稀释比邻肌细胞的电流;不管是短距离还是远距离,肌细胞都能跨成纤维细胞传导电脉冲[8];成纤维细胞表达的连接蛋白可成为治疗心律失常的新靶点[9];成纤维细胞可作为外周感受器为心脏负反馈压力和牵拉变化[10]。故成纤维细胞在窦房结中具有重要的作用及意义。
在心室中心肌之间和异种细胞间主要表达Cox43,成纤维细胞中主要表达Cox45,且异种细胞间也会少量表达Cox45[11]。心室中心肌细胞成砖块状叠加排列,成纤维细胞则镶嵌在心肌之间。而体外共培养成纤维细胞和心房细胞时发现,随着成纤维细胞密度的增高心肌细胞的搏动频率会相应下降,且心肌间的传导速率也会减慢[12]。研究发现这与两者间形成的Cox43和少量的Cox45有关。当抑制成纤维细胞中的Cox43时搏动频率和传导速率显著恢复[2]。当成纤维细胞与心肌细胞比邻时,因成纤维细胞静息电位较高,会诱导周边的心肌细胞去极化从而降低其兴奋性,且成纤维细胞的高电阻及低电容特性会使心肌的电脉冲只能缓慢地通过Cox45传到较远的细胞。如上所述,本实验中当成纤维细胞与转染的心肌细胞共培养时心肌搏动频率有所下降,而转染的成纤维细胞与心肌细胞共培养时心肌搏动有所恢复。这可能跟TBX18可以降低成纤维细胞与心肌细胞的缝隙连接有关,又因TBX18本身可以提高心肌搏动,TBX18也可以提高成纤维细胞的起搏电流从而辅助心肌细胞提高心率。
本实验并没有探究转染成纤维细胞明显提高共培养系统中转染心肌细胞搏动频率的机制,而TBX18对成纤维细胞的影响及其对心肌细胞的作用还需要进一步研究。
本研究发现:①TBX18可显著提高心肌细胞的自发搏动;②比起TBX18-NRVMs组,GFP-CFs或CFs与TBX18-NRVMs共培养并没有明显改变搏动频率,但CFs具有减缓心肌自发搏动的趋势;③经TBX18转染后的CFs与TBX18-NRVMs共培养可显著提高心肌细胞的搏动频率。
[1] Kapoor N,Liang W,Marban E,et al.Direct conversion of quiescent cardiomyocytes to pacemaker cells by expression of TBX18[J].Nat Biotechnol,2013,31(1):54-62.
[2] Fahrenbach J P,Mejia-Alvarez R,Banach K.The relevance of non-excitable cells for cardiac pacemaker function[J].J Physiol,2007,585(Pt 2):565-578.
[3] Wiese C,Grieskamp T,Airik R,et al.Formation of the sinus node head and differentiation of sinus node myocardium are independently regulated by TBX18 and TBX3[J].Circ Res,2009,104(3):388-397.
[4] Kapoor N,Liang W,Marban E,et al.Direct conversion of quiescent cardiomyocytes to pacemaker cells by expression of TBX18[J].Nat Biotechnol,2013,31(1):54-62.
[5] Hu Y F,Dawkins J F,Cho H C,et al.Biological pacemaker created by minimally invasive somatic reprogramming in pigs with complete heart block[J].Sci Transl Med,2014,6(245):245ra94.
[6] Inada S,Zhang H,Tellez J O,et al.Importance of gradients in membrane properties and electrical coupling in sinoatrial node pacing[J].PLoS One,2014,9(4):e94565.
[7] Mahoney V M,Mezzano V,Morley G E.A review of the literature on cardiac electrical activity between fibroblasts and myocytes[J].Prog Biophys Mol Biol,2016,120(1-3):128-133.
[8] Haraguchi Y,Shimizu T,Yamato M,et al.Electrical interaction between cardiomyocyte sheets separated by non-cardiomyocyte sheets in heterogeneous tissues[J].J Tissue Eng Regen Med,2010,4(4):291-299.
[9] Efimov I R,Fedorov V V,Joung B,et al.Mapping cardiac pacemaker circuits:methodological puzzles of the sinoatrial node optical mapping[J].Circ Res,2010,106(2):255-271.
[10] Abramochkin D V,Lozinsky I T,Kamkin A.Influence of mechanical stress on fibroblast-myocyte interactions in mammalian heart[J].J Mol Cell Cardiol,2014,70:27-36.
[11] Goldsmith E C,Hoffman A,Morales M O,et al.Organization of fibroblasts in the heart[J].Dev Dyn,2004,230(4):787-794.
[12] Rosker C,Salvarani N,Schmutz S,et al.Abolishing myofibroblast arrhythmogeneicity by pharmacological ablation of alpha-smooth muscle actin containing stress fibers[J].Circ Res,2011,109(10):1120-1131.
(2016-08-03 收稿)
Effect of Neonatal Rat Fibroblasts Transfected with TBX18 on Beating Frequency of Myocardial Cells Transfected with TBX18
Quan Dajun1,Cao Zheng2△,Li Qi1etal
1DepartmentofCardiology,RenminHospitalofWuhanUniversity,CardiovascularResearchInstitute,WuhanUniversity,HubeiKeyLaboratoryofCardiology,Wuhan430060,China2DepartmentofCardiology,TaiheHospitalofShiyanCity,Shiyan442008,China
Objective In this study,fibroblasts and cardiomyocytes were transfected with TBX18 respectively,and we want to explore the impact of transfected fibroblasts on the co-culture system.Methods Neonatal rat ventricular myocytes(NRVMs)and cardiac fibroblasts(CFs)were transfected with TBX18 respectively,and divided into 5 groups:NRVMs group,TBX18-NRVMs group,TBX18-NRVMs+CFs group,TBX18-NRVMs+GFP-CFs group and TBX18-NRVMs+TBX18-CFs group.All the cells were cultured for 7 days,and the beating frequency was compared.Results After a total of 7 days’ culture,we found TBX18 could significantly increase the beating frequency of NRVMs[(94.20±7.38)b/minvs.(62.10±11.67)b/min,P<0.01].Compared with TBX18-NRVMs group,co-cultivation of GFP-CFs or CFs with TBX18-NRVMs had no obvious effects on beating frequency,but CFs had a tendency to slow down the beating frequency.Co-cultivation of TBX18-CFs and TBX18-NRVMs could significantly improve the beating rate in the co-cultured system[(118.50±7.25)b/minvs.(82.80±15.82)b/min,P<0.01].Conclusion In the co-cultured system of fibroblasts and NRVMs transfected with TBX18,TBX18-CFs can significantly improve the beating frequency of NRVMs.
TBX18; fibroblasts; neonatal rat ventricular myocytes; biological pacemaker
*国家自然科学基金资助项目(No.81070142);湖北省科技支撑计划资助项目(No.2013BCB013)
权大君,男,1991年生,硕士研究生,E-mail:411108619@qq.com
△通讯作者,Corresponding author,E-mail:caozheng908@163.com
R541.7
10.3870/j.issn.1672-0741.2017.01.002

