薄芝糖肽联合胸腺法新对胃癌放化疗大鼠免疫功能的影响
韩忠学,巩静,胡永胜,孙小杰,刘静
(1.武警辽宁省总队医院临床实验室,辽宁 沈阳 110034;2.武警辽宁省总队医院普外科,辽宁 沈阳 110034;3.中国医科大学盛京医院中医科,辽宁 沈阳 110004)
薄芝糖肽联合胸腺法新对胃癌放化疗大鼠免疫功能的影响
韩忠学1,巩静1,胡永胜2,孙小杰3,刘静1
(1.武警辽宁省总队医院临床实验室,辽宁 沈阳 110034;2.武警辽宁省总队医院普外科,辽宁 沈阳 110034;3.中国医科大学盛京医院中医科,辽宁 沈阳 110004)
目的探讨薄芝糖肽联合胸腺法新对经放化疗的胃癌大鼠免疫功能的影响。方法选取104只成功造模的胃癌大鼠,应用随机数字表法分为对照组(50只)和观察组(54只),两组大鼠均进行放疗(10~12 Gy)、化疗(顺铂+5-氟尿嘧啶)并同时给予胸腺法新治疗,观察组大鼠在此基础上给予薄芝糖肽治疗,共治疗15 d。比较两组大鼠治疗前、后免疫功能的改变情况。结果两组大鼠治疗后血清CD3、CD4、自然杀伤细胞(NK)、IgG、IgM、IgA浓度与CD4/CD8较治疗前有所降低,CD8较治疗前有所升高,且观察组大鼠的血清CD3、CD4、CD4/CD8、IgG、IgM、IgA浓度明显高于对照组,CD8明显低于对照组,差异均有统计学意义(P<0.05);两组大鼠治疗后IL-2、IL-4浓度较治疗前有所降低,且观察组IL-2浓度明显高于对照组,差异均有统计学意义(P<0.05);两组大鼠治疗后IL-6、IL-12浓度较治疗前有所升高,且观察组IL-6浓度明显低于对照组,差异均有统计学意义(P<0.05)。结论行放化疗的胃癌大鼠给予薄芝糖肽联合胸腺法新治疗有助于改善大鼠的免疫功能,为临床实践提供一定理论基础。
大鼠;胃癌;薄芝糖肽;胸腺法新;放化疗;免疫功能
胃癌是发病率最高的消化系统恶性肿瘤。我国是胃癌高发国家,且发病率逐年提高,其主要原因是生活水平的提高导致饮食种类更加丰富。手术结合放化疗是目前最常用的治疗方案,其中手术为首选治疗方案,但是对于一些晚期失去手术机会的患者来说只能采取放化疗,但放化疗仅有40%~50%的临床疗效,放化疗的同时给患者带来了很多副反应,机体自身免疫反应亦遭受破坏[1-3]。薄芝糖肽是一种与灵芝多糖具有相似药理学作用的糖肽类物质,它是从灵芝属薄树芝中分离出来的,有一定的调节免疫力及其抗肿瘤活性,在肿瘤的辅助性治疗中广泛应用[4]。胸腺法新是一种免疫调节剂,能很好的增强机体免疫力,增加机体免疫力来发挥抗肿瘤活性[5]。本实验通过建立胃癌大鼠实验动物模型,给予相应的临床治疗,评估治疗前后的免疫学状态,能够给临床实践提供一定的指导意义。
1 材料与方法
1.1 材料
1.1.1 实验动物与胃癌细胞株的选择 挑选144只健康且性成熟的Wistar大鼠(中国医科大学实验动物中心提供,合格证号:LD20140032),周龄8~10周,体质量230~250 g(雄鼠)、210~230 g(雌鼠);人BGC823胃癌细胞株由上海市肿瘤研究所提供。造模前雌雄大鼠分开饲养,自由饮水取食,人工控温20℃~26℃,12 h光照,12 h黑暗,两组大鼠的周龄、雌雄比、体质量等方面差异无统计学意义(P>0.05),见表1。
表1 两组大鼠周龄、体质量、性别比较(±s)
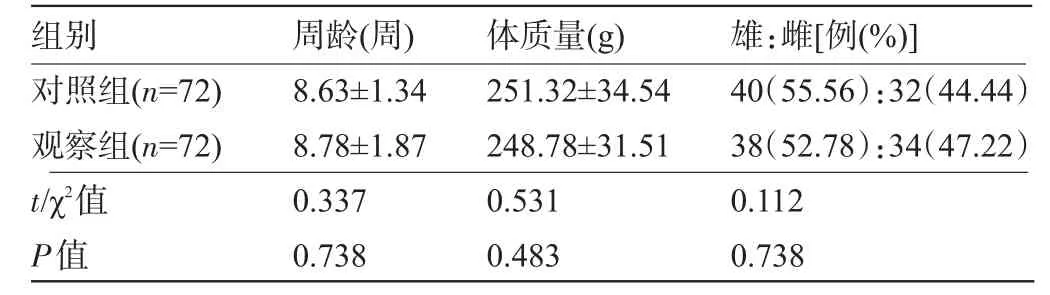
表1 两组大鼠周龄、体质量、性别比较(±s)
组别对照组(n=72)观察组(n=72)周龄(周) 8.63±1.34 8.78±1.87体质量(g) 251.32±34.54 248.78±31.51雄:雌[例(%)] 40(55.56):32(44.44)38(52.78):34(47.22)t/χ2值P值0.337 0.738 0.531 0.483 0.112 0.738
1.1.2 主要试剂 薄芝糖肽注射液由北京赛升药业提供;胸腺法新由成都地奥九泓制药有限公司提供(3.6 mg/支,白色粉末状);5-氟尿嘧啶(5-FU)与顺铂均为齐鲁制药有限公司提供;酶联免疫法检测试剂盒(IL-2、IL-4、IL-6、IL-12)由美国Sigma公司提供;淋巴细胞分离液(Ficoll-hypque)为美国Sigma公司提供;Ig-Grl-FITC/IgGr2a-PE、CD3-FITC/CD4-PE、CD3-FITC/ CD8-PE和FACS Lysing Solution溶血素为BD公司产品;IgG、IgM、IgA体液免疫指标检测采用美国BD公司提供的双色荧光试剂盒。
1.1.3 主要仪器 AxSYM型全自动免疫发光分度仪与FACSCalibur流式细胞仪均为美国雅培公司产品。
1.2 方法
1.2.1 动物造模方案[6]人BGC823胃癌细胞株传代培养后,制成活细胞悬液(细胞浓度为1.0×107/mL),在每只大鼠大腿内侧近腹股沟处皮下接种0.5 mL,制作胃癌大鼠动物模型,此模型经过大鼠临床表现、症状体征确定成功后才可以进行试验。
1.2.2 治疗方案 两组大鼠均给予连续放化疗15 d+胸腺法新注射液。放射剂量为10~12 Gy,进一步采取化疗方案(第1天腹腔注顺铂6 mg·kg-1·d-1,第10天注射5-氟尿嘧啶10 mg·kg-1·d-1,连续化疗15 d,同时每隔1 d给予腹腔注射胸腺法新0.5 mg·kg-1·d-1,观察组在此基础上每天给予腹腔注射薄芝糖肽注射液2 mL(含5 mg多糖、1 mg多肽)。胸腺法新、5-氟尿嘧啶、顺铂粉末均溶解于0.9%的生理盐水中(1 mg/mL)配成混悬液,用注射器腹腔注射液,现用现配。
1.2.3 免疫指标(细胞免疫、体液免疫、相关细胞因子)的测定 抽取静脉血3 mL,注入玻璃试管中,静置10 min,以3 000 r/min离心10 min,分离血清在-70℃超低温冰箱内保存待测,采用流式细胞仪细胞计数仪检测外周血T细胞亚群(CD3、CD4、CD8)水平,用淋巴细胞分离液密度梯度离心法分离外周血有核细胞,外周血中有核细胞染色标记30 min,弃去上清液,冲洗两次后上机检测。免疫散射比浊法检测免疫球蛋白(IgG、IgM、IgA);酶联免疫法测定血清中IL-2、IL-4、IL-6、IL-12(检测时按试剂盒说明进行),所取标本均在1周内测定,结果均用均数±标准差(±s)表示。
1.3 统计学方法 应用SPSS17.0统计软件进行数据分析,计量资料以均数±标准差(±s)表示,计量资料不同组间比较采用独立样本t检验,计量资料组内治疗前后比较采用配对样本t检验;计数资料组间比较采用χ2检验,以P<0.05为差异有统计学意义。
2 结果
2.1 大鼠造模情况 144只大鼠成功造模104只,其中雄鼠56只,雌鼠48只,40只造模失败,其中造模过程中死亡16只(40.00%)、造模后出现无法进食13只(32.50%)、造模未达到实验所需的胃癌模型11只(27.50%)。其中对照组造模成功50只、失败22只;观察组成功54只、失败18只,两组造模成功率无统计学差异(χ2=0.554,P=0.457>0.05)。治疗中共死亡16只(对照组8只,观察组8只),两组大鼠治疗过程中死亡率差异无统计学意义(χ2=0.028,P=0.867>0.05),完成实验的大鼠共88只(对照组42只,观察组46只)。
2.2 两组大鼠治疗前后细胞免疫功能、体液免疫功能和相关细胞因子比较 两组造模大鼠治疗前免疫功能(细胞免疫、体液免疫、相关细胞因子)差异无统计学意义(P>0.05)。两组大鼠治疗后血清自然杀伤细胞(NK)、CD4、CD3、IgA、IgG、IgM浓度及CD4/CD8跟治疗前相比有所降低(P<0.05),CD8比治疗前有所升高(P<0.05);治疗后观察组患者血清IgG、IgA、IgM、CD3、CD4/CD8、CD4浓度明显的高于对照组(P<0.05),观察组比对照组CD8低(P<0.05);两组大鼠治疗后IL-2、IL-4浓度较治疗前有所降低(P<0.05),且观察组IL-2浓度明显高于对照组(P<0.05);两组大鼠治疗后IL-6、IL-12浓度比治疗前升高(P<0.05),且观察组IL-6浓度明显低于对照组(P<0.05),见表2、表3。
表2 两组大鼠治疗前后细胞免疫功能和体液免疫功能比较(±s)

表2 两组大鼠治疗前后细胞免疫功能和体液免疫功能比较(±s)
注:治疗后与对照组比较,aP<0.05。
组别对照组(n=72)治疗前治疗后t值P值观察组(n=72)治疗前治疗后t值P值CD3(%)CD4(%)CD8(%)CD4/CD8NK IgG IgM IgA 72.64±8.54 62.47±8.37 -4.342<0.01 46.64±6.76 34.57±6.34 -3.447<0.01 31.65±5.43 35.67±6.47 2.436<0.01 1.47±0.21 0.97±0.15 -3.452<0.01 22.65±4.21 17.32±2.45 -3.326<0.01 14.76±3.56 10.32±2.12 -3.342<0.01 1.84±0.21 1.53±0.21 -2.437<0.01 2.64±0.36 2.12±0.37 -1.576<0.01 71.94±9.56 65.21±7.53a-5.763<0.01 45.92±7.45 39.41±7.34a-4.375<0.01 30.89±5.76 32.31±4.52a3.672<0.01 1.49±0.23 1.22±0.24a-2.324<0.01 21.97±3.53 18.73±3.32a-2.452<0.01 14.72±2.67 11.56±2.63a-1.325<0.01 1.85±0.24 1.64±0.23a-2.546<0.01 2.61±0.42 2.38±0.45a-0.324<0.01
表3 两组大鼠治疗前后免疫相关细胞因子水平比较(±s)
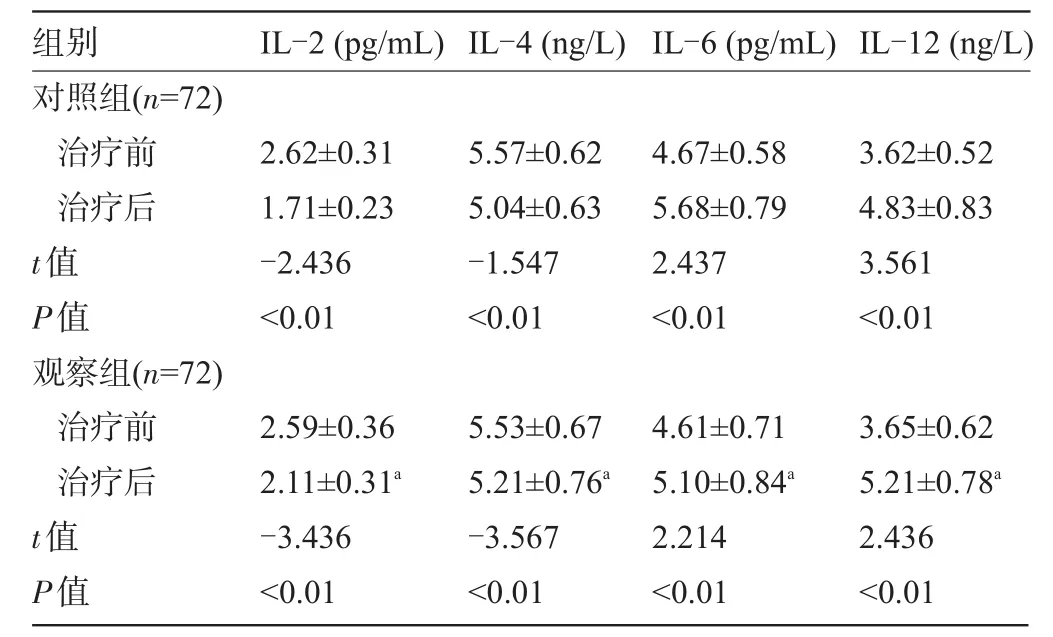
表3 两组大鼠治疗前后免疫相关细胞因子水平比较(±s)
注:治疗后免疫相关细胞因子水平明显低于治疗前,aP<0.05。
组别IL-2(pg/mL)IL-4(ng/L)IL-6(pg/mL)IL-12(ng/L对照组(n=72)治疗前治疗后t值P值观察组(n=72)治疗前治疗后t值P值) 2.62±0.31 1.71±0.23 -2.436<0.01 5.57±0.62 5.04±0.63 -1.547<0.01 4.67±0.58 5.68±0.79 2.437<0.01 3.62±0.52 4.83±0.83 3.561<0.01 3.65±0.62 5.21±0.78a2.436<0.01 2.59±0.36 2.11±0.31a-3.436<0.01 5.53±0.67 5.21±0.76a-3.567<0.01 4.61±0.71 5.10±0.84a2.214<0.01
3 讨 论
远端型为我国胃癌发病的主要类型,但近年来胃癌有逐渐向近端型发展的趋势。中低分化的腺癌为主要病理类型,分化程度、病理类型、发病部位均将影响患者的预后。生活水平的提高导致饮食类型的改变,这导致我国胃癌近年来的发病部位向近端型发展[7]。过去针对胃癌的治疗以手术结合放化疗为主。胃癌晚期患者失去了手术机会,便以放化疗为主,但放化疗有毒副反应大及患者副反应较多的缺点,很多患者因此不能坚持治疗。虽然肿瘤得到了很好的抑制,但是放化疗同时损伤机体自身免疫功能。肿瘤侵蚀压迫周围组织导致正常细胞新陈代谢与营养状态受到损伤,因此这些都大大降低了放化疗的临床疗效。往往在临床中需要配合使用一些辅助性的药物以增强并调节放化疗导致的免疫功能降低,此外也能更好地对微小病灶的肿瘤细胞实施有效的杀伤[8]。顺铂+5-氟尿嘧啶化疗是有着优良临床使用经验的化疗方案,但同时存在的副反应多(骨髓抑制、胃肠反应为主)及其患者耐受性差的缺点,大大降低了临床疗效[6]。薄芝糖肽是临床中使用较广泛的一种免疫调节剂,是肿瘤患者化疗辅助性用药,能通过抗自由基、保护免疫细胞膜、保护肝脏解毒功能来抗肿瘤。研究表明:薄芝糖肽在发挥抗肿瘤作用上主要是通过促进DC细胞的成熟与分化、增强对肿瘤细胞的识别性、直接抑制肿瘤细胞增殖来实现的,特别是在消化道恶性肿瘤的辅助性治疗中取得了很好的临床疗效[4]。胸腺法新又称胸腺肽α1(thymosin alpha-1),是由28个氨基酸组成的小分子多肽类免疫制剂,目前已经可以化学合成。主要通过促进T淋巴细胞在胸腺内的增生、分化与成熟来发挥其免疫作用的[9]。蔡鹏等[10]研究了胸腺法新应用于非小细胞肺癌化疗过程中对免疫功能的影响,实验设计为:经长春瑞滨+顺铂化疗方案的两组患者,其中试验组是在该化疗方案的基础上加用胸腺法新每次1.6 mg,2次/周。化疗结束后,试验组患者外周血清CD3、CD4、CD4/CD8和NK细胞水平均较高于对照组,CD8水平低于对照组,证实了该化疗药物的免疫调节作用,针对T淋巴细胞的免提调节性作用较强。
T淋巴细胞(亚群包括CD3、CD4、CD8等)参机体的细胞免疫应答反应。恶性肿瘤患者免疫功能严重受到抑制,免疫细胞浓度降低。流式细胞仪检查发现参与机体特异性免疫反应的T淋巴细胞亚群(CD3、CD4、CD8)数量均明显减少[11]。机体内的体液免疫主要载B淋巴细胞所分泌的抗体(IgG、IgM、IgA)来实现体液免疫反应应答,其抗体浓度高低直接反应其活力强弱,是机体内重要的免疫球蛋白[12]。两组大鼠治疗后血清CD3、CD4、自然杀伤细胞(NK)、IgG、IgM、IgA浓度与CD4/CD8较治疗前有所降低(P<0.05),CD8较治疗前有所升高(P<0.05);治疗后观察组患者血清CD3、CD4、CD4/CD8、IgG、IgM、IgA浓度明显高于对照组(P<0.05),观察组CD8较对照组低(P<0.05);两组大鼠治疗后IL-2、IL-4浓度较治疗前有所降低(P<0.05),且观察组IL-2浓度明显高于对照组(P<0.05);两组大鼠治疗后IL-6、IL-12浓度较治疗前有所升高(P<0.05),且观察组IL-6浓度标明显低于对照组(P<0.05),其中细胞免疫学变化情况与蔡鹏等[10]研究肺癌结果相同。
本研究通过大鼠胃癌动物模型的建立来证实胃癌放化疗过程中免疫制剂辅助治疗的重要性,采用薄芝糖肽与胸腺法新两种免疫调节剂来改善免疫功能,很好的指导临床实践。免疫功能与营养状态是相辅相成、互相影响的,今后我们还将从胃癌大鼠的营养状态的改变去深入研究。
[1]谢晶日,王宏宇.欣胃颗粒治疗胃癌前病变45例临床观察[J].中医药学报,2013,41(3):148-149.
[2]庄庆昕,徐建明,林莉,等.636例胃癌患者临床治疗现状分析[J].中华肿瘤杂志,2012,34(4):316-320.
[3]谢晶日,孙芳,梁国英.中医药治疗胃癌前病变的实验研究进展[J].中医药信息,2013,3(1):121-123.
[4]张颖,于莉,杨玲,等.薄芝糖肽降低消化道肿瘤辅助化疗不良反应的疗效评价[J].实用药物与临床,2013,16(3):213-215.
[5]司继刚,曹原,赵群.胸腺法新的临床应用进展[J].中国药房,2015, 26(3):3304-3306.
[6]袁慕荣,王汝上,蔡丽云,等.参芪十一味颗粒对胃癌放化疗大鼠免疫功能及不良反应的影响[J].今日药学,2014,24(7):484-488.
[7]吴晓松,陈凛.胃癌术后复发治疗新进展[J].解放军医学院学报, 2013,22(2):189-191.
[8]覃红斌,张洁,张京伟.复方苦参注射液联合FOLFOX4化疗方案治疗晚期胃癌的作用[J].武汉大学学报(医学版),2012,32(2): 215-218.
[9]Serafino A,Pica F,Andreola F,et al.Thymosinα1 activates complement receptor-mediated phagocytosis in human monocyte-derived macrophages[J].J Innate Immun,2014,6(1):72-78.
[10]蔡鹏,陈桂明,杨先国,等.胸腺肽α1对非小细胞肺癌化疗患者免疫功能的影响[J].中国肿瘤临床与康复,2014,21(3):261-264.
[11]Jemal A,Bray F,Center MM,et al.Global cancer statistics[J].CA Cancer J Clin,2011,62(2):69-90.
[12]李晓辉,李军民,冯秋霞,等.围手术期肠内营养支持对食管癌患者术后免疫功能的影响[J].中国医学创新,2011,8(8):57-59.
Effects of ganoderma's glycopeptide combined with thymalfasin on immune function in rats with gastric cancer treated by chemoradiotherapy.
HAN Zhong-xue1,GONG Jing1,HU Yong-sheng2,SUN Xiao-jie3,LIU Jing1. 1.Department of Clinical Laboratory,Liaoning Provincial Corps Hospital of Chinese People's Armed Police Forces,Shenyang 110034,Liaoning,CHINA;2.Department of General Surgery,Liaoning Provincial Corps Hospital of Chinese People's Armed Police Forces,Shenyang 110034,Liaoning,CHINA;3.Department of Traditional Chinese Medicine,Shengjing Hospital of China Medical University,Shenyang 110004,Liaoning,CHINA
ObjectiveTo study the effects of ganoderma′s glycopeptide combined with thymalfasin on immune function in rats with gastric cancer treated by chemoradiotherapy.MethodsA total of 104 gastric cancer rat models were successfully established and divided into two groups using random number table:observation group(n=50), control group(n=54).The rats were all treated by radiotherapy(10~12 Gy),chemotherapy(cisplatin+5-fluorouracil),and thymalfasin,and the rats in the observation group were additionally given ganoderma′s glycopeptide.The course of treatment was 15 days.The indexes of immune function in the two groups of rats were compared before and after treatment.ResultsThe levels of CD3,CD4,natural killer(NK)cell,IgG,IgM,IgA,IL-2,IL-4,and CD4/CD8 after treatment were lower than those before treatment(P<0.05),and the levels of CD8 and IL-6,IL-12 were higher than that before treatment(P<0.05).After treatment,the levels of CD3,CD4,CD4/CD8,IgG,IgM,IgA,IL-2 in the observation group were higher than those in the control group(P<0.05),and the levels of CD8 and IL-6 were lower than those in the control group(P<0.05).ConclusionGanoderma′s glycopeptide combined with thymalfasin can improve the immune function in rats with gastric cancer treated by chemoradiotherapy,and provide certain theoretical basis for clinical practice.
Rat;Gastric cancer;Ganoderma′s glycopeptide;Thymalfasin;Chemoradiotherapy;Immune function
R-332
A
1003—6350(2017)01—0017—03
2016-05-26)
刘静。E-mail:jiayy813@126.com
10.3969/j.issn.1003-6350.2017.01.005

