血红素加氧酶-1对哮喘小鼠Treg细胞和Th17细胞平衡的影响
杨欣,张庆,张艳萍,魏晓晔,姬亚梅
(1.榆林市儿童医院儿科,陕西 榆林 719000;2.榆林市星元医院儿科,陕西 榆林 719000)
血红素加氧酶-1对哮喘小鼠Treg细胞和Th17细胞平衡的影响
杨欣1,张庆2,张艳萍2,魏晓晔2,姬亚梅2
(1.榆林市儿童医院儿科,陕西 榆林 719000;2.榆林市星元医院儿科,陕西 榆林 719000)
目的探讨血红素加氧酶-1(HO-1)对哮喘小鼠Treg细胞和Th17细胞平衡的影响,阐述HO-1的免疫调节作用。方法60只雌性BALB/c小鼠按数字表法随机分为正常组、哮喘组、高铁氯化血红素(Hemin)组、锡-原卟啉(SnPP)组、Hemin+siRNA scramble组和Hemin+siRNA HO-1组,每组10只。通过注射和雾化吸入鸡卵蛋白(OVA)制备哮喘模型,正常组以生理盐水代替致敏液。Hemin组和SnPP组分别腹腔注射Hemin或SnPP 75 μmol/kg,Hemin+ siRNA scramble组和Hemin+siRNA HO-1组分别在腹腔注射Hemin前转染pSicoR-GFP-siRNA scramble或pSicoR-GFP-siRNA HO-1。末次激发后24 h内,Western blot和比色法分别检测各组小鼠肺部组织中HO-1蛋白表达和HO-1活性;HE染色观察肺部组织病理变化;流式细胞术检测外周血中Treg细胞、Th17细胞占CD4+T细胞的百分比,ELISA法检测血清和支气管肺泡灌洗液(BALF)中IL-10、IL-17的水平。结果与正常组相比,哮喘组小鼠肺部HO-1表达和活性有所增加,炎性反应明显,Treg/CD4+T细胞的百分比和IL-10水平显著降低,Th17/CD4+T细胞的百分比和IL-17水平显著升高,差异具有统计学意义(P<0.05)。与哮喘组相比,Hemin组明显增加HO-1表达和活性,减少肺部组织炎性反应,增加Treg/CD4+T细胞的百分比和IL-10水平,降低Th17/CD4+T细胞的百分比和IL-17水平,而SnPP组没有明显变化。与Hemin组相比,Hemin+siRNA HOv1组肺部组织中HO-1表达和活性降低,炎性反应增加,Treg/CD4+T细胞的百分比和IL-10水平降低,Th17/CD4+T细胞的百分比和IL-17水平增加,差异具有统计学意义(P<0.05)。结论增加HO-1的表达和活性能够明显改善哮喘小鼠炎性反应,增加Treg细胞的数目并促进IL-10的产生,同时抑制Th17细胞的表达及IL-17的产生。
血红素加氧酶-1;哮喘;CD4+CD25+调节性T细胞;Th17细胞
近年来,世界各国的支气管哮喘(简称哮喘)发病率均有显著上升[1],同时儿童的哮喘患病率也逐年攀升,严重影响儿童的健康成长[2]。研究表明T细胞的免疫失衡参与了哮喘气道炎症的发生同时占据了重要作用[3]。CD4+CD25+调节性T细胞(regulatory T cells,Treg)以及Th17细胞是独立的CD4+T细胞亚群,Treg细胞能够维持机体免疫稳态并且抑制针对自身抗原的异常免疫反应,通过与其他细胞直接接触和/或分泌一些抑制性的细胞因子如TGF-β、IL-10等发挥免疫负调控的作用[4]。Th17细胞分泌的IL-17在炎性反应以及免疫调节中发挥着重要的作用[5]。Treg细胞和Th17细胞之间平衡紊乱已成为研究哮喘免疫损伤的新热点,调节哮喘患者的免疫功能或将成为治疗哮喘更为有效的发展方向。血红素加氧酶-1(heme oxygenase-1,HO-1)是哺乳动物和人体内血红素代谢途径中的限速酶,在体内免疫系统激活及免疫反应中发挥重要作用[6]。因此,本研究通过建立哮喘小鼠动物模型,探讨Treg与Th17细胞在哮喘发病中的变化,并观察HO-1对其平衡的影响。
1 材料与方法
1.1 实验动物 60只SPF级BALB/c雌性小鼠,6周龄,体质量(20±2)g,购于河南省实验动物中心[许可证号:SCXK(豫)2010-0002]。采用随机数字表示法分6组,每组10只,分笼饲养,给予不含致敏原的特殊饲料喂养。
1.2 实验试剂 卵清蛋白(ovalbumin,OVA)、高铁氯化血红素(hemin)和锡-原卟啉(tin protoporphyrin IX,SnPP)购自美国Sigma公司;苏木素伊红(hematoxylin and eosin,HE)染色试剂盒和血红素加氧酶-1活性比色法定量检测试剂盒购自南京金斯瑞生物科技有限公司;小鼠IL-17 ELISA试剂盒、小鼠IL-10 ELISA试剂盒购自美国Biolegend公司;抗小鼠HO-1抗体、FITC-anti-CD4抗体、APC-anti-CD25抗体、PE-anti-Foxp3抗体和PE-Cy7-anti-IL-17抗体均购自美国Invitrogen公司。
1.3 动物模型制备与分组 按照数字表法随机将60只SPF级BALB/c雌性小鼠均分为正常组、哮喘组、Hemin组、SnPP组、Hemin+siRNA scramble组和Hemin+siRNA HO-1组,每组10只。除正常组小鼠之外的每组小鼠分别于实验第1、8、15天腹腔注射0.2 mL鸡卵蛋白和氢氧化铝混合液(含鸡卵蛋白100 μg,氢氧化铝2 mg);第22天开始,连续5 d,每天吸入2%鸡卵蛋白进行雾化30 min,制备哮喘模型;另外,Hemin组和SnPP组分别于第1次雾化致敏前连续2 d,每天1次腹腔注射Hemin或SnPP 75 μmol/kg,Hemin+siRNA scramble组和Hemin+siRNAHO-1组分别于腹腔注射Hemin前1 d经尾静脉注射200 μL已经构建并鉴定的慢病毒载体 pSicoR-GFP-siRNA scramble或 pSicoR-GFP-siRNA HO-1。正常组腹腔注射和雾化均以生理盐水代替。
1.4 小鼠肺部组织HO-1表达检测 采用Western blot检测。分离各组小鼠200 μg左肺组织并提取总蛋白,采用BCA法定量蛋白浓度。每组各取样本量30 μg,7.5%SDS-PAGE电泳分离蛋白并移至PVDF膜,置于新鲜配制的含5%BSA的TBST液中室温封闭1 h,加入抗小鼠HO-1抗体(1:1 000)和兔抗大鼠β-actin抗体(1:1 000),4°C反应过夜;用TBST液洗膜3次,每次5 min,加入HRP标记的山羊抗兔IgG二抗孵育;ECL显影,BandScan 5.0凝胶电泳图像分析软件行条带灰度扫描,以β-actin为内参照对HO-1进行灰度值半定量分析。重复3次,取均值。
1.5 小鼠肺部组织HO-1活性检测 按照组织HO-1活性比色法定量检测试剂盒说明书步骤检测各组小鼠肺部组织中HO-1活性。
1.6 小鼠肺部组织HE染色 末次雾化激发结束后24 h内各组小鼠以吸入乙醚进行麻醉,开胸,分离肺动脉,制备4 μm厚度切片。随机选取每组小鼠肺组织3张石蜡切片,脱蜡后进行HE染色,每张切片随机选取5个以上高倍镜视野观察支气管壁的形态学改变。
1.7 Treg细胞和Th17细胞检测 采用流式细胞仪检测。取各组小鼠100 μL外周血置于流式管中,依次加入4 mL红细胞裂解液和4 mL磷酸盐缓冲液(PBS),离心去上清后计数。稀释配制每管含1×106个细胞的细胞悬液,加入100 μL含FITC-anti-CD4抗体和APC-anti-CD25抗体的流式染色液,混合均匀,4℃避光孵育30 min。洗涤,破膜,固定后每管加入100 μL含有PE-anti-Foxp3抗体的1×破膜液或者含有PECy7-anti-IL-17抗体的1×破膜液,4℃避光孵育30 min,加3 mL PBS,4℃条件下1 500 r/min离心5 min,弃上清,用500 μL 2%的多聚甲醛固定后分别检测各组小鼠外周血Treg细胞和Th17细胞比例。
1.8 小鼠血清和支气管肺泡灌洗液(BALF)中IL-17、IL-10水平检测 采用ELISA检测。末次雾化激发结束后24 h内将各组小鼠以吸入乙醚麻醉处死,气管切开后,留置针置入,缝线固定,以0.75 mL PBS灌洗,反复2次,回收率80%~90%,3 000 r/min离心5 min,收集其上清液,即为小鼠支气管肺泡灌洗液(BALF)。采用ELISA试剂盒进行各组小鼠血清和BALF中IL-17和IL-10水平检测。
1.9 统计学方法 应用SPSS17.0统计软件进行数据分析,计量资料以均数±标准差(±s)表示,多个样本均数的比较采用单因素方差分析,组间数据两两比较采用LSD-t法,以P<0.05为差异有统计学意义。
2 结果
2.1 Hemin诱导小鼠肺部组织中HO-1表达以及活性 与正常组小鼠相比,哮喘组小鼠肺部组织中HO-1表达和活性升高,差异具有统计学意义(P<0.05);与哮喘组小鼠相比,Hemin组小鼠肺部组织中HO-1表达和活性显著升高,差异具有统计学意义(P<0.05),SnPP组小鼠肺部组织中HO-1表达虽然显著增多,但活性显著受到抑制;与Hemin组小鼠相比,Hemin+siRNA HO-1组小鼠肺部组织中HO-1表达和活性显著受到抑制,差异具有统计学意义(P<0.05),见图1和图2。
2.2 各组小鼠肺部组织病理学观察 与正常组小鼠相比,哮喘组小鼠肺部组织气道周围分布有大量炎症细胞,气道上皮细胞脱落,分泌粘液增多,气道管壁显著增厚;与哮喘组小鼠相比,Hemin组小鼠气道壁厚度明显减小,炎症细胞大量减少,SnPP组与哮喘组无明显差异;与Hemin组小鼠相比,Hemin+siRNA HO-1组小鼠气道壁厚度增加,炎症细胞明显较多,见图3。
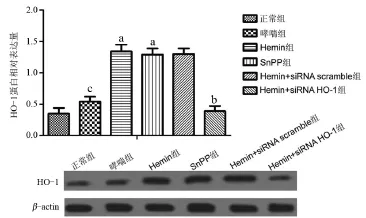
图1 各组小鼠肺部组织中HO-1蛋白表达量

图2 各组小鼠肺组织中HO-1酶活性
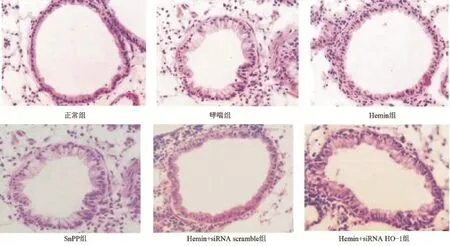
图3 各组小鼠肺部组织HE染色(×400)
2.3 各组小鼠外周血中Treg细胞和Th17细胞比例 与正常组小鼠相比,哮喘组小鼠Treg/CD4+T细胞的百分比显著降低,Th17/CD4+T细胞的百分比显著升高,差异具有统计学意义(P<0.05);与哮喘组小鼠相比,Hemin组小鼠Treg/CD4+T细胞的百分比明显升高,Th17/CD4+T细胞的百分比显著降低,差异具有统计学意义(P<0.05),SnPP组与哮喘组相比无明显差异,不具有统计学意义;与Hemin组小鼠相比,Hemin+ siRNA HO-1组小鼠Treg/CD4+T细胞的百分比显著降低,Th17/CD4+T细胞的百分比显著升高,差异具有统计学意义(P<0.05),见表1、图4和图5。
表1 各组小鼠外周血Treg及Th17细胞数目(±s)
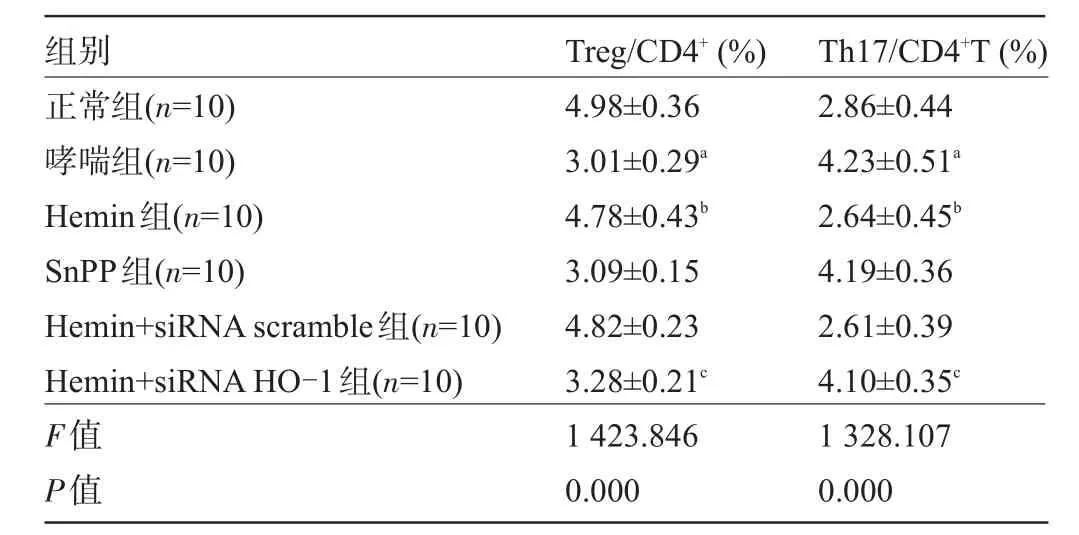
表1 各组小鼠外周血Treg及Th17细胞数目(±s)
注:与正常组比较,aP<0.05;与哮喘组比较,bP<0.05;与Hemin组比较,cP<0.05。
组别Treg/CD4+(%)Th17/CD4+T(%)正常组(n=10)哮喘组(n=10) Hemin组(n=10) SnPP组(n=10) Hemin+siRNAscramble组(n=10) Hemin+siRNAHO-1组(n=10) F值P值4.98±0.36 3.01±0.29a4.78±0.43b3.09±0.15 4.82±0.23 3.28±0.21c1 423.846 0.000 2.86±0.44 4.23±0.51a2.64±0.45b4.19±0.36 2.61±0.39 4.10±0.35c1 328.107 0.000

图4 各组小鼠外周血Treg细胞水平
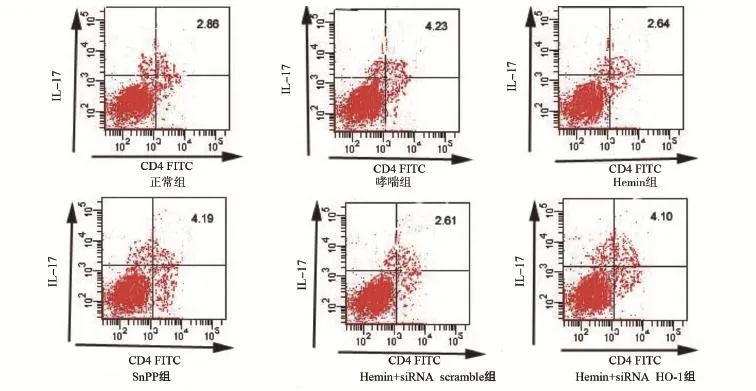
图5 各组小鼠外周血Th17细胞水平
2.4 各组小鼠血清和BALF中IL-17、IL-10的水平 与正常组小鼠相比,哮喘组小鼠血清和BALF中IL-10水平显著降低,IL-17水平显著升高,差异具有统计学意义(P<0.05);与哮喘组小鼠相比,Hemin组小鼠血清和BALF中IL-10水平明显升高,IL-17水平明显降低,差异具有统计学意义(P<0.05),SnPP组与哮喘组相比无明显差异,不具有统计学意义;与Hemin组小鼠相比,Hemin+siRNA HO-1组小鼠血清和BALF中IL-10水平显著降低,IL-17水平显著升高,差异具有统计学意义(P<0.05),见表2。
表2 各组小鼠BALF和血清中IL-10、IL-17水平(±s,pg/mL)
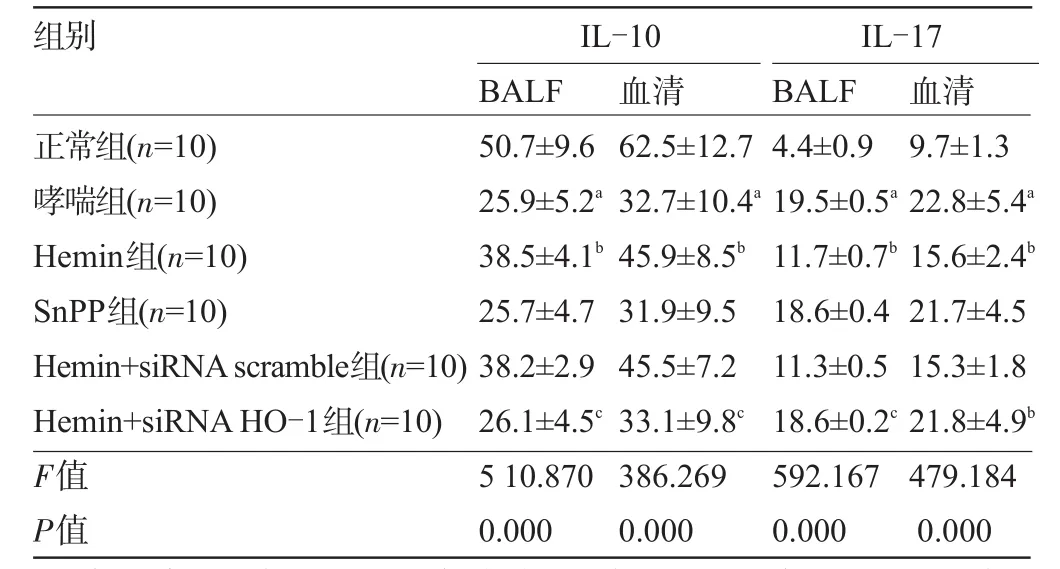
表2 各组小鼠BALF和血清中IL-10、IL-17水平(±s,pg/mL)
注:与正常组比较,aP<0.05;与哮喘组比较,bP<0.05与Hemin组比较,cP<0.05。
组别IL-10IL-17 BALF 血清BALF 血清正常组(n=10)哮喘组(n=10) Hemin组(n=10) SnPP组(n=10) Hemin+siRNAscramble组(n=10) Hemin+siRNAHO-1组(n=10) F值P值50.7±9.6 25.9±5.2a38.5±4.1b25.7±4.7 38.2±2.9 26.1±4.5c5 10.870 0.000 62.5±12.7 32.7±10.4a45.9±8.5b31.9±9.5 45.5±7.2 33.1±9.8c386.269 0.000 4.4±0.9 19.5±0.5a11.7±0.7b18.6±0.4 11.3±0.5 18.6±0.2c592.167 0.000 9.7±1.3 22.8±5.4a15.6±2.4b21.7±4.5 15.3±1.8 21.8±4.9b479.184 0.000
3 讨论
HO-1是一种具有广泛调节作用的蛋白,参与各种免疫相关性人类疾病和动物模型中免疫保护作用[7]。通常情况下,HO-1在大多数组织细胞中呈现低水平表达,但在应激情况下HO-1的表达显著升高[8]。在本研究中发现,哮喘组小鼠肺部组织中HO-1较正常组略微升高,推测该现象可能是机体防止过度炎症对机体伤害而产生的免疫保护作用。Hemin是HO-1的底物,能显著诱导HO-1蛋白表达并增强其活性;SnPP则是HO-1的竞争性抑制剂,虽能诱导HO-1蛋白表达但是同时抑制其活性。因此Western blot和比色法结果显示Hemin明显上调HO-1的表达和活性,而SnPP仅仅诱导HO-1的表达并不增加HO-1活性。同时HE染色结果显示,上调HO-1表达并增强其活性的Hemin处理哮喘小鼠明显改善了小鼠肺部组织炎症反应,仅诱导HO-1高表达的SnPP对哮喘小鼠肺部组织炎症反应无抗炎效应,然而Hemin+siRNA HO-1组抑制HO-1表达的同时逆转Hemin对哮喘小鼠肺部组织的抗炎效应。这表明Hemin能够特异性诱导HO-1表达并增强其活性,从而发挥对哮喘小鼠气道炎症反应的抗炎作用,也可以推测HO-1在抵抗哮喘小鼠气道炎症反应中占据重要作用。
Treg细胞和Th17细胞是共同来源于初始CD4+T细胞的新亚类,参与哮喘和过敏性疾病的发生和发展[5,9]。Treg细胞是维持外周免疫耐受的关键细胞,分泌抑制性细胞因子IL-10、转化生长因子-β(TGF-β)并能介导自身抗原诱导的免疫耐受,抑制炎性反应[10-11]。Th17细胞能够促进炎性细胞因子IL-17、IL-22、IL-6以及肿瘤坏死因子-α(TNF-α)的释放[12],还可在气道炎性反应过程中招募中性粒细胞,进一步促进多种炎症细胞释放炎性因子,加重气道的阻塞和气道的高反应性,扩大炎性反应[13-14]。此外,Treg细胞与Th17细胞之间在分化上互相影响、在功能上相互拮抗,共同维持机体免疫状态的相对稳定,使机体处于复杂的免疫平衡状态。因此,Treg细胞和Th17细胞之间的平衡在免疫反应相关疾病的发生发展中起着重要作用。本研究中发现哮喘组小鼠外周血中Th17细胞占CD4+T细胞的百分率显著高于正常组,Treg/CD4+T细胞百分比显著降低,BALF、血清中IL-17表达水平明显升高,提示Th17细胞及其分泌的细胞因子IL-17可能参与了哮喘的免疫调节作用,其机体Treg/Th17的失衡可能是哮喘发生、发展或急性加重的原因之一。与哮喘组相比,Hemin组明显上调Treg细胞及IL-10表达,下调Th17细胞数量及降低IL-17的表达,纠正机体Treg/Th17的免疫失衡状态,减轻气道炎性反应,从而减轻哮喘的症状。与Hemin组相比,Hemin+siRNA HO-1组中HO-1表达受到抑制后,逆转Hemin对Treg细胞和Th17细胞平衡的影响,削弱了Hemin对哮喘小鼠炎性反应的抑制作用,进一步证实HO-1参与哮喘模型中Treg细胞和Th17细胞平衡的调节,减轻气道炎性反应。
综上所述,Hemin特异性诱导HO-1表达和活性增强,调节哮喘小鼠外周血中Treg细胞和Th17细胞平衡,抑制炎性因子释放,从而能有效改善哮喘气道炎性反应。从而证实了HO-1在哮喘炎性反应以及Treg细胞和Th17细胞平衡中具有重要意义。由此推测在今后的临床工作中,若对具有患哮喘高风险因素的儿童进行有效的早期免疫干预,可能会起到避免哮喘的发病或减轻哮喘症状的目的。
[1]Feng M,Yang Z,Pan L,et al.Associations of early life exposures and environmental factors with asthma among children in rural and urban areas of Guangdong,China[J].Chest,2016,149(4):1030-1041.
[2]年宏蕾,刘仁慧,石浩天,等.淫羊藿女贞子配伍对激素局部干预哮喘大鼠气道病理改变的影响[J].世界中西医结合杂志,2016,12 (10):1672-1687.
[3]Ren J,Hu L,Yang J,et al.Novel T-cell epitopes on Schistosoma japonicum SjP40 protein and their preventive effect on allergic asthma in mice[J].Eur J Immunol,2016,46(5):1203-1213.
[4 Wan G,Wei B.Erythropoietin regulates Treg cells in asthma through TGFbeta receptor signaling[J].Am J Transl Res,2015,7(11): 2305-2315.
[5]Wei Y,Dong M,Zhang H,et al.Acupuncture attenuated inflammation and inhibited Th17 and treg activity in experimental Asthma[J]. Evid Based ComplementAlternat Med,2015,2015:340126.
[6]Zhong W,Di C,Lv J,et al.Heme oxygenase-1 inhibits basophil maturation and activation but promotes its apoptosis in T helper type 2-mediated allergic airway inflammation[J].Immunology,2016,147 (3):321-337.
[7]Hu B,Shi C,Xu C,et al.Heme oxygenase-1 attenuates IL-1beta induced alteration of anabolic and catabolic activities in intervertebraldisc degeneration[J].Sci Rep,2016,6:21190.
[8]Azuma J,Wong RJ,Morisawa T,et al.Heme oxygenase-1 expression affects murine abdominal aortic aneurysm progression[J].PLoS One,2016,11(2):e0149288.
[9]Imani S,Salimian J,Bozorgmehr M,et al.Assessment of Treg/Th17 axis role in immunopathogenesis of chronic injuries of mustard lung disease[J].J Recept Signal Transduct Res,2016,36(5):531-541.
[10]娄春艳,李敏,李丽.哮喘小鼠气道重塑过程中CD4+CD25+调节性T细胞和Th17细胞表达的动态变化[J].中国当代儿科杂志,2015, 17(9):994-1000.
[11]Liu F,Yu J,Bai L,et al.Pingchuan formula improves asthma via restoration of the Th17/Treg balance in a mouse model[J].BMC ComplementAltern Med,2015,15:234.
[12]Jiang H,Wu X,Zhu H,et al.FOXP3(+)Treg/Th17 cell imbalance in lung tissues of mice with asthma[J].Int J Clin Exp Med,2015,8(3): 4158-4163.
[13]Kugyelka R,Kohl Z,Olasz K,et al.Enigma of IL-17 and Th17 cells in rheumatoid arthritis and in autoimmune animal models of arthritis [J].Mediators Inflamm,2016,2016:6145810.
[14]张敏,农光民,蒋敏,等.Tc17细胞在中性粒细胞哮喘小鼠的表达及意义[J].中国当代儿科杂志,2016,18(2):172-176.
Effect of Heme Oxygenase-1 on the balance of Treg cells and Th17 cells in asthmatic mice.
YANG Xin1,ZHANG Qing2,ZHANG Yan-ping2,WEI Xiao-ye2,JI Ya-mei2.1.Department of Paediatrics,YuLin Children's Hospital,Yulin 719000,Shaanxi,CHINA;2.Department of Paediatrics,Xingyuan Hosptial of Yulin,Yulin 719000,Shaanxi,CHINA
ObjectiveTo investigate the effect of Heme Oxygenase-1(HO-1)on the balance of Treg cells and Th17 cells in asthmatic mice,and to explain the immunomodulatory effect of HO-1.MethodsSixty female BALB/c mice were randomly divided into six groups according to random number table:normal control group,asthma group,Hemin group,tin-protoporphyrin(SnPP)group,Hemin+siRNA scramble group and Hemin+siRNA HO-1 group,with 10 mice in each group.Asthmatic mouse model was established by intraperitoneal injection and aerosol inhalation of ovalbumin(OVA),while mice in the normal control group were given normal saline instead.Hemin group and SnPP group were intraperitoneally injected with Hemin or 75 μmol/kg SnPP,respectively.Hemin+siRNA scramble group and Hemin+siRNA HO-1 group were transfected with pSicoR-GFP-siRNA scramble or pSicoR-GFP-siRNA HO-1 before intraperitoneal injection with Hemin.All mice were sacrificed at 24 hours after the last excitation.Western blot and HO-1 activity quantitative Kit were respectively used to measure the expression and activity of HO-1 in lung tissues.The hematoxylin-eosin staining was used to observe the airway structural changes.Flow cytometry was used to measure the percentages of Treg cells and T helper(Th17)cells in CD4+T cells in peripheral blood,while enzyme-linked immunosorbent assay(ELISA)was used to measure the levels of interleukin(IL)-10 and IL-17 in serum and bronchoalveolar lavage fluid.ResultsCompared with the normal control group,asthma group showed an increase in the expression and activity of HO-1,and inflammatory reaction was obvious.The percentage of Treg/CD4+T cells and the level of IL-10 were significantly decreased,and percentage of Th17/CD4+T cells and the level of IL-17 were significantly increased, with statistically significant differences(P<0.05).Compared with the asthma group,Hemin group had significantly increased expression and activity of HO-1,inhibited inflammatory reaction in lung tissue,increased percentage of Treg cells and I-10 level,decreased percentage of Th17 cells and IL-17 level.However,there was no significant change in the SnPP group.Compared with the Hemin group,Hemin+siRNA HO-1 group showed an obvious decrease in the ex-pression and activity of HO-1,percentage of Treg cells and IL-10 level,and an increase in inflammatory reaction,percentage of Th17 cells,and IL-17 level.The differences were statistically significant(P<0.05).ConclusionIncreasing the expression and activity of HO-1 could significantly improve the inflammatory reaction,increase the number of Treg cells and promote the production of IL-10,and meanwhile inhibit the generation of Th17 cells and production of IL-17 in asthmatic mice.
Heme oxygenase-l;Asthma;CD4+CD25+regulatory T cell;T helper cell(Th17)cell
R-332
A
1003—6350(2017)01—0009—06
2016-07-27)
姬亚梅。E-mail:lijieyulin@163.com
10.3969/j.issn.1003-6350.2017.01.003

