球孢白僵菌胞外酶的活性与其毒力的相关性
张丹丹, 刘廷辉, 赵 丹, 李瑞军, 董建臻, 陆秀君
(河北农业大学植物保护学院,河北保定 071001)
球孢白僵菌胞外酶的活性与其毒力的相关性
张丹丹, 刘廷辉, 赵 丹, 李瑞军, 董建臻, 陆秀君
(河北农业大学植物保护学院,河北保定 071001)
为了研究球孢白僵菌胞外酶的活性与其毒力的相关性,以黄粉虫为标准试虫测定9株球孢白僵菌的毒力,并分别测定其胞外蛋白酶、几丁质酶和脂肪酶的生产水平。相关分析表明,3种胞外酶活性与毒力的线性关系分别为y1=-13.815 4x+185.954 4,r12=0.495 7;y2=-10.976 0x+58.977 0,r22=0.432 5;y3=-1.122 3x+8.469 5,r32=0.830 3。由r2值可以看出,胞外脂肪酶活性与毒力的线性关系最明显,脂肪酶活性可作为大量菌株毒力初筛的参考性指标。
球孢白僵菌;胞外酶;毒力;相关性
球孢白僵菌(Beauveriabassiana)是目前国内外研究应用最为广泛的害虫生防真菌,同时也是一类广谱性的昆虫病原真菌[1],白僵菌以其高效、低毒、不污染环境、对人畜无害等特点长期以来受到了广泛的关注和深入的研究[2]。白僵菌对多种害虫具有致病性,能侵染包括15目149科521属700多种昆虫和至少6科7属13种蜱螨类[3-4],并且致病力强、持效期长、不易产生抗药性、对人畜无害,利用其开发微生物杀虫剂具有良好的发展前景[5-6]。
大量研究表明,白僵菌主要通过与寄主的表皮接触,从昆虫的体壁、气门、节间膜、气孔及伤口等处侵入而感染,但有时也在昆虫取食、呼吸时经过消化道和呼吸道等内部途径进行感染[7]。昆虫的表皮成分可以为白僵菌的萌发提供营养物质,同时对芽管的形成具有刺激作用。白僵菌分生孢子吸收营养后开始萌发,从端部或侧面长出芽管[8]。另有研究表明,球孢白僵菌在代谢过程中能合成、分泌一系列胞外酶,如蛋白酶、几丁质酶和脂肪酶等,它们在白僵菌入侵寄主时,尤其在穿透昆虫体壁过程中,起到溶解昆虫表皮以利于菌体侵染的作用[1]。有学者研究表明,球孢白僵菌蛋白酶、几丁质酶和脂肪酶产生水平与其菌株毒力之间存在一定的相关性[9-14]。目前测定球孢白僵菌毒力一般采用生物测定的方法,这种方法受到许多因素的影响,包括试虫的虫龄、生理状态、生物测定时的环境条件等,常使毒力测定结果的重现性较差,如果可以通过借助普通的生物化学方法测定这些酶的活性,间接揭示菌株的毒力,在大量菌株中筛选高毒力菌株的同时就可以实现既准确又高效的目的[15]。因此,本试验测定了9株球抱白僵菌的胞外蛋白酶、几丁质酶和脂肪酶的活性及其对黄粉虫(TenebriomolitorL.)的毒力,并进行相关性研究,以期探讨上述3种体壁降解酶作为毒力指标的可靠性。
1 材料与方法
1.1 试验材料
1.1.1 供试菌株 9株球孢白僵菌菌株,由笔者实验室从北方野外土壤中诱集分离得到。
1.1.2 试虫 黄粉虫,笔者实验室饲养所得的低龄幼虫。
1.1.3 药品 吐温-80、PDA培养基、SDA培养基、酪氨酸、酪蛋白、Folin-酚试剂、几丁质、二硝基水杨酸、橄榄油、NaOH、酚酞、聚乙烯醇、磷酸缓冲液(pH值为7.5)等。
1.2 试验方法
1.2.1 菌株毒力测定
1.2.1.1 孢子悬浮液的制备 将实验室保存的球孢白僵菌菌株,在PDA平板上(25±1) ℃恒温培养10 d,在无菌条件下刮取孢子粉,放于装有少量含0.05% 吐温-80无菌水的组织研磨器中研磨,充分研磨后倒入灭菌后的小烧杯中,用血球计数板计数,并将孢子悬浮液浓度调至1亿个/mL备用。
1.2.1.2 毒力测定 将3龄黄粉虫幼虫浸入上述配好的孢子悬浮液中3 s后,放入铺有滤纸的培养皿中,并用无菌水保湿,用0.05% 吐温-80无菌水处理作对照。每天观察并记录死虫数,死虫进行保湿培养,观察并记录虫体是否有菌丝长出。
1.2.2 胞外酶测定
1.2.2.1 菌株液体培养,粗酶液制备 根据“1.2.1.1”节中的方法制备孢子悬浮液,以1%的量接种到100 mL SDA培养基中(置于250 mL三角瓶中),于(25±1) ℃恒温摇床中 150 r/min 振荡培养,按试验进度定时取出培养物,过滤后留滤液测定胞外酶活性。
1.2.2.2 蛋白酶活性的测定 (1)取培养5 d后的液体培养物,用灭菌滤纸过滤,留滤液(酶液)备用。(2)用Tris-HCl缓冲液(0.05 mol/L,pH值为8.5)将底物酪蛋白配成 10 mg/mL 酪蛋白溶液,取1 mL 10 mg/mL酪蛋白溶液,加入1 mL待测酶液中,于37 ℃反应30 min,每个处理3次重复。(3)用2 mL 0.4 mol/L三氯乙酸中止反应并过滤。(4)留滤液用Folin-酚试剂进行检测,每管加入400 μL滤液,2 mL Folin等A、B混合液(1 ∶50的比例配制)室温下静止反应 10 min,加入200 μL酚试剂,静止30 min,在650 nm波长处测吸光度,以1 min催化分解生成1 μg酪氨酸的酶量为1个活性单位(U/mL),用酪氨酸标准溶液制作标准曲线,从而得出不同菌株的胞外蛋白酶的活性。
1.2.2.3 几丁质酶活性的测定 (1)取培养4 d后的液体培养物,用灭菌滤纸过滤,留滤液(酶液)备用。(2)以1.0 mL 的1%胶体几丁质为底物,加入0.5 mL酶液,50 ℃水浴反应1 h。(3)用DNS (3,5-二硝基水杨酸)法测定产生的还原糖。样品液适当稀释,使糖浓度为0.1~1.0 mg/mL,取 1.0 mL 稀释后的糖液于15 mL刻度试管中,加入2.0 mL DNS试剂,沸水浴反应2 min,冷却后用水补足到15 mL刻度,在540 nm波长处测定吸光度。从葡萄糖制备标准曲线,得出不同菌株几丁质酶的活性。
1.2.2.4 脂肪酶活性的测定 (1)取培养4 d后的液体培养物,用灭菌滤纸过滤,留滤液(酶液)备用。(2)在100 mL三角瓶中加入4 mL聚乙烯醇橄榄油乳化剂和5 mL 0.025 mol/L 磷酸缓冲液(pH值为7.5),置于40 ℃预热5~10 min,加入 1 mL 酶液,计时准确反应16 min后立即加入15 mL 95%乙醇终止酶反应。(3)加酚酞指示剂2~3滴,用0.1 mol/L NaOH滴定至红色为终点。
2 结果与分析
2.1 9株球孢白僵菌菌株对黄粉虫的毒力测定结果
球孢白僵菌对黄粉虫的毒力测定结果如表1所示,经过方差和显著性水平分析可知,其中B07-09-7毒力最高,致死中时为2.29 d;B07-09-124毒力最低,致死中时为 4.39 d。

表1 9株球孢白僵菌菌株对黄粉虫的致死中时(LT50)
注:同列数据后不同大写、小写字母分别表示在1%、5%水平上差异显著。下表同。
2.2 蛋白酶活性测定结果
球孢白僵菌蛋白酶活性测定结果如表2所示,经过方差和显著性水平分析可知,9株球孢白僵菌的蛋白酶活性有明显的差异。其中,B07-09-7的蛋白酶活性最高,高达174.51 U/mL,而B07-09-124的蛋白酶活性只有 125.22 U/mL。对表1、表2中的数据进行相关性分析,得出球孢白僵菌蛋白酶活性y1和致死中时x之间的线性关系为y1=-13.815 4x+185.954 4、r1=0.704 0、r12=0.495 7 (P=0.034 3)。由此可以看出,球孢白僵菌蛋白酶活性与致死中时的线性关系并不明显,蛋白酶活性单独作为衡量菌株毒力水平的指标预测性较差。

表2 9株球孢白僵菌菌株蛋白酶活性方差分析结果
2.3 几丁质酶活性测定结果
球孢白僵菌几丁质酶活性的测定结果如表3所示,经过方差和显著性水平分析可知,9株球孢白僵菌的几丁质酶活性有明显的差异。其中,B07-09-7的几丁质酶活性最高,高达38.61 U/mL,而B07-09-143的几丁质酶活性只有 8.10 U/mL,结合表1得出球孢白僵菌几丁质酶活性y2和致死中时x之间线性关系为y2=-10.976 0x+58.977 0、r2=0.657 7、r22=0.432 5(P=0.054 2)。由此可以看出,球孢白僵菌几丁质酶活性与致死中时的线性关系并不明显。
2.4 脂肪酶活性测定结果
球孢白僵菌脂肪酶活性的测定结果如表4所示,经过方差和显著性水平分析可知,9株球孢白僵菌的脂肪酶活性有明显的差异。其中,B07-06-362的脂肪酶活性最高,高达6.04 U/mL,而B07-09-143的脂肪酶酶活性只有 3.34 U/mL,结合表1得出球孢白僵菌脂肪酶活性y3和致死中时x之间线性关系y3=-1.122 3x+8.469 5、r3=0.911 2、r32=0.830 3(P=0.000 6)。由此可以看出,球孢白僵菌脂肪酶活性与毒力极显著相关。
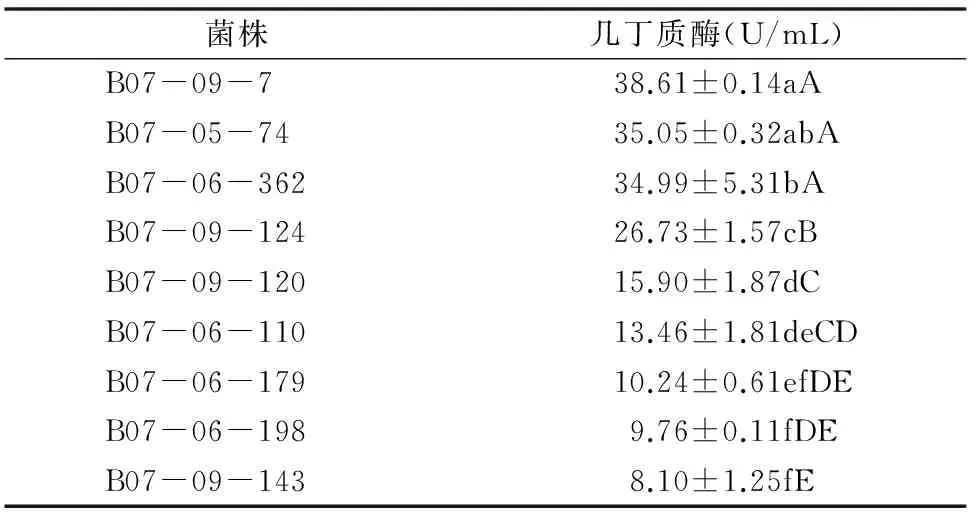
表3 9株球孢白僵菌菌株几丁质酶活性方差分析结果
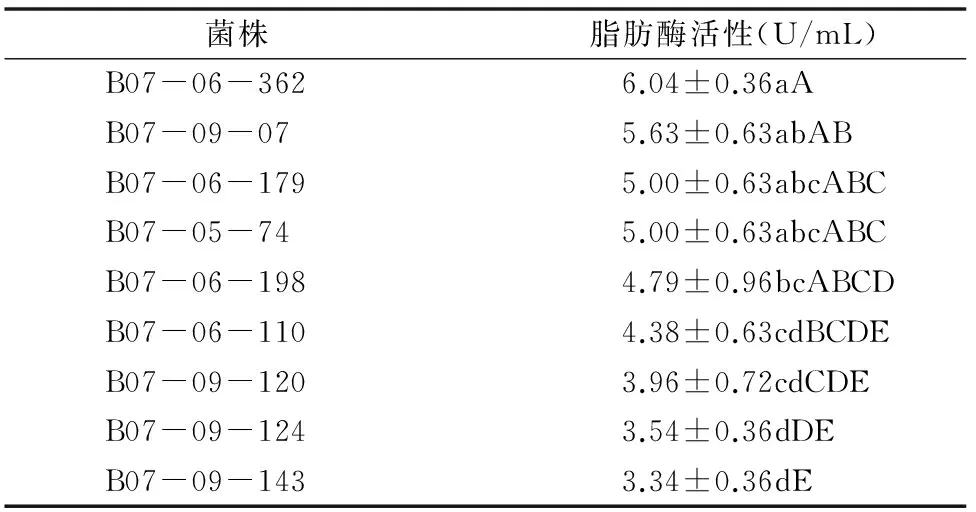
表4 9株球孢白僵菌菌株脂肪酶活性方差分析结果
3 结论与讨论
9株球孢白僵菌的胞外蛋白酶、几丁质酶、脂肪酶活性与对黄粉虫毒力的相关性研究结果中,脂肪酶活性与毒力的相关性最显著,就相关性而言,脂肪酶活性的高低在一定程度上可以表达白僵菌毒力的强弱。r2=0.830 3,即脂肪酶可以表达毒力的83.03%,由此可以考虑用脂肪酶活性表示球孢白僵菌毒力。
球孢白僵菌的脂肪酶活性对白僵菌侵染寄主的过程有一定的影响。球孢白僵菌入侵寄主分几个阶段,其中包括孢子的萌发、附着、入侵和定殖,而入侵是其中至关重要的一步。根据昆虫表皮的结构,白僵菌入侵寄主的第1道屏障是昆虫虫体表面的蜡脂,而脂肪酶可以消除蜡脂层,打破白僵菌入侵寄主的第1道屏障,为其进一步入侵提供基础。Pavlyushin发现,球孢白僵菌的脂肪酶活性与其对昆虫的毒力有关[16],Smith等的试验也进一步证实了这一点[17]。脂肪酶的作用不仅消除了孢子入侵的屏障,而且可能给真菌提供营养。由此可认为,脂肪酶对降解昆虫表皮、提供真菌营养具有一定的贡献。
脂肪酶仅是昆虫体壁结构物降解酶系之一。本研究结果表明脂肪酶在白僵菌侵染过程中的重要作用,这一结论与冯明光所得出的胞外蛋白酶作为毒力生物测定的补充指标[15]有一定的出入。因此,无论是用胞外蛋白酶活性还是用胞外脂肪酶活性作为白僵菌毒力指标,都须持谨慎态度,应当有条件地使用或者用于大量菌株的初筛工作中。
[1]林海萍,韩正敏,张 昕,等. 球孢白僵菌研究现状及提高其杀虫效果展望[J]. 浙江农林大学学报,2006,23(5):575-580.
[2]刘廷辉,武丽芬,李瑞军,等. 7株白僵菌菌株的抗逆性研究[J]. 河北农业大学学报,2013,36(3):82-86,97.
[3]李增智,李春如,黄 勃. 中国虫生真菌研究与应用[J]. 昆虫知识,1988,1:241-255.
[4]Tafoya F,Zunigadelgadillo M,Alatorre R,et al. Pathogenicity ofBeauveriabassiana(Deuteromycota:Hyphomycetes) against the cactus weevil,Metamasiusspinolae(Coleoptera:Curculionidae) under laboratory conditions[J]. Florida Entomologist,2004,87(4):533-536.
[5]李阜棣,胡正嘉. 微生物学[M]. 北京:中国农业出版社,2000:283-284.
[6]蒲蛰龙. 害虫生物防治[M]. 北京:科学出版社,1977:104-108.
[7]王园园. 球孢白僵菌分生孢子田间生存潜能及与常用药剂的相容性研究[D]. 保定:河北农业大学,2013.
[8]季香云,杨长举. 白僵菌的致病性与应用[J]. 中国生物防治学报,2003,19(2):82-85.
[9]Stleger R J,Bidochka M J,Roberts D W. Isoforms of the cuticle-degrading Pr1 proteinase and production of a metalloproteinase byMetarhiziumanisopliae[J]. Archives of Biochemistry and Biophysics,1994,313(1):1-7.
[10] Leger R J,Frank D C,Roberts D W,et al. Molecular cloning and regulatory analysis of the cuticle-degrading-protease structural gene from the entomopathogenic fungusMetarhiziumanisopliae[J]. European Journal of Biochemistry,1992,204(3):991-1001.
[11]Fang W,Leng B,Xiao Y,et al. Cloning ofBeauveriabassianachitinase geneBbchit1 and its application to improve fungal strain virulence[J]. Applied and Environmental Microbiology,2005,71(1):363-370.
[12]St. Leger R J. The role of cuticle-degrading proteases in fungal pathogenesis of insects[J]. Canadian Journal of Botany,1995,73(S1):1119-1125.
[13]樊美珍,胡景江. 白僵菌酯酶同工酶、脂肪酸与其毒力的关系[J]. 安徽农业大学学报,1996,23(3):260-266.
[14]姚 剑,黄大庆. 球孢白僵菌蛋白质酶、几丁质酶和β-N-乙酰葡萄糖苷酶产生水平及其与毒力关系的研究[J]. 宿州学院学报,2004,19(4):102-106.
[15]冯明光. 胞外蛋白酶和脂酶活性作为球孢白僵菌毒力指标的可靠性分析[J]. 微生物学报,1998,38(6):461-467.
[16]Pavlyushin V A. Virulence mechanisms of the entomopathogenic fungusBeauveriabassiana(Bals.) Vuill[C]//Proceedings of the First Joint US USSR Conference on the Production,Selection and Standardization of Entomopathogenic Fungi of US/USSR Joint Working Group on the Production of Substances by Microbiological Means,1978.
[17]Smith R J,Pekrul S,Grula E A. Requirement for sequential enzymatic activities for penetration of the integument of the corn earworm (Heliothiszea)[J]. Journal of Invertebrate Pathology,1981,38(3):335-344.
10.15889/j.issn.1002-1302.2017.02.025
2015-11-24
国家花生产业技术体系专项(编号:CARS-14)。
张丹丹(1990—),女,河北邯郸人,硕士研究生,研究方向为害虫生物防治及分子生物学。E-mail:1404547846@qq.com。
李瑞军,博士,副教授,研究方向为害虫生物防治及农业生态安全。E-mail:liruijun99@sina.com。
S432.4+4
A
1002-1302(2017)02-0093-03
张丹丹,刘廷辉,赵 丹,等. 球孢白僵菌胞外酶的活性与其毒力的相关性[J]. 江苏农业科学,2017,45(2):93-95.

