原发四肢软组织肉瘤的综合治疗
白靖平
. 专论 Special article .
原发四肢软组织肉瘤的综合治疗
白靖平
四肢;软组织肿瘤;临床方案;治疗
软组织肉瘤 ( soft tissue sarcoma,STS ) 是一组高度异质性不常见的肿瘤,目前已经明确的 STS 亚型有50 多种。成人最常见的 STS 依次为:多形性未分化肉瘤、脂肪肉瘤、平滑肌肉瘤、滑膜肉瘤及恶性神经鞘瘤等。儿童最常见的 STS 是横纹肌肉瘤。对于成人 STS 并没有可以被广泛接受的治疗规范。一些预后因素已经明确,包括肿瘤的病理分级、大小、部位及是否发生远处转移等。对于 STS 治疗的一些相关因素尚有争议,如:怎样的外科切缘是安全的?什么时候实施放疗?系统化疗是否可以改善预后?现就近年来国内外有关四肢 STS 治疗的相关现状及最新进展介绍如下。
一、STS 的诊断、分级与分期
诊断采取三结合模式:临床、影像与病理综合考虑,建议思路或步骤:( 1 ) 肿块是肿瘤还是反应性、增生性或假恶性病变;( 2 ) 病变生物学潜能是良性、中间性或恶性;( 3 ) 病变是肉瘤还是癌、淋巴瘤或黑色素瘤等;( 4 ) STS 的类型;( 5 ) 分级及分期。
临床信息的采集注意以下几点:( 1 ) 年龄,总的来说发生于儿童和成人的 STS 几乎没有交叉;( 2 ) 深浅,大多数情况下 STS 表现为部位深在的肿块;( 3 ) 生长速度;( 4 ) 大小;( 5 ) 活动度与质地;( 6 ) 是否有持续进行性加重的疼痛;( 7 ) 局部的表现,如温度、静脉怒张或肿胀。
常用的影像学检查有:X 线片、CT、MRI、ECT / SPET-CT、PET 等。影像学可提供病变的范围,与邻近组织结构的毗邻关系及病变内在影像学特征。诊断性影像学检查的目的在于:( 1 ) 病变的检出和特征描述;( 2 ) 区分肿瘤和非肿瘤性疾病;( 3 ) 提供特异性诊断或恰当的鉴别诊断;( 4 ) 指导病变活检;( 5 ) 肿瘤分期。
目前显微镜下的形态学评估是 STS 诊断的金标准。由于部分 STS 的组织学类型通常很难直接根据形态学确定,所以经常需要用到一些辅助诊断的方法,如免疫组化、细胞遗传学和基因分析等。一些 STS 亚型具有特征性的遗传学变异。
分级有 NCI[1]和 FNCLCC[2]3 级系统和 Markhede 等[3]4 级分级系统,目的是根据肿瘤的组织学表现来评估其恶性程度,预测其发生复发和远处转移的可能性。临床实际工作中,主要是根据组织学类型和亚型确定肿瘤分化程度。某些组织学亚型就意味着一种分级。分期是将组织学表现与临床情况结合,更能反映疾病范围信息。如果没有转移,分级基本就决定了临床分期。
STS 的诊断强调临床、影像与病理三结合,包括按 2013 年 WHO 软组织肿瘤组织学分类标准[4]进行分类,采用 STS 的 FNCLCC 组织学分级系统[5]进行分级,采用 2010 年 ATCC STS 分期标准[6]进行分期。原则为相互印证,综合判断,特别要注意在具体实践中每个诊断指标的权重及发生概率。在相互矛盾时,应特别慎重作出诊断,可以再次进行病理检查或进行多学科讨论。
二、多学科综合治疗原则
手术治疗、放疗和化疗等综合治疗可显著提高 STS 生存率,减少局部复发的可能。目前手术对于大多数类型的 STS 是主要的治疗选择。通过当前的治疗方案,大多数死于 STS 的患者通常存在化疗耐受的转移性疾病。
1. 手术治疗原则、目标及相关问题:详尽的局部影像病理解剖分析、周密的手术方案设计是非常重要的。手术需在 STS 未受浸润的层次进行分离,在实际操作时许多人提倡做到在肿瘤的三维空间上达到 2~3 cm 的外科切缘,其实是很难做到的,除增加一些不必要的外科操作,外科切缘的绝对数值从来就没有得到科学的验证,而且也没有像肿瘤概念上的安全边缘重要。肿瘤邻近或压迫主要血管、神经或骨,只要其未受侵犯,可以切除相应的膜屏障后保留这些结构。总之,手术的目标是 R0 切除,目的是控制局部复发 ( 复发率低于 20% )。如果最终的术后病理结果为切缘阳性,只要不会带来明显的功能障碍,强烈建议再次进行扩大切除,以获得阴性切缘。对切缘 < 1 cm 或邻近重要血管、神经或骨的切缘阳性 ( 镜下 ) 者应该进行辅助放疗[7]。
局部复发的患者完善检查后,按照原发 STS AJCC II、III 期处理;活检部位和引流通道应该与大体标本一起整块切除;已按良性肿瘤进行边缘或囊内切除的 STS 患者,强烈建议再次积极的手术治疗,以获得阴性的切缘。
对四肢 STS 能进行的最大范围手术是截肢术,目前已经很少采用此术式,大多数肢体 STS 均可实施保肢手术。但某些情况下仍有必要进行截肢,这点很重要。现在保肢的标准术式是扩大切除,对术者而言,决定最终预后的手术切缘应考虑采纳“最小安全切缘”这一概念。
外科切除结合放疗是局部高度恶性 STS 的基本治疗原则。对于局部晚期 STS 而言,当无法确定能否可以获得 R0 切除术时,常采用新辅助治疗 ( 例如放疗、肢体隔离灌注化疗及系统治疗 ),目的是为了使局部肿瘤缩小,为后续切除术创造更好的条件。
迄今为止尚没有“扩大切除”的循证医学和临床公认的定义,从肿瘤学的观点,与其说是“扩大”还不如说是“安全”,边缘切除 ( 沿着肿瘤假包膜 ) 是不充分的,通常也不能通过其它辅助治疗所弥补。
2. 对于高度恶性 STS 而言,不论放疗的实施时间 ( 新辅助或辅助 ) 或实施技术 ( 体外放疗、术中放疗、短距放疗 ),放疗对局部无复发生存率有良好的效果,但并不影响总体生存率。放疗对总生存率没有影响。对于低度恶性 STS,放疗结合外科治疗并不提高局部控制率。单独放疗无法代替再次扩大切除。
新辅助放疗因有明确的肿瘤定位和精确的放疗计划,可达到更小的治疗范围和较小的剂量要求。术前实施放疗同时也可获得“氧增强效应”。肿瘤缩小和边界清晰,在一定程度上更有利于保肢手术的成功实施。不利之处在于术前放疗可能导致伤口愈合延迟,因放疗需要推迟手术进行,以及放疗后造成不同程度的组织坏死,故可能影响病理诊断的准确性。
术后放疗通常在伤口愈合后进行,切口并发症少,手术切除肿瘤标本完整,未经放射线照射,可以进行准确的病理诊断评估。缺点是无法精准确定放疗靶区的边界,常需给予较大放射剂量。
目前治疗高危 STS 是联合使用新辅助化疗和放疗,化疗除能治疗早期微转移病灶外,还可充当辐射增敏剂以减少肿瘤局部复发的机会。
3. 化疗在辅助治疗中的作用存在争议[9],进行疗效评价应建立在准确的 STS 亚型或分子病理分型上,辅助化疗或者新辅助化疗对于尤文氏肉瘤 / 原始神经外胚层肿瘤、横纹肌肉瘤是合适的标准治疗。滑膜肉瘤、黏液圆细胞脂肪肉瘤及未分化肉瘤也应考虑。对于儿童和青少年 STS,全身化疗已成为最佳治疗选择之一[10],但对于成人而言,高度恶性 STS 的全身化疗仍是临床研究的课题。毫无疑问,对于 IV 期的治疗,应该考虑全身化疗。
三、局部晚期 STS 治疗的选择( 图1,2 )
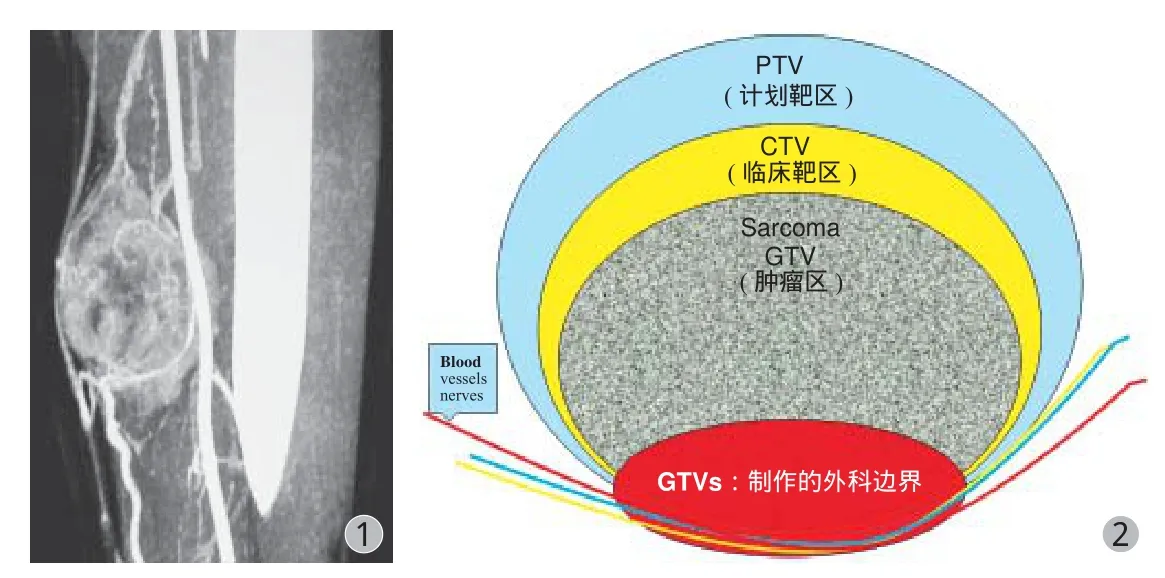
图1 局部晚期肢体 STS 血管造影显示肿瘤与血管关系图2 SIB-IMRT 技术制作局部晚期 STS 安全外科边界示意图Fig.1 The angiography of the patient with locally advanced extremity STSshowed the relationship between the tumor and the blood vesselFig.2 The diagram showed the safe surgical boundary of locally advanced STS by SIB-IMRT
1. 目前 STS 存在的主要问题:( 1 )难以明确其真正的侵袭性边界;( 2 ) 术前难以确定是否存在“卫星灶”或局部“跳跃转移灶”;( 3 ) 局部是否存在多中心发病模式;( 4 ) 远隔器官是否存在微转移病灶;( 5 ) 由于 STS 发病率低、病种繁杂,高水平的临床随机对照研究难以进行;( 6 ) 显微镜下组织学分类的困难及免疫组化及分子分型的困境;( 7 ) 组织学分类与预后的不一致性;( 8 ) 规范化的治疗与个体化的原则如何统一。
2. 要想达到 R0 切除的目标,必须通过扩大切除或屏障切除的方法来实现。但局部晚期患者肿瘤组织毗邻重要结构如神经、血管或骨,难以实现在不损害重要结构前提下满意的手术治疗。可能的选择如下:( 1 )截肢,造成一定程度的残疾;( 2 ) 保肢:① 扩大切除,切除相关的重要结构并进行重建,有严重并发症发生的风险或在有些情况下不能进行重建可能造成残疾;② 屏障切除,肉瘤组织未侵及血管、神经鞘膜或骨膜的情况下;③ 边缘或囊内切除,局部复发率高是突出问题;④ 新辅助放化疗后再评估,如可保证安全外科边界( R0 ) 就进行保肢手术[11-13]。
SIB-IMRT 技术 ( 同步推量调强放疗 )[14-15]在不延长放疗疗程的同时提高重点关注区剂量、减小高剂量体积、降低并发症发生,以提高 R0 切除率,降低复发率。局部晚期肿瘤毗邻重要血管、神经或骨骼的部位,是实行扩大切除的难点,也难于保证 R0 切除的实现。此处应是重点关注的区域,使用 SIB-IMRT 在此区域造成一定范围 ( 1 cm ) 坏死区,继之形成初步的反应性包膜。此时在重点关注区进行边缘切除,但可达 R0 切除的效果,关注区以外为通过一定距离达到扩大切除的目的,故在切除范围不变的情况下提高了手术级别,达到扩大切除的目的。
总之,STS 的诊断和治疗存在很多困难,因亚型多,发病率低,为了提高临床研究及诊治水平,进行多中心、前瞻性临床随机对照试验研究非常有必要。强调在区域肿瘤中心进行多学科团队医疗模式,按照建立在高水平的循证医学证据基础上进行个体化诊断和治疗是最佳的医疗实践。
[1] Costa J, Wesley RA, Glatstein E, et al. The grading of soft tissue sarcomas results of a clinicohistopathologic correlation in a series of 163 cases[J]. Cancer, 1984, 53(3):530-541.
[2] Hasegawa T, Yamamoto S, Nojima T. Validity and reproducibility of histologic diagnosis and grading for adult soft-tissue sarcomas[J]. Human Pathlogy, 2002, 33(1):111-115.
[3] Markhede G, Angervall L, Stener B. A multivariate analysis of the prognosis after surgical treatment of malignant soft-tissue tumors[J]. Cancer, 1982, 49(8):1721-1733.
[4] Jo VY, Fletcher CD. WHO classif cation of tumours of soft tissue and bone[J]. Pathlogy, 2014, 46(2):95-104.
[5] Guillou L, Coindre JM, Bonichon F, et al. Comparative study of the National Cancer Institute and French Federation of Cancer Centers Sarcoma Group grading systems in a population of 410 adult patients with soft tissue sarcoma[J]. J Clin Oncol, 1997, 15(1):350-362.
[6] Peabody TD, Jr GC, Simon MA. Evaluation and staging of musculoskeletal neoplasms[J]. J Bone Joint Surg Am, 1998, 80(8):1204-1218.
[7] Delaney TF, Kepka L, Goldberg SI, et al. Radiation therapy for control of soft-tissue sarcomas resected with positive margins[J]. Int J Radiat Oncol Biol Phys, 2007, 67(5):1460-1469.
[8] Zagars GK, Ballo MT, Pisters PW, et al. Surgical margins and reresection in the management of patients with soft tissue sarcoma using conservative surgery and radiation therapy[J]. Cancer, 2003, 97(10):2544-2553.
[9] Cormier JN, Huang X, Xing Y, et al. Cohort analysis of pat ients with localized, High-Risk, extremity soft tissue sarcoma treated at two cancercenters: chemotherapy-associated outcomes[J]. J Clin Oncol, 2004, 22(22):4567-4574.
[10] Koscielniak E, Klingebiel T. Soft tissue sarcoma in children and adolescents[C]//ONKOLOGIE. ALLSCHWILERSTRASSE 10, CH-4009 BASEL, SWITZERLAND: KARGER, 2012, 35:103.
[11] Kraybill WG, Harris J, Spiro IJ, et al. Long-term results of a phase 2 study of neoadjuvant chemotherapy and radiotherapy in the management of high-risk, high-grade, soft tissue sarcomas of the extremities and body wall[J]. Cancer, 2010, 116(19):4613-4621.
[12] Nedea EA, Spiro IJ, Suit HD, et al. Long-term follow-up of patients treated with neoadjuvant chemotherapy and radiotherapy for large, extremity soft tissue sarcomas[J]. Cancer, 2012, 118(15):3758-3765.
[13] Look Hong NJ, Hornicek FJ, Harmon DC, et al. Neoadjuvant chemoradiotherapy for patients with high-risk extremity and truncal sarcomas: A 10-year single institution retrospective study[J]. Eur J Cancer, 2013, 49(4):875-883.
[14] Wang CW, Zhou Y, Bai JP, et al. Application of volumetric modulated arc therapy and simultaneous integrated boost techniques to prepare“Safe Margin” in the Rabbit VX2 Limb tumor model[J]. Med Sci Monit, 2015, 21:2397-2405.
[15] Zhou Y, Xie PM, Dong C, et al. Prospective clinical study of pre-operative SIB-IMRT in preparing surgical boundary of extremity soft tissue sarcoma[J]. Eur Rev Med Pharmacol Sci, 2015, 19(24):4738-4750.
( 本文编辑:裴艳宏 )
Comprehensive treatment of primary extremity soft tissue sarcomas
BAI Jing-ping. Department of Bone and Soft Tissue, Xinjiang Tumor Hospital, Xinjiang Medical University, Urumqi, Sinkiang, 830011, China
Sarcoma is a rare solid tumor which roots in different mesenchymal cells, with distinct clinical and pathologic features. Soft tissue sarcoma ( STS ) roots in the fat, muscles, nerves, blood vessels and other connective tissues. The pathogenesis is still unclear. In the diagnosis of STS, the combination of clinical features, imaging and pathology is emphasized. Pathologic evaluation should include the type of STS, grading and staging. Operation is given priority in the comprehensive treatment of STS. According to the pathologic evaluation, clinical stage and the relationship between STS and bones, joints and peripheral nerves and blood vessels, the surgical method is selected. The curative effects of STS could be improved by normative diagnosis and treatment. The importance of a multidisciplinary team ( MDT ) is emphasized in regional cancer center. On the basis of the high-level evidence-based medicine, individualized diagnosis and treatment is the best medical practice.
Extremities; Soft tissue neoplasms; Clinical protocols; Therapy
10.3969/j.issn.2095-252X.2017.02.002
R738.6
乌鲁木齐市科学技术计划项目 ( Y141310040 )
830011 乌鲁木齐,新疆医科大学附属肿瘤医院骨与软组织科
2016-11-08 )

