臂丛区域肿瘤外科分区建议及手术入路探讨沙漠
沙漠 丁真奇 康两期 洪海森 王臻 郭征
臂丛区域肿瘤外科分区建议及手术入路探讨沙漠
沙漠 丁真奇 康两期 洪海森 王臻 郭征
目的 探讨臂丛区域肿瘤外科分区方法及相应手术路径,评估手术疗效及预后。方法 回顾2008 年 1 月至 2014 年 12 月收治的 19 例臂丛区域肿瘤患者。根据肿瘤相对臂丛主干解剖空间位置进行外科分区:臂丛上方、臂丛下方、臂丛内部、臂丛前方、臂丛后方,并采取相应的手术入路:锁骨上方入路、经典臂丛前路、改良三角肌胸大肌间隙入路、锁骨截骨入路、后方肩胛下入路,分析其临床结果。结果 所有患者均获 8~49 个月随访,平均 24.1 个月。良性肿瘤 10 例 ( 52.63% ),交界性肿瘤 3 例 ( 15.79% ),恶性肿瘤6 例 ( 31.58% )。边缘切除 13 例,囊内切除 6 例,切缘阳性 3 例。2 例术中并发神经损伤,随访末期 1 例症状改善。10 例术前疼痛患者,术后 8 例疼痛消失,2 例缓解。1 例术前感觉异常患者术后症状缓解。6 例术前活动障碍患者,术后 4 例恢复正常,2 例得到改善。良性肿瘤随访过程均无复发。交界性复发 2 例。恶性肿瘤1 例术后 8 个月因肺转移死亡,其余均健在未复发转移。结论 根据肿瘤相对臂丛主干解剖空间位置,将臂丛区域肿瘤进行外科分区并选择相应的手术入路,此方法简单易交流,可获得良好的手术效果。
臂丛;软组织肿瘤;外科手术
臂丛区域肿瘤在临床上比较少见,文献报道其占上肢肿瘤中的发生率不到 5%[1]。较低的发病率低加上复杂的解剖结构,使得手术风险及难度较大,较多文献报道了有关臂丛区域肿瘤的诊治方法[2],但对臂丛区域肿瘤的外科治疗尚未形成一致意见,而此类肿瘤的手术风险并不小于臂丛源性肿瘤,且手术方式的选择有一定规律性。本研究对我科 7 年来处理的 19 例臂丛区域肿瘤患者进行回顾性分析,提出一种相对简单的臂丛区域肿瘤外科分区方法,探讨不同分区肿瘤对应手术入路的选择,以期最大限度地切除肿瘤及保护臂丛神经。
资料与方法
一、临床资料
1. 一般资料:本研究收集了自 2008 年 1 月至 2014 年 12 月,我科诊治的臂丛区域肿瘤患者19 例,男 8 例 ( 42.11% ),女 11 例 ( 57.89% )。年龄2.2~67 岁,平均 31 岁。病程最短 0.5 个月,最长36 个月,平均为 9.3 个月。左侧 11 例,右侧 8 例( 表1 )。
2. 临床表现及体征:本组 19 例入院时的临床症状、体征 ( 表1 )。其中 16 例 ( 84.21% ) 发现逐渐增大的肿块为主要首发症状病史。10 例 ( 52.63% ) ( 良性 3 例、交界性 3 例、恶性 4 例 ) 局部有疼痛、麻木感。恶性肿瘤患者疼痛更明显。6 例 ( 31.58% ) ( 良性 1 例、交界性 2 例、恶性 3 例 ) 出现不同程度的活动障碍、无力。1 例 ( 5.26% ) 局部感觉异常。Tinel 征阳性者 7 例。
3. 术前评估:本组所有患者均行 MRI 增强、神经根及血管成像,可疑累及骨质增加三维 CT 检查。怀疑恶性肿瘤则行全身 PET-CT 检查,或相关全身检查排除远处转移。对于臂丛上方、下方及前方肿瘤根据 MRI 相对于肿瘤的较远的位置进行 B 超引导下活检,而臂丛内部和后方肿瘤不行活检直接切除。
二、研究方法
( 一 ) 臂丛区域肿瘤外科分区方法
观察肿瘤 MRI 冠状位、矢状位片,根据肿瘤相对臂丛主干解剖空间位置进行分区:( 1 ) 臂丛上方肿瘤 ( 3 例 ):定义为位于臂丛主干上方、锁骨上窝处的肿瘤;( 2 ) 臂丛内部肿瘤 ( 7 例 ):定义为位于臂丛主干内部、与臂丛神经关系密切的肿瘤;( 3 )臂丛下方肿瘤 ( 4 例 ):定义为位于臂丛主干下方、腋窝处的肿瘤;( 4 ) 臂丛前方肿瘤 ( 3 例 ):定义为位于臂丛主干前方、锁骨后方的肿瘤;( 5 ) 臂丛后方肿瘤 ( 2 例 ):定义为位于臂丛主干后方、肩胛骨前方的肿瘤。
( 二 ) 手术方法
1. 臂丛上方肿瘤-锁骨上方入路:锁骨上 C 形切口,切口以肿瘤为中心,向前延长至锁骨,后方至斜方肌上缘 ( 图1 ),内侧靠胸锁乳突肌外缘。暴露斜方肌,将其后方牵开,注意保护副神经肌支及肩胛上神经。探查肿瘤与臂丛主干和锁骨下血管关系,术中须注意颈横动脉及肩胛上动静脉的干扰,必要时结扎。若术中见肿瘤部分位于锁骨下方暴露不清,则行锁骨截骨增加暴露,降低神经血管损伤风险。在胸膜顶剥离肿瘤时采取钝性剥离,避免损伤肺尖部胸膜,作好放置胸腔闭式引流的准备。
2. 臂丛内部肿瘤-经典臂丛前路:切口以肿瘤为中心,向内上沿胸锁乳突肌后缘延长,向外下沿三角肌胸大肌间沟延长 ( 图2 )。将锁骨解剖钢板放置锁骨上缘,预钻孔固定,再截断锁骨后切开锁骨下肌,结扎颈横动脉及肩胛上动脉,牵开胸锁乳突肌,暴露肿瘤、臂丛及锁骨下血管束。
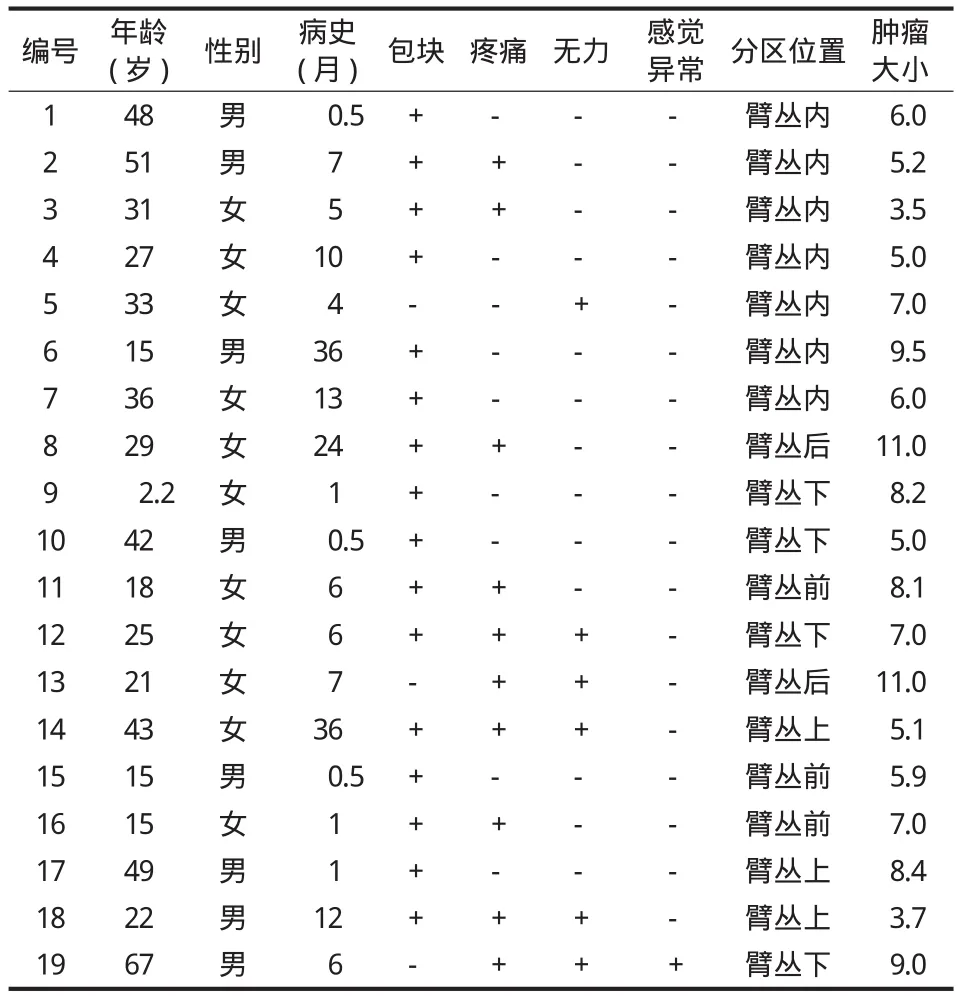
表1 19 例臂丛区域肿瘤患者临床资料Tab.1 Clinical data of brachial plexus region tumors in 19 Patients
3. 臂丛下方肿瘤-改良三角肌胸大肌入路:切口以肿瘤为中心,向前上沿三角肌胸大肌间沟延长切口至锁骨,向后下做弧形切口至腋后襞下 5 cm ( 图3 )。将喙突截骨,翻转胸小肌肌腱是暴露肿瘤的关键。注意保护臂丛神经主干、胸长神经和肌皮神经。
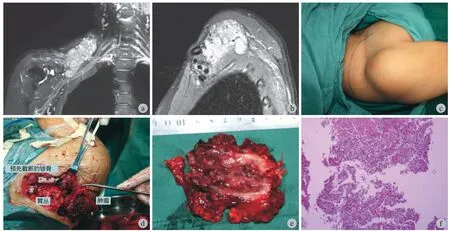
图1 患者,女,43 岁,臂丛上方肿瘤 a~b:术前 MRI 示肿瘤位于臂丛上方;c:示手术切口位置;d:为术中肿瘤暴露与切除;e:为切除肿瘤,包膜完整;f:组织病理结果提示腺泡状软组织肉瘤Fig.1 Female, 43 years old, upper brachial plexus tumor a - b: MRI showed tumor above the brachial plexus; c: Operative incision; d: Exposure of excision tumor; e: Extracapsular excision of tumor; f: Histological sections of the lesion showed that this tumour was alveolar soft part sarcoma
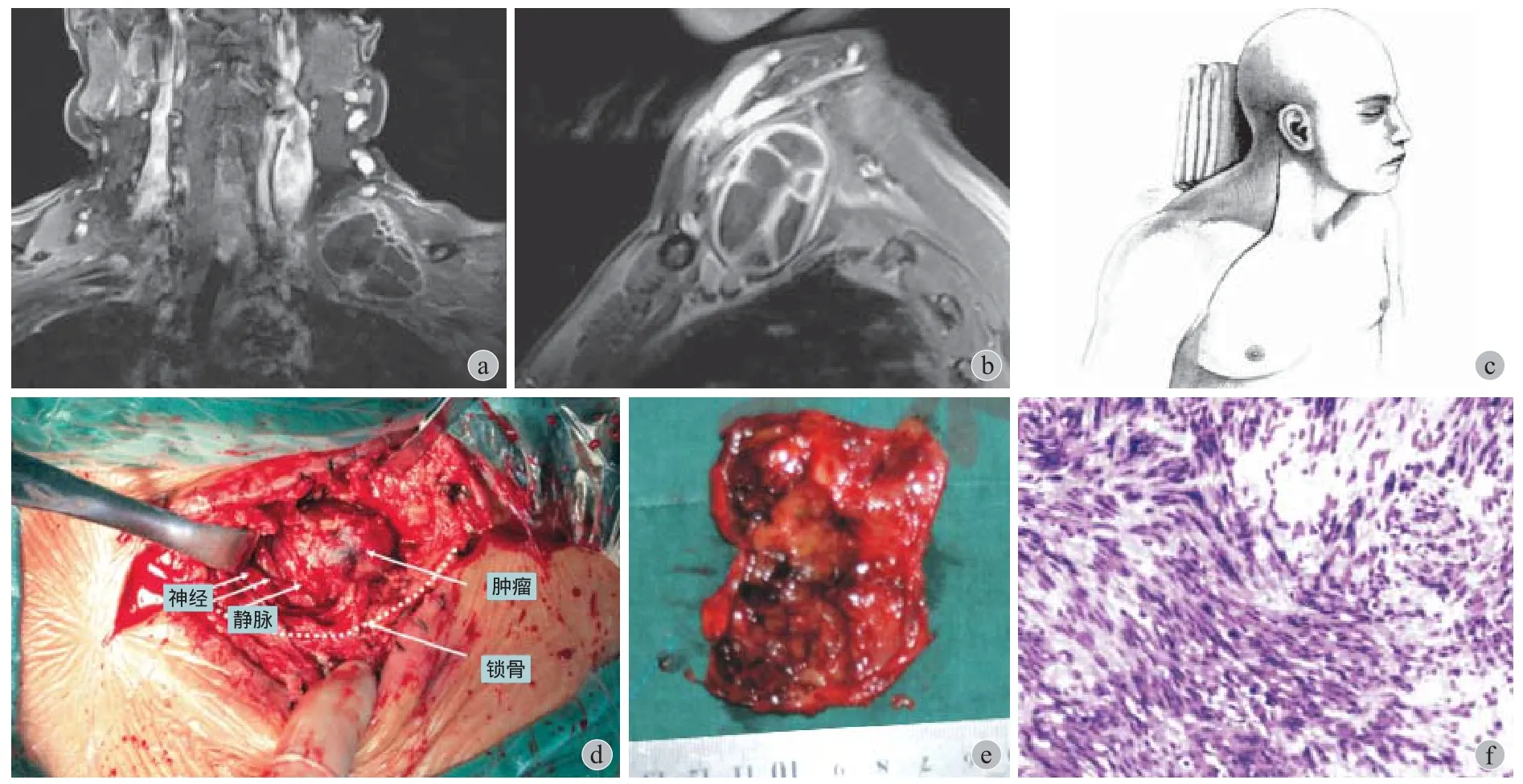
图2 患者,男,51 岁,臂丛内部肿瘤 a~b:术前 MRI 示肿瘤被多根神经血管包绕;c:示手术切口位置;d:为术中肿瘤暴露与切除;e:为切除肿瘤,包膜完整;f:组织病理结果提示神经鞘瘤Fig.2 Male 51 years, old, interior brachial plexus tumor a - b: MRI showed that the tumor was surrounded by abundant blood vessels and nerves; c: Operative incision; d: Intraoperative exposure and excision; e - f: Tumors were surrounded by an intact capsule, that were proven to be schwa nnomas on histopathology
图3 患者,女,2 岁 3 个月 23 天,臂丛下方肿瘤 a~b:术前 MRI 示右侧腋窝区可见团块状异常信号,臂丛神经血管束被包绕;c:示虚线为文献建议标准切口,红色为改良切口;d:为术中肿瘤暴露与切除;e:为切除肿瘤,包膜完整;f:组织病理结果提示血管淋巴瘤;g:为术后患者右上肢功能正常Fig.3 Female, 2 years and 3 m, inferior brachial plexus tumor a - b: MRI showed that the mass was located in axillary cavity and was surrounded by neurovascular bundle; c: Classic literature incision ( dashed line ) and modif ed incision ( red line ); e - f: Tumor with intact capsule was proven to be angiolymphangioma on histopathology; g: Right upper extremity with good function
4. 臂丛前方肿瘤-锁骨截骨入路:切口起自臂丛主干近端,沿肿瘤外缘做弧形切口 ( 图4 )。切从包膜外将肿瘤与弧型皮瓣分离,分别自肿瘤远近端间隔肿瘤 1~2 cm 处用线锯锯断锁骨,注意肿瘤底部与神经血管束的关系,肿瘤切除后采用髂骨或自体腓骨重建锁骨缺损。闭合时注意肌层覆盖内植物。
5. 臂丛后方肿瘤-后方肩胛下入路:切口起肩胛骨上缘中点 ( 图5 ),沿肩胛骨上缘至肩胛骨上角,再转向下,沿肩胛骨内侧缘至肩胛骨下角,切断部分斜方肌、背阔肌,切断菱形肌、肩胛提肌的止点,注意保护胸长神经,胸背神经,腋神经,旋肱后动脉,往上牵拉肩胛骨暴露肿瘤视野,分离肿瘤远端时注意避免损伤腋神经。
结 果
一、肿瘤病理特征
术后肿瘤病理检查结果:良性肿瘤 10 例( 52.63% ):神经鞘瘤 5 例,神经纤维瘤 2 例,血管瘤 1 例,血管淋巴管瘤 1 例,脂肪瘤 1 例。交界性肿瘤 3 例 ( 15.79% ):硬纤维瘤 3 例。恶性肿瘤 6 例( 31.58% ):尤文氏肉瘤 1 例,弥漫性大 B 细胞淋巴瘤 1 例,滤泡样软组织肉瘤 1 例,血管扩张性骨肉瘤 1 例,转移性鳞状细胞癌 1 例,转移性血管内皮瘤 1 例 ( 表2 )。
二、术中情况
本组 19 例臂丛区域肿瘤采用边缘切 13 例,囊内切 6 例。19 例 ( 100% ) 肿瘤均得到完全切除,其中镜下切缘阳性 3 例,包括 1 例硬纤维瘤,1 例血管瘤和 1 例转移性鳞状细胞癌。术中 2 例出现神经损伤并发症。手术时间 55~193 min,平均 105.2 min。出血量 30~1000 ml,平均 399.5 ml。输血 0~1300 ml,平均 210.5 ml ( 表2 )。
三、随访结果
本组 19 例均获得 8~49 个月随访,平均 23.8个月。所有患者术后切口均 I 级愈合,2 例术后分别出现 C8、T1神经根性症状,C8神经根损伤患者随访 29 个月,症状无明显改善,T1神经根损伤患者术后 1 个月症状缓解。10 例术前疼痛者,其中 8 例术后疼痛消失,2 例疼痛较严重者术后得到缓解,本组无一例出现术后疼痛加重。3 例术前感觉异常和麻木患者术后均得到缓解,术后新增 1 例感觉异常和麻木。1 例术前感觉异常患者术后症状缓解,术后新增 1 例感觉异常患者,因术中神经与肿瘤一并全切除,随访期间未见恢复。6 例术前活动障碍患者,术后 4 例恢复正常,2 例得到改善,新增 1 例活动障碍患者,因术中神经与肿瘤一并全切除,随访期间未见恢复。10 例良性肿瘤患者在随访期间均未见复发。2 例切缘阴性的硬纤维瘤患者分别在术后 10、21 个月复发再次手术;1 例切缘阳性的复发性硬纤维瘤患者术后常规放疗,随访 24 个月内未见复发。3 例肉瘤术后常规放化疗,分别随访 35、31、32 个月均未见复发。1 例恶性腺泡状软组织肉瘤患者肺部转移,术后常规化疗后随访 35 个月仍健在。1 例转移性鳞癌患者术后常规放化疗随访 12 个月仍健在。1 例转移性血管内皮瘤患者术后常规放化疗,术后 8 个月死于肺部转移 ( 表2 )。
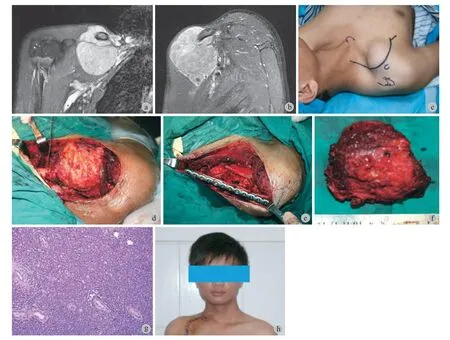
图4 患者,男,15 岁,臂丛前方肿瘤a~b:术前 MRI 示右锁骨后下见团块状异常信号,边界尚清楚,部分包绕锁骨;c:示手术切口位置;d:为术中肿瘤暴露与切除;e:为肿瘤切除后锁骨缺损,取腓骨重建;f:为切除肿瘤,包膜完整;g:组织病理结果提示 Ewing 肉瘤;h:为术后患者右上肢外观功能正常Fig.4 Male,15 years old, anterior brachial plexus tumor a - b: MRI showed the mass in front of the brachial plexus and surrounded the clavicle; c: Operative incision; d: intraoperative exposure and excision; e: Clavicle defect reconstruction with auto-f bula graft; f - g: Tumor with intact capsule was proven to be Ewing sarcoma on histopathology; h: Right shoulder with good shape and function
讨 论
一、臂丛区域肿瘤外科分区的意义
目前尚无文献对臂丛区域肿瘤做出明确定义。由于臂丛解剖结构复杂且肿瘤种类繁多、位置多变[3-5],有学者根据不同手术方式,将臂丛神经鞘瘤分为:( 1 ) 节前神经根;( 2 ) 节后脊髓神经;( 3 ) 锁骨前后神经丛;( 4 ) 锁骨下神经丛共 4 个层面,并采用相应的手术入路:① 后路切除、② 胸锁乳突肌后缘 C 型切口、③ 锁骨切断、④ 三角肌胸大肌间隙入路[6]。此分型方法仅限用于神经鞘瘤、神经纤维瘤等神经源性肿瘤,然而对广义臂丛区域没有文献给予统一的建议。将臂丛区域肿瘤定义为生长在臂丛神经根、干、股、束、支内部或锁骨后方、肩胛骨前方、锁骨上窝和腋窝的肿瘤,并根据神经血管主干的位置给予相应的分区。本研究提出的臂丛区域肿瘤外科分区法简洁明了、便于交流,有利于指导手术入路的选择。
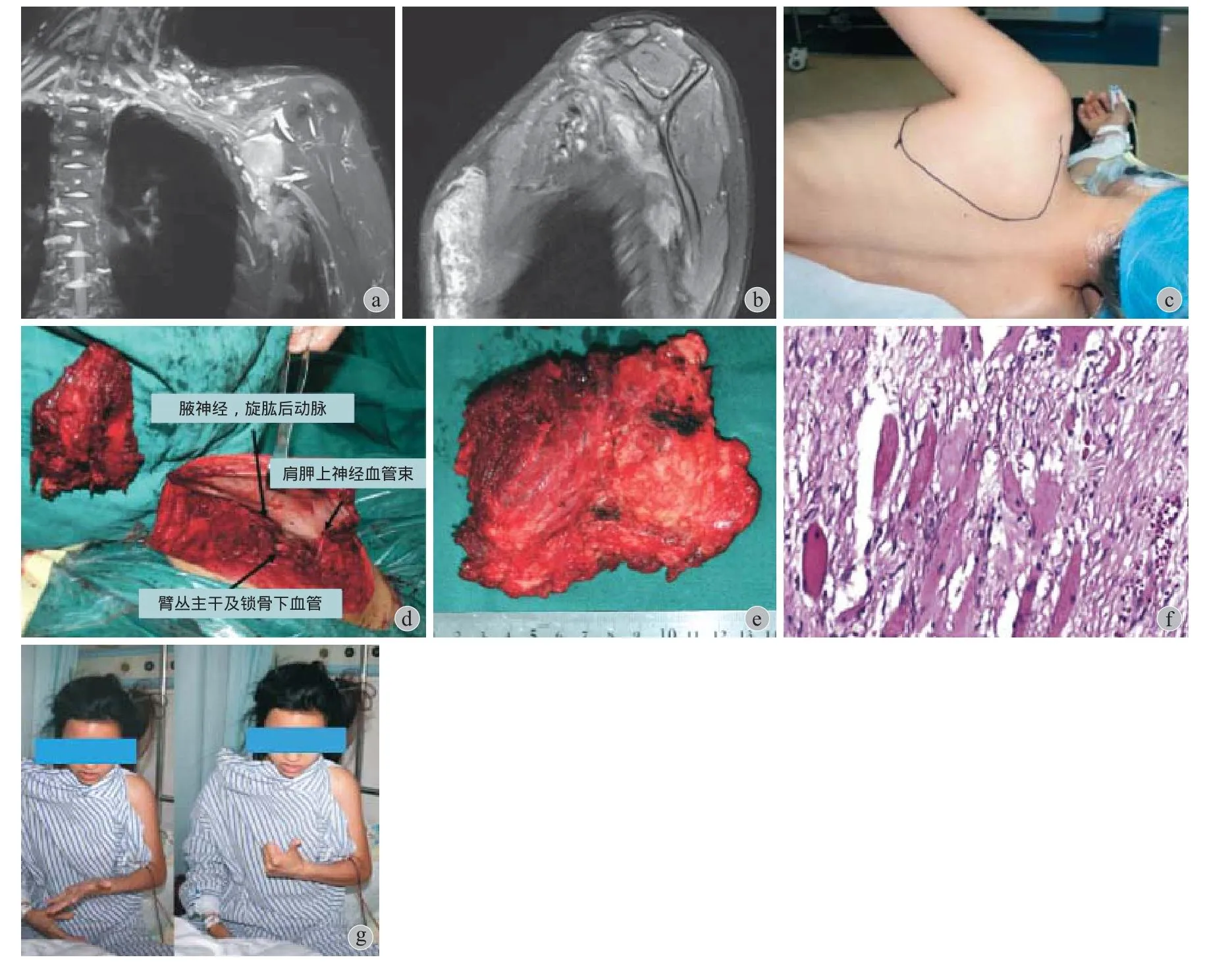
图5 患者,女,21 岁,臂丛后方肿瘤 a~b:术前 MRI 示左侧锁骨区及肩胛骨前方软组织内多发大小不等结节影,臂丛神经血管束挤压变形;c:示手术切口位置;d:为术中肿瘤暴露与切除;e:为切除肿瘤,包膜完整;f:组织病理结果提示侵袭性纤维瘤;g:为术后患者右上肢功能正常Fig.5 Female, 21 years old, posterior brachial plexus tumor a - b: MRI showed the masses in front of the scapula and behind the brachial plexus, distorted the normal neurovascular anatomy; c: Operative incision; d: Intraoperative exposure and excision; e - f: Tumor with intact capsule was proven to be desmoids on histopathology; g: Right upper extremity with good function
二、各种手术方式特点、适应证及术中注意事项
虽然有很多方法建议治疗臂丛区域的肿瘤,但手术建议和文献报道的不完全相同。
1. 采用锁骨上入路 C 型切口适用于主要位于臂丛主干上方和锁骨上窝的肿瘤,可获得良好的暴露。Arvind[7]采用锁骨上入路手术切除 3 例臂丛上方肉瘤,2 例获得扩大切,1 例边缘切。本组臂丛上方肿瘤 3 例均为恶性,均采用边缘切,3 例术后病理提示切缘均为阴性,术中无神经损伤并发症,随访无复发。
2. 经典臂丛前路包括锁骨前上、锁骨下、锁骨上下联合入路[8]。当肿瘤累及 C8、T1神经根或臂丛下干时前路常因肿瘤被锁骨阻挡造成暴露困难,文献建议此处肿瘤选择后路[9]。但后路不能在直视下分离锁骨下血管,一旦发生血管损伤将造成难以控制的大出血。笔者体会是臂丛下干肿瘤采用前路并锁骨截骨后也可获得良好的暴露。虽然锁骨截骨创伤较大,但可在直视下分离锁骨下血管,便于控制术中出血。本组 7 例采用经典臂丛前路,2 例位于下干,无一例复发及症状加重。
3. 三角肌胸大肌入路,可广泛显露肱骨近端[10],经过改良常用于肱骨近端肿瘤切除,切口向远端延伸可切除肩胛骨[11]。本组在此入路基础上进行改良,使切口的远端偏向内移,与传统入路比可获得更好的手术视野,肿瘤暴露更充分。缺点是会导致一部分胸大肌纤维失神经支配。本组 4 例患者采用改良三角肌胸大肌入路,术后无神经损伤并发症,3 例切缘阴性,1 例转移瘤因广泛侵润切缘阳性。
4. 锁骨截骨入路切口形成的弧型皮瓣牵开后可以充分暴露肿瘤上下极神经血管束。臂丛前方肿瘤累及锁骨时需将肿瘤与锁骨一并切除,锁骨骨缺损会引起明显的肩峰下应力增高 ( >40% ),远期易导致肩周炎[12],故对于良性肿瘤引起的缺损一些学者还建议进行重建。根据笔者的经验是缺损在 7 cm 以内,锁骨与髂骨的弧度较吻合,建议取自体髂骨重建;缺损超过 7 cm 时锁骨与髂骨吻合度较差,故采用自体腓骨重建。本组 3 例采用锁骨截骨入路,所有瘤体均获得较好暴露切除,切缘均阴性,术后无神经损伤并发症,2 例恶性,1 例良性,随访 2 年均存活。
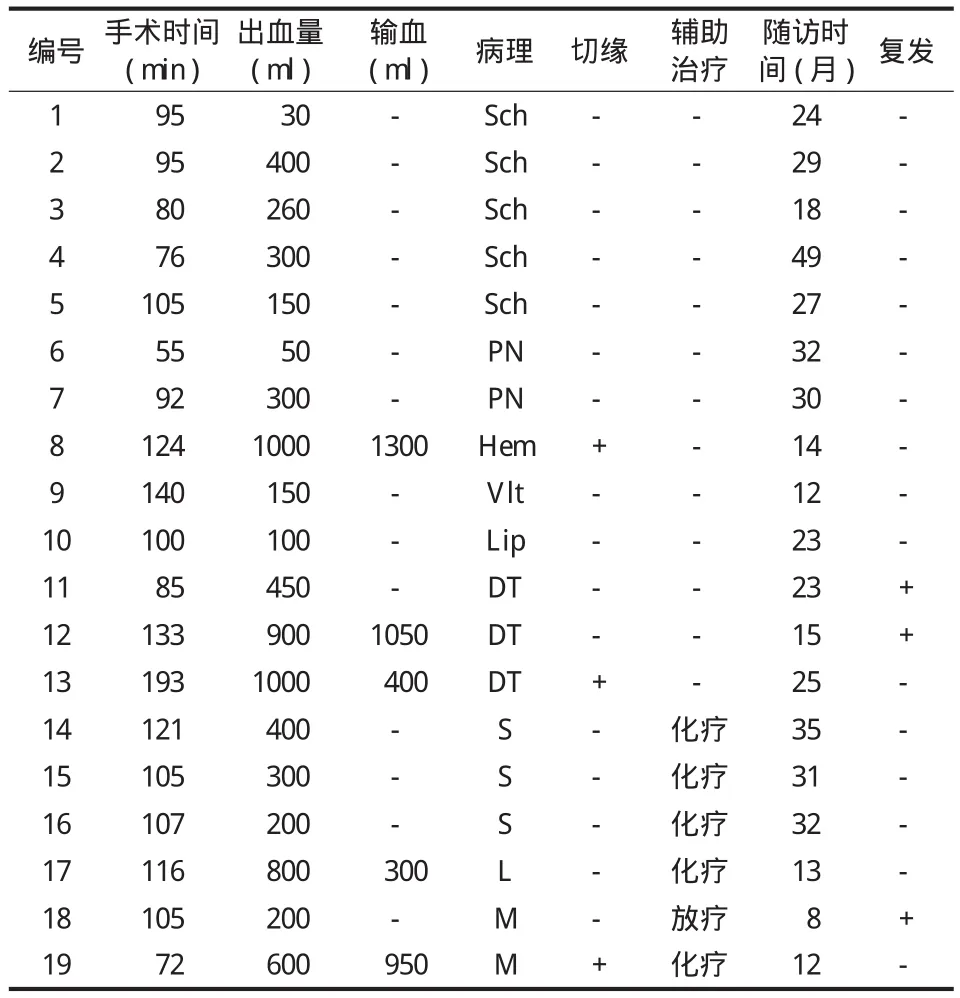
表2 术中数据及术后随访Tab.2 Intraoperative data and post-operative follow up
5. 后方入路适用于位于臂丛神经根部或下位臂丛神经的肿瘤[13],最早由 Dubuisson 等[14]提出。但暴露空间有限,肿瘤位置深在,一旦损伤血管,将造成难以控制的大出血,从而影响切除的安全性和彻底性。有学者建议可用于切除哑铃状神经纤维瘤或同时侵犯椎间孔内外的臂丛神经,对于前路术后复发的臂丛后方肿瘤也是理想的适应证[15]。本组2 例采用后方入路,术中无神经损伤并发症,虽无复发,但切缘均阳性。
本研究的缺陷是将不同类型的肿瘤混杂在一起,一定程度上影响了结果的可比性。主要原因还是此部位肿瘤发病率太低。同一类型同一部位很难积累足够数量病例进行比较,影响了本研究数据的循证力度。
[1] Kehoe NJ, Reid RP, Semple JC. Solitary benign peripheralnerve tumours[J]. J Bone Joint Surg Br, 1995, 77(3):497-500.
[2] Huang JH, Jason H, Samadani U, et al. Brachial plexus region tumors: a review of their history, classification, surgical management, and outcomes[J]. Neur Quarterly, 2003, 13(3): 151-161.
[3] Enneking WF. A system of staging musculoskeletal neoplasms[J]. Clin Orthop Relat Res, 1986, (204):9-24.
[4] Boriani S, Bandiera S, Biagini R, et al. Staging and treatment of primary tumors of the spine[J]. Cur Opin Orthop, 1999, 10(2):93-100.
[5] Tomita K, Kawahara N, Baba H, et al. Total en bloc spondylectomy: a new surgical technique for primary malignant vertebral tumors[J]. Spine, 1997, 22(3):324-333.
[6] Ho CR, Chuang CC. Neural sheath tumors of the brachial plexus-- 22-year experience at Chang Gung Memorial Hospital[J]. J Taiwan Soci Plas Surg, 2010, 19(4):287-298.
[7] Rawal A, Yin Q, Roebuck M, et al. Atypical and malignant peripheral nerve-sheath tumors of the brachial plexus: Report of three cases and review of the literature[J]. Microsurgery, 2006, 26(2):80-86.
[8] Tender GC, Kline DG. Anterior supraclavicular approach to the brachial plexus[J]. Neurosurgery, 2006, 58(4 Suppl 2): S364-365.
[9] Das S, Ganju A, Tiel RL, et al. Tumors of the brachial plexus[J]. Neurosurgical Focus, 2007, 22(6):E26.
[10] Maman E, Malawer MM, Kollender Y, et al. Large tumors of the axilla: limb-sparing resection versus amputation in 27 patients[J]. Clin Orthop Relat Res, 2007, 461:189-196.
[11] Wittig JC, Bickels J, Wodajo F, et al. Utilitarian shoulder approach for malignant tumor resection[J]. Orthop, 2002, 25(5):479-484.
[12] Andermahr J, Jubel A, Elsner A, et al. Malunion of the clavicle causes signif cant glenoid malposition: a quantitative anatomic investigation[J]. Surg Radiol Anat, 2006, 28(5):447-456.
[13] Hager S, Backus TC, Futterman B, et al. Posterior subscapular dissection: An improved approach to the brachial plexus for human anatomy students[J]. Ann Anat, 2014, 196(2-3):88-91.
[14] Dubuisson AS, Kline DG, Weinshel SS. Posterior subscapular approach to the brachial plexus: report of 102 patients[J]. J Neurosurgery, 1993, 79(3):319-330.
[15] Zhao B, Xu J. Extensive posterolateral exposure and total removal of the giant extraforaminal dumbbell tumors of cervical spine: surgical technique in a series of 16 patients[J]. Spine J, 2009, 9(10):822-829.
( 本文编辑:裴艳宏 )
Suggestions for surgical classification of and operative approach to brachial plexus region tumors
SHA Mo,DING Zhen-qi, KANG Liang-qi, HONG Hai-sen, WANG Zhen, GUO Zheng. Department of Orthopedics, the 175th Hospital of the People’s Liberation Army (PLA), Xiamen University Affiliated to South East Hospital, Zhangzhou, Fujian, 363000, China
SHA Mo, Email: shamo5@163.com
ObjectiveTo investigate the surgical classif cation of and the corresponding surgical approach to brachial plexus region tumors, and to evaluate the surgical outcomes and prognosis.MethodsA retrospective study was performed from January 2008 to December 2014 after surgical treatment of brachial plexus region tumors in 19 cases in our department. According to the space relationship between tumour and brachial plexus, we proposed a relatively simple surgical partitioning method and gave advice for the corresponding operative approach: ( 1 ) Upper brachial plexus tumor ( anterior supraclavicular ); ( 2 ) Interior brachial plexus tumor ( classic anterior clavicular ); ( 3 ) Inferior brachial plexus tumor ( utilitarian shoulder approach ); ( 4 ) Anterior brachial plexus tumor ( clavicle osteotomy ); ( 5 ) Posterior brachial plexus tumor ( posterior subscapular ). Postoperative analysis of pathological features, surgical complications and follow-up information was performed to understand the extent of improvement in symptoms, relapse and mortality of the 19 cases.ResultsThe 19 patients were followed up for a range from 8 to 49 months ( average = 24.1 months ). There was no recurrence of benign tumor during follow-up. Two patients developed C8and T1nerve root symptoms in postoperative period, one patient with the C8nerve root symptoms did not signif cantly improve during the follow-up for 29 months, the other patients with the T1nerve root symptoms improved after 1 month. In patients who complained of pain at presentation, 8 became pain free, while pain severity was reduced after surgery in the remaining 2 patients. Only one patient with sensory loss at initial presentation, reported postoperative remission of the symptom. After surgery, motor def cits improved in 4 patients and resolved in 2 patients. One patient presented with new motor def cits postsurgery, who subjected to an en bloc resection, did not improve. Two patients diagnosed as desmoid had recurrence. One patient diagnosed as follicle-like soft tissue sarcoma died of lung cancer metastasis after 8 months, the others were alive.ConclusionsAccording to the space relationship between tumour and brachial plexus to do surgicalpartitioning and give advice for the corresponding operative approach, it’s simple and easy for communication. Using this classif cation as a reference to select the appropriate surgical approach, good results can be obtained.
Brachial plexus; Soft tissue neoplasms; Surgical procedures, operative
10.3969/j.issn.2095-252X.2017.02.006
R738.6
本研究各单位的第一作者均为本文并列第一作者。363000 漳州,厦门大学附属东南医院,解放军第 175 医院全军骨科中心 ( 沙漠、丁真奇、康两期、洪海森 );710032 西安,第四军医大学附属西京医院全军骨科研究所( 王臻、郭征 )
沙漠,Email: shamo5@163.com
2016-11-08 )

