还原Cr(VI)的混菌胞外聚合物和细菌群落结构分析
张恩华,戴幼芬,肖 勇,陈必链,杨朝晖,赵 峰(1.湖南大学环境科学与工程学院,环境生物与控制教育部重点实验室,湖南 长沙 41008;.中国科学院城市环境研究所,中国科学院城市污染物转化重点实验室,福建 厦门 6101;.福建师范大学生命科学学院,福建 福州 50108)
还原Cr(VI)的混菌胞外聚合物和细菌群落结构分析
张恩华1,2,戴幼芬2,3,肖 勇2,陈必链3,杨朝晖1*,赵 峰2(1.湖南大学环境科学与工程学院,环境生物与控制教育部重点实验室,湖南 长沙 410082;2.中国科学院城市环境研究所,中国科学院城市污染物转化重点实验室,福建 厦门 361021;3.福建师范大学生命科学学院,福建 福州 350108)
为了更好地理解混菌还原Cr(VI)机制,比较了源于活性污泥的混菌体系在厌氧和好氧培养条件下Cr(VI)还原能力的差异,分析了相应的胞外聚合物(EPS),并通过MiSeq高通量测序研究了细菌群落结构及多样性.结果表明,好氧和厌氧两个混菌体系对Cr(VI)均没有明显的吸附作用;随着培养时间的延长,溶液中的 Cr(VI)逐渐被还原为 Cr(III);培养至 72h,好氧体系和厌氧体系对 Cr(VI)的还原率分别达到 67%和78%.两种培养条件下,不加Cr(VI)对照组EPS含量明显高于加Cr(VI)实验组;实验组细菌群落多样性均低于相应对照组,厌氧体系细菌群落多样性低于好氧体系.接种源中的优势细菌类群为变形菌门、厚壁菌门、绿弯菌门和放线菌门,但经过 36d驯化培养后所有样本都是变形菌门占主导地位;在属水平上,柠檬酸杆菌属在Cr(VI)胁迫下相对丰度明显下降,而肠杆菌属相对丰度明显提高.
重金属;Cr(VI)还原;胞外聚合物;细菌群落;高通量测序
冶金、电镀等工业造成的铬污染正在威胁着自然环境和人类的健康[1].铬在环境中主要以Cr(III)和 Cr(VI)两种价态存在,其中 Cr(VI)易溶于水,迁移能力强,且毒性远大于 Cr(III)[2].因此,治理 Cr(VI)的主要策略之一是将其转化成Cr(III),从而降低其环境危害,常用的方法主要包括化学还原法、植物及微生物修复法,与这些方法相比,微生物修复法操作简单、经济安全,因此相关研究受到越来越多重视[3].
具有 Cr(VI)还原能力的微生物在自然环境和受 Cr(VI)污染的环境中广泛存在,已报道的Cr(VI)还原菌既有好氧菌、厌氧菌,也有兼性菌[4-5].目前利用微生物还原 Cr(VI)的研究报道多基于纯菌培养[6],利用混菌还原 Cr(VI)的研究则相对较少.但事实上使用混菌比使用纯菌还原 Cr(VI)操作更简单,成本更低,更适合实际应用于Cr(VI)污染的治理,因此对混菌还原Cr(VI)进行深入研究是非常必要的.混菌中不同微生物对 Cr(VI)耐受能力不同,面对 Cr(VI)的胁迫,能建立起自我保护机制的菌种在群落中逐渐占优,反之则被淘汰,这将引起微生物群落结构和多样性的变化.胞外聚合物(EPS)作为菌体与环境之间的缓冲层,有助于减小环境因素对菌体的损害[7],微生物通过调节EPS的产量和组分构成可能是应对 Cr(VI)胁迫的有效方式.然而,在驯化混菌还原Cr(VI)的过程中,我们对微生物群落结构及其多样性,混菌群落 EPS在驯化前后有何差异知之甚少.
本研究开展了驯化混菌还原 Cr(VI)的实验,分析了混菌在好氧和厌氧条件下驯化后还原Cr(VI)能力的差异,测定了相应的EPS产量,通过高通量测序测定了细菌群落结构及多样性,期望通过这些分析对混菌还原 Cr(VI)有更深入的认识,为微生物法还原 Cr(VI)投入实际应用提供理论依据.
1 材料与方法
1.1 试验过程
本研究以厦门市集美污水处理厂二沉池的活性污泥作为接种源.实验采用 M9培养基(pH 7.0),成分为(g/L):Na2HPO4·12H2O 15.12, KH2PO43.0,NH4Cl 1.0,NaCl 0.5,MgSO4·7H2O 0.492, CaCl2·2H2O 0.02,葡萄糖 4.0.设置好氧与厌氧培养两个混菌体系,厌氧培养基采用通入高纯度氮气1h的方式除氧.取5mL活性污泥,接种于60mL的好氧和厌氧体系培养基中,分别设对照组和加入10mg/L Cr(VI)实验组,每组3个平行,置于25℃,转速150r/min的摇床中培养.3d为一个培养周期,转接培养12个周期后,进行后续实验.
1.2 检测方法
铬的测定:Cr(VI)采用国标二苯碳酰二肼分光光度法(GB 7467-87)测定.以电感耦合等离子体原子发射光谱法(ICP-OES)测定溶液中的总Cr,预先用2%HNO3(V/V)配制一系列浓度的总铬溶液,取样进行标曲测定,样品也用2%HNO3稀释至合适浓度后进行测定.菌体吸附的Cr的含量由初始加入培养基的Cr(VI)含量减去所测总Cr含量得到.
EPS的提取与测定:EPS的提取采用加热法提取[8],将待测菌液离心收集菌体并用0.9%NaCl溶液洗涤后重悬,置于60℃下水浴30min,离心收集上清液,上清液即为加热法提取到的EPS溶液.胞外聚合物中的多糖和蛋白分别采用蒽酮比色法[9]和改良型 Bradford法[10]蛋白质浓度测定试剂盒(上海生工)测定.
EPS的荧光光谱分析:所用仪器为 Hitachi F-4600型荧光光谱仪.扫描波长范围: Ex=200~400nm, Em=250~550nm;激发和发射狭缝宽度均为5nm,步长均为5nm,扫描速度为1200nm/min.
1.3 微生物群落结构分析
DNA的提取:使用 FastDNA SPIN Kit for Soil(MP, USA)试剂盒提取微生物基因组 DNA,凝胶电泳检测合格后保存于-20℃备用.
PCR扩增与测序:PCR扩增引物采用细菌16S rDNA通用引物对338F/806R对V3+V4区进行PCR扩增引物.PCR反应体系为20μL,产物用 2%琼脂糖凝胶进行电泳检测,切胶回收 PCR产物并进行定量,制备 Miseq PE文库并用Miseq(Illumina, USA)进行高通量测序.
2 结果与讨论
2.1 Cr(VI)还原效果
好氧和厌氧两个培养条件下,无菌培养基中加入的 Cr(VI)含量基本保持不变,说明培养基对Cr(VI)没有去除效果,对后续实验不造成干扰.在第12个培养周期,每隔12h取样测定溶液中的总Cr和Cr(VI)含量,并计算出Cr(III)的含量.图1表明,好氧和厌氧体系溶液中所测总Cr量与加入体系中的初始 Cr(VI)量基本保持一致,说明这两个体系中的混菌对Cr没有明显的吸附或吸收作用.随着培养时间的延长,溶液中的 Cr(VI)逐渐被还原为Cr(III).培养72h后,好氧体系和厌氧体系对Cr(VI)的还原率分别达到67%和78%.前12h两个体系对 Cr(VI)的还原速率均较低,可能是因为微生物正处在生长阶段,体系中菌量较少,限制了Cr(VI)的还原.随后菌量不断增加,Cr(VI)还原速率也相应加快.而在 48h至 72h阶段,两个体系Cr(VI)还原速率逐渐产生差异.在 72h数据显示,厌氧体系Cr(VI)还原率比好氧高11%.造成这种差异的原因可能是在48h后,两体系内的菌量已经不再是还原 Cr(VI)的限制因素,而因培养条件不同导致的两体系内微生物群落结构的不同成为了相应的 Cr(VI)还原机制和速率存在差异的主要原因.由此可知,虽然在0h至48h这一阶段,厌氧混菌和好氧混菌 Cr(VI)还原率基本一致,但此后厌氧混菌表现出更高的 Cr(VI)还原率,说明在混菌治理 Cr(VI)污染过程中,保持厌氧环境有利于Cr(VI)的还原.

图1 不同培养条件下铬浓度变化Fig.1 Variation of Cr concentration in different conditions
2.2 EPS分析
在第12周期末期测定EPS含量,由图2可知,好氧和厌氧条件下不加Cr(VI)对照组EPS含量均显著高于加Cr(VI)实验组,对照组EPS中多糖含量也显著高于实验组.一些已报道纯菌还原Cr(VI)实验中,实验组 EPS含量通常要比对照组高[11],这与本实验结果不一致.其原因可能是,本实验为混菌体系,无 Cr(VI)对照组微生物群落组成中有些菌种高产 EPS但 Cr(VI)耐受性差,加Cr(VI)实验组中,这些菌无法耐受 Cr(VI),在群落占比中明显减少,这就使得对照组EPS含量高于实验组.本实验中厌氧加Cr(VI)实验组EPS含量比好氧加 Cr(VI)实验组含量高,尤其是蛋白含量明显高于好氧实验组,结合厌氧实验组 Cr(VI)还原率比好氧实验组高 11%这一结果,可得出与之前研究一致的结论,即EPS对重金属的去除起到重要作用,尤其蛋白的含量是影响去除效率的关键因素[12-13].Das、Kang等的研究表明EPS具有还原 Cr(VI)的能力,参与还原过程的主要是蛋白和一些还原性多糖,进一步的分析证明,蛋白中的酰胺基团(酰胺I带、酰胺II带)、羧基,以及多糖中的羟基、醛基、甲基、亚甲基是EPS与Cr(VI)作用的主要官能团[14-17].
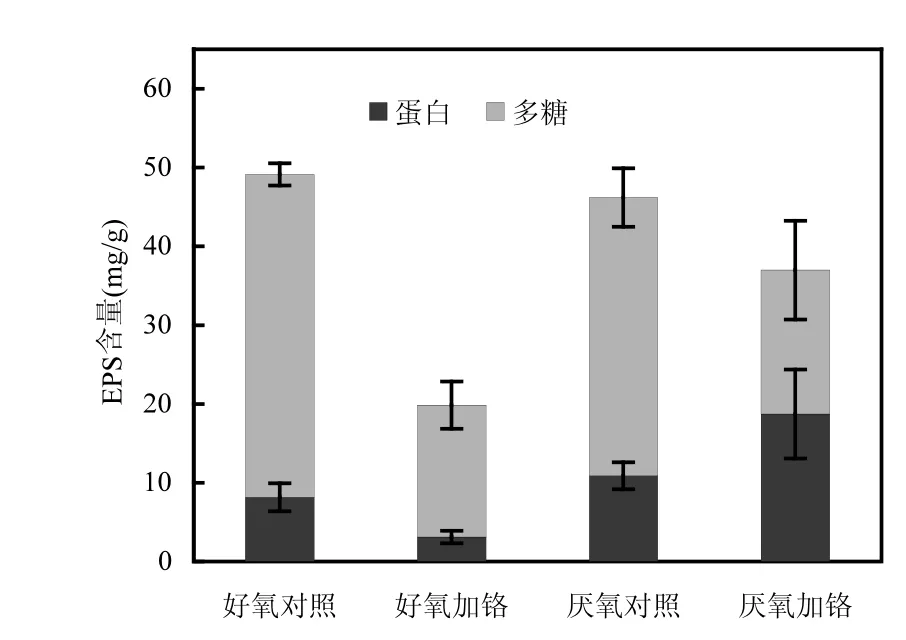
图2 对照组和实验组中EPS含量Fig.2 EPS content in the control groups and the experimental groups
不同培养条件下混合菌的EPS组分的荧光光谱分析见图 3, 1峰(Ex/Em=280/335~340nm)属于色氨酸类化合物和酪氨酸类化合物,2峰(Ex/Em=225/310~325nm)归属于芳香族类蛋白质, 3峰(Ex/Em=350/440nm)是腐殖酸类物质,4峰(Ex/Em=275/440~445nm)是富里酸类物质
[18_21].由图3a、3c可知,只有从好氧体系混菌提取得到的EPS才存在较明显的腐殖酸类和富里酸类物质的荧光峰,厌氧体系中则检测不到明显的对应峰,说明这是由于好氧和厌氧两种不同培养条件导致的.在 EPS成分上的不同可能也是好氧和厌氧两个体系 Cr(VI)还原能力存在差异的原因.

图3 两个混菌体系EPS的EEM荧光光谱Fig.3 EEM fluorescence spectra of EPS extracted from two mixed cultures
2.3 细菌群落结构分析
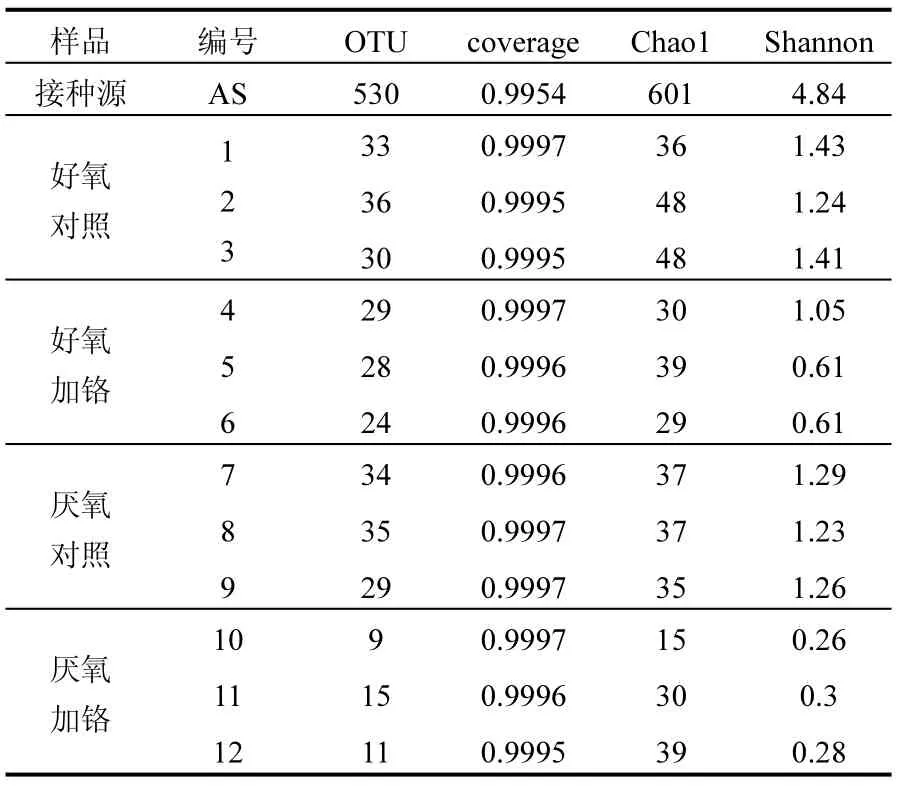
表1 所有样本细菌群落α-多样性Table 1 Alpha diversity of bacterial communities of all samples
在第12周期结束后取样分析微生物群落结构.微生物群落α-多样性:以16S rRNA基因序列97%相似度水平归类OUT并统计各样本的α-多样性见表1.各样本的coverage值都接近1,说明测序数据可以较好地反映微生物群落的真实情况.与其他样本相比,接种源样本OTU值、Chao1值和Shannon值均最大,说明其群落多样性最丰富.各样本经过 12个周期培养后多样性降低,加Cr(VI)实验组多样性显著低于相应对照组,说明Cr(VI)的胁迫会造成实验组群落多样性的降低.由此可知,铬污染可能会造成相应土壤、水体中原有微生物群落多样性的降低.厌氧体系对照组和实验组多样性比相应好氧体系偏低,表明如果应用到 Cr(VI)的治理中,好氧体系由于多样性较高,面对实际应用中运行参数和环境条件波动时,其系统稳定性可能更高.
细菌群落结构组成和相对丰度:图 4a(样品编号同表1)是样本群落结构在门水平上的相对丰度,接种源样本中主要存在四个门的细菌类群:变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、绿弯菌门(Chloroflexi)和放线菌门(Actinobacteria).经过不同条件的驯化培养后,物种多样性减小,绿弯菌门和放线菌门占比几乎为 0,除了厌氧对照组样本中有少部分的厚壁菌门存在,其他样本中几乎都是变形菌门.厌氧对照组中厚壁菌门占比高于好氧对照组,说明其更适合在厌氧条件下生长.加Cr(VI)实验组中厚壁菌门相对丰度非常低,说明其对Cr(VI)耐受性差.变形菌门细菌在所有样本中占据绝对主导地位,在好氧及厌氧条件下均大量存在,属于优势菌群,同时说明变形菌门中可能存在大量耐受Cr(VI)细菌.
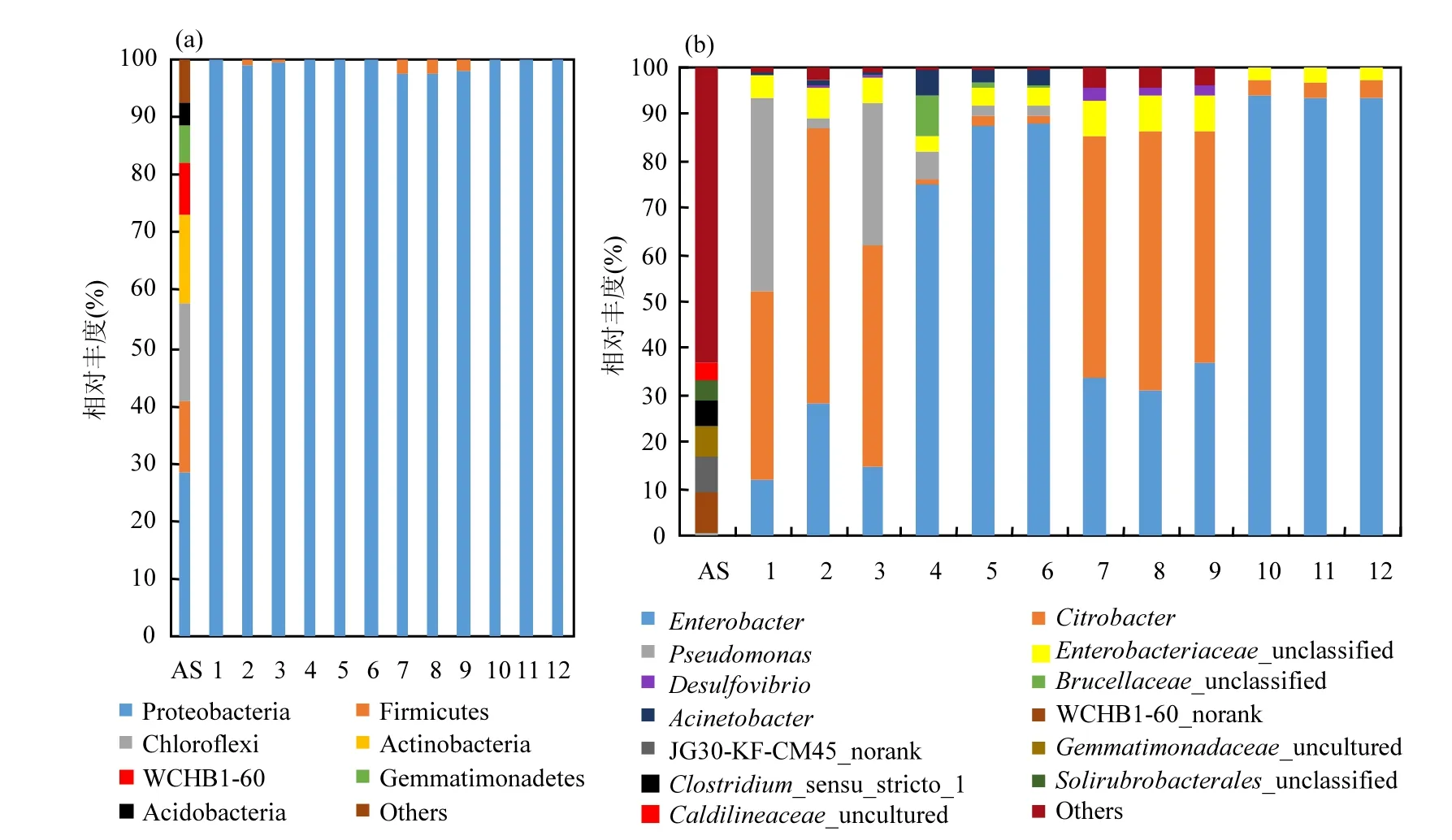
图4 各样本细菌群落在门(a)和属(b)水平上的相对丰度Fig.4 Relative abundance of phylum (a) and genus (b) in all samples
图4b进一步从属水平上对群落结构进行分析.在无Cr(VI)胁迫下,柠檬酸杆菌属(Citrobacter)无论是在好氧还是厌氧条件下均属于优势种群,相对丰度均大于40%.在Cr(VI)胁迫下,柠檬酸杆菌属的相对丰度显著下降,相对丰度均小于 5%,同时肠杆菌属(Enterobacter)相对丰度显著提高,相对丰度均大于 70%.说明柠檬酸杆菌属大部分细菌对 Cr(VI)耐受能力较弱,而肠杆菌属中存在对Cr(VI)耐受能力较强的菌种.已有研究报道,肠杆菌属中存在某些兼性还原菌,在好氧和厌氧条件下均可耐受一定浓度的 Cr(VI)[22],与本实验结果一致.好氧无 Cr(VI)胁迫下假单胞菌属(Pseudomonas)平均相对丰度大于20%,在Cr(VI)胁迫下相对丰度小于 10%.厌氧条件不存在假单胞菌属,证明假单胞菌属属于好氧Cr(VI)还原菌,与之前报道一致[23].不动杆菌属(Acinetobacter)主要出现在好氧条件下,且有 Cr(VI)存在时其丰度更大,表明该属对 Cr(VI)的好氧还原可能具有比较重要的作用.
3 结论
3.1 好氧和厌氧培养的混菌均可还原 Cr(VI)为Cr(III),但对Cr没有明显的吸附或吸收作用,厌氧培养条件下Cr(VI)的还原率高于好氧培养.
3.2 不加 Cr(VI)对照组 EPS含量明显高于加Cr(VI)实验组,可能是由于对照组和实验组中微生物群落结构的不同造成的.
3.3 加 Cr(VI)实验组细菌群落多样性均低于相应对照组,厌氧体系多样性均低于对应好氧体系.Cr(VI)的加入会显著降低细菌群落多样性,肠杆菌属是加 Cr(VI)实验组中的优势属,表明该属可能具有较强的 Cr(VI)耐受性甚至 Cr(VI)还原能力.
[1] 任学昌,徐丽凤,杜翠珍,等.光助纳米铁还原 Cr(VI)的研究 [J].中国环境科学, 2014,34(10):2562-2567.
[2] 秦泽敏,董黎明,刘 平,等.零价纳米铁吸附去除水中六价铬的研究 [J]. 中国环境科学, 2014,34(12):3106-3111.
[3] 叶锦韶,尹 华,彭 辉,等.高效生物吸附剂处理含铬废水 [J].中国环境科学, 2005,25(2):245-248.
[4] Jeyasingh J, Philip L. Bioremediation of chromium contaminated soil: optimization of operating parameters under laboratory conditions [J]. Journal of Hazardous Materials, 2005,118(1):113-120.
[5] Cheung K, Gu J D. Mechanism of hexavalent chromium detoxification by microorganisms and bioremediation application potential: a review [J]. International Biodeterioration & Biodegradation, 2007,59(1):8-15.
[6] 高小朋,张欠欠,许 平,等.微生物还原 Cr(VI)的研究进展 [J].微生物学通报, 2008,35(5):820-824.
[7] 康福星,龙 健,王 倩,等.微生物胞外聚合物对水体重金属和富营养元素的环境生化效应研究展望 [J]. 应用与环境生物学报, 2010,16(1):129-134.
[8] Sun M, Li W W, Mu Z X, et al. Selection of effective methods for extracting extracellular polymeric substances (EPSs) from Bacillus megaterium TF10 [J]. Separation and Purification Technology, 2012,95:216-221.
[9] Yuan S J, Sun M, Sheng G P, et al. Identification of key constituents and structure of the extracellular polymeric substances excreted by Bacillus megaterium TF10for their flocculation capacity [J]. Environmental Science & Technology, 2010,45(3):1152-1157.
[10] Frølund B, Palmgren R, Keiding K, et al. Extraction of extracellular polymers from activated sludge using a cation exchange resin [J]. Water Research, 1996,30(8):1749-1758.
[11] Sheng G P, Yu H Q, Yue Z B. Production of extracellular polymeric substances from Rhodopseudomonas acidophila in the presence of toxic substances [J]. Applied Microbiology and Biotechnology, 2005,69(2):216-222.
[12] Ledin M. Accumulation of metals by microorganisms—processes and importance for soil systems [J]. Earth-Science Reviews, 2000,51(1):1-31.
[13] Sheng G P, Yu H Q, Li X Y. Extracellular polymeric substances (EPS) of microbial aggregates in biological wastewater treatment systems: a review [J]. Biotechnology Advances, 2010,28(6):882-894.
[14] Das S K, Guha A K. Biosorption of chromium by Termitomyces clypeatus [J]. Colloids and Surfaces B: Biointerfaces, 2007, 60(1):46-54.
[15] Kang S Y, Lee J U, Kim K W. Biosorption of Cr (III) and Cr (VI) onto the cell surface of Pseudomonas aeruginosa [J]. Biochemical Engineering Journal, 2007,36(1):54-58.
[16] Doshi H, Ray A, Kothari I. Biosorption of cadmium by live and dead Spirulina: IR spectroscopic, kinetics, and SEM studies [J]. Current Microbiology, 2007,54(3):213-218.
[17] Parikh S J, Chorover J. FTIR spectroscopic study of biogenic Mn-oxide formation by Pseudomonas putida GB-1 [J]. Geomicrobiology Journal, 2005,22(5):207-218.
[18] Ramesh A, Lee D J, Hong S. Soluble microbial products (SMP) and soluble extracellular polymeric substances (EPS) from wastewater sludge [J]. Applied Microbiology and Biotechnology, 2006,73(1):219-225.
[19] 姚 萌,罗红元,谢小青,等.城市污水厂活性污泥胞外聚合物的三维荧光特性分析 [J]. 中国环境科学, 2012,32(1):94-99.
[20] Wu F, Tanoue E. Isolation and partial characterization of dissolved copper-complexing ligands in streamwaters [J]. Environmental Science & Technology, 2001,35(18):3646-3652.
[21] Adav S S, Lee D J. Extraction of extracellular polymeric substances from aerobic granule with compact interior structure [J]. Journal of Hazardous Materials, 2008,154(1):1120-1126.
[22] Komori K, Wang P C, Toda K, et al. Factors affecting chromate reduction in Enterobacter cloacae strain HO1 [J]. Applied Microbiology and Biotechnology, 1989,31(5/6):567-570.
[23] Schackmann A, Müller R. Reduction of nitroaromatic compounds by different Pseudomonas species under aerobic conditions [J]. Applied Microbiology and Biotechnology, 1991,34(6):809-813.
Analysis of extracellular polymeric substances and bacterial community in mixed cultures for Cr(VI) reduction.
ZHANG En-hua1,2, DAI You-fen2,3, XIAO Yong2, CHEN Bi-lian3, YANG Zhao-hui1*, ZHAO Feng2
(1.Key Laboratory of Environmental Biology and Pollution Control, College of Environmental Science and Engineering, Hunan University, Changsha 410082, China;2.Key Laboratory of Urban Pollutant Conversion, Institute of Urban Environment, Chinese Academy of Sciences, Xiamen 361021, China;3.College of Life Sciences, Fujian Normal University, Fuzhou 350108, China). China Environmental Science, 2017,37(1):352~357
To better understand the mechanisms of Cr (VI) reduction by mixed microbial communities, Cr (VI) bio-reduction was performed by mixed cultures from activated sludge under both aerobic and anaerobic conditions. The component and quantity of extracellular polymeric substances (EPS) were analyzed, and the bacterial communities were determined by high throughput sequencing. No chromium adsorption was observed by the mixed cultures in the present study. In the 12th acclimation cycle, 67% and 78% of Cr(VI) was reduced by the aerobic and anaerobic cultures in 72h, respectively. More EPS were extracted from control groups than that from Cr(VI)-treated groups. The diversities of bacterial communities in Cr(VI)-treated groups were lower than those in control groups. Proteobacteria, Firmicutes, Chloroflexi and Actinobacteria were the most dominant phyla in the inoculum sample. But, all samples were dominated by Proteobacteria after a culture of 36days with Cr(VI). While the relative abundance of Citrobacter in cultures was significantly decreased by Cr(VI), the relative abundance of Enterobacter was remarkably increased by Cr(VI).
heavy metal;Cr(VI) reduction;EPS;bacterial community;high-throughput sequencing
X172
A
1000-6923(2017)01-0352-06
张恩华(1991-),男,河南鹤壁人,湖南大学硕士研究生,主要研究方向为水污染控制.
2016-05-20
国家自然科学基金资助项目(51208490,51478451);中国科学院知识创新工程青年人才领域前沿项目(IUEQN201306)
* 责任作者, 教授, yzh@hnu.edu.cn

