盐生植被演替对土壤微生物碳源代谢活性的影响
裴 振,孔 强,郭笃发(山东师范大学地理与环境学院,山东 济南 250014)
盐生植被演替对土壤微生物碳源代谢活性的影响
裴 振,孔 强,郭笃发*(山东师范大学地理与环境学院,山东 济南 250014)
采用Biolog-Eco微平板法,研究了黄河三角洲地区不同盐生植被下土壤微生物的碳源代谢特征,并探讨了土壤微生物碳源代谢水平与盐生植被演替的关系.结果表明,黄河三角洲土壤质量随盐生植被正向演替呈现逐渐改善的趋势,盐生植被从“裸地-强耐盐植物-轻耐盐性植物”演替过程中,土壤微生物碳源代谢活性极显著增强(P<0.01).土壤微生物群落的 Shannon-Wiener指数、丰富度、Simpson指数和Pielou均匀度指数按演替顺序逐渐增加,且与全氮、碱解氮呈现显著(P<0.05)正相关,与土壤盐度呈现极显著负相关(P<0.01).随着“光板地-强耐盐植物-轻度耐盐植物”的演替,微生物利用的碳源种类不断增加,所利用的各类碳源数量上也越来越接近.全氮(Total nitrogen)和碱解氮(Available nitrogen)显著促进了微生物的碳源代谢活性,土壤盐度则显著抑制了土壤微生物的碳源代谢活性.
Biolog-Eco微平板法;碳源代谢多样性;盐生植被演替;主成分分析;冗余分析
黄河三角洲为陆进海退之地,由于离海距离、成陆时间及土壤脱盐程度不同,以裸地为起点,形成了强度、中度、轻度不同耐盐程度的植被演替系列,植被演替系列完整[1],是研究土壤微生物碳源代谢多样性和盐生植被演替关系的天然实验室.
目前,对黄河三角洲土壤微生物的研究比较活跃,内容主要涉及到黄河三角洲地区土壤微生物群落结构和分布特征,酶活性和土壤微生物数量,群落演替和土壤微生物之间的关系.
土壤微生物多样性在维持土壤质量和生态系统稳定方面的作用日益引起人们的重视[2].田伟君等在研究石油输入对河口芦苇湿地根际微生物的影响中发现,石油输入降低了土壤的含氧量,减少了微生物的数量,改变了微生物的优势种群[3].土壤微生物多样性对环境的作用主要是通过群落代谢功能差异实现的,土壤微生物功能多样性信息对于明确不同环境中微生物群落的作用,深入了解生态系统的内部结构和功能变化具有重要意义[4].张玥等在研究黄河三角洲土壤古菌群落结构对盐生植被演替的响应中发现,土壤古菌群落结构与盐生植被演替顺序不具有严格的一致性[5].而当前对于黄河三角洲土壤微生物功能多样性和黄河三角洲地区盐生植被演替的研究相对较少.
本研究采用Biolog-Eco微平板法[6],对不同盐生植被群落下土壤微生物碳源代谢水平和微生物功能多样性指数进行研究,同时结合土壤理化性质进行分析,来探寻土壤微生物碳源代谢水平随盐生植被演替的变化规律,为盐生植被演替提供重要的参考依据,从而为黄河三角洲生态恢复和利用提供理论支持和技术支持.
1 材料与方法
1.1 研究区概况和样品采集
研究地点位于山东省东营市垦利县(118°44′14.1″E~118°55′10.3″E, 37°26′16.7″N~37°32′41.4″N),地处北温带大陆性季风型气候带,四季气候变化明显,降水量时空分布不均,降水主要集中在7、8月,占全年的70%,年平均蒸发量是降水量的3.22倍[7].根据成陆时间以及离海距离,该区分布着含盐量不同的盐成土和雏形土,且土壤普遍含有碳酸钙.
通过对黄河三角洲的实地考察,在研究区内沿东西向路线(横跨现代三角洲和近代三角洲),依照盐生植被演替顺序,于2012年6月选择光板地(Bare board)、两种强耐盐植物群落(翅碱蓬(Saline seepweed)和獐茅(Angiospermae)、两种轻耐盐植物群落(白茅(Imperata)和罗布麻(Apocynum venetum)),每个群落取3个样地,在每个样地采用对角线5点采样法,采集土壤样品.采样时,采集深度 0~20cm,并混合均匀,除去较大的根系等杂物,分成两份,每份约 200g.一份土样封于灭菌袋中,保存在 4℃条件下,用于土壤理化性质和酶活性分析;另一份土样利用冷冻干燥保藏法,保存在-80℃条件下,用于土壤微生物功能多样性研究[8].
1.2 土壤理化性质测定
土壤全氮和有机碳测定采用元素分析仪,碱解氮测定采用碱解扩散法,土壤速效磷测定采用Olsen法,土壤粒径分析参考 Kettler等的方法[9],土壤pH值采用pH计测定(土:水=1:5).
1.3 土壤微生物碳源代谢水平测定
采用Biolog-Eco微平板法对不同盐生植被下土壤的微生物碳源代谢活性进行分析.具体实验步骤参照Govaerts等的研究方案[10].生态板放置在生化培养箱中 28℃的条件下培养 8d,每隔24h在Biolog微生物自动鉴定系统(Micro Station TM System,美国Biolog公司)上测定590nm的吸光度[11].
每孔的平均吸光值(average well color development, AWCD)来指示微生物群落功能代谢能力,计算表达式:
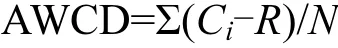
式中:Ci是所测的每个培养孔的吸光值,用来表示土壤微生物碳源代谢活性;R是对照孔的吸光值;N为培养基碳源的种类,碳源种类数为31[12].
土壤微生物功能多样性计算公式如下[13]:
Shannon-Wiener指数 H=-ΣPi*ln(Pi),H为; Pi=(Ci-R)/Σ(Ci-R),Pi为每个孔扣除空白以后吸光度与总吸光度的比值;
丰富度指数(Richness):为每孔中(C-R)的值大于0.25的孔数S;
Simpson 指数(D)又称优势度指数: D=1-ΣPi2;
Pielou均匀度指数: JSW = H/lnS,S为每孔中(C-R)的值大于0.25的孔数S.
土壤微生物AWCD值、土壤微生物多样性指数和稳定性指标的显著性检验采用单因素方差分析(one-way ANOVA)和最小显著性差异(LSD);用Person相关系数分析微生物多样性指标与土壤理化性质相关性;主成分分析采用 SPSS22.0软件完成;冗余分析采用Canoco5.0软件[14].
2 结果与分析
2.1 土壤理化性质分析
不同植被类型下土壤理化性质存在显著差异(见表 1).本研究采用电导率表征土壤含盐量,光板地盐化程度显著高于其他盐生植被土壤(P<0.05),轻耐盐群落(罗布麻群落、白茅群落)土壤中含盐量最低.有机碳、全氮、碱解氮在轻度耐盐群落土壤中高于强耐盐性群落土壤;土壤pH值随盐生植被演替呈现逐渐降低的趋势,在“光板地-强耐盐性植物演替”过程中,土壤pH值变化不大,相互之间差异不显著,但是从“强耐盐植物-轻度耐盐植物”演替过程中,土壤 pH值显著降低.总体来说,随盐生植被演替土壤质量呈改善的趋势.

表1 黄河三角洲地区不同盐生植被下土壤理化性质比较Table 1 Analysis of physicochemical property of different vegetations in The Yellow River Delta
2.2 不同盐生植被下土壤微生物碳源代谢水平的动态分析
土壤微生物平均吸光值(AWCD)是对生态板中31 种碳源利用能力的综合反映,可作为微生物整体活性的有效指标来表征微生物对碳源的利用情况.图1表明, AWCD值在一定的时间范围内随着时间的延长而增强,变化趋势呈“S”型,盐生植被从裸地-强耐盐性植物-轻耐盐性植物演替过程中,土壤微生物碳源代谢活性显著升高.在24h以内土壤微生物AWCD较低,全部低于0.1,微生物利用碳源能力较低,而在24~120h内的AWCD值迅速上升,碳源被大量利用, 微生物进入指数生长期120h后,生长速度降低,到168h时达到平衡.
120~192h的平均吸光度值(AWCD)方差分析表明,轻耐盐群落(白茅群落和罗布麻群落)下土壤微生物的 AWCD值显著(P<0.05)高于翅碱蓬和獐茅,两种强耐盐性植物群落下土壤微生物的 AWCD值显著高于光板地.值得注意的是,翅碱蓬和獐茅覆被类型下土壤微生物AWCD值差异不显著(P>0.05).
2.3 土壤微生物多样性指数分析比较
Shannon-Wiener指数、丰富度、Simpson指数和 Pielou均匀度指数可以反映土壤微生物群落功能多样性和均匀程度.表3表明,随着盐生植被从“裸地-强耐盐性植物-轻耐盐性植物” 演替,4种多样性指标逐渐增加.轻耐盐性植物群落(白茅群落和罗布麻群落)下土壤微生物的Shannon-Wiener指数、丰富度、Simpson指数和Pielou均匀度指数显著(P<0.05)高于强耐盐植物群落,光板地除了Shannon-Wiener指数高于翅碱蓬外,其各项指标最低.值得注意的是: 獐茅覆被下土壤微生物 4类功能多样性指数与罗布麻覆被下土壤微生物4 类功能多样性数相近.而两种强耐盐植物(翅碱蓬和獐茅)覆被下土壤微生物4类功能多样性指数差异较大.
全氮、碱解氮和土壤盐度对 4 类土壤微生物多样性指标具有显著影响.相关分析结果表明(表3), AWCD值与全氮、碱解氮以及酶活性呈现显著正相关(P<0.05),与土壤盐度呈现极显著负相关(P<0.01).Shannon-Wiener指数、丰富度、Simpson指数均与全氮、碱解氮呈现显著正相关,丰富度、Simpson指数和Pielou均匀度指数均与活性有机质具有显著正相关性,土壤盐度与4类微生物多样性指标呈现显著负相关.而土壤含水率、速效磷与AWCD值和多样性指数之间并无显著相关关系.

表2 不同覆被类型下土壤微生物功能多样性指数(N=96)Table 2 Diversity indices of soil microbial communities in different vegetations.

表3 平均吸光度值、土壤微生物多样性指数与土壤理化性质相关性相关系数Table 3 Correlation of diversity indexes of soil microbial communities, average well color development and physicochemical property of soil.

图1 土壤微生物平均吸光值变化(N=96)Fig.1 Changes of average well color development of soil microorganism.
2.4 不同盐生植被群落下土壤微生物碳源代谢主成分分析
对Biology-Eco微平板上31 种碳源代谢情况进行主成分分析,提取主成分相对应特征值大于1的前3 个主成分,累计贡献率可达97.008%.其中第一主成分的特征根和贡献率分别为19.712和 63.587%,第二主成分的特征根和贡献率分为7.458和24.058%,第三主成分的特征根和贡献率分别为2.902和9.362%.选取前两个主成分进行绘图,以PC1、PC2分别为x轴,y轴,以不同盐生植被在 2个主成分上的得分值为坐标绘制,得到土壤微生物碳源代谢的主成分分析图(图2).
不同覆被类型下土壤微生物利用主要碳源种类不同.光板地土壤微生物利用的主要碳源包括: 2-羟基苯甲酸、L-苯基丙氨酸等氨基酸和羧酸类物质;翅碱蓬覆被下土壤微生物利用的主要碳源包括: D-半乳糖醛酸和 L-苯基丙氨酸等碳水化合物和氨基酸类物质;獐茅覆被下土壤微生物利用的主要碳源包括: i-赤藓糖醇、D-甘露醇等碳水化合物类物质;罗布麻覆被下土壤微生物利用的主要碳源包括:D-半乳糖酸-γ-内脂、L-精氨酸等碳水化合物和氨基酸类物质,利用的碳源种类高达有5种;白茅覆被下土壤微生物利用的主要碳源包括: N-乙酰-D-葡萄糖胺、L-丝氨酸等碳水化合物和氨基酸等5类碳源,并且微生物利用各类碳源数量几乎相等.图2表明,白茅覆被下土壤微生物碳源代谢活性最强,其次是罗布麻,獐茅和翅碱蓬覆被下土壤微生物碳源代谢活性相差不大,光板地覆被下土壤微生物代谢活性最低,几乎为0.结果表明,不同覆被下土壤微生物碳源代谢不仅存在数量上的差异,同时也存在代谢活性上的差异;随着“光板地-强耐盐植物-轻度耐盐植物”的演替过程中,微生物利用的碳源种类不断增加,所利用的各类碳源数量上也越来越接近. 土壤理化性质对土壤微生物活性具有不同程度的影响,群落下土壤微生物碳源代谢活性与土壤理化性质关系如图3所示.电导率、全氮、碱解氮和活性.

图2 土壤微生物碳源代谢活性主成分分析Fig.2 Principal component analysis (PCA) on the functional diversity of soil microorganism.

表4 不同盐生植被下土壤微生物利用的主要碳源Table 4 Main carbon substrates utilized by microbial communities in different halophytic vegetations
2.5 黄河三角洲地区不同覆被下土壤微生物功能多样性冗余分析(RDA分析)

图3 土壤微生物功能多样性RDA分析Fig.3 Bioplots diagram of the redundancy analysis (RDA) of soil microbial community constrained by soil data
有机质是控制土壤微生物碳源代谢的主要因素第1轴序(Axis1)与第2轴序(Axis2)的解释变量达到83.31%,特征根分别是0.8210和0.0121,相关系数分别为0.9145和0.8744,说明环境因子对土壤微生物碳源代谢水平具有显著影响.第 1轴序与全氮(TN,r=0.8040)、碱解氮(AN,r= 0.8209)、活性有机质(SOC, r=0.6756)呈现负相关,与电导率(EC, r=0.9487)、土壤 pH(pH, r= 0.7783)、含水率(MC,r=0.1795)和温度(T,r= 0.6565)呈现正相关.第2轴序与全氮(r=0.2174)、碱解氮(r=0.2954)、活性有机质(r=0.0905)、电导率(r=0.3818)、土壤 pH(pH, r=0.5383)和含水率(r=0.7142)呈现负相关,与温度(r=0.5590)呈现正相关.第1轴几乎代表了所测土壤理化性质变化特征,电导率、碱解氮和全氮对土壤微生物代谢碳源活性影响高于其他理化性质.
3 讨论
3.1 黄河三角洲地区随盐生植被演替土壤微生物碳源代谢活性增加的理化性质调节机制
随着盐生植被从“裸地—强耐盐性植物—轻耐盐性植物”的演替,不同盐生植被下土壤微生物碳源种类利用具有较大的差异.总体来说,碳水化合物、氨基酸和多聚物是控制微生物碳源代谢发生分异的主要碳源,其中 D-半乳糖酸-γ-内脂和 D-半乳糖醛酸(碳水化合物)是强耐盐性植物和轻耐盐性植物覆被下微生物利用的主要碳源;L-苯基丙氨酸(氨基酸类)和 α-环式糊精是“裸地-强耐盐性植物-轻耐盐性植物”演替过程中盐生植被下微生物的主要碳源.具体来说,L-苯基丙氨酸(氨基酸类)、2-羟基苯甲酸(酚酸类)、D-半乳糖酸-γ-内脂(碳水化合物)、腐胺(胺类)是光板地利用的主要碳源;D-半乳糖醛酸(碳水化合物)、L-天门冬酰胺(氨基酸)和 α-环式糊精(多聚物类)是强耐盐性植物(獐茅和翅碱蓬)下土壤微生物碳源代谢的主要碳源;而两种轻耐盐植物(白茅和罗布麻)下土壤微生物碳源代谢种类丰富,但二者之间碳源代谢种类具有明显的不同.
朱平等研究发现,土壤有机质、pH值和全氮是主要引起微生物碳源代谢发生分异的重要因素[15-17].这是由于土壤全氮、碱解氮和活性有机质决定了土壤微生物生存的微环境,为土壤微生物生长提供能量,是影响土壤微生物群落的种类、活性和分布的关键[18].
图3表示,盐生植被基本上是按照从右向左水平进行演替,在演替过程中,獐茅和罗布麻之间距离较近.说明二者之间碳源代谢活性相似,从表1可知,二者之间除了活性有机质、速效磷、含水率和黏粒含量具有显著性差异之外,其他土壤理化性质差异性不显著;从表4中可知,二者虽然利用具体的碳源种类不同,但是都对碳水化合物、氨基酸和羧酸类代谢活性较高,这可能是导致上述4 种多样性指数相近的原因之一[19-20].獐茅群落到罗布麻群落演替过程中,由于演替程度相近,土壤微生物群落结构变化有限,导致功能多样性指数相近.但是獐茅和翅碱蓬两类强耐盐性植物之间4 类多样性指数差异较大[21].由图1可以看出,白茅和翅碱蓬之间其碱解氮、土壤有机质等7类土壤理化指标具有显著性差异,说明在盐生植被演替过程中,土壤理化性质变化对土壤微生物功能多样性指数影响较大[22-24].
3.2 黄河三角洲地区随盐生植被演替土壤微生物碳源代谢活性增加的植物调节机制
4种功能多样性指数描述了不同覆被类型下土壤微生物群落结构多样性,土壤微生物群落多样性、丰富度和均匀度随着盐生植被演替显著增加,优势度不断降低,土壤微生物群落结构朝着更稳定的方向变化[25].
植物群落和土壤微生物是相互关联的,之间具有显著的相互作用关系.大量研究发现,不同植被群落下土壤微生物的种类不同[26-28].随盐生植被演替,地上植物的种类不断增加,植物凋落物的类型、堆积深度、水分含量等对土壤生物定居的物理环境产生重要影响[29].植物通过根系作用释放了糖类、氨基酸、多聚物等小分子有机物,为微生物生长提供了丰富碳源;主成分表明,碳水化合物、氨基酸和多聚物是控制碳源代谢利用发生分异的主要碳源,但不同演替阶段的覆被类型下土壤微生物对上述三种碳源中具体的代谢种类具有较大差异.表4表明,光板地土壤微生物利用的主要碳源包括: 2-羟基苯甲酸、L-苯基丙氨酸等氨基酸和羧酸类物质;强耐盐性植物(翅碱蓬覆和獐茅)被下土壤微生物利用的主要碳源包括碳水化合物和氨基酸类等3 类物质;轻度耐盐植物(罗布麻和白茅)覆被下土壤微生物利用的主要碳源包括碳水化合物、氨基酸和多聚物等 5类碳源,微生物利用各类碳源数量几乎相等.研究表明,在“光板地-强耐盐性植物-轻耐盐性植物演替”演替过程中,地上植物种类不断增加,植物分泌碳源种类更加丰富,从而有利于微生物的生长.植物与微生物之间也通过这些凋落物和根系分泌物建立起密切联系,导致微生物与植物协同进化,促进了土壤微生物多样性[30-31].不同覆被下土壤微生物碳源代谢存在数量上的差异,但是随着“光板地-强耐盐植物-轻度耐盐植物”的演替过程中,微生物利用的碳源种类不断增加,所利用的各类碳源数量上也越来越接近[32].
4 结论
4.1 随着盐生植被“光板地-强耐盐性植物-轻耐盐性植物”的演替,土壤微生物AWCD显著增加(P<0.05).
4.2 不同覆被下土壤微生物碳源代谢存在数量上的差异,但是随着“光板地-强耐盐植物-轻度耐盐植物”的演替,微生物利用的碳源种类不断增加,所利用的各类碳源数量上也越来越接近.
4.3 不同盐生植被下土壤微生物 AWCD值、Shannon-Wiener指数、丰富度、优势度和均匀度指数与全氮、碱解氮呈现显著正相关(P<0.05),土壤盐度、全氮和碱解氮是土壤微生物利用碳源的调控因子.土壤盐度对微生物生长具有极显著抑制作用(P<0.01).
[1] 李 玲,仇少君,檀菲菲,等.盐分和底物对黄河三角洲区土壤有机碳分解与转化的影响 [J]. 生态学报, 2013,(21):6844-6852.
[2] 夏品华,寇永珍,喻理飞.喀斯特高原退化湿地草海土壤微生物群落碳源代谢活性研究 [J]. 环境科学学报, 2015,(8):2549-2555.
[3] 田伟君,王勇梅,孙会梅,等.石油输入对河口芦苇湿地根际微生物的影响 [J]. 中国环境科学, 2014,34(10):2676-2683.
[4] 曲同宝,王呈玉,庞思娜,等.松嫩草地 4种植物功能群土壤微生物碳源利用的差异 [J]. 生态学报, 2015,(17):5695-5702.
[5] 张 玥,孔 强,郭笃发,等.黄河三角洲土壤古菌群落结构对盐生植被演替的响应 [J]. 中国环境科学, 2016,36(7):2162-2168.
[6] 时 鹏,高 强,王淑平,等.玉米连作及其施肥对土壤微生物群落功能多样性的影响 [J]. 生态学报, 2010,(22):6173-6182.
[7] 郗金标,宋玉民,邢尚军,等.黄河三角洲生态系统特征与演替规律 [J]. 东北林业大学学报, 2002,(6):111-114.
[8] 罗希茜,郝晓晖,陈 涛,等.长期不同施肥对稻田土壤微生物群落功能多样性的影响 [J]. 生态学报, 2009,(2):740-748.
[9] Spohn M, Klaus K, Wanek W, et al. Microbial carbon use efficiency and biomass turnover times depending on soil depth implications for carbon cycling [J]. Soil Biology and Biochemistry, 2016,96:74-81.
[10] Rutgers M, Wouterse M, Drost S M, et al. Monitoring soil bacteria with community-level physiological profiles using Biolog™ ECO-plates in the Netherlands and Europe [J]. Applied Soil Ecology, 2016,97:23-35.
[11] Xu W, Ge Z, Poudel D R. Application and Optimization of Biolog EcoPlates in Functional Diversity Studies of Soil Microbial Communities [J]. MATEC Web of Conferences, 2015, 22:4015.
[12] 董立国,袁汉民,李生宝,等.玉米免耕秸秆覆盖对土壤微生物群落功能多样性的影响 [J]. 生态环境学报, 2010,(2):444-446.
[13] 张 杰,胡 维,刘以珍,等.鄱阳湖湿地不同土地利用方式下土壤微生物群落功能多样性 [J]. 生态学报, 2015,(4):965-971.
[14] Tian J, McCormack L, Wang J, et al. Linkages between the soil organic matter fractions and the microbial metabolic functional diversity within a broad-leaved Korean pine forest [J]. European Journal of Soil Biology, 2015,66:57-64.
[15] 朱 平,陈仁升,宋耀选,等.祁连山不同植被类型土壤微生物群落多样性差异 [J]. 草业学报, 2015,(6):75-84.
[16] Li Q, Hu Q, Zhang C, et al. The effect of toxicity of heavy metals contained in tailing sands on the organic carbon metabolic activity of soil microorganisms from different land use types in the karst region [J]. Environmental Earth Sciences, 2015,74(9): 6747-6756.
[17] 夏江宝,许景伟,李传荣,等.黄河三角洲退化刺槐林不同改造方式对土壤酶活性及理化性质的影响 [J]. 水土保持通报, 2012, (5):171-175.
[18] 侯晓杰,汪景宽,李世朋.不同施肥处理与地膜覆盖对土壤微生物群落功能多样性的影响 [J]. 生态学报, 2007,(2):655-661.
[19] Yu S, Li S, Tang Y, Wu X. Succession of bacterial community along with the removal of heavy crude oil pollutants by multiple biostimulation treatments in the Yellow River Delta, China [J]. Journal of Environmental Sciences, 2011,23(9):1533-1543.
[20] Yu Y, Wang H, Liu J, et al. Shifts in microbial community function and structure along the successional gradient of coastal wetlands in Yellow River Estuary [J]. European Journal of Soil Biology, 2012,49:12-21.
[21] 王 笛,马风云,姚秀粉,等.黄河三角洲退化湿地土壤养分、微生物与土壤酶特性及其关系分析 [J]. 中国水土保持科学, 2012, (5):94-98.
[22] 翁永玲,宫 鹏.黄河三角洲盐渍土盐分特征研究 [J]. 南京大学学报(自然科学版), 2006,(6):602-610.
[23] Xiang S, Doyle A, Holden P A, et al. Drying and rewetting effects on C and N mineralization and microbial activity in surface and subsurface California grassland soils [J]. Soil Biology and Biochemistry, 2008,40(9):2281-2289.
[24] Li Y, Hu Y, Ai X, et al. Acute and sub-acute effects of enrofloxacin on the earthworm species Eisenia fetida in an artificial soil substrate [J]. European Journal of Soil Biology, 2015,66:19-23.
[25] 丁秋祎,白军红,高海峰,等.黄河三角洲湿地不同植被群落下土壤养分含量特征 [J]. 农业环境科学学报, 2009,28(10):2092-2097.
[26] 张广帅,林勇明,马瑞丰,等.汶川地震灾区不同气候区土壤微生物群落碳源代谢多样性 [J]. 环境科学, 2015,36(2):669-6778.
[27] Zhang Z, Zhang X, Hao J, et al. Tillage and rotation effects on community composition and metabolic footprints of soil nematodes in a black soil [J]. European Journal of Soil Biology, 2015,66:40-48.
[28] Lammel D R, Nüsslein K, Tsai S M, et al. Land use, soil and litter chemistry drive bacterial community structures in samples of the rainforest and Cerrado (Brazilian Savannah) biomes in Southern Amazonia [J]. European Journal of Soil Biology, 2015,66:32-39.
[29] Guénon R, Gros R. Increasing the maturity of compost used affects the soil chemical properties and the stability of microbial activity along a mediterranean post-fire chronosequence [J]. European Journal of Soil Biology, 2015,66:1-10.
[30] 赵晓琛,刘红梅,皇甫超河,等.贝加尔针茅草原土壤微生物功能多样性对养分添加的响应 [J]. 农业环境科学学报, 2014, (10):1933-1939.
[31] Chen X, Li Z, Liu M, Jiang C, et al. Microbial community and functional diversity associated with different aggregate fractions of a paddy soil fertilized with organic manure and/or NPK fertilizer for 20 years [J]. Journal of Soils and Sediments, 2015,15(2):292-301.
[32] 王丽娟,李 刚,赵建宁,等.转基因大豆对根系土壤微生物群落功能多样性的影响 [J]. 农业科学学报, 2013.32(2):290-298.
Effect of succession of halophytic vegetation on soil microbial carbon metabolic activity.
PEI Zhen, KONG Qiang, GUO Du fa*
(College of Geography and Environment, Shandong Normal University, Jinan 250014, China). China Environment Science, 2017,37(1):373~380
Biolog method was used to reveal the distinction of carbon source metabolic activities in Yellow River Delta. The samples indicated three succession phases of salt vegetation types, which included “bare board-severe salt tolerant communities (Saline Seepweed, Angiospermae)-mild salt communities (Imperata and A. Venetum.)”. The results showed that the soil quality and the carbon source metabolic activities of soil microbial had the trend of significant and continuous improvement along with the succession of salt vegetation types (P<0.05), and the carbon source metabolic activities of soil microbial had the trend of extremely significant enhance (P<0.01). Shannon-wiener index, Richness index, Simpson index and Pielou evenness index were increased with the succession of salt vegetation types and had the significant correlation with total nitrogen, available nitrogen and conductivity (P<0.05). While those indexes had a significant negative correlation with soil salinity (P<0.01). Along with the succession of salt vegetation in the Yellow River Delta, the types and amounts of utilized carbon source were increased. Total nitrogen and available nitrogen were the crucial factors which significantly stimulated carbon metabolic abilities. While, soil salinity was the negative control factor.
Biolog method;carbon catabolic diversity;halophytic vegetation succession;principal component analysis;redundancy analysis
A
1000-6923(2017)01-0373-08
裴 振(1991-),男,山东泰安人,山东师范大学环境科学专业硕士研究生,主要从事土壤微生物功能多样性研究.
2016-04-25
山东省自然科学基金资助项目(ZR2012DM013);山东省高等学校科技计划项目(No.J15LE07)
* 责任作者, 教授, guodufa@163.com

