水稻土Fe(II)氧化耦合NO3-还原的微生物变化
陈鹏程,李晓敏,李芳柏*(1.中国科学院广州地球化学研究所,广东 广州 510640;.广东省生态环境与土壤研究所,广东 广州 510650;3.中国科学院大学,北京 100049)
水稻土Fe(II)氧化耦合NO3-还原的微生物变化
陈鹏程1,2,3,李晓敏2,李芳柏2*(1.中国科学院广州地球化学研究所,广东 广州 510640;2.广东省生态环境与土壤研究所,广东 广州 510650;3.中国科学院大学,北京 100049)
利用不同驯化条件(Soil、Soil+Fe(II)、Soil+NO3-和Soil+Fe(II)+NO3-)对华南水稻土进行中性厌氧条件下的富集培养, 探究淹水期水稻土亚铁(Fe(II))氧化和硝酸盐(NO3-)还原过程,及此过程中微生物群落的变化.结果表明,在 Soil+Fe(II)处理中,亚铁不能发生自然氧化.只有在Soil+Fe(II)+NO3-处理中,Fe(II)才能被氧化成Fe(III);同时,Fe(II)的存在减慢了NO3-的还原.利用高通量测序技术表征微生物群落组成随培养时间的变化,结果表明, Soil+Fe(II)和Soil处理的微生物群落组成没有显著差异.在Soil+NO3-处理中,Pseudogulbenkiania、Flavobacterium和Rhodocyclus属成为优势菌群.在Soil+Fe(II)+NO3-处理中,Zoogloea、Geothrix、Sunxiuqinia和Vulcanibacillus等属成为优势菌群,主要包括硝酸盐还原菌、Fe(II)氧化菌和Fe(III)还原菌.
亚铁氧化;硝酸盐还原;微生物群落;水稻土;中性pH
-and Soil+Fe(II)+NO3-) at circumneutral pH under anoxic conditions. The objectives were to investigate the transformations of Fe(II) and nitrate as well as the shifts of composition and diversity of microbial communities during these processes. The results revealed that Fe(II) could not be oxidized in the treatment of Soil+Fe(II), but only be oxidized in the treatment of Soil+Fe(II)+NO3-. Meanwhile, the presence of Fe(II) slowed down the NO3
-reduction. Illumina high throughput sequencing was used to profile the diversity and abundance of microbial communities over time. The results showed that no significant difference of microbial communities between treatments of Soil+Fe(II) and Soil. Pseudogulbenkiania, Flavobacterium and Rhodocyclus gradually became the dominant genera in the treatment of Soil+NO3
-. Zoogloea, Geothrix, Sunxiuqinia and Vulcanibacillus were the most abundant genera in the treatment of Soil+Fe(II)+NO3-, which was a mixture of nitrate reducers, Fe(II) oxidizers and Fe(III) reducers. Key words:Fe(II) oxidation;nitrate reduction;microbial community;paddy soil;circumneutral pH
铁元素是地壳中含量第 4高的变价金属元素[1].铁的生物地球化学循环过程耦合其他元素的氧化还原过程,对碳、氮和重金属等元素的转化有重要的影响[2-4].铁在天然环境中多数以不溶态 Fe(III)氧化物的形式存在.微生物驱动的Fe(II)氧化和 Fe(III)还原可以发生在厌氧环境中[5].厌氧环境中铁氧化还原过程主要是由铁相关微生物群落所驱动的,包括Fe(II)氧化菌和Fe(III)还原菌[6].其中,硝酸盐依赖型亚铁氧化微生物可以利用厌氧环境中的硝酸盐作为电子受体,在有机物质存在的情况下氧化 Fe(II),从而影响着环境中Fe元素和N元素的循环[7].
目前,大部分关于 Fe(II)氧化耦合硝酸盐还原过程及其微生物的研究,主要关注从环境中分离纯化出来的纯菌,并探究其亚铁成矿机制[8].混合培养主要集中在淡水底泥环境中[9],这个过程是由多种不同微生物共同完成的.然而,关于稻田环境中的 Fe(II)氧化耦合硝酸盐还原过程,以及其中的微生物群落组成的研究还很少[10-11].
水稻土是一个由干湿交替引起的好氧-厌氧反复交替的生态系统,水稻土含铁量高达100~200 μmol/cm3[12],因此在淹水期时 Fe(III)还原和 Fe(II)氧化过程均能发生[13].此外,水稻土系统受人为活动干扰大,碳和氮的输入与积累量高,因此厌氧条件下Fe(II)氧化耦合硝酸盐还原过程也是有可能发生的.最近,关于水稻土在厌氧条件下发生的Fe(II)氧化和硝酸盐还原过程及其微生物群落组成变化初有报道,并发现 Azospira、Zoogloea和 Dechloromonas 等属是此过程中的优势微生物[14].深入了解由水稻土微生物引起的Fe(II)氧化耦合硝酸盐还原过程,有利于揭示此过程中的微生物机制,并可为调控水稻土环境中铁-氮循环提供科学依据.本研究采用花岗岩发育的华南水稻土作为研究对象,分别添加Fe(II)、NO3
-以及Fe(II)+NO3-对其富集培养.研究水稻土在中性 pH厌氧条件下 Fe(II)氧化耦合NO3
-还原的动力学变化过程,探讨不同富集处理中微生物群落组成的动态变化.
1 材料与方法
1.1 采样点和样品处理
实验用的水稻土于2014年采集自广州市中国 科 学 院 华 南 植 物 园 (23°10'38.26"N, 113°21'10.12"E).水稻土样品采集自表层以下10cm深度,放置于冰盒0℃保存带回实验室进行富集培养,水稻土pH值为5.8,总铁含量为23g/kg,有机碳量为35g/kg,水解N为287mg/kg.
本次的孵育水稻土所采用的培养基配方如下:缓冲液采用 1,4-piperazinediethanesulfonic acid (PIPES)-buffer(30mmol/L, pH 7.0),含有10mmol/L硝酸盐作为电子受体,5mmol/L乙酸盐作为电子供体,中性盐(0.68mmol/L CaCl2, 1.03mmol/L KH2PO4, 2.03mmol/L MgCl2和5.14mmol/L NaCl),微量元素(1mL/L,)维生素溶液(1mL/L)和硒-钨溶液(1mL/L).孵育体系分装于125mL西林瓶,参照之前的报道[10]100mL缓冲液体系加入 1g水稻土.培育试验开始前,所有西林瓶都采用高压蒸汽灭菌(121℃, 20min).为了最大限度的防止氧气对FeCl2氧化,FeCl2溶液的配置方式如下:10mL的去离子水用氮气(99.99%)鼓吹25min,加入 9.9g FeCl2配成 1mol/L浓度的母液.500μL 1mol/L FeCl2溶液转移至每个 125mL西林瓶(西林瓶培养基预先鼓吹氮气15min除氧),继续鼓吹氮气 10min后,压橡胶盖和铝盖封紧,Fe2+离子的终浓度为 5mmol/L.样品模拟采样实际温度置于厌氧培养箱中(30±0.5)℃避光静置培养,每个实验处理设置3个重复.每隔2d取样,西林瓶摇匀后吸取2mL悬浊液用于Fe浓度测定,再取约5mL上清液用于硝酸盐、亚硝酸盐、铵的含量测定、余下的样品经 10000r/min离心后收集沉淀用于DNA提取.实验设计分为4个处理组:(1) Soil; (2) Soil+NO3-; (3) Soil+Fe(II); (4) Soil+Fe(II)+NO3-. Soil+Fe(II)+NO3
-体系第2d开始有气泡从沉积在瓶底的水稻土中逐渐渗出,水稻土的颜色也由黑色逐渐转化为棕黄色,表明经过2d的Fe-N富集,反应体系中的Fe2+发生氧化,并释放出气体产物,这也表明了反应体系中的优势微生物经过调整之后开始发挥作用.
1.2 检测方法
硝酸盐和亚硝酸盐用离子色谱进行定量检测(ICS-90, Dionex, US),阴离子交换柱的型号是IonPac AS14A 4×250mmol/L.为了防止Fe2+离子进入阴离子柱与淋洗液(浓度8:1的碳酸钠/碳酸氢钠)发生反应生成 Fe(III)沉淀而堵塞了阴离子柱,样品在打入机器前必须经过以下处理.样品取出后经过离心(10000r/min),上清液经过钠离子交换柱,去除所有残留的 Fe2+或者 Fe3+,再用0.22μm滤膜过滤.
N2O 用气相色谱仪进行检测(GC-7900, Techcomp, China).用1mL注射器吸取西林瓶顶空气体1mL直接注射进气相色谱仪的进样口进行检测[15].铵的检测,采用纳氏试剂比色法,检测的波段在420nm[16].HCl浸提态Fe(III)和溶解态Fe(II)的检测,使用 1,10-邻菲洛林比色法在510nm波段进行比色检测[17].1.3 DNA的提取和PCR扩增
对于水稻土各个处理的总DNA提取采用土壤试剂盒(PowerSoilTM, MO BIO)按照说明书的使用步骤操作,提取出来的DNA储存在-45℃冰箱.细菌和古细菌的16S rRNA V4区的特异性扩增使用515F正向引物,806R反向引物(带有一个12bp的标签).每个DNA样品都是用50μL体系进行扩增,设置 3个平行样.扩增条件如下:95 ℃5min,变性(94℃ 0.5min),退火(50 ℃ 1min),延伸(72 ℃ 1min),最终的延伸温度72 ℃ 7min.最终得到一个约470bp长度的片段,并用一个QIA快速胶回收试剂盒(Qiagen, Chatsworth, CA, US)进行纯化.所有的PCR产物都按照均一的分子比例混合成为一管样品.样品采用 IIluminaMiseq PE(paired end)250bp进行测序.每个样品均做 3个重复.
1.4 高通量测序分析方法
由于IIlumina测序技术在序列末端(3’端)呈现明显的质量下降,为了保持数据的准确性,必须对数据进行评价并进行质量筛选.对测序序列(成对.fastq)使用 fastqc软件评价数量和质量,并利用perl脚本进行质量控制,去除低质量的碱基.用 Mothur将两端拼成一个完整片段后,利用Mothur和 Quantitative Insights Into Microbial Ecology(QIIME)进行流程化分析.利用 Uclust在16S的 97%序列相似度水平上分类 Operational taxonomic units (OTUs).在每个OTUs所属的序列里,抽取出一条作为代表序列.将代表序列和已知的比对好的原核生物16S rRNA基因进行匹配,并用 FastTree做以 OTU为单位的系统发育树.使用Ribosomal Database Project(RDP)数据库在80%的可信度水平上进行分类,并进行物种注释,了解物种来源.建立 OTU表格后,根据序列信息和物种分类信息,将样品中的序列划分到不同的分类等级,即门(phylum),纲(class),目(order),科(family),属(genus).相对丰度用 R语言的 Scale Function功能进行标准化.即一个样品在某个分类水平上的标准化值为该样品在某个分类上的相对丰度和所有样品在该分类的相对丰度平均值的差除以所有样品在该分类上的标准差所得到的值,本文的结果在标准化以后的值在-1~3之间.序列被随机挑取用来计算 alpha 多样性和beta多样性.
2 结果和讨论
2.1 Fe元素的转化

图1 (A)溶解态Fe(II)和(B)盐酸浸提态Fe(III)浓度变化Fig.1 Transformations of (A) dissolved Fe(II), (B) HCl-extractable Fe(III)
如图 1所示,土壤自身含有<0.2mmol/L的Fe(III)背景值(即Soil处理),且溶解态Fe(II)和盐酸浸提态Fe(III)浓度随培养时间的推移没有发生明显的变化.Soil+NO3-处理中溶解态Fe(II)和盐酸浸提态 Fe(III)与 Soil处理相比没有明显差异.在Soil+Fe(II)处理中,溶解态 Fe(II)浓度没有发生明显变化,这说明土壤中原有的成分在厌氧条件下不能引发 Fe(II)氧化.在 Soil+Fe(II)+NO3-体系里,培养前2d就有60%的溶解态Fe(II)被氧化,在第4d时有 90%的 Fe(II)被氧化;同时,检测到0.5mmol/L的盐酸浸提态Fe(III),说明大部分生成的Fe(III)转化成矿物,而没办法被0.5M盐酸溶解.
2.2 N元素的转化
如图 2所示,在 Soil和 Soil+Fe(II)处理中, NO3-、NO2-和N2O的含量均低于仪器检测限,但可以检测到约0.08mmol/L的NH4+背景值.NH4+浓度在Soil和Soil+Fe(II)处理中随时间逐渐降低,表明NH4+可能被土壤中的微生物吸收利用.
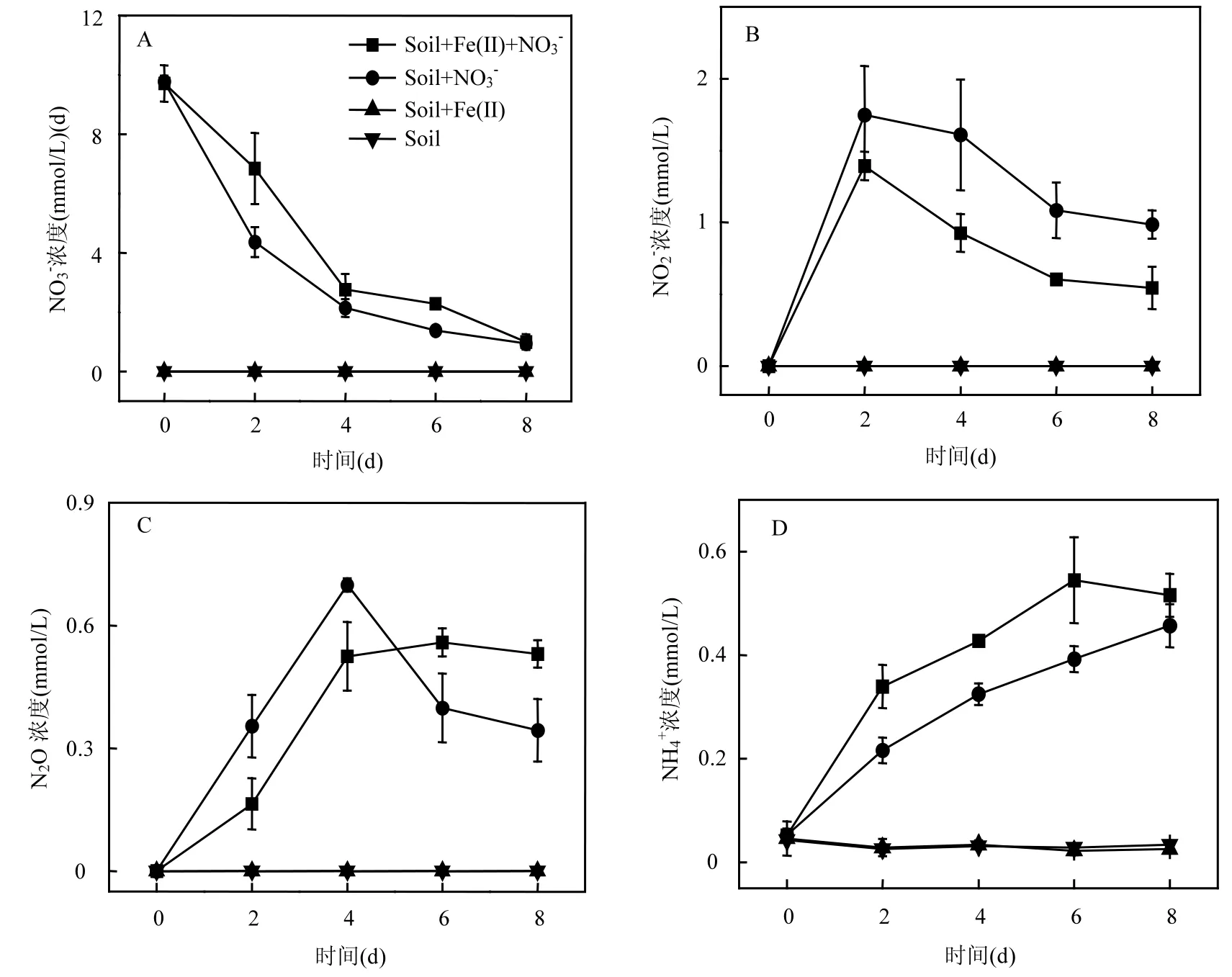
图2 (A) NO3-, (B)NO2-, (C)N2O和(D)NH4+的浓度变化Fig.2 Transformations of (A)NO3-, (B)NO2-, (C) N2O and (D)NH4+
在 Soil+Fe(II)+NO3-和 Soil+NO3-体 系里,NO3-的浓度均随时间推移而逐步减少,Fe(II)的存在减慢了硝酸盐的还原.这可能和 Fe(II)生成 Fe(III)后,和 NO-产生竞争效应有关[18].NO-33在厌氧条件下的还原主要是硝酸盐还原菌的作用[10],其对 NO3-的还原代谢可以分为 2条途径:反硝化途径(NO3-→NO2-→NO→N2O→N2)和异化硝酸盐还原途径(NO3-→NO2-→NH4+)[12],其中NO2-均是这2个途径的第一个中间产物.培养第2d时,在Soil+Fe(II)+NO3-和Soil+NO3-体系里,分别检测到约1.4mmol/L和1.7mmol/L的NO2-,随后这2个处理的NO2-浓度均逐渐减少.在Soil+ Fe(II)+NO3-体系里,在微生物的作用下,Fe(II)除了可以跟NO3-发生反应(如方程(1)所示)以外,还可以和NO2-发生化学反应,如方程(2)所示.
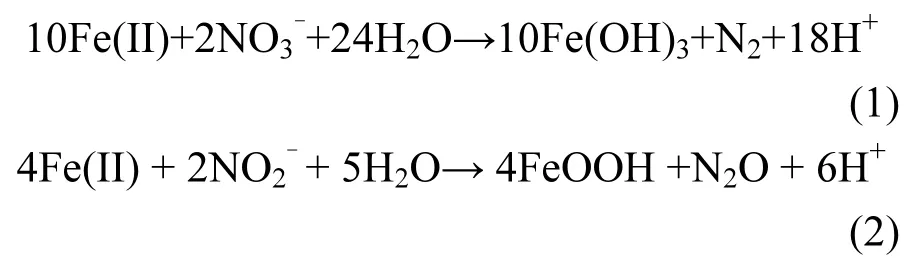
在培养的前4d里,Soil+Fe(II)+NO3-和Soil+NO3-的 N2O生成量的上升趋势几乎一致.第 4d之后,在 Soil+NO3-体系中,N2O浓度在达到峰值后随时间逐渐减少,N2O是微生物反硝化过程的中间产物,其浓度的减少有可能是反硝化过程的进一步进行导致的.而在Soil+Fe(II)+NO3-体系里,培养第4d后N2O浓度则保持一个平稳的状态,根据反应式(1),这有可能是Fe(II)与NO2-的化学反应生成N2O所导致的.
在 Soil+NO3-和 Soil+Fe(II)+NO3-体系里, NH4+浓度随培养时间的推移逐步提高,表明异化硝酸盐还原成铵(DNRA)过程的发生.在Soil+NO3-体系里,与 N2O的生成量相比,NH4+的生成量较低,推测反硝化途径在硝酸盐还原过程中的贡献要大于异化硝酸盐还原途径,这和之前的实验结果相类似[9].根据已测得的 NO-、3NO2-、N2O和NH4+结果进行简单的氮平衡加减计算,可推算出 Soil+NO-和 Soil+Fe(II)+NO-体33系分别最多可生成6.51mmol/L和5.72mmol/L的NX(包括:NO和N2),再加上已测到的N2O生成量,可推测 Fe(II)的存在减慢了反硝化途径.此外,NH4+是自然环境中较易被生物吸收利用的氮素,DNRA过程是土壤氮储存的过程[19].在 Soil+ Fe(II)+NO-体系里,NH+的生成量比 Soil+NO-343体系里的要高,表明 Fe(II)的存在促进了 DNRA过程的发生,也增加了氮的储存.
2.3 微生物群落在门水平上的动态变化

图3 基于16S rDNA高通量测序的不同处理微生物群落在门水平上相对丰度随反应时间的变化情况(>1%)(D表示天数)Fig.3 Relative abundance (%) of the dominant microbial phyla (>1%) with time dependence in different treatments revealed by 16S rDNA Illumina high-throughput sequencing (D means day)
如图3所示,原始土壤中(D0),Chloroflexi的相对丰度最高(10%),其相对丰度在Soil处理中随时间推移波动很小(7.5%~11%),此外 Deltaproteobacteria (11%~15%)和 Betaproteobacteria(7.9%~14%)的相对丰度也较高.在 Soil+Fe(II)体系中,门水平的变化趋势(除了 D2以外)和 Soil处理区别不大, Deltaproteobacteria(9.4%~16%)、Betaproteobacteria (11%~12%)和 Chloroflexi (5.1%~11%)等几个优势门类同样处于一个比较稳定的水平.这说明,在不添加 NO3-作为电子受体的条件下,添加 Fe(II)并不能改变水稻土微生物门水平上的群落组成.
在 Soil+NO3-和 Soil+Fe(II)+NO3-体系中, Betaproteobacteria的相对丰度在培养第2d就上升到74%以上,成为绝对的优势群落,且其变化趋势在2个处理中也几乎一致(图3).除此之外,在Soil+NO3-和 Soil+Fe(II)+NO3-体系中的优势菌群分别是Deltaproteobacteria(26%~35%)和 Acidobacteria (2.7%~13%).这说明 NO3-的添加会促进Betaproteobacteria和Deltaproteobacteria这2个门的微生物的生长,而 Fe(II)的加入还能刺激Acidobacteria这个门的微生物的生长.
2.4 微生物群落在属水平上的动态变化
在 Soil体系,相对丰度较高的属有: Belliinea、Thermodefovibrio、Geobacter和Pseudobenkiania等属,其含量随培养时间推移保持相对稳定,含量分别在4.1%~6.6%、4.0%~ 5.2%、2.7%~6.3%,0.9%~1.4%之间波动(图 4).由此可见,自然土壤在没有人为添加 Fe(II)或 NO3-的厌氧体系里,其微生物群落的组成结构没有发生明显的变化.其中,Geobacter[20]和Pseudogulbenkiania等属[21]分别属于Fe(III)还原菌和硝酸盐依赖型Fe(II)氧化菌,由此可见,在碳酸盐发育的富含铁的华南水稻土中,铁相关细菌的相对丰度处于一个较高的水平.在 Soil+Fe(II)体系,优势微生物群落同样以Geobacter (1.1%~7.6%)、 Bellilinea(2.9%~6.7%)、 Thermodesulfovibrio(1.9%~4.8%)和Pseudogulbenkiania(1.1%~2.2%)等属为主(图 4).这说明,水稻土在淹水期时,如果没有有效的电子受体(如:NO3-)存在,即使存在高浓度 Fe(II),微生物群落也不会发生明显的变化.
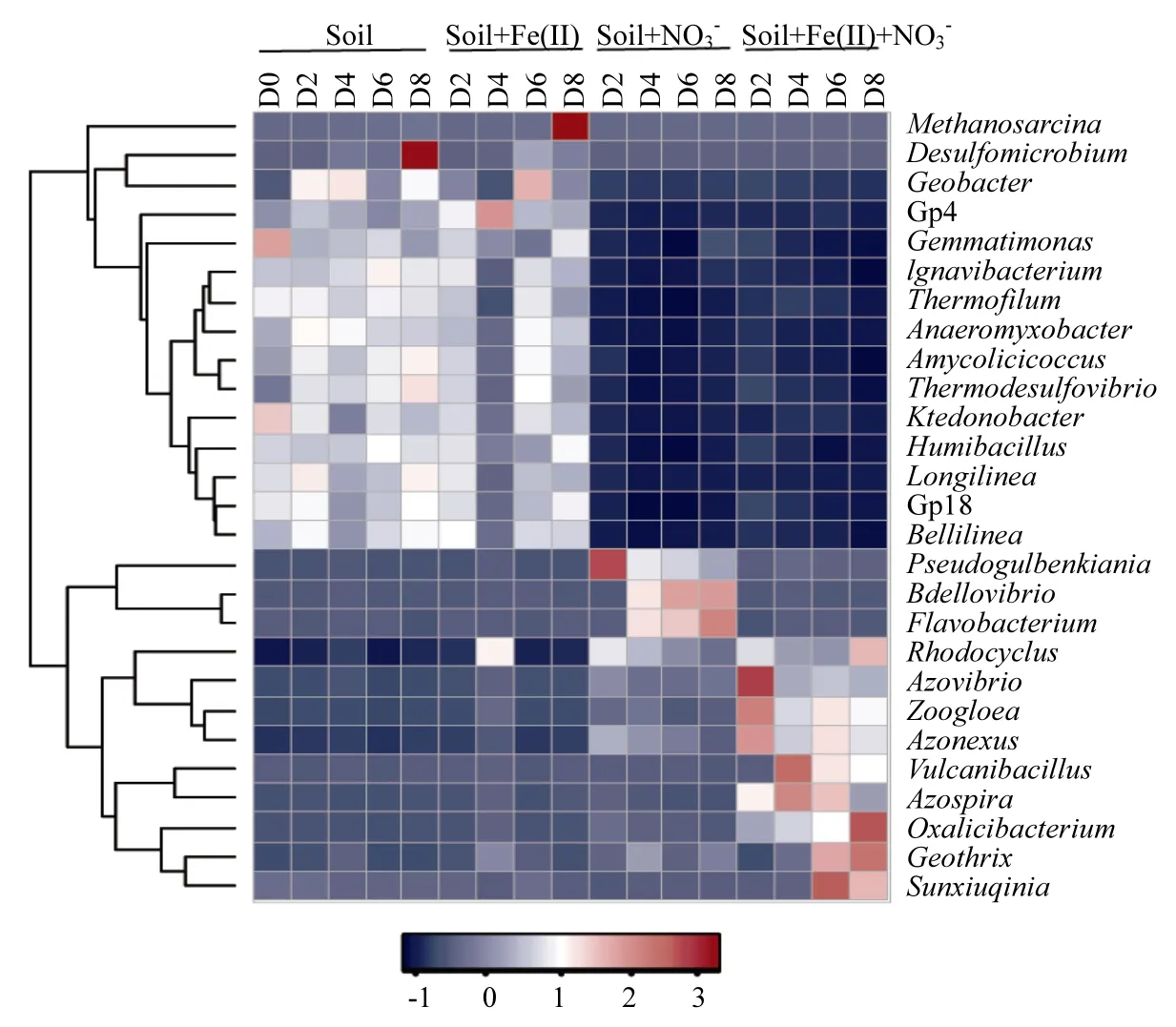
图4 基于16S rDNA高通量测序的不同处理的微生物群落在属水平上相对丰度随反应时间的变化情况 (D表示天数)Fig.4 Relative abundance (%) of the dominant microbial genera (>1%) with time dependence in different treatments revealed by 16S rDNA Illumina high-throughput sequencing (D means day)
在 Soil+NO3-体 系,培 养 第 2d 时Pseudogulbenkiania和Rhodocyclus 等属成为优势菌群,其相对丰度分别提高到34.5%和17.2%.随后,Bdellovibrio和Flavobacterium 等属的相对丰度随时间推移逐渐增加,到培养第8d时,其相对丰度分别为32.8%和3.9%.其中, Pseudogulbenkiania、 Rhodocyclus和Flavobacterium等属均具有硝酸盐还原功能[22],这与体系中存在较高浓度NO3-有关.尽管 Soil+NO3-处理中相对丰度较高的细菌和Soil+Fe(II)+NO3-的处理有一定的重合性,但优势菌群还是存在明显的区别,表明 Fe(II)的存在对优势菌群仍然起到一定的筛选作用.
在Soil+Fe(II)+NO3-体系,第2d时Azovibro、Azonexus和Zoogloea 等属的相对丰度分别增加到4%、4%和20.7%,其中Azovibro和Azonexus属于固氮菌属[23],而 Zoogloea等属于亚铁氧化菌
[10].在第4d时,这3种细菌的相对丰度有所下降,但 Azospira(1.4%)和 Vulcanibacillu(2.6%)等属的相对丰度逐渐上升,前者是硝酸盐依赖型亚铁氧化菌[10].后者属于硝酸盐还原菌[24].硝酸盐还原菌还原硝酸盐所生成的亚硝酸根,可以跟 Fe(II)发生非生物的化学氧化反应(反应式1)[25-26].所以,在 Soil+Fe(II)+NO3-体系中所检测到的硝酸盐还原菌对亚铁的氧化也存在潜在的贡献.在第6d时,尽管2株硝酸盐依赖型亚铁氧化菌Zoogloea和Azospira等属仍处于较高相对丰度(分别为 14.0%和 1.2%),但 Fe(III)还原菌Geothrix[27]、硝酸盐还原菌 Rhodocyclus[28]和Sunxiuqinia[29]等属已成为优势菌群,其相对丰度分别达到9.1%,11.1%和1.9%.到第8d时,优势菌群分别是 Rhodocyclus(24.1%)、Zoogloea (12.2%)和 Geothrix(11.2%)等属.由于培养第 4d时,约 90%的 Fe(II)已经被氧化(图 1),因此推测Fe(III)的积累有可能激活了铁还原菌,发生Fe(III)的还原溶解,导致培养第6、8d时Fe(III)浓度有所下降.在本研究的 4个处理中,均没有检测到相对丰度超过 1%的厌氧氨氧化菌(如:Candidatus Scalindua和Candidatus kuenina stuttgartiensis等属),所以可以排除厌氧氨氧化作用的存在.
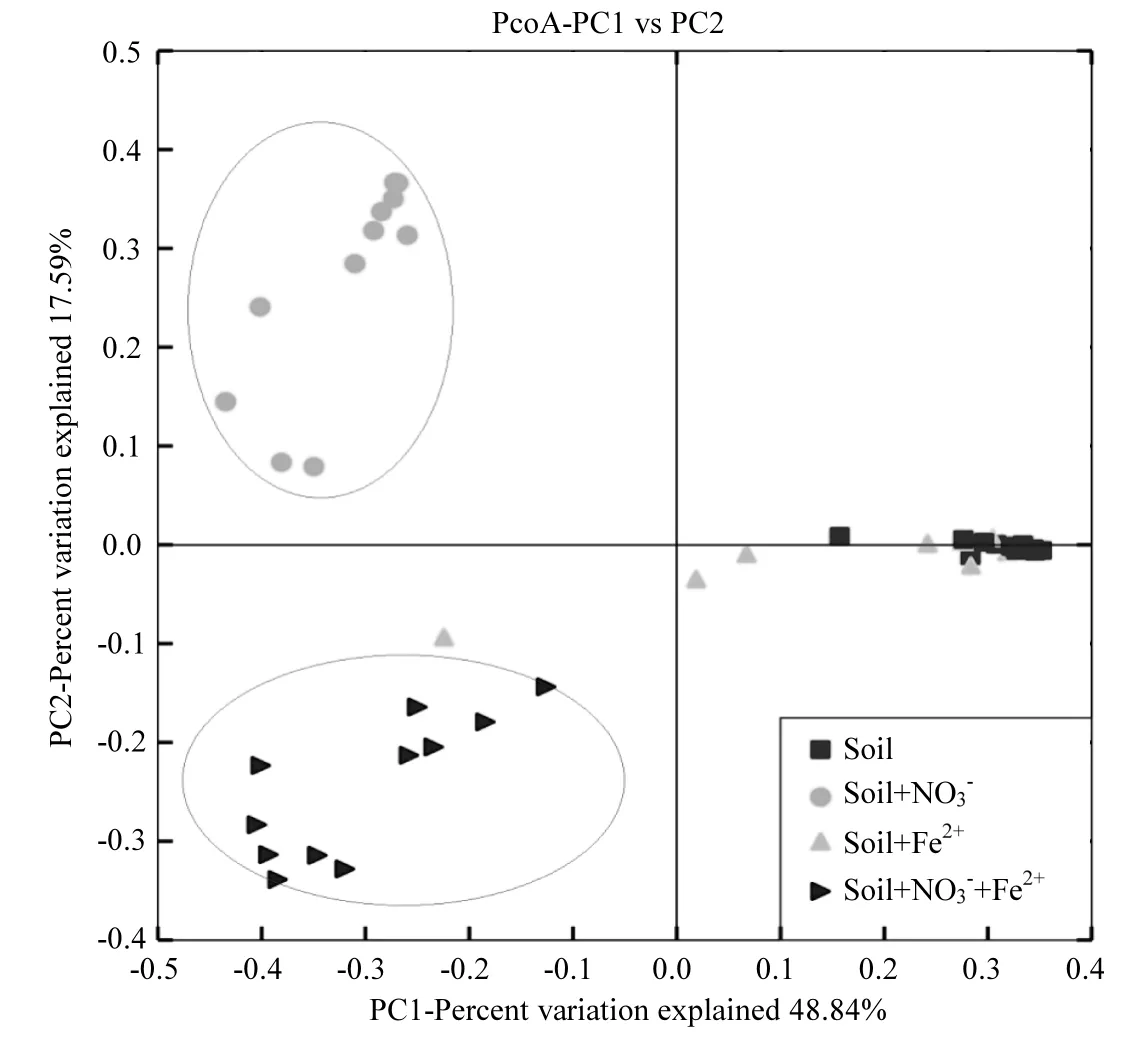
图5 根据不同处理16S rRNA高通量测序所获得的微生物群落的Beta多样性Fig.5 Beta diversities of microbial communities from different treatments based on 16S rRNA Illumina high-throughput sequencing
2.5 Beta多样性分析
如图5所示,Soil+Fe(II)和Soil处理相比,微生物群落结构的差异不明显,表明单纯添加Fe(II)不能有效改变土壤的微生物群落结构.Soil+ Fe(II)+NO3
-、Soil+NO3-和Soil+Fe(II) 3种不同处理所富集的微生物群落组成在物种水平上呈现出明显的差异,尤其是 Soil+Fe(II)+NO3-和 Soil+ NO3-2个处理之间的差异,说明 Fe(II)的加入能有效改变硝酸盐还原菌的群落结构组成.在人为添加NO3-的 2个体系中(即 Soil+NO3-和 Soil+ Fe(II)+NO3-),优势微生物均为硝酸盐还原菌.尽管硝酸盐还原菌是广泛存在于自然界中,并且其可以通过反应式(1~2)间接地耦合 Fe(II)氧化过程,使人无法确认微生物直接介导的亚铁氧化过程的贡献[30].然而 Fe(II)的加入还是能够显著改变硝酸盐还原菌的种类和丰度,表明这些具有Fe(II)氧化功能(不管是直接或者间接介导)的硝酸盐还原菌是有区别于其他的硝酸盐还原菌的.以上结果,加深了人们对厌氧中性水稻土中驱动硝酸盐还原与亚铁氧化耦合过程的优势微生物的了解,有助于理解整个水稻生态系统中铁循环和氮循环之间的关系.
3 结论
3.1 在中性厌氧水稻土中,Fe(II)在 Soil+Fe(II)体系中不能发生氧化,只有在Soil+Fe(II)+NO3-体系中 Fe(II)才能发生氧化;在 Soil+NO3-体系中, NO3-可以在 4d内被还原 72%,在 Soil+Fe(II)+ NO3-处理中 Fe(II)的存在减缓了 NO3-的还原.NO3-的还原主要经过反硝化途径完成,少部分经过异化硝酸盐还原途径生成NH4+. 3.2 Soil+NO3-和 Soil+Fe(II)+NO3-体系的优势微生物,在门水平上差异不明显,但在属水平上差异显著.
3.3 Soil+ NO3-体系中的优势菌群以Pseudogulbenkiania、Flavobacterium和Rhodocyclus等属为主.
3.4 Soil+ Fe(II)+NO3-体系中优势微生物群落由第0~2d的Azovibro、Azonexus和Zoogloea等属逐渐变成第 6~8d的 Zoogloea、Geothrix、Sunxiuqinia和Vulcanibacillus等属.
[1] Hauck S, Benz M, Brune A, et al. Ferrous iron oxidation by denitrifying bacteria in profundal sediments of a deep lake (Lake Constance) [J]. FEMS Microbiology Ecology, 2001,37(2):127–134.
[2] Kendall B, Anbar A D, Kappler A, et al. The global iron cycle [J]. Fundamentals of Geobiology, 2012:65–92.
[3] Lovley D R, Holmes D E, Nevin K. P. Dissimilatory Fe(III) and Mn (IV) reduction [J]. Advances in microbial physiology, 2004,49:219–286.
[4] 李芳柏,王旭刚,周顺桂,等.红壤胶体铁氧化物界面有机氯的非生物转化研究进展 [J]. 生态环境, 2006,15(6):1343–1351.
[5] Ding L J, Su J Q, Xu H J, et al. Long-term nitrogen fertilization of paddy soil shifts iron-reducing microbial community revealed by RNA-(13)C-acetate probing coupled with pyrosequencing [J]. Isme Journal, 2014,9(3):721–734.
[6] Posth N R, Canfield D E, Kappler A. Biogenic Fe(III) minerals: From formation to diagenesis and preservation in the rock record [J]. Earth-Science Reviews, 2014,135(4):103–121.
[7] Kappler A, Straub K L. Geomicrobiological cycling of iron [J]. Reviews in Mineralogy and Geochemistry, 2005,59(1):85–108.
[8] Miot J, Benzerara K, Morin G, et al. Iron biomineralization by anaerobic neutrophilic iron-oxidizing bacteria [J]. Geochimica et Cosmochimica Acta, 2009,73(3):696–711.
[9] Coby A J, Picardal F, Shelobolina E, et al. Repeated anaerobic microbial redox cycling of iron [J]. Applied and Environmental Microbiology, 2011,77(17):6036–6042.
[10] Straub K L, Schönhuber W A, Buchholz-Cleven B E, et al. Diversity of ferrous iron-oxidizing, nitrate-reducing bacteria and their involvement in oxygen-independent iron cycling [J]. Geomicrobiology Journal, 2004,21(6):371–378.
[11] Weber K A, Achenbach L A, Coates J D. Microorganisms pumping iron: anaerobic microbial iron oxidation and reduction [J]. Nature Reviews Microbiology, 2006,4(10):752–764.
[12] Ratering S, Schnell S. Nitrate-dependent iron(II) oxidation in paddy soil [J]. Environmental Microbiology, 2001,3(2):100–109.
[13] 易维洁,曲 东,黄婉玉,等.淹水培养时间对水稻土中 Fe( )Ⅲ异化还原能力的影响 [J]. 农业环境科学学报, 2010,29(9):1723–1729.
[14] Li X, Zhang W, Liu T, et al. Changes in the composition and diversity of microbial communities during anaerobic nitrate reduction and Fe(II) oxidation at circumneutral pH in paddy soil [J]. Soil Biology and Biochemistry, 2016,94:70–79.
[15] Rhoderick G C, Dorko W D. Standards development of global warming gas species: Methane, nitrous oxide, trichlorofluoromethane, and dichlorodifluoromethane [J]. Environmental Science & Technology, 2004,38(9):2685–2692.
[16] Paul T, Miller P L, Strathmann T J. Visible-light-mediated TiO2photocatalysis of fluoroquinolone antibacterial agents [J]. Environmental Science & Technology, 2007,41(13):4720–4727.
[17] Fadrus H, Malý J. Rapid extraction-photometric determination of traces of iron (II) and iron (III) in water with 1,10-phenanthroline [J]. Analytica Chimica Acta, 1975,77:315–316.
[18] 张 伟,刘同旭,李芳柏,等.铁还原菌介导的氧化铁还原与硝酸盐还原的竞争效应研究 [J]. 生态环境学报, 2013,1:123–128.
[19] Wolfe J P, Wagaw S, Marcoux J F, et al. Nitrogen fixation and dissimilatory nitrate reduction to ammonium (DNRA) support nitrogen dynamics in Texas estuaries. Limnol Oceanogr [J].Limnology & Oceanography, 2006,51(1):558–568.
[20] Mahadevan R, Bond D R, Butler J E, et al. Characterization of metabolism in the Fe(III)-reducing organism Geobacter sulfurreducens by constraint-based modeling [J]. Applied and Environmental Microbiology, 2006,72(2):1558–1568.
[21] Zhao L, Dong H, Kukkadapu R, et al. Biological oxidation of Fe(II) in microbially reduced nontronite coupled with nitrate reduction by Pseudogulbenkiania sp. Strain 2002: Implications for remediation of nitrate contamination in the environment [J]. Geochimica et Cosmochimica Acta, 2013,119:231–247.
[22] Horn M A, Ihssen J, Matthies C, et al. Dechloromonas denitrificans sp. nov., Flavobacterium denitrificans sp. nov., Paenibacillus anaericanus sp. nov. and Paenibacillus terrae strain MH72, N2O-producing bacteria isolated from the gut of the earthworm Aporrectodea caliginosa [J]. International Journal of Systematic and Evolutionary Microbiology, 2005,55(3):1255–1265.
[23] Reinhold-Hurek B, Hurek T. The genera Azoarcus, Azovibrio, Azospira and Azonexus [M]. The prokaryotes. Springer, 2006: 873–891.
[24] L'Haridon S, Miroshnichenko M, Kostrikina N, et al. Vulcanibacillus modesticaldus gen. nov., sp. nov., a strictly anaerobic, nitrate-reducing bacterium from deep-sea hydrothermal vents [J]. International Journal of Systematic and Evolutionary Microbiology, 2006,56(5):1047–1053.
[25] Carlson H K, Clark I C, Blazewicz S J, et al. Fe(II) oxidation is an innate capability of nitrate-reducing bacteria that involves abiotic and biotic reactions [J]. Journal of Bacteriology, 2013, 195(14):3260–3268.
[26] Picardal F. Abiotic and microbial interactions during anaerobic transformations of Fe(II) and NOx−[J]. Frontiers in Microbiology, 2012,3(3):112.
[27] Nevin K P, Lovley D R. Mechanisms for accessing insoluble Fe(III) oxide during dissimilatory Fe(III) reduction by Geothrix fermentans [J]. Applied and Environmental Microbiology, 2002,68(5):2294–2299.
[28] Kong Y, Nielsen J L, Nielsen P H. Microautoradiographic study of Rhodocyclus-related polyphosphate-accumulating bacteria in full-scale enhanced biological phosphorus removal plants [J]. Applied and Environmental Microbiology, 2004,70(9):5383–5390.
[29] Takai K, Abe M, Miyazaki M, et al. Sunxiuqinia faeciviva sp. nov., a facultatively anaerobic organoheterotroph of the Bacteroidetes isolated from deep subseafloor sediment [J]. International Journal of Systematic and Evolutionary Microbiology, 2013,63(5): 1602–1609.
[30] 胡晓婷,程 吕,林贤彪,等.沉积物硝酸盐异化还原过程的温度敏感性与影响因素——以长江口青草沙水库为例 [J]. 中国环境科学, 2016,36(9):2624–2632.
Shifts of microbial communities during Fe(II) oxidation coupled to nitrate reduction in paddy soil.
CHEN Peng-cheng1,2,3*, LI Xiao-min2, LI Fang-bai2*
(1.Guangzhou Institute of Geochemistry, Chinese Academy of Sciences, Guangzhou 510640, China;2.Guangdong Institute of Eco-Environmental and Soil Sciences, Guangzhou 510650, China;3.Graduate University of Chinese Academy of Sciences, Beijing 100049, China). China Environmental Science, 2017,37(1):358~366
A paddy soil which was collected from South China was cultivated in different treatments (Soil, Soil+Fe(II), Soil+NO3
X172
A
1000-6923(2017)01-0358-09
陈鹏程(1986-),男,广东汕头人,中国科学院广州地球化学研究所博士研究生,主要从事土壤微生物环境生态研究.
2016-05-08
国家自然科学基金资助项目(41330857) * 责任作者, 研究员, cefbli@soil.gd.cn

