超临界二氧化碳法萃取桑叶中总黄酮工艺研究
石仝雨, 缪伟伟, 王志雄,3*
1.上海理工大学医疗器械与食品学院, 上海 200093; 2.日本国立大阪大学, 大阪 565-087, 日本; 3.上海健康医学院药学院, 上海 200093
超临界二氧化碳法萃取桑叶中总黄酮工艺研究
石仝雨1, 缪伟伟2,3, 王志雄1,3*
1.上海理工大学医疗器械与食品学院, 上海 200093; 2.日本国立大阪大学, 大阪 565-087, 日本; 3.上海健康医学院药学院, 上海 200093
为了探索超临界二氧化碳法萃取桑叶中总黄酮提取的最佳方案,利用超临界二氧化碳萃取技术,依次用响应面法考查萃取压强、萃取温度、萃取时间以及夹带剂无水乙醇的流速对桑叶中总黄酮得率的影响,优选出桑叶黄酮类化合物在使用超临界萃取装置时提取的最佳工艺。结果显示:响应面法的最佳萃取条件为:压力26 MPa,温度50℃,时间3 h,流速2.5 mL/min,最佳条件下总黄酮得率为6.21%±0.05%。
桑叶;超临界萃取技术;总黄酮得率;曲面相应法
桑叶是我国传统中药之一,为桑属(Morus)植物桑树(MorusalbaL.)的叶子,载于《神农本草经》,中医又称“神仙草”、“铁扇子”。 桑叶性味苦甘、寒,甘可以益血,寒可以凉血。甘寒相合,故下气而益阴,又能止咳,有补益之功。主治风热感冒、肺热燥咳、头晕头疼、目赤晕花等症[1,2],因此桑叶作为一种治疗药,其化学成分以及药理作用成为当今研究者讨论的重点[3]。桑叶中主要的活性物质是桑叶黄酮,许多学者围绕桑叶黄酮的开发和利用做了大量工作,当前萃取桑叶中总黄酮的方法主要有水浸法、回流提取法、超声提取法和索氏提取法等[4~6]。相对于其他萃取方法而言,超临界二氧化碳流体(supercritical CO2fluid extraction,SFE-CO2)萃取方法是一种新兴技术,目前在国际上应属于最先进的物理萃取分离技术;该方法主要利用高渗透性和高溶解能力来提取分离成分,其用到的溶剂是二氧化碳,以二氧化碳作为溶剂,与一般的萃取方法相比,超临界二氧化碳萃取在速度上和范围上更占优势。目前已有多种中药材中的黄酮类物质采用超临界CO2萃取的相关报道[7],但目前尚无采用相应曲面方法优化桑叶黄酮提取工艺的报道。本文运用响应面法分析超临界萃取中桑叶总黄酮提取的关键因素,并获得其最佳提取条件,以期为进一步开发和利用桑叶中的总黄酮成分提供依据。
1 材料与方法
1.1 材料
1.1.1 实验材料、药品与耗材 桑叶干粉(日本野姬和株式会社);芦丁标准品(上海金穗生物公司),含量不低于98%;无水乙醇、九水硝酸铝(上海金穗生物)、氢氧化钠、亚硝酸钠(上海金穗生物)均为分析纯;二氧化碳(纯度99.999%);0.45 μm过滤器;石英比色杯。
1.1.2 仪器 紫外可见光分光光度计(756P上海光谱仪器有限公司制造);超临界二氧化碳流体萃取设备(美国Waters公司);恒温水浴箱(CV-420,上海恒一精密仪器有限公司);超纯水系统(RE-100,上海本昂科学仪器有限公司);电子天平(FA2104,上海舜宇恒平)。
1.2 工艺线路
称重干燥后的桑叶粉2 g,装入超临界萃取装置的萃取釜中,以无水乙醇作为夹带剂。在本试验中通过改变相关的萃取参数,完成相关萃取,获得总黄酮提取液,并且计算得总黄酮提取率。具体步骤:桑叶→干燥→称重→超临界萃取→总黄酮提取液→测定总黄酮提取率。
1.3 标准曲线的绘制
精确称取干燥恒重的芦丁标准品5.0 mg 置于50 mL 容量瓶中,用无水乙醇超声溶解,摇匀,定容至50 mL,使之成为浓度为100 μg/mL 的芦丁标准品溶液,作为贮备液备用。精密量取上述溶液0、1 mL、2 mL、3 mL、4 mL、5 mL,置于10 mL 容量瓶。加5%亚硝酸钠水溶液0.3 mL,放置6 min,加10%硝酸铝0.3 mL,混匀后放置6 min,加入1%氢氧化钠溶液4 mL,混匀,放置15 min后,加无水乙醇定容至10 mL,静置15 min,等待显色后用紫外可见分光光度计,根据相关文献在510 nm波长处测吸光度,试剂空白为参比,芦丁标准品的浓度为横坐标,510 nm 处的吸光度为纵坐标作图,绘制标准曲线[8,9](图1)。
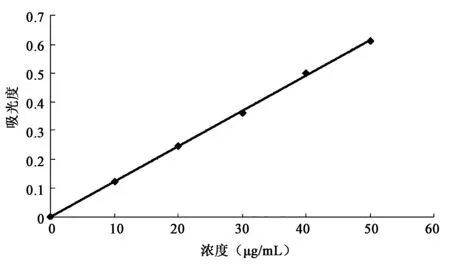
图1 芦丁标准溶液曲线Fig.1 Rutin standard solution curve.
利用SPSS 17.0统计软件,算出回归方程为:y=0.0123x,R2=0.9994。
1.4 总黄酮提取率计算
量取1 mL桑叶提取液于10 mL容量瓶,按绘制芦丁标准曲线时的步骤显色,直接于510 nm 波长处测定吸光度,根据相关公式,计算总黄酮提取率。
C:提取液总黄酮的浓度(mg/mL);V:提取液定容后的体积(mL);m:称取得样品桑叶干粉的质量(mg)。
1.5 单因素实验
根据相关文献[10~12]和美国Waters公司二氧化碳萃取仪器的使用说明,得到影响调整总黄酮得率的主要因素有萃取温度、压强、萃取时间和夹带剂流速。在本研究采用这4个因素水平进行单因素试验,分别考察各因素对桑叶黄酮得率的影响,具体各因素水平设置如表1所示。
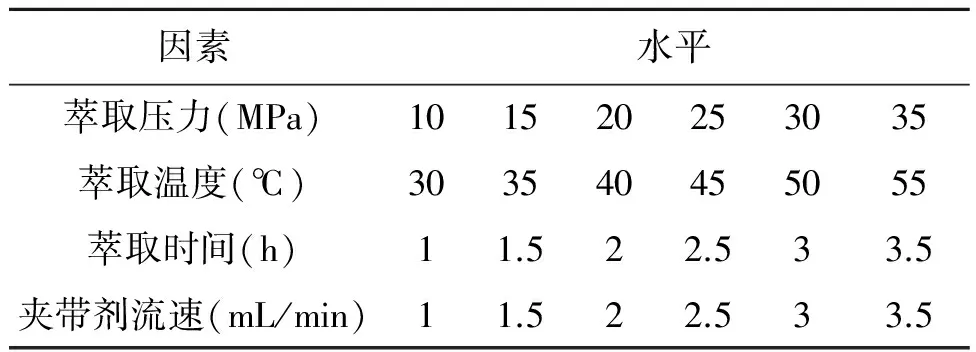
表1 单因素试验因素及水平
1.6 响应曲面实验设计
按照最佳单因素条件,根据中心组合(Box-Behnken)实验设计原理采用4因素3水平的响应曲面法对各个因素的显著性和交互作用进行分析,优化总黄酮得率结果,对桑叶提取总黄酮工艺条件进行分析和优化。具体因素编码及因素水平见表2。
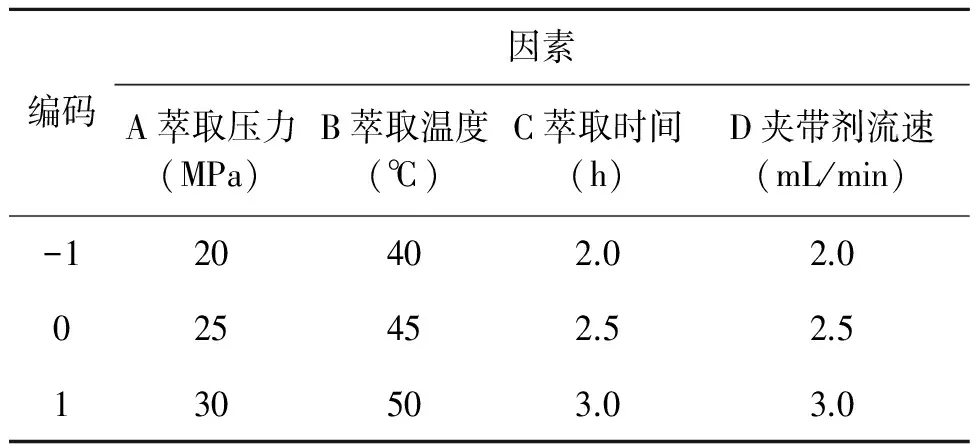
表2 响应面实验因素编码及因素水平
1.7 实验数据分析
通过SPSS 19.0软件进行统计分析处理,通过Design expert 8.0.6软件进行响应面试验的设计和统计分析,采用Sigmaplot 10.0和Excel 2007作图。
2 结果与分析
2.1 单因素实验结果分析
根据表1中的单因素试验因素及水平所得结果见图2。萃取温度45℃、提取时间2.5 h、萃取压强为35 MPa和夹带剂流速为2.5 mL/min为各单因素的最大响应值。故在下文中以此为基础条件,设计因素水平,进行提取工艺的优化。
2.2 响应曲面实验结果
2.2.1 黄酮得率条件拟合 根据前期实验分析,选取萃取时间、萃取压强、夹带剂流速、萃取温度4 个因素,运用Design-Expert 8.0.6.0 软件设计两水平因子实验,筛选显著因素;接着通过爬坡实验逼近最大响应区;然后运用Design-Expert 8.0.0.6软件设计中心组合实验,建立提取模型,预测最佳提取条件和黄酮得率[13~15]。因素编码及因素水平见表3。
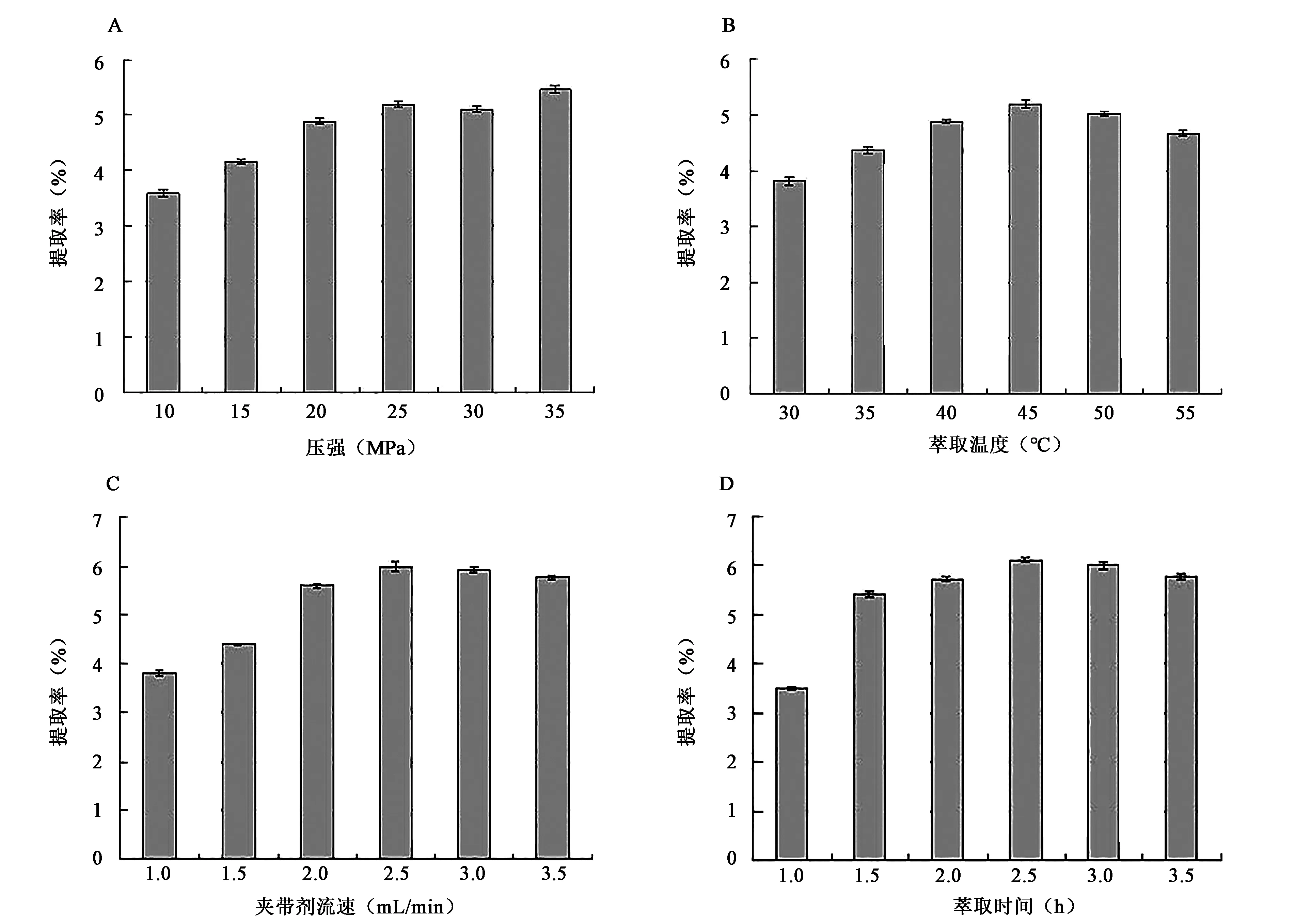
图2 单因素试验结果Fig.2 Results of single factor experiment.A:萃取压力对总黄酮提取率的影响; B:萃取温度对总黄酮提取率的影响; C:夹带剂流速对总黄酮提取率的影响; D:萃取时间对总黄酮提取率的影响
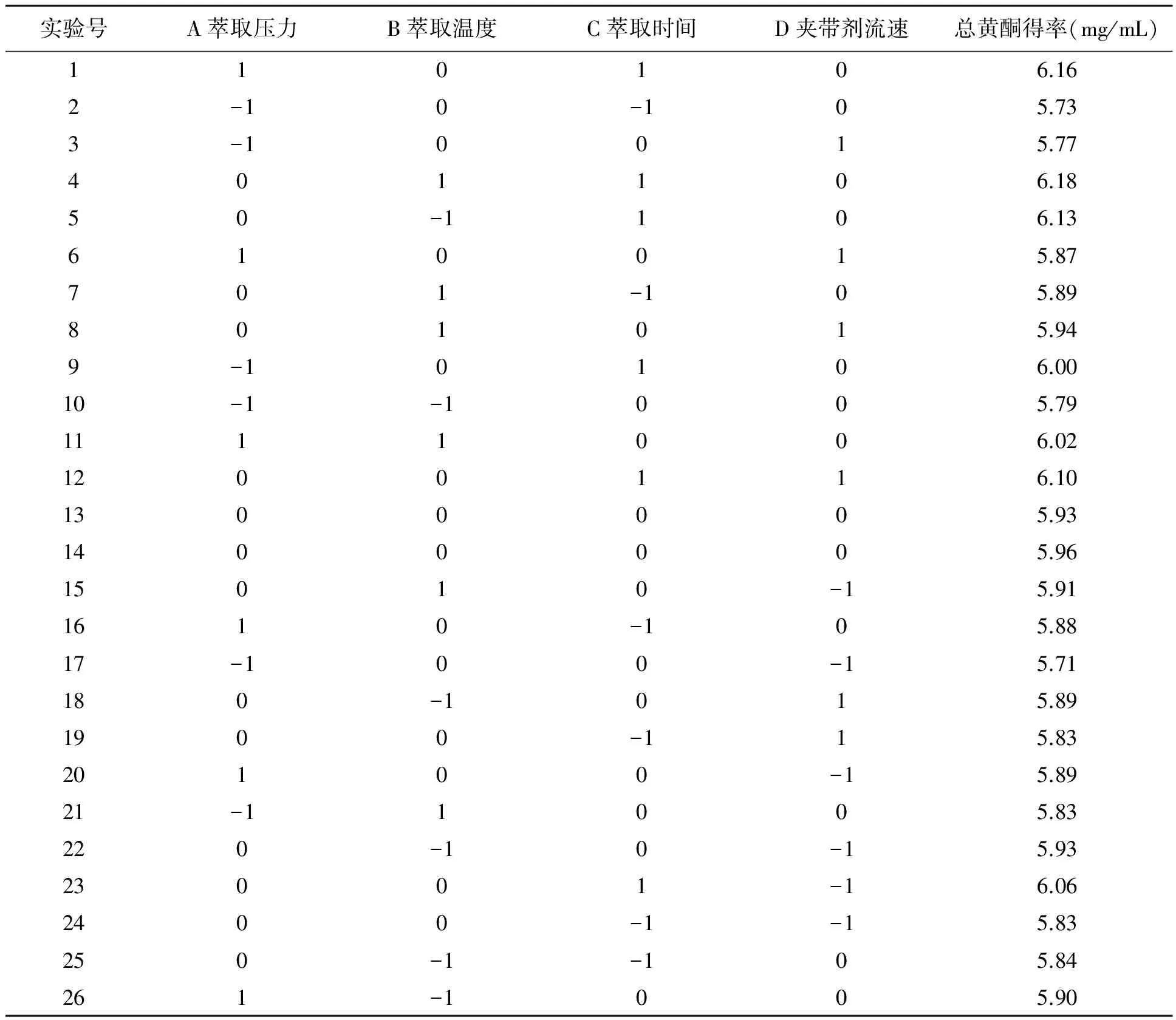
实验号A萃取压力B萃取温度C萃取时间D夹带剂流速总黄酮得率(mg/mL)110106.162-10-105.733-10015.77401106.1850-1106.13610015.87701-105.89801015.949-10106.0010-1-1005.791111006.021200116.101300005.931400005.9615010-15.911610-105.8817-100-15.71180-1015.891900-115.8320100-15.8921-11005.83220-10-15.9323001-16.062400-1-15.83250-1-105.84261-1005.90
由表4 可知,萃取时间和萃取压力对黄酮得率影响极显著(P<0.01),温度、流速对黄酮得率影响不显著(P>0. 05)。比较各因素的P值,可知各单因素对黄酮得率的影响程度大小依次为:萃取时间>萃取压力>萃取温度>夹带剂流速。
2.2.2 拟合模型的建立 从图3A和图3B可知,实验模型的各残差基本分布结果表明,经方法分析对总黄酮得率建立的实验模型极在同一条直线上,与失拟分析相一致,图3B的残差预测也极显著(P<0.01)。从模型分析显著性可以明确看到该实验模型的表现各残差点在零点直线两侧不均匀分布,通过两个的建立是具有可靠性的。失拟项P=0.479 4>0.05,不显著;失拟项图对比可知,纯误差值为0.000 45,数值比较小,通过相关数据的分析可知该实验模型的拟合程度较好,试验误差较小,从分析值来看,分析本模型具有重要的作用。
模型方程回归系数及其显著性检验见表4,结果表明:模型一次项A、C显著,B、D 不显著;二次项A2、C2、D2显著;其余各项不显著。因此各个具体试验因素与响应值都不是线性关系。
通过软件对于实验模型进行分析,并且采用Y作为因变量,采用R1为总黄酮提取量,A、B、C、D分别代表萃取压力、萃取温度、萃取时间、流速。得到回归方如下:
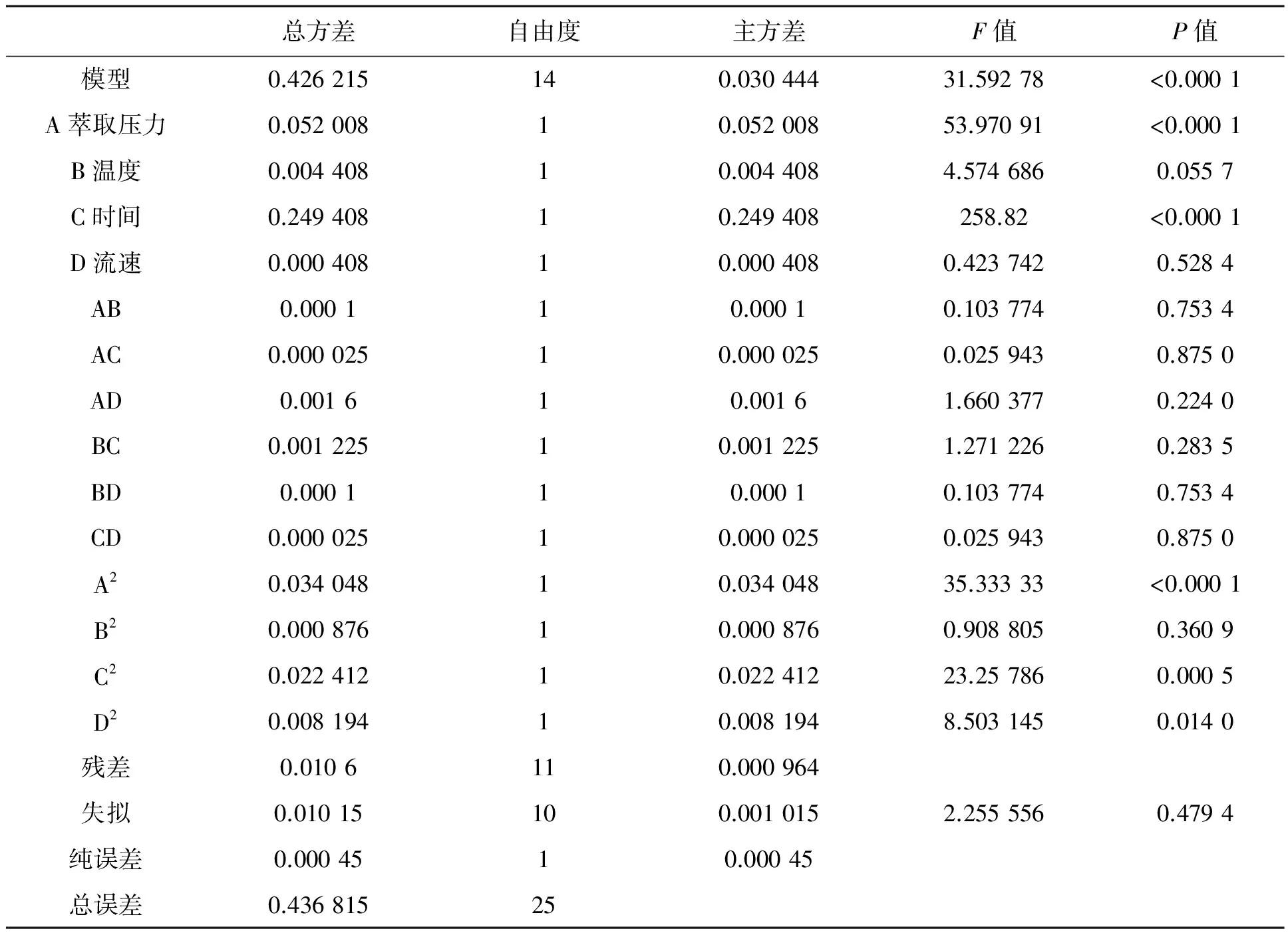
表4 4因素3水平实验方差分析表
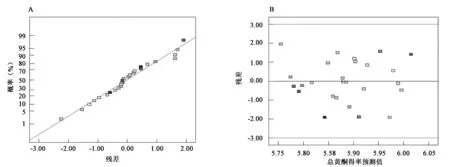
图3 总黄酮提取率残差分布(A)与预测分布(B)示意图Fig.3 Residual(A) and predict distribution(B) diagram of flavonoids extraction yield.A.残差分布示意图;B.预测分布示意图
R1= 5.95+0.066A+0.019B+0.14C+5.833E-003D-5.000E-0.03AB+2.500E-0.03 AC-0.020AD+0.018BC+5.000E-0.03BD+2.500E-0.03CD+0.088A2+0.014 B2+0.072 C2-0.043 D2
2.2.3 响应曲面结果分析 通过模型方程所作的响应曲面图及其等高线,结果见图4。采样时间比对总黄酮得率的影响最显著,其次是萃取压力,并且各个因素之间的交互作用并不显著。
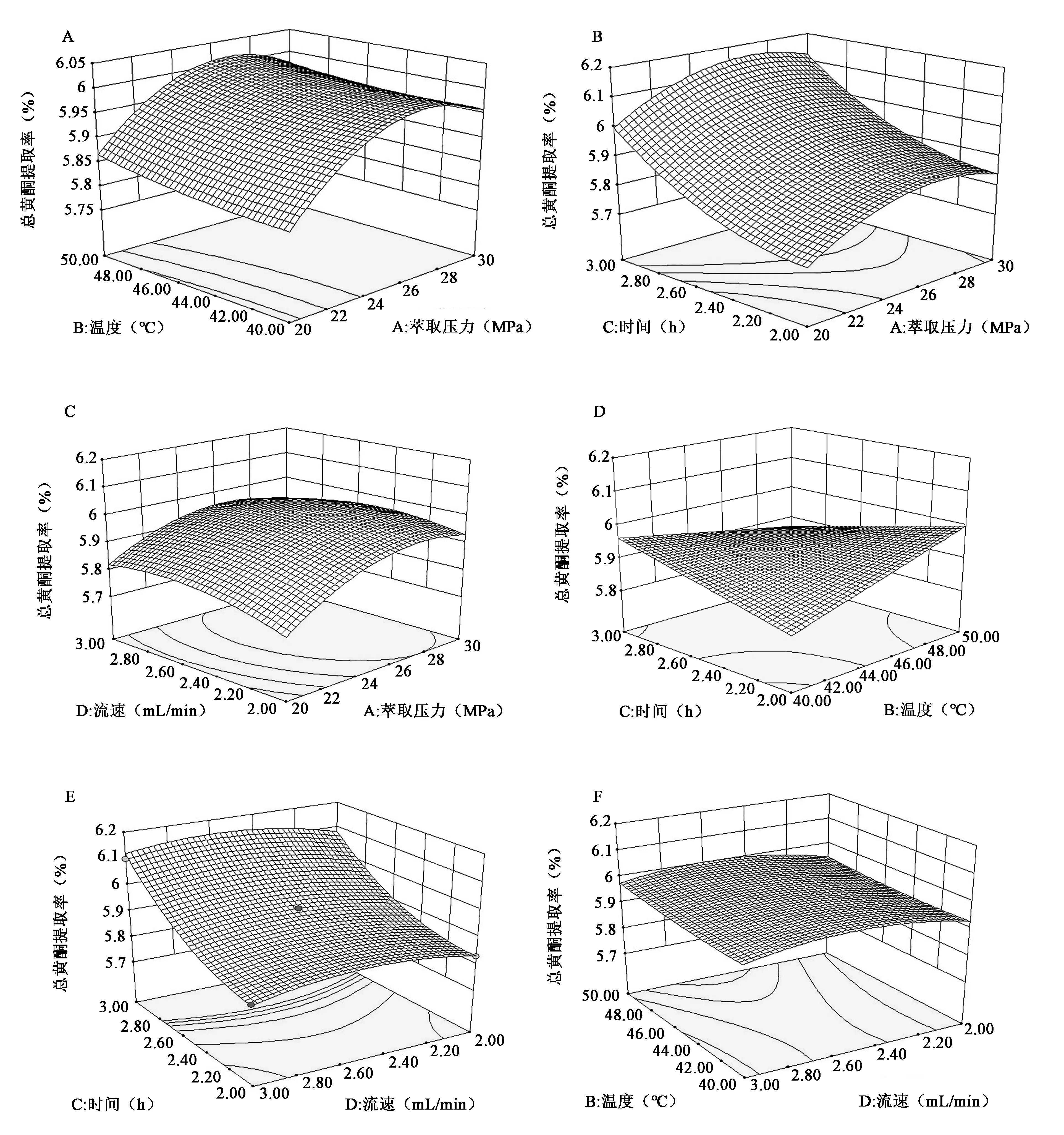
图4 各因素影响桑叶黄酮得率的响应曲面Fig.4 Response surface of each factor on flavonoids yield in mulberry leaves.A:提取率=f(A,B)的响应面; B:提取率=f(A,C)的响应面; C:提取率=f(A,D)的响应面; D:提取率=f(B,C)的响应面; E:提取率=f(C,D)的响应面; F:提取率=f(B,D)的响应面
2.3 最优提取条件的选择
根据Design-Expert 8.0.5 软件可以优化最佳方案,最佳的提取率方案为压力26 MPa,温度50℃,时间3 h,流速2.5 mL/min,预期的总黄酮得率6.22%。
为了验证该模型的准确性,在不同的提取条件下进行了6组验证实验(均选择在实验的范围之内,3组实验按照得到的最优条件进行,另外3组随机选择)。验证实验的实验值与预测值的相关系数都大于0.98,并且差异不显著(P>0.05),证明该模型能较好地用于桑叶提取总黄酮物质的的预测及评价。最优实验条件下得到的总黄酮提取率结果为6.21%±0.05%,实验结果与Design-Expert 8.0.5软件的优化理论预测值比较误差为4.6%,可以证明采用响应曲面法优化得到的提取条件参数基本准确可靠,具有一定的实用价值。
3 讨论
本试验采用响应面法通过构建二次回归模型,建立了总黄酮提取率和相关的萃取因素之间的方程,根据响应曲面对总黄酮的提取影响因素分析得到,即萃取时间>萃取压强>萃取温度>夹带剂流速,最后采用方程确定最佳提取工艺最优工艺为萃取压强为26 MPa,萃取温度为50℃,萃取时间为3 h,流速为2.5 mL/h,此条件下,总黄酮提取率可达6.21%。
现在对于桑叶中的总黄酮提取方法主要有回流提取法、超声提取法、微波提取法和索氏提取法[13~15]等。其中回流提取法操作方法相对复杂,并且由于不同种类的桑叶总黄酮含量和具体成分不同,需要不断改变萃取剂和液料比得到最佳的实验条件,工艺流程相对复杂。超声提取法、微波提取法加剧了体系中分子的碰撞频率,使黄酮类分子容易从桑叶内部扩散到萃取溶剂中,但是会使桑叶中的细胞膜和细胞壁破裂,使提取溶剂进入细胞,溶解并释放出细胞内物质,导致植物细胞内部分黄酮类物质产生化学反应分解,降低总黄酮提取率。超声提取法会产生比较明显的超声-热效应,但是如果超过了最适合的值之后,则有可能导致一些热敏感的黄酮物质在提取过程中分解或产生异构化反应,从而降低了总黄酮得率。索氏提取法需要消耗比较多的时间,同时由于桑叶中的黄酮类物质极性较大,故采用索氏提取法提取桑叶总的总黄酮,其总黄酮得率普遍较低。
相对而言,超临界CO2萃取方法具有能够在较低温度条件下实现桑叶中总黄酮物质的高效提取、萃取液中保留了多种具有生理活性的总黄酮成分、萃取物无有机溶剂残留、流程简单、操作相对简单、可保护桑叶总黄酮中热敏性物质不受破坏等特点。而本方法具有准确、可靠、可重复性强等特点,为提高桑叶中总黄酮的提取率提供了参考价值。
实验结果分析,采用CO2超临界技术萃取桑叶中的黄酮类物质,提取温度和压力是需要考虑的重要因素之一[13~16]。这是因为提高萃取温度和压强虽然有利于生物活性物质从植物细胞中释放出来,但是如果超过了最适合的值之后,则有可能导致一些压敏、热敏感的黄酮物质在提取过程中分解或是产生异构化反应[17]。目前已经有研究表明,在高温高压条件下总黄酮中的部分物质的异构化进程大大地加快[18]。萃取时间也是影响黃酮提取率的一个重要因素,在一定的萃取温度、萃取压力下,实验得到的桑叶总黄酮提取率随着萃取时间的增加而增加,但是增加萃取时间会增加夹带剂的消耗,同时增加仪器的损耗,故设定萃取时间需要综合考虑,以获得更好的经济效应。相比其他参数而言,夹带剂流速对黄酮得率影响最不显著(P=0.528 4),故在实际的生产中,可以适当降低夹带剂流速,降低生产成本。
[1] 中国药典委员会.中国药典[C].北京:中国医药科技出版社,2015,297-298.
[2] Doss S, Chakraborti S, Chattopadhyay S,etal.. Physiological and biochemical characteristics associated with leaf retention in mulberry (Morusspp.)[J]. Open J. Genet., 2011,1:27-33.
[3] 宿树兰,段金廒,欧阳臻,等. 我国桑属(Morus) 药用植物资源化学研究进展[J]. 中国现代中药,2012,14 (7):1-6.
[4] Doss S, Chakraborti S, Roychowdhuri S,etal.. Variability, heritability and genetic advance in mulberry (Morusspp.) for growth and yield attributes[J]. Agric. Sci., 2012,3:208-213.
[5] Mohammad I, Hamayun K, Mohibullah S,etal.. Chemical composition and antioxidant activity of certainMorusspecies[J]. J. Zhejiang Univ. Sci.B(Biomed. Biotechnol.),2010,11(12): 973-980.
[6] 孙 莲,孟 磊,阎 超,等.桑叶的降血糖活性成分和药理作用[J].中草药,2002,33(5):471.
[7] 孙 玲. 桑叶的化学成分、 研究方法及药理活性研究进展[J].临床合理用药,2012,5(28):178-179.
[3] 王志雄,高剑文,缪伟伟.桑叶对肿瘤血管生成的影响[J].中国医药导报,2014,11(25):22-25.
[4] 张丽洁,张 志. 桑叶的药理作用及临床应用[J].中医中药,2010,17(29):80-81.
[5] 朱自强.超临界流体技术原理和应用[M].北京:化学工业出版社,2000.
[7] Ye W. Development features of supercritical(ultra-supercritical) technology in the world and experiences we can learn[J]. J. Power Energy Engin., 2016,4:1-3.
[8] Ma B, Cui F, Zhang Y. Rapid analysis of morusin from ramulus mori by HPLC-DAD, its distribution in vivo and differentiation in the cultivated mulberry species[J]. Food Nutr. Sci., 2013, 4(2):189-194.
[9] Rima M B, Dipti B P. RP-HPLC method for simultaneous estimation of montelukast sodium and desloratadine in combined dosage form[J/OL]. Pharmatutor, http://gnu.inflibnet.ac.in/bitstream/123456789/986/1/45.pdf,2013.
[10] Luik H, Luik L, Palu V,etal.. Applicability of static supercritical carbon dioxide extraction in biogeochemical characterization of oil shales[J]. Am. J. Anal. Chem., 2014,5 (3):173-180.
[11] Allawzi M, Al-Otoom A, Allaboun H,etal.. CO2supercritical fluid extraction of jordanian oil shale utilizing different co-solvents[J]. Fuel Proc. Technol., 2011, 92(10):2016-2023.
[12] Carulo M. Use of SFC in extraction of adaptogens from Brazilian plants[J]. Am. J. Anal. Chem.2012, 3(12A):977-982.
[13] Al-Asheh S, Allawzi M, Al-Otoom A,etal.. Supercritical fluid extraction of useful compounds from sage[J]. Nat. Sci., 2012,4:544-551.
[14] Vuong Q V, Golding J B, Stathopoulos C E,etal.. Optimizing conditions for the extraction of catechins from green tea using hot water[J]. J. Separ. Sci., 2011, 34(21):3099-3106.
[15] 何 晶,钱斐莹,邹 培,等.不同提取方法对桑叶中芦丁含量的影响研究[J].广东化工,2016,43(17):18-19.
[16] 李佳慧,拱健婷,赵丽莹,等.黄蜀葵花总黄酮提取工艺[J].国际药学研究杂志,2016(2):370-373.
[17] 马泽刚,袁小红,徐春霞,等.费约果叶片总黄酮的提取工艺研究[J].食品研究与开发,2016(9): 79-82.
[18] 钱亚琴, 刘汉清, 庄 炜. SFE-CO2萃取技术在中药提取分离中的应用[J]. 南京中医药大学学报, 2004, 20(4): 254-256.
Study on Supercritical Carbon Dioxide Extraction of Total Flavonoids from Mulberry Leaves
SHI Tongyu1, MIAO Weiwei2,3, WANG Zhixiong1,3*
1.SchoolofMedicalInstrumentandFoodEngineering,UniversityofShanghaiforScienceandTechnology,Shanghai200093,China; 2.OsakaUniversity,Osaka565-0871,Japan; 3.SchoolofPhamacy,ShanghaiUniversityofMedicineandHealthScience,Shanghai200093,China
To explore the optimal plan of extracting total flavone from mulberry leaves through the method of supercritical carbon dioxide, this research utilized supercritical carbon dioxide extraction technology and applies response surface method to examine the influence of extraction pressure, extraction temperature, extraction time and flow velocity of entrainer absolute ethyl alcohol on yield of total flavone in mulberry leaves, and selected the optimal technology that mulberry leaves flavonoids extract using supercritical fluid extraction device. The results indicated that, the optimal extraction condition of response surface method was as follows: pressure in optimal extraction plan was 26 MPa, temperature was 50℃, time was 3 hours, and flow velocity was 2.5 mL/min. The predicted total flavone yield under optimal condition was 6.21%±0.05%.
mulberry; supercritical carbon dioxide extraction; flavonoid yield; corresponding method of curved surface
2016-10-18; 接受日期:2016-12-01
国家自然科学基金项目(81402030)资助。
石仝雨,硕士研究生,研究方向为生物医学工程。E-mail:styshlg@126.com。*通信作者:王志雄,高级工程师,研究方向为生物医学工程。E-mail:wangzx@sumhs.edu.cn
10.3969/j.issn.2095-2341.2017.01.13

