玉米转录因子ZmERF1的克隆及表达分析
史庆玲, 董永彬, 周 强, 马智艳, 乔大河, 邓 飞, 李玉玲
1.河南农业大学农学院, 粮食作物协同创新中心, 小麦玉米国家重点实验室, 郑州 450002 2.河南省种子管理站, 郑州 450016;
玉米转录因子ZmERF1的克隆及表达分析
史庆玲1,2, 董永彬1*, 周 强1, 马智艳1, 乔大河1, 邓 飞1, 李玉玲1*
1.河南农业大学农学院, 粮食作物协同创新中心, 小麦玉米国家重点实验室, 郑州 450002 2.河南省种子管理站, 郑州 450016;
ERF类转录因子是乙烯信号转导途径中的下游响应因子,参与乙烯调控的多种生理生化反应。从玉米自交系丹232授粉后20 d的胚乳中克隆了一个ERF类转录因子ZmERF1,并对其进行了序列及表达分析。结果显示,ZmERF1基因全长811 bp,ORF 690 bp,编码230个氨基酸,包含一个典型的AP2结构域,含有3个α-helix和1个β-sheets,亚细胞定位于细胞核中。进化树分析表明该基因与单子叶高粱SbERF和水稻OsERF同源性较高。在体外原核表达系统中能够检测到重组蛋白His-ZmERF1,并用Western Blot验证了所表达蛋白为重组蛋白,表明该基因具有体外活性。荧光定量PCR分析表明该基因在胚乳发育的前期表达量较少,后期(36 d)表达量较高。进一步对胚乳总蛋白的定量Western Blot分析,表明该蛋白在胚乳发育后期积累量高于发育前期。因此,初步推测玉米ZmERF1可能在籽粒胚乳发育后期发挥重要作用。该研究结果为了解该基因家族转录因子并进一步阐明其生物学功能提供了依据。
AP2/EREBP类转录因子;ZmERF1;荧光定量PCR;Western Blot
转录因子是指能够与真核生物启动子区域的顺式作用元件发生特异性相互作用的DNA结合蛋白,能够激活或抑制下游基因转录的关键因子。AP2/EREBP类转录因子是植物中最大的、特有的并且起源古老的一类转录因子,其广泛参与植物的生长发育及各种逆境胁迫应答调控[1~4]。该转录因子家族的共同特点是其DNA结合域含有1~2个高度保守的AP2结构域,根据所含结构域的数目和结构域的特点可将该类转录因子分为AP2(含有2个保守结构域)和EREBP(含有1个保守结构域)2个亚类,ERF类转录因子属于EREBP类[5]。在拟南芥、水稻和玉米中分别发现了122个、139个和167个ERF类转录因子[6,7]。
ERF类转录因子作为AP2/EREBP家族的一个亚家族,主要参与生物和非生物胁迫的应答反应,在干旱、高盐和高低温胁迫应答以及植物发育、激素反应等调控网络中起重要作用[8~10]。但不少研究发现该亚家族基因在种子、茎秆、叶片和幼苗中均有表达,表明该亚家族基因可能在植物的生长发育过程中起着更加广泛的作用[11],在植物的器官发育、细胞分裂、分化、花发育和果实成熟中均有相关研究[12,13]。在番茄中过表达Sl-ERF2基因能够激活编码甘露聚糖酶基因Sl-Man2,从而导致番茄未成熟种子提前萌发[14];水稻基因Sub1A/C参与植物的生长代谢[15];苹果基因MdERF1/2与果实成熟有关[16],但玉米中ERF亚家族基因的功能还没有相关报道。
ERF类转录因子作为乙烯信号转导途径中一个关键的下游细胞核响应因子,参与多种乙烯调控的生理生化反应,对玉米籽粒的生长发育起着重要作用[17, 18]。因此,本研究从玉米自交系丹232中克隆了一个ERF类转录因子ZmERF1,氨基酸序列分析表明该基因属于ERF类转录因子,并通过荧光定量PCR及胚乳总蛋白的Western Blot分析了该基因在籽粒不同发育时期的表达特征,为进一步克隆该家族其他基因及全面阐述其功能奠定了基础。
1 材料与方法
1.1 实验材料
选取玉米自交系丹232为材料,2012年种植于郑州河南农业大学科教园区,行长4 m,行距0.67 m,每行17株。授粉后不同时期取样,3个果穗为1个重复,剥取穗中部籽粒混合,剥掉种皮和胚,-70℃保存备用。
1.2ZmERF1基因克隆和生物信息学分析
利用NCBI (http://www.ncbi.nlm.nih.gov/)数据库中已知的ERF序列(GenBank登录号:AY672654)设计引物(表1)。PCR扩增体系为(50 μL):模板cDNA 1 μL,TaqHifi Buffer (10×) 5 μL,2.5 mol/L dNTP 2 μL,Primer-F(R) 1 μL,TaqDNA Polymerase 1 μL,ddH2O 39 μL;PCR程序为:95℃ 5 min;94℃ 50 s,58℃ 45 s,72℃ 1 min,34个循环;72℃ 10 min。PCR产物经电泳回收连接到pMD19-T载体,转化大肠杆菌筛选阳性克隆,提取质粒,由华大生物科技有限公司测序。利用软件BioXM 2.6进行蛋白质序列比对;cNLS Mapper分析基因核定位信号肽;SoftBerry (http://www.softberry.com/)在线分析基因亚细胞定位;Predict Protein (https://www.predict-protein.org/)预测蛋白质保守结构域的α-螺旋和β-折叠。利用Clustal W程序进行序列比对,利用MEGA 4.0软件的Neighbor-Joining方法构建ZmERF1与已知ERF蛋白的系统进化树。

表1 实验所用引物序列
1.3 荧光定量PCR分析
分别提取自交系丹232授粉后10 d、16 d、20 d、26 d、30 d、36 d和40 d的胚乳总RNA,纯化后反转录获得cDNA,产物用于定量PCR扩增。根据ZmERF1基因的ORF序列设计引物(表1),以玉米Actin基因为参照基因。反应体系为(25 μL):12.5 μL 2× SYBR Premix ExTaq,引物2 μL,模板2 μL,超纯水8.5 μL。反应条件为95℃ 30 s;95℃ 5 s,58℃ 30 s,共40个循环,每个反应重复3次,通过比较Ct值来确定相对表达量。
1.4ZmERF1原核表达
利用引物YH-F与YH-R以保存的丹232重组质粒pMD19-ZmERF1为模板,进行PCR扩增后与pEASY-E1表达载体连接,将连接好的质粒转化大肠杆菌BL21感受态细胞。挑取阳性单克隆摇菌,当菌液浓度OD600为0.6~1.0之间时,取出3 mL作为不加IPTG的空白对照,剩余的7 mL加入终浓度为0.5 mmol/L的IPTG进行诱导表达。37℃诱导表达3~6 h后,利用10%的SDS-PAGE胶分离蛋白。
1.5 总蛋白提取
取-80℃冰箱中冻存的丹232不同发育时期的胚乳,在液氮中加PVPP研磨成粉末,用TCA-丙酮法提取总蛋白。蛋白浓度通过Bradford法测定,根据标准曲线计算待测样品的浓度,根据测定的浓度确定上样量,最多45 μL,进行SDS-PAGE胶分离蛋白。
1.6 Western Blot分析
离心收集诱导表达的菌株蛋白和籽粒胚乳蛋白,用10%的SDS-PAGE胶分离蛋白,制作三明治转化PVDF膜后,4℃过夜封闭PVDF膜。用含有0.5%脱脂奶粉的TBST稀释一抗(兔多克隆抗体,华大)到合适浓度孵育PVDF膜,用TBST冲洗3次。带有辣根过氧化物的羊抗兔IgG二抗(天根)1/10 000稀释后孵育1 h,用TBST冲洗2次,用DAB显色试剂盒显色。总蛋白的WB分析中一抗和二抗孵育大肠杆菌的诱导蛋白用化学荧光方法,在暗室中用X光片显色。
2 结果与分析
2.1ZmERF1克隆与序列分析
以玉米自交系丹232的籽粒cDNA为模板,PCR扩增并获得ZmERF1基因序列,测序结果表明,自交系丹232中ZmERF1基因序列全长811 bp,其中ORF 690 bp (图1)。
根据AP2/EREBP家族特征,ERF类基因属于含有一个AP2保守结构域的EREBP亚家族。结构域预测表明在自交系丹232中该基因编码蛋白包含一个AP2结构域(第57~120个氨基酸),并含有3个α-螺旋和1个β-折叠;信号肽预测表明该基因编码蛋白含有双边核定位信号肽,其中“IPARRRVSTADFWPGSEADAEDIHASHSPDP”为得分最高的一段信号肽,该蛋白主要在细胞核中发挥作用。利用软件MEGA 4.0中Neighbor-Joining方法生成系统进化树,表明ZmERF1属于ERF转录因子家族成员,与单子叶水稻OsERF和高粱SbERF基因具有较高同源性(图2)。
2.2ZmERF1原核表达及Western Blot
将包含pEASY-E1-ZmERF1重组质粒的BL21菌株挑取单菌落振荡培养,ZmERF1重组蛋白在22~29 kDa之间有明显蛋白表达量增加条带(图3A,彩图见图版二),而生物信息学预测ZmERF1蛋白分子量大小约为24 kDa,加上6×His标签,表达的重组蛋白大小与理论计算值相符合;而诱导不加IPTG的空白对照时在22~29 kDa之间没有蛋白表达量增加条带,说明ZmERF1重组蛋白经IPTG诱导后可以在BL21菌株中稳定有效地表达。将经过SDS-PAGE胶电脉后的蛋白电转到PVDF膜,用含有0.5%脱脂奶粉TBST稀释的一抗孵育2 h,然后用带有辣根过氧化物的二抗孵育1 h,用HRP-DAB试剂盒显色,诱导表达的蛋白如图3B所示。
2.3 玉米胚乳发育中ZmERF1的表达分析
对不同发育时期玉米胚乳中ZmERF1表达分析结果表明,在自交系丹232胚乳发育早期、中期ZmERF1表达量相对较低,发育后期表达量明显升高,随后下降但也高于前期(图4A)。进一步对不同发育时期的胚乳蛋白进行定量Western BlotERF类亚家族成员在植物的生长发育、代谢、抵抗生物与非生物胁迫中都有重要作用。ERF亚家族是乙烯信号转导途径中的下游调控因子,当植物受到逆境胁迫刺激时会激发体内的信号级联系统,乙烯的生物学合成被诱导,可以启动其他相关基因进行应激反应而调控植物的生长分析,表明在自交系丹232胚乳发育后期(36 d)该蛋白含量也较多(图4B)。

图2 ZmERF1基因序列和进化树分析结果Fig.2 Sequence analysis and phylogenetic trees of ZmERF1.A:AP2保守结构域中3个α-螺旋和1个β-折叠 (E:α-螺旋; H:β-折叠); B:SoftBerry在线预测自交系丹232中ZmERF1亚细胞定位; C:ZmERF1进化树分析
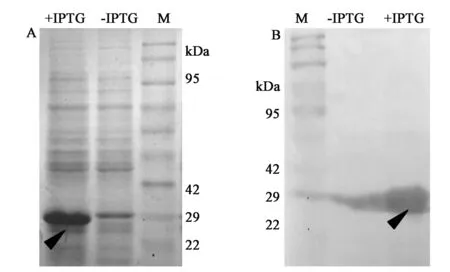
图3 ZmERF1基因原核表达分析 Fig.3 Prokaryotic expression analysis of ZmERF1.A.重组蛋白SDS-PAGE胶检测;B.重组蛋白Western Blot分析(彩图见图版二)
3 讨论
玉米是当前第一大作物,在世界粮食安全中占有重要地位,提高玉米产量是解决粮食安全问题的一个重要途径。玉米籽粒是代表性的贮藏器官,而胚乳是籽粒积累和贮藏营养物质的场所,占籽粒重量的80%以上,胚乳细胞的发育、增殖和充实情况决定了籽粒的重量和品质。因此,挖掘影响玉米籽粒发育相关基因对其产量提高具有重要意义。
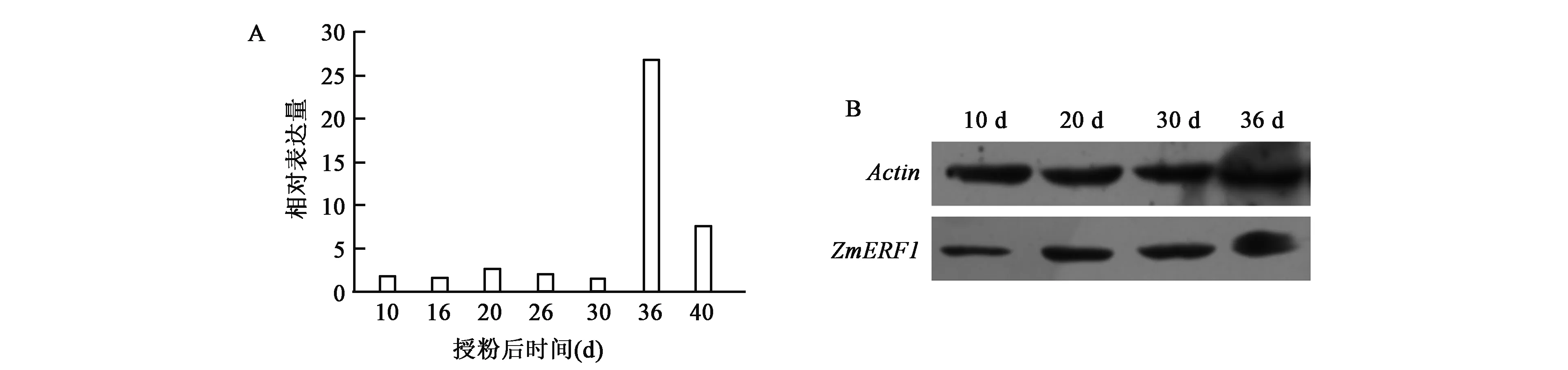
图4 不同发育时期玉米自交系丹232胚乳中ZmERF1表达分析Fig.4 Expression analysis of ZmERF1 from endosperm of Dan232 in different development period.A.ZmERF1在发育胚乳中的表达分析; B.胚乳中ZmERF1的Western Blot分析
发育[19~21]。香蕉中ERFs类基因的研究表明,MaERF9和MaERF11在香蕉成熟的过程中呈现不同程度的表达模式,同时与乙烯合成基因MaACO1互作调节果实成熟[22]。
本研究从玉米籽粒中克隆了1个含有保守AP2结构域的ERF类亚家族基因ZmERF1,该基因编码序列全长690 bp,编码230个氨基酸残基,该序列包含1个典型的AP2结构域,并且含有3个α-螺旋和1个β-折叠,属于ERF亚家族,通过亚细胞定位预测该转录因子在细胞核中发挥作用。在授粉后10 d到30 d的玉米胚乳中,该基因的表达量相对比较平缓,随着胚乳灌浆结束,开始脱水成熟,ZmERF1表达量明显增加。但要明确ZmERF1在玉米籽粒发育和脱水成熟中的具体作用,还需要进一步研究。
[1] Boutilier K, Offringa R, Sharma V K,etal.. Ectopic expression of BABY BOOM triggers a conversion from vegetative to embryonic growth[J]. Plant Cell, 2002, 14 (8):1737-1749.
[2] Chuck G, Muszynski M, Kellogg E,etal.. The control of spikelet meristem identity by the branchedsilkless1 gene in maize[J]. Science, 2002, 298 (5596):1238-1241.
[3] Park J M, Park C J, Lee S B,etal.. Overexpression of the tobaccoTsi1 gene encoding an EREBP/AP2-type transcription factor enhances resistance against pathogen attack and osmotic stress in tobacco[J]. Plant Cell, 2001, 13 (5):1035-1046.
[4] Elliott R C, Betzner A S, Huttner E. AINTEGUMENTA, an APETALA2-like gene ofArabidopsiswith pleiotropic roles in ovule development and floral organ growth[J]. Plant Cell, 1996, 8 (2):155-168.
[5] Sakuma Y, Liu Q, Dubouzet J G,etal.. DNA-binding specificity of the ERF/AP2 domain ofArabidopsisDREBs, transcription factors involved in dehydration-and cold-inducible gene expression[J]. Biochem. Biophys. Res. Commun., 2002, 290 (3): 998-1009.
[6] Nakano T, Suzuki K, Fujimura T,etal.. Genome-wide analysis of the ERF gene family inArabidopsisand rice [J]. Plant Physiol., 2006, 140 (2): 411-432.
[7] Zhuang J, Deng D X, Yao Q H,etal.. Discovery, phylogeny and expression patterns of AP2-like genes in maize [J]. Plant Growth. Regul., 2010, 62 (1): 51-58.
[8] Zhang Z, Huang R. Enhanced tolerance to freezing in tobacco and tomato overexpressing transcription factorTERF2/LeERF2 is modulated by ethylene biosynthesis [J]. Plant Mol. Biol., 2005, 73 (3): 241-249.
[9] Sakuma Y, Liu Q, Dubouzet J G,etal.. DNA-binding specificity of the ERF/AP2 domain ofArabidopsisDREBs, transcription factors involved in dehydration-and cold-inducible gene expression [J]. Biochem. Biophys. Res. Commun., 2002, 290 (3): 998-1009.
[10] Agarwal P, Agarwal P K, Joshi A J,etal.. Overexpression ofPgDREB2Atranscription factor enhances abiotic stress tolerance and activates downstream stress-responsive genes [J]. Mol. Biol. Rep., 2000, 37 (2): 1125-1135.
[11] Cheng M C, Liao P M, Kuo W W,etal.. TheArabidopsisETHYLENE RESPONSE FACTOR1 regulates abiotic stress-responsive gene expression by binding to different cis-acting elements in response to different stress signals [J]. Plant Physiol., 2013, 162 (3): 1566-1582.
[12] Nakano T, Fujisawa M, Shima Y,etal.. The AP2/ERF transcription factor SlERF52 functions in flower pedicel abscission in tomato [J]. J. Exp. Bot., 2014, 65 (2): 3111-3119.
[13] El-Sharkawy I, Sherif S, Mila I. Molecular characterization of seven genes encoding ethylene-responsive transcriptional factors during plum fruit development and ripening [J]. J. Exp. Bot., 2009, 60 (3): 907-922.
[14] Pirrello J, Jaimes-Miranda F, Sanchez-Ballesta M T,etal.. Sl-ERF, a tomato ethylene response factor involved in ethylene response and seed germination [J]. Plant Cell Physiol., 2006, 47 (9): 1195-1205.
[15] Fukao T, Xu K, Ronald P C,etal.. A variable cluster of ethylene response factor-like genes regulates metabolic and developmental acclimation responses to submergence in rice [J]. Plant Cell, 2006, 18 (8): 2021-2034.
[16] Wang A, Tan D, Takahashi A,etal..MdERFs, two ethylene-response factors involved in apple fruit ripening [J]. J. Exp. Bot., 2007, 58 (13): 3743-3748.
[17] Johnson P R, Ecker J R. The ethylene gas signal transduction pathway: a molecular perspective [J]. Ann. Rev. Genet., 1998, 32 (1): 227-254.
[18] Beltrano J, Carbone A, Montaldi E R,etal.. Ethylene as promoter of wheat grain maturation and ear senescence [J]. Plant Growth. Regul., 1994, 15 (2):107-112.
[19] Wang F F, Cui X K, Sun Y,etal.. Ethylene signaling and regulation in plant growth and stress responses[J]. Plant Cell Rep., 2013, 32 (7): 1099-1109.
[20] Iqbal N, Trivellini A, Masood A,etal.. Current understanding on ethylene signaling in plants: The influence of nutrient availability [J]. Plant Physiol. Biochem., 2013, 73 (5): 128-138.
[21] Xu Z S, Chen M, Li L C,etal.. Functions and application of the AP2/ERF transcription factor family in crop improvement [J]. Integr. Plant Biol., 2011, 53 (7): 570-585.
[22] Xiao Y Y, Chen J Y, Kuang J F,etal.. Banana ethylene response factors are involved in fruit ripening through their interactions with ethylene biosynthesis genes [J]. J. Exp. Bot., 2013, 64 (8): 2499-2510.
Cloning and Expression Analysis ofZmERF1 in Maize
SHI Qingling1,2, DONG Yongbin1*, ZHOU Qiang1, MA Zhiyan1, QIAO Dahe1, DENG Fei1, LI Yuling1*
1.NationalKeyLaboratoryofWheatandMaizeCropScience,CollaborativeInnovationCenterofHenanGrainCrops,CollegeofAgronomy,HenanAgriculturalUniversity,Zhengzhou450002,China; 2.Seed Administrative Station of Henan, Zhengzhou 450016, China
ERFsaredownstreamcomponentinethylenesignalingandinvolvesinplantresponsestoethylene.Inthisstudy,anERFgene,designatedasZmERF1,wasisolatedfrom20DAPendospermofinbredDan232 (Zea maysL.)anditssequenceandexpressioncharacteristicswereanalyzed.ZmERF1contains811bpwitha690bpORF,andencodes230aawithasingleconservedAP2domain.Onlineproteinstructurepredictionrevealedthattherearethreeβ-sheetsandoneα-helixintheAP2domain.TheZmERF1localizedinthenucleusbyonlineproteinprediction. ZmERF1wascloselyhomologouswithsorghumSbERFandriceOsERF.ProkaryoticexpressionandWesternBlotanalysisshowedthatZmERF1proteinscouldbeobtainedinvitro.TheexpressionlevelofZmERF1proteinsinearly-stagewaslowerthanthatinlater-stageofendosperm(36DAP)inDan232. ZmERF1mayplayakeyroleinlater-stageofendospermdevelopmentinmaize.TheresultsofthisworkuncoveredcharacteristicsofERFsinmaize,andprovidedabasicforexploringtheirbiologicalfunctionsingrainsdevelopment.
AP2/EREBP family;ZmERF1; qPCR; Western Blot
2016-09-06; 接受日期:2016-12-15
国家自然科学基金项目(31671770);河南省高等学校重点科研项目(15A210003)资助。
史庆玲,农艺师,研究方向为玉米分子生物学。E-mail:qinglingshi021@163.com。*通信作者:董永彬,副教授,研究方向为玉米遗传育种。E-mail:dyb0816@163.com;李玉玲,教授,研究方向为玉米遗传育种。E-mail:yuling_li@126.com
10.3969/j.issn.2095-2341.2017.01.07

