大鼠慢性束缚应激后肠道病理及其菌群变化
王 华, 王志红
合肥市第二人民医院消化内科, 合肥 230000
大鼠慢性束缚应激后肠道病理及其菌群变化
王 华, 王志红*
合肥市第二人民医院消化内科, 合肥 230000
基于慢性束缚应激法建立大鼠慢性应激模型,结合苏木精-伊红染色和肠道细菌基因间重复序列(enterobacterial repetitive intergenic consensus,ERIC)-PCR技术观察大鼠肠道组织病理及菌群变化规律。选取10只健康雄性sprague-dawley (SD)大鼠,随机分为对照组和模型组,每组5只。对照组正常饲养,模型组采用束缚筒每天束缚应激4 h,连续造模30 d,造模前后记录大鼠的体重并于造模后进行行为学评估,采用脱臼法处死并收集大鼠肠道组织及其内容物,包被切片后进行HE染色,肠道内容物初步分离后提取基因组DNA并采用ERIC-PCR检测菌群变化规律。结果显示,与对照组相比,应激模型组大鼠体重、穿越次数、直立次数、理毛次数均显著降低,强迫游泳不动时间显著延长、糖水偏爱显著降低;造模后大鼠肠道微绒毛结构破损严重,细胞核轻微固缩且深染,肠道菌群变化明显,出现了多个特征性变化条带。采用慢性束缚应激法并结合行为学评估成功建立了大鼠慢性应激模型,结合病理学检测和肠道菌群表达谱变化为基于慢性应激相关疾病的研究提供了重要参考,具有一定的应用价值。
大鼠慢性束缚应激模型;行为学评估;肠道组织;肠道菌群;变化
以往的研究揭示了应激对机体的神经内分泌系统[7]、免疫系统[8]和胃肠道系统[9]等具有明显的调控作用,初期的反应调控机体的代偿作用,进而促进机体分泌保护因子维持机体基本平衡,后期的反应将造成机体的代偿紊乱,出现严重的应激性疾病。当机体处于长期的压力应激下,压力信号通过机体的交感和副交感神经传导,进而导致肠道出现不正常的生理改变而改变肠道菌群生活的环境,最终导致肠道菌群发生显著性改变[10,11]。本研究结合文献报道研究慢性束缚应激后大鼠的行为学变化、肠道病理学及菌群变化,以期从肠道菌群的角度为慢性应激性损伤机理的研究提供新的研究思路和方法,具有一定的应用价值。
1 材料与方法
1.1 材料
选取10只成年雄性SD(sprague-dawley)大鼠,体重200~220 g,随机分为对照组和模型组,每组5只。实验前适应饲养一周:自然光照,室温22±2℃,自由摄取食物和水,每日定时更换饲料,通风良好,排除其他应激因素干扰。
1.2 方法
1.2.1 大鼠慢性束缚应激动物模型制备 上述适应性饲养的大鼠置于束缚筒中,每天束缚应激4 h,连续应激处理30 d。大鼠束缚期间禁食禁水,束缚结束后恢复自由饮水。其中,束缚筒用于限制大鼠的活动范围,对躯体和胃肠道等无压迫,对其呼吸无抑制。束缚筒内置一个移动插片控制大鼠的活动空间,调节到其不产生强烈反抗的程度。
1.2.2 慢性束缚应激大鼠行为学评估 ①旷场实验。旷场实验需要在安静、暗光环境下进行,行为测定于造模前和造模后各进行1次。将大鼠放置旷场箱中,每次测定5 min,包括穿越格数(以穿越底面积块数为水平运动得分)、直立次数(为垂直运动得分)及理毛次数,记录各组数据后进行统计学分析。
②强迫游泳实验。强迫游泳实验前,分别将大鼠置于强迫游泳缸内进行预适应游泳15 min,然后用毛巾擦干,24 h后进行强迫游泳6 min,计算大鼠后4 min在水面漂浮的累计不动时间,记录各组数据后进行统计学分析。不动时间判断标准:大鼠停止挣扎或呈漂浮状态,四肢有轻微动作以保持在水面即为不动。
以天津市和平区、河西区、河东区、南开区、河北区、红桥区6个区的养老机构作为调研对象,每区随机抽取8家养老机构,共发放问卷48份,回收有效问卷46份,有效回收率95.8%。
③糖水偏爱实验。糖水消耗实验前,将大鼠进行分笼饲养(1只/笼),分别给予等体积的1%蔗糖水2瓶(200 mL/瓶)进行糖水预适应训练24 h。然后于造模禁水24 h后的第30 d,分别给予等体积的1%蔗糖水和纯水各1瓶(200 mL/瓶),1 h后称量剩余液体的体积,计算大鼠的总液体消耗、糖水消耗、纯水消耗和糖水偏爱(糖水偏爱=糖水消耗/总液体消耗×100%)。记录各组数据后进行统计学分析。
1.2.3 样品收集及处理 行为学检测结束后,将大鼠脱臼处死,分别收集回肠、盲肠、结肠组织及其内容物,组织样本经生理盐水清洗后置于4%多聚甲醛固定备用,组织内容物收集冻存于-80℃低温冰箱待进行基因组DNA提取。
1.2.4 HE染色 采用脱臼法处死大鼠,分别收集回肠、盲肠、结肠组织及其内容物,组织样本经生理盐水清洗后投入预先配好的固定液中(4%多聚甲醛)固定及切片,切片厚3~4 μm。脱水后进行HE染色,苏木精染色5 min,自来水冲洗多余染液;1%盐酸乙醇(70%乙醇配制)分化15 s左右,镜检待细胞核和核内染色质清晰为止,自来水冲洗30 min,蒸馏水冲洗2 min;0.5%伊红溶液染色5 min,使细胞核着色;梯度乙醇各脱水3 min:70%→85%→95%→100%;二甲苯I和II透明10 min后中性树胶封片,采集图片并进行分析。分别选取每只大鼠胃部、回肠、盲肠、结肠较好的切片各1张,进行40倍、100倍、200 倍光镜下观测拍照保存。
1.2.5 肠道组织内容物基因组DNA提取 按照基因组DNA提取试剂盒所述步骤进行回肠、盲肠、结肠等肠道组织内容物基因组DNA提取:称取180~200 mg组织内容物置于2 mL EP管,加入1.4 mL GSL缓冲液,间歇振荡混匀1 min,70℃水浴5 min;涡旋混匀15 s,13 000 r/min室温离心1 min,吸取上清液至一新的2 mL EP管,加入抑制剂吸附片,室温孵育1 min,13 000 r/min室温离心3 min;吸取上清液至新的1.5 mL EP管并重复加入抑制剂吸附片并离心;吸取200 μL上清液至新的1.5 mL EP管并加入15 μL蛋白酶K,进而加入200 μL GB缓冲液涡旋混匀15 s,70℃水浴5 min;加入200 μL无水乙醇并涡旋混匀,并将所有液体转移至CR2吸附柱,12 000 r/min室温离心30 s,弃去离心液;加入500 μL GD缓冲液,12 000 r/min室温离心30 s,弃去离心液;加入700 μL PW漂洗液,12 000 r/min室温离心30 s,弃去离心液;加入500 μL PW漂洗液,12 000 r/min室温离心30 s,弃去离心液;将CR2吸附柱置于新的收集管,12 000 r/min室温离心2 min,弃去收集管并室温放置10 min;再将CR2吸附柱置于新的收集管,并于CR2吸附柱膜中心位置加入50 μL TB洗脱液,室温放置2~5 min,12 000 r/min室温离心2 min,收集离心液-20℃冰箱保存。
1.2.6 ERIC-PCR检测 按照文献报道的ERIC-PCR引物序列(ERIC-1: 5′-ATGTAAGCTCCTGGGGATTCAC-3′,ERIC-2: 5′-AAGTAAGTGACTGGGGTGAGCG-3′)进行化学合成并稀释备用。以上述定量的基因组DNA为模板,按照如下体系加样:1 μL基因组DNA模板、0.125 μL Ex-Taq(5 U/μL)、2.5 μL 10×Ex-TaqBuffer、2 μL dNTP、0.5 μL ERIC-1、0.5 μL ERIC-2,ddH2O定容至25 μL。加样完成后进行ERIC-PCR扩增,具体步骤为:95℃预变性7 min; 90℃ 30 s, 52℃ 1 min, 65℃ 8 min, 30个循环;65℃ 16 min,4℃保存。PCR扩增产物采用1%(w/V)琼脂糖凝胶电泳验证,凝胶成像仪采集图片后进行分析。
1.2.7 数据处理及统计分析 所有的统计过程均用SPSS 17.0统计软件处理。用均数±标准误差均值(Mean±SE)表示。采用Kolmogorov-Smirnov Z法进行正态性检验,采用Student’st-test检验比较两组间差异,P<0.05水平有显著差异认定结果具有统计学意义。
2 结果与分析
2.1 慢性束缚应激后大鼠体重变化
如下图1所示,比较慢性束缚应激方法处理前后大鼠体重变化发现,造模前模型组大鼠的体重与对照组相比不存在显著差异,造模后模型组大鼠的体重显著低于对照组,说明慢性束缚应激影响了大鼠的体重变化。
2.2 慢性束缚应激后大鼠旷场穿越次数、直立次数、理毛次数变化
如图2所示,慢性束缚应激模型组大鼠的旷场穿越次数与对照组相比显著降低(P<0.01);模型组大鼠的旷场直立次数与对照组相比显著降低(P<0.01);模型组大鼠的旷场理毛次数与对照组相比显著降低(P<0.01);模型组大鼠的强迫游泳不动时间显著延长,具有统计学意义(P<0.01),说明大鼠的行为学发生了明显的变化,出现了明显抑郁倾向。
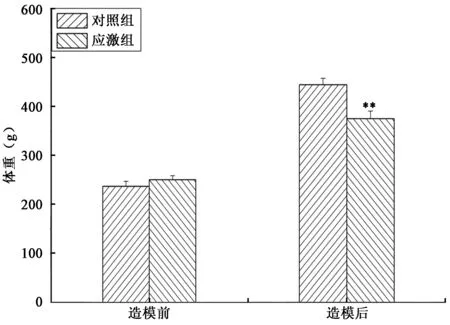
图1 造模前后大鼠体重变化Fig.1 Analysis of rat body weight change before or after modeling.注:“**”表示同一处理组与对照相比差异极显著(P<0.01)。
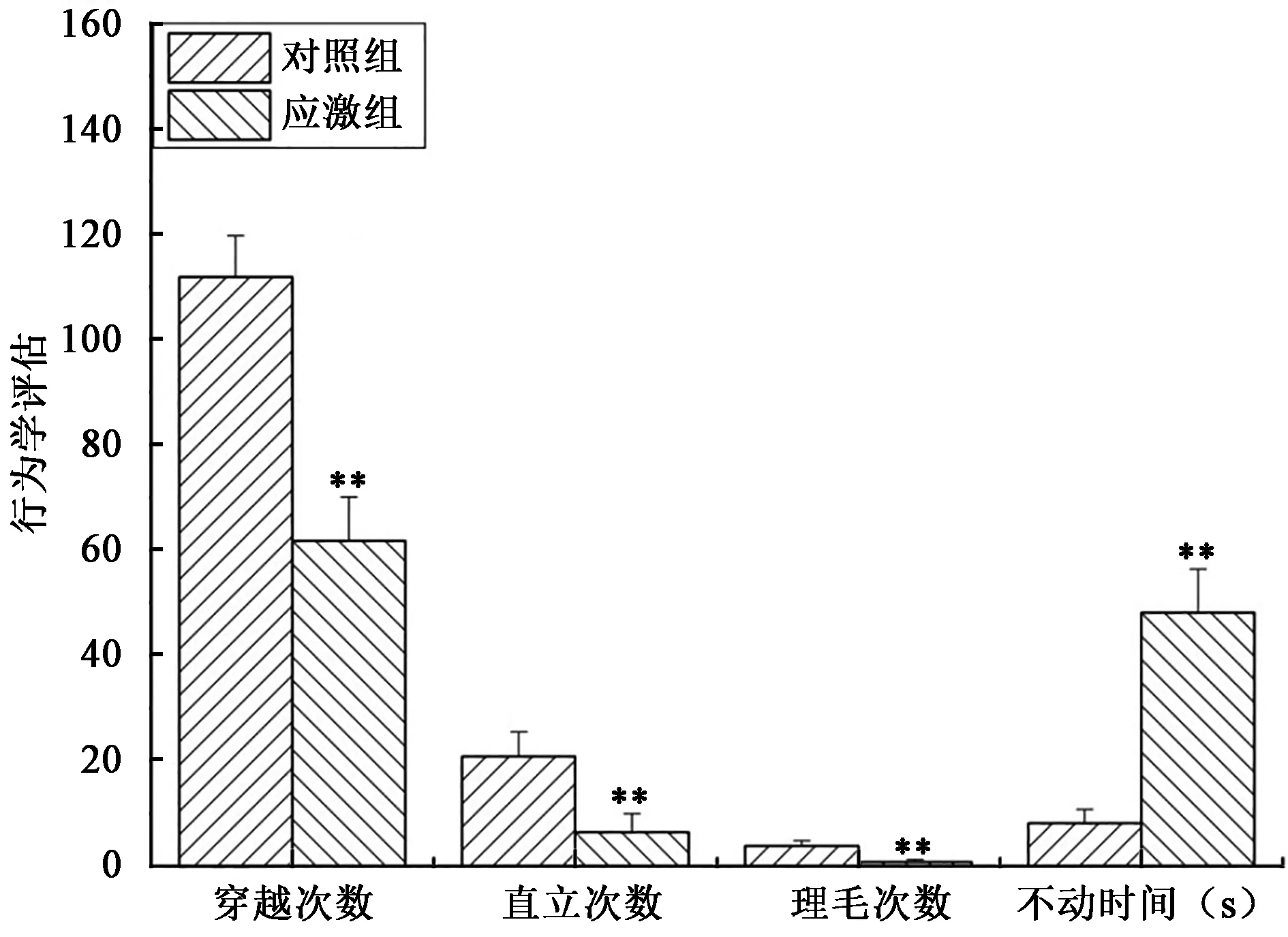
图2 大鼠慢性束缚应激后行为学变化Fig.2 Analysis of rat behavior changes after chronic constraint stress.注:“**”表示同一处理组与对照相比差异极显著(P<0.01)。
2.3 慢性束缚应激后大鼠糖水偏爱变化
如图3所示,与对照组相比,慢性束缚应激模型组大鼠的糖水偏爱性明显降低近30%,具有统计学意义(P<0.01),说明慢性束缚应激后大鼠出现了厌食等抑郁症状。
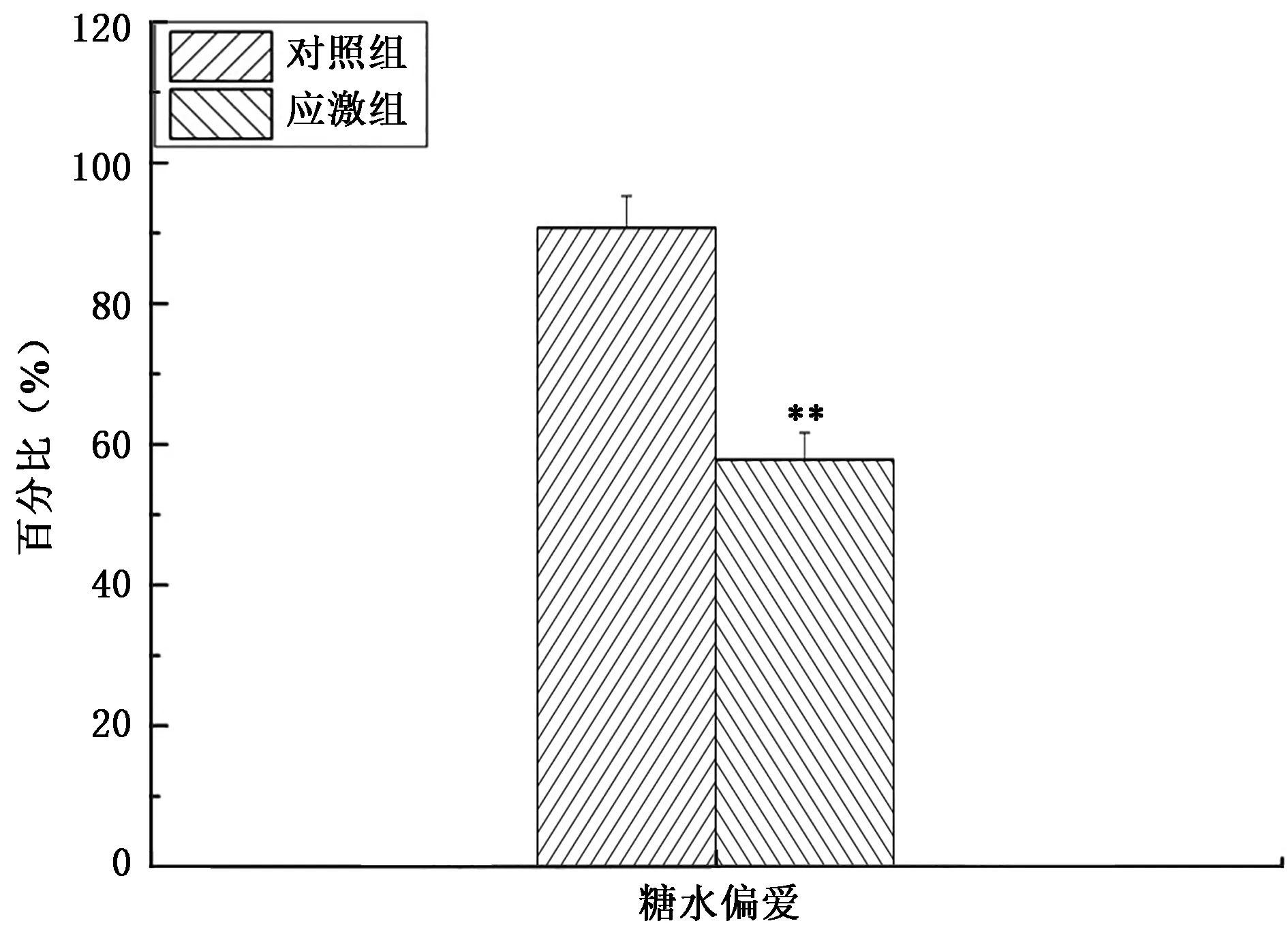
图3 大鼠慢性束缚应激后糖水偏爱Fig.3 Analysis of rat scurose preference after chronic constraint stress.注:“**”表示与对照组相比差异极显著(P<0.01)。
2.4 慢性束缚应激后大鼠肠道组织形态变化
如图4(彩图见图版二)所示,与对照组相比,急性应激后回肠组织形态结果破坏明显,微绒毛等断裂,细胞局部溶解,细胞核皱缩变形并深染;盲肠组织形态结果破坏明显,微绒毛等断裂,细胞局部溶解,细胞核皱缩变形并深染;结肠组织形态结果破坏明显,微绒毛等断裂,细胞局部溶解,细胞核皱缩变形并深染,说明慢性束缚应激导致大鼠消化道出现了验证的病理性损伤。
2.5 慢性束缚应激后大鼠肠道菌群变化
如图5中ERIC-PCR鉴定结果所示,与对照组相比,大鼠回肠组织250~500 bp处的条带和1 000~2 000 bp处的条带在慢性束缚应激处理后消失;大鼠盲肠组织中特征性条带较多,慢性束缚应激处理后在250~500 bp和2 000 bp处出现明显特征条带,大于2 000 bp处的条带在应激后消失;大鼠结肠组织在应激后大于2 000 bp的条带消失,在250~500 bp之间出现明显特征条带。说明慢性束缚应激严重破坏了大鼠的肠道菌群平衡。
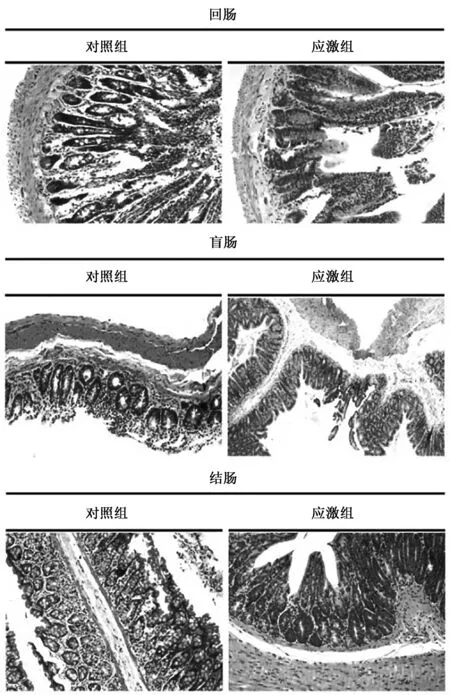
图4 HE染色检测慢性束缚应激后大鼠回肠、结肠、盲肠组织病理变化Fig.4 The pathological change assay of the stomach, ileum, cecum and colon in acute stress rats using HE staining.(彩图见图版二)
3 讨论
为了研究慢性应激对机体病理及肠道菌群的影响,本研究采用慢性束缚应激法成功建立了大鼠慢性束缚应激模型,束缚期间禁食禁水,束缚后恢复自由饮水,每天束缚4 h,持续30 d。结果发现,慢性束缚应激后大鼠的体重和对照组相比明显降低,旷场穿越次数、直立次数和理毛次数显著降低,强迫游泳时间显著延长,糖水偏好显著降低,大鼠出现抑郁症状。肠道病理结果显示,慢性束缚应激后大鼠的回肠、盲肠、结肠组织粘膜及微绒毛等严重破坏,细胞变形,细胞核深染。
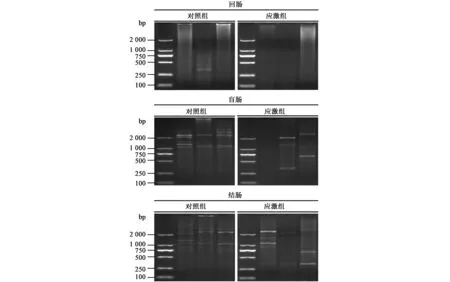
图5 ERIC-PCR检测慢性束缚应激后大鼠回肠、盲肠、结肠菌群变化Fig.5 The change of intestinal flora profile of the stomach, ileum, cecum and colon in acute stress rat by ERIC-PCR.
人类肠道细菌数量是人体自身细胞数量的10倍,其基因数量是人体的100倍,生理状态下,肠道微生物的组成、功能与宿主之间存在动态平衡,即肠道稳态。数目庞大、种类多样的微生物组成了复杂的微生态系统,显著调节消化道免疫、营养物质吸收、能量代谢和肠道生物屏障功能[12,13]。由于不同宿主的微生物可能会在其他宿主体内引起不良反应。一旦平衡被各种内外因素打破,其生存环境改变,正常的免疫和代谢等功能紊乱,出现各种临床症状称为菌群失调。当宿主的饮食结构、生活习惯和生理发育等发生变化时,体内菌群的结构也会发生变化[14,15]。本文ERIC-PCR结果显示,慢性束缚应激后大鼠胃肠道菌群发生了特征性变化,如回肠250~500 bp和1 000~2 000 bp的条带消失,盲肠250~500 bp出现新条带,结肠2 000 bp左右的条带消失,250~500 bp出现新条带,表明盲肠和结肠的肠道菌群种类较多,变化较快,在受到外界压力刺激时最先受到影响且变化较明显。然而,无论是对照组还是模型组,同组大鼠的肠道菌群的变化差异也比较大,肠道菌群的个体差异较大,受到外界因素的影响较多,后续我们将进一步优化实验增加样品量,并判定应激后优势菌落的变化。同时,结合分子生物学技术收集优势菌群条带进行主条带分析,并判定慢性束缚应激刺激下机体肠道菌群的变化规律。
本研究基于慢性束缚应激法建立了大鼠的慢性束缚应激模型,结合行为学评估及肠道组织病理和肠道内容物菌群变化揭示了特征病理和特征变化菌群规律,为基于肠道菌群研究慢性应激潜在作用规律的研究奠定了重要基础。
[1] 李 秧. 军人应激压力影响其心理健康与心身健康研究[D]. 兰州:兰州大学,硕士学位论文, 2007.
[2] 张云翌,杨乃定,刘效广. 突发事件下决策者应激历程与心理压力调整研究[J]. 西北工业大学学报(社会科学版), 2013, 02: 15-20,39.
[3] 彭云丽. 慢性应激诱发抑郁行为的炎性机制研究[D]. 上海:第二军医大学,博士学位论文,2013.
[4] 潘 苗,张三强,裴丽粉,等. 慢性应激抑郁大鼠海马CA1神经元突触可塑性研究[J]. 中国神经精神疾病杂志, 2012, 11: 672-676.
[5] 杜建政,夏冰丽. 急性应激障碍(ASD)研究述评[J]. 心理科学进展, 2009, 03: 482-488.
[6] 孙伊思. 急性应激期大鼠学习敏感化的改变及其对PTSD样症状形成的预测作用[D]. 长沙:湖南师范大学,硕士学位论文, 2012.
[7] 李红武. 长时间不同运动应激导致大鼠神经内分泌系统变化机制的研究[D].上海:华东师范大学, 硕士学位论文,2003.
[8] 王玮文,邵 枫,林文娟. 不同时程应激对大鼠行为、免疫和交感神经系统反应的影响[J]. 心理学报, 2007, 02: 292-298.
[9] 樊荣荣,李恕军,盛剑秋. 幽门螺杆菌感染与应激性胃肠道疾病关系的研究进展[J]. 现代消化及介入诊疗, 2012, 01: 55-58.
[10] 朱晓慧. 肠道菌群失调与应激源性抑郁相关性的初步研究[D].北京:中国人民解放军军事医学科学院,博士学位论文, 2015.
[11] 付 蕾,冀建伟,郑鹏远,等. 双歧杆菌对应激大鼠肠道菌群及促肾上腺皮质激素释放激素的影响[J]. 世界华人消化杂志, 2010, 15: 1544-1549.
[12] 鲜凌瑾,唐 勇. 肠道细菌微生态与人类疾病关系研究进展[J]. 微生物学免疫学进展, 2015, 04: 75-79.
[13] 翁幸鐾,糜祖煌. 人体肠道细菌群落与疾病[J]. 中国微生态学杂志, 2011, 07: 662-666,669.
[14] 李 旻. 人体肠道菌群结构与宿主代谢的相关性研究[D].上海:上海交通大学, 博士学位论文,2009.
[15] 章荣华,闫国华,刘俊康,等. 肠道细菌潜生体形成的诱导因素实验分析[J]. 实用诊断与治疗杂志, 2006, 06: 391-393,395.
Alteration of Rat Intestinal Pathology and Flora Based on the Chronic Stress Model
WANG Hua, WANG Zhihong*
DepartmentofGastroenterology,theSecondPeoplesHospitalofHefei,Hefei230000,China
To establish the rat chronic stress model using the chronic stress method, and further observe the variation rule of rat intestinal pathology and its flora based on HE staining and ERIC-PCR technique. A total of 10 healthy male SD rats were chosen, and randomly divided into two groups: Control group and model group, 5 rats in each group. Wherein, rats in control group were regular raised, and rats in model group were perform constraint stress for 4 hours everyday using a constraint tube for 30 days, and the rats body weight was recorded before or after modeling, and then performed the behavioral evaluation. In addition, rats were killed, and the intestinal tissues and contents were collected, and then sliced to stain by HE staining, and the genomic DNA was extracted to perform ERIC-PCR assay. Results showed that, compared to control, the body weight, the number of through, upright, grooming significantly decreased, the no moving time of forced swimming significantly prolonged, and sugar water preference significantly decreased. Furthermore, the microvilli of intestinal tract were seriously damaged, and nuclei mild contraction and deeply staining. The intestinal flora obviously changed, and several characteristic bands appeared. Rats chronic stress model was correctly established using chronic constraint stress methods and behavioral evaluation, and provided a significant reference on the study of the chronic stress associated diseases based on pathological assay and intestinal flora expression profile alteration, and exhibited a certain application value.
rats chronic constraint model; behavioral evaluation; intestinal tissue; intestinal flora; alteration
2016-08-23; 接受日期:2016-10-13
合肥市科技局重点立项项目[合科(2011)25号]资助。
王华,医师,研究方向为分子细胞生物学。E-mail:410908699@qq.com。*通信作者:王志红,主任医师,硕士生导师,研究方向为分子细胞生物学。 E-mail:410908699@qq.com
10.3969/j.issn.2095-2341.2017.01.09

