拟南芥质体定位的叶酰谷氨酸合成酶基因在低氮条件下的功能分析
许博思, 孟红岩, 张春义*, 姜 凌
1.中国农业科学院生物技术研究所, 北京 100081; 2.福建省亚热带植物研究所, 福建 厦门 361006
拟南芥质体定位的叶酰谷氨酸合成酶基因在低氮条件下的功能分析
许博思1, 孟红岩2, 张春义1*, 姜 凌1
1.中国农业科学院生物技术研究所, 北京 100081; 2.福建省亚热带植物研究所, 福建 厦门 361006
叶酰聚谷氨酸合成酶(folylpolyglutamate synthetase, FPGS)在细胞的不同位置负责将多个谷氨酸残基逐个加在单谷氨酸四氢叶酸(tetrahydrofolate, THF)的γ-羧基上,从而形成有活性的多尾形式四氢叶酸。AtDFB是定位在质体中的FPGS,利用AtDFB基因的T-DNA插入突变体Atdfb-3,通过比较野生型拟南芥及突变体在不同氮源条件下的生长状态以了解AtDFB基因的生物学功能。结果表明,低氮条件下AtDFB基因功能的缺失导致Atdfb-3突变体主根的急剧缩短,叶酸含量的明显下降;而在Atdfb-3突变体中过表达AtDFB基因后,在低氮条件下的表型恢复至野生型拟南芥水平,并且叶酸含量有所提高。综上所述,AtDFB基因在拟南芥叶酸合成代谢途径中发挥着重要作用,可能影响低氮环境下植物主根的发育。
叶酸;AtDFB基因;低氮胁迫;发育;拟南芥
叶酸是四氢叶酸(tetrahydrofolate,THF)及其一系列衍生物的总称,广泛参与了核苷酸、氨基酸和泛酸的生物合成,是一碳单位的重要供体,在植物中还参与了木质素的形成以及光呼吸作用[1]。人体叶酸摄入不足可能会导致出生缺陷、智力发育不完全和巨幼红细胞贫血等疾病[2]。在植物体中,叶酸缺乏可以导致玉米木质素代谢异常[3]、植物胚胎发育[4]和低氮胁迫反应的异常[5]。
叶酸分子由喋啶、对氨基苯甲酸和多聚谷氨酸残基组成[6],其中蝶啶在胞质中合成,对氨基苯甲酸在叶绿体中合成,而叶酰聚谷氨酸合成酶(folylpolyglutamate synthetase, FPGS)负责将多个谷氨酸残基逐个加在单谷氨酸四氢叶酸(tetrahydrofolate, THF)的γ-羧基上,由此形成多尾形式四氢叶酸。拟南芥的FPGS有AtDFB、AtDFC、AtDFD 3个同工酶,分别定位于质体、线粒体和细胞质中,它们在各自的细胞器中行使功能。Mehrshahi等[7]对拟南芥FPGS的生理功能及多种亚细胞定位意义的进一步探究发现,虽然Atdfb、Atdfc、Atdfd3种单突变体在营养生长时期与野生型拟南芥没有明显的表型差异,但叶酸的多聚谷氨酸状态却影响着整个生物体内总叶酸及多尾叶酸的稳态。
拟南芥中AtDFB基因拥有2个不同长度的转录本,DFBCDS.1含有1 716个碱基,可翻译为含有571个氨基酸的蛋白质;DFBCDS.2含有1 542个碱基,可翻译为含有513个氨基酸的蛋白质,两个转录本之间相差174个碱基、58个氨基酸。Srivastava 等[8]发现Atdfb(fpgs1)主根明显短于野生型。进一步观察发现,突变体根部生长素梯度分布发生了变化并导致根尖静止中心(quescent center,QC)细胞的排列异常。此外,Atdfb分生区细胞的分裂及伸长区细胞的伸长都出现了障碍。该研究还发现,AtDFB功能的缺失影响了多尾叶酸的含量,尤其是在根部,进而影响了处于代谢旺盛期的根尖细胞的一碳代谢及分生组织的维持和细胞伸长[8]。外源添加500 μmol/L 5-F-THF后,突变体根长及QC均恢复至正常水平。
本文以拟南芥突变体Atdfb-3为研究对象,首先了解不同氮源条件下AtDFB基因功能缺失对拟南芥鲜重和根长的影响,然后分别构建了两个转录本的过表达载体转化Atdfb-3,并对获得的纯合后代在不同氮源条件下的表型及叶酸含量进行了分析,以期为深入研究AtDFB基因的功能提供参考。
1 材料与方法
1.1 材料
1.1.1 试验材料 Columbia野生型拟南芥(Arabidopsisthaliana,WT)种子由中国农业科学院生物技术研究所作物基因组及遗传改良研究室保存;AtDFB基因突变体种子Atdfb-3购自ABRC的SALK库,编号SALK_015472 ;大肠杆菌DH5α及农杆菌LBA4404由实验室保存;设计引物部分均由英潍捷基(上海)贸易有限公司合成,测序反应由北京博艾永华生物技术有限公司完成。
1.1.2 试验试剂 实验所用的EasyTaqDNA Polymerase、DNA分子量标准(100 bp plus DNA Ladder)购自北京全式金生物技术有限公司;DNase I(RNase-free)购自TaKaRa公司;Fermentas反转录试剂盒、蛋白质分子量标准(PageRulerTM Prestained Protein Ladder) 购自北京经科宏达生物技术有限公司;溴化乙锭(EB)、琼脂糖购自Sigma公司;Trizol购自Invitrogen公司;DEPC购自北京鼎国昌盛生物技术有限责任公司;壮观霉素、潮霉素和利福平购自北京楚和霞光生物技术有限公司。大鼠血清购自中国科学院遗传与发育研究所。化学药品均为国产分析纯。
1.2 试验方法
1.2.1 构建AtDFB基因两个转录本的过表达载体 以野生型拟南芥cDNA为模板,针对两个不同的转录本分别设计引物,长转录本为DFB CDS.1(引物为DFB.1-F/DFB-R),较短转录本为DFB CDS.2(引物为DFB.2-F/DFB-R),在引物序列两端添加EcoRⅠ酶切位点,同时加入3~5个保护碱基。目的片段扩增结束后与中间载体进行连接转化,经菌落PCR和测序鉴定正确后,再将目的片段与pENTR3C载体进行连接转化,得到过表达载体pHZGWT-DFB(图1)。鉴定正确后,通过Gateway过表达系统使pENTR3C-DFB.1、pENTR3C-DFB.2和pH2GW7载体进行LR重组反应,随后利用花蘸法侵染Atdfb-3突变体,获得转基因植株。
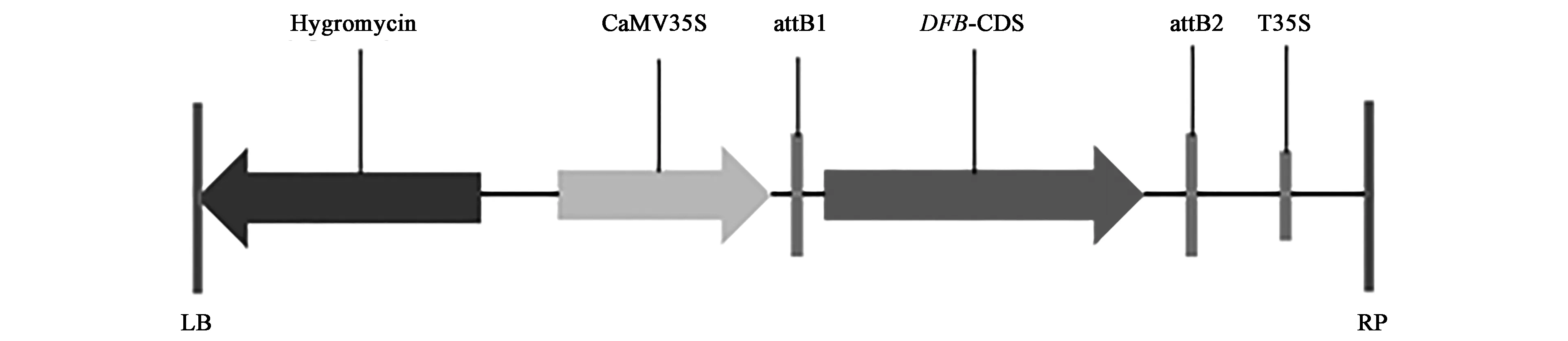
图1 AtDFB基因过表达载体pH2GW7-DFB示意图Fig.1 The overexpression vector pH2GW7-DFB of AtDFB gene.

1.2.3 转录水平鉴定 利用Trizol法提取拟南芥叶片RNA,通过RevertAid First Strand cDNA Synthesis试剂盒将RNA反转录成cDNA,具体方法见试剂盒操作说明。使用ACTIN2(At3g18780)作为内参基因,用各自基因特异性引物(表1)检测目标植株AtDFB、AtDFC、AtDFD基因的转录水平,以野生型拟南芥作为对照。PCR反应体系共20 μL:模板 cDNA 1 μL,EasyTaq(5 U/μL)0.2 μL,10×TaqBuffer(Mg2+plus)2 μL,dNTP(2.5 mmol/L)2 μL,Primer-F(10 μmol/L)0.5 μL, Primer-F(10 μmol/L)0.5 μL,ddH2O 13.8 μL。PCR反应条件:94℃ 5 min预变性;94℃变性30 s,55℃退火30 s,72℃延伸30 s,共30个循环;72℃ 10 min。 引物退火温度均为55℃。
1.2.4 叶酸含量测定 在0.3 N和9.4 N培养基上分别种植WT、Atdfb-3、dfb-DFB.1(1-1、1-2)、dfb-DFB.2(2-1、2-2)。光照培养9 d进行取材,每个株系每种处理设置5个生物学重复,每个样品称取50 mg,放入已加好2 mm无菌玻璃珠的螺帽管中,在液氮中研磨打样。向螺帽管中加入250 μL叶酸提取缓冲液(1%w/V维生素C,50 mmol/L NaH2PO4,50 mmol/L Na2HPO4·12H2O,0.1% β-巯基乙醇),充分混匀,沸水煮10 min,取出后立即冰上冷却10 min。 4℃ 13 000 r/min离心10 min,取出样品,转移上清至新的螺帽管中。向沉淀中加入250 μL叶酸提取缓冲液,依次重复如上步骤。最终将上清合并后加入6.25 μL大鼠血清,37℃孵育4 h。处理结束后将样品再次沸水煮10 min,冰浴10 min,4℃ 13 300 r/min离心10 min。取200 μL上清至于新的进口EP管中,标注样品编号,用HPLC-MS/MS法测定叶酸含量。

表1 本实验所用的引物序列
2 结果与分析
2.1 过表达载体构建及转基因植株的获得
通过对2个转录本的分析,经Gateway过表达系统构建过表达载体,最终测序确认构建成功。在获得了转基因植株后,利用PCR进一步确认,最终通过统计分离比筛选出pH2GW7-DFB.1侵染的Atdfb-3突变体纯合植株2个株系;pH2GW7-DFB.2侵染的Atdfb-3突变体选出纯合植株2个株系。AtDFB基因的两个转录本在Atdfb-3突变体背景下进行过表达,本实验中称为互补植株,分别选出2个纯合株系作为研究,命名为dfb-DFB.1(1-1、1-2)、dfb-DFB.2(2-1、2-2)。
2.2 野生型拟南芥与Atdfb-3突变体在低氮环境下的表型
2.2.1 野生型植株和Atdfb-3突变体中编码FPGS的基因的转录情况 在9.4 N培养基条件下,选取生长6 d的野生型拟南芥和Atdfb-3突变体提取RNA反转录合成cDNA,使用基因特异性引物检测叶酰聚谷氨酸合成酶AtDFB、AtDFC、AtDFD的转录水平表达量。结果可以看出,Atdfb-3突变体的AtDFC基因表达量明显提高、AtDFD基因表达相对野生型较弱(图2)。
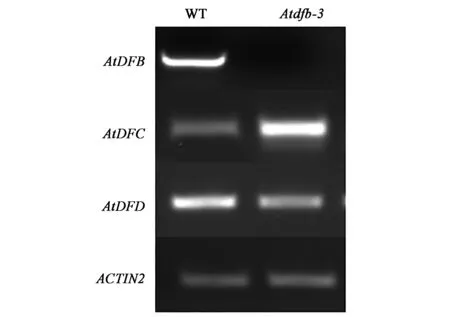
图2 野生型拟南芥和Atdfb-3突变体的RT-PCR鉴定结果Fig.2 RT-PCR results of WT and Atdfb-3.
2.2.2 野生型植株和Atdfb-3突变体在低氮环境下鲜重、根长变化 在正常光照条件下的WT与Atdfb-3突变体生长在不同氮源浓度的培养基平板上,野生型拟南芥主根长度随着氮源的减少基本无变化,而Atdfb-3突变体的主根长度随着培养基氮源浓度的降低而明显缩短(图3A,彩图见图版一)。同时,突变体子叶呈紫色,花青素积累增加,真叶发育受阻。这说明Atdfb-3突变体对于低氮环境的反应不同于野生型拟南芥。
随着氮源浓度的降低,野生型拟南芥与Atdfb-3突变体鲜重都随之下降。相比野生型Atdfb-3突变体反应更加敏感,在1N浓度时鲜重即明显降低,而野生型拟南芥鲜重在0.3N时才大幅降低;同时,Atdfb-3突变体从9.4 N时鲜重为野生型的50%,到0.3 N时只有野生型的10%,下降幅度更加剧烈(图3B)。
在主根生长方面,低氮条件对于野生型拟南芥的影响不明显,而Atdfb-3突变体的主根随着生长发育时期的变化,低氮条件对其影响逐渐加大;在同样的培养条件下,野生型拟南芥和Atdfb-3突变体的主根长度有极显著差异(P<0.01),9.4 N条件下12 d 时Atdfb-3突变体为野生型的30%,0.3 N条件下12 d 时Atdfb-3突变体为野生型的6%(图3C)。从表型、鲜重和根长的结果可见,AtDFB基因的功能缺失对于拟南芥在低氮环境上的生长发育有重要影响。
2.3AtDFB基因的互补实验
2.3.1 互补植株的转录水平分析 在9.4 N培养基上种植WT、Atdfb-3、dfb-DFB.1(1-1、1-2)、dfb-DFB.2(2-1、2-2)4个株系,光照培养6 d后提取RNA反转录合成cDNA,使用基因特异性引物检测叶酰聚谷氨酸合成酶(AtDFB、AtDFC、AtDFD)、GTP环化水解酶(GTP cyclohydrolase I,GTPCHI)、10-甲酰四氢叶酸合成酶(10-formyltetrahydrofolate synthetase,THFS)、氨基脱氧分支酸合成酶(4-aminodeoxychorismate synthase,ADCS)等6种叶酸合成过程中的关键酶。结果显示,dfb-DFB.1(1-1、1-2)、dfb-DFB.2(2-1、2-2)植株中AtDFB、AtDFD、GTPCHI、THFS、ADCS基因的转录水平与WT基本一致,DFC基因在dfb-DFB.1(1-1、1-2)、dfb-DFB.2(2-1、2-2)植株中表达量与Atdfb-3相同(图4)。
2.3.2AtDFB基因功能的互补对Atdfb-3突变体表型的影响 将WT、Atdfb-3、dfb-DFB.1(1-1、1-2)、dfb-DFB.2(2-1、2-2)分别在9.4 N、0.3 N上种植,培养条件为正常光照培养(16 h 光照/8 h 黑暗)。选取幼苗培养 6 d 时的拍照记录进行展示,从图5A(彩图见图版一)中可以看到,互补植株在9.4 N培养基和0.3 N培养基上,1-1、2-1互补植株的主根已恢复到野生型拟南芥的长度。
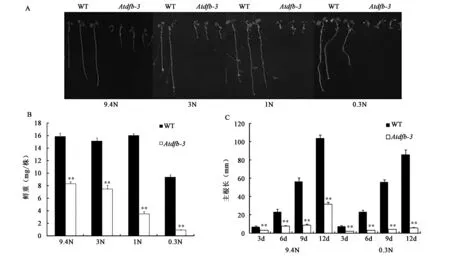
图3 不同低氮条件下野生型拟南芥和Atdfb-3突变体的表型分析结果Fig.3 The phenotype results of WT and Atdfb-3 under different nitrogen conditions注:A. 不同低氮水平下野生型拟南芥和Atdfb-3突变体的根长表型比较;B. 不同低氮水平下野生型拟南芥和Atdfb-3突变体的鲜重比较;C.不同低氮水平下野生型拟南芥和Atdfb-3突变体的主根长比较。WT:野生型拟南芥;Atdfb-3:AtDFB基因的T-DNA插入突变体;9.4N:含9.4 mmol/的特殊氮源培养基;3N:含3 mmol/的特殊氮源培养基;1N:含1 mmol/的特殊氮源培养基;0.3N:含0.3 mmol/的特殊氮源培养基;AtDFB、AtDFC、AtDFD:叶酰聚谷氨酸合成酶的3个同工酶;ACTIN2:内参基因;**:表示同组数据中与对照相比差异极显著(P<0.01)。(彩图见图版一)
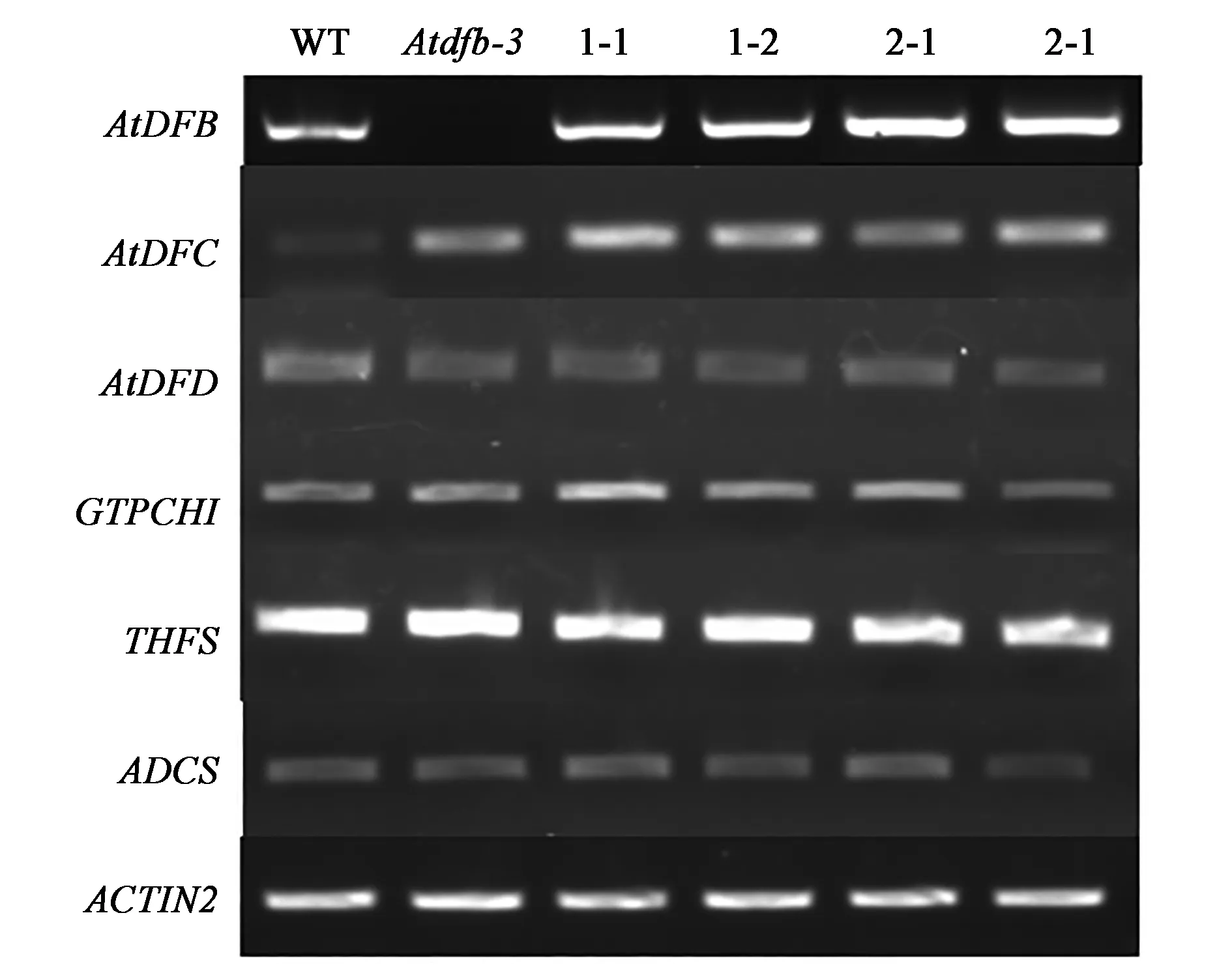
图4 转基因株系在9.4 N培养条件下的RT-PCR鉴定Fig.4 RT-PCR analysis of transgenic plants under 9.4 N condition.注:WT:野生型拟南芥;Atdfb-3:AtDFB基因的T-DNA插入突变体;1-1、1-2、2-1、2-1:Atdfb-3突变体过表达AtDFB,筛选出2个纯合株系分别命名为dfb-DFB.1(1-1、1-2)、dfb-DFB.2(2-1、2-2);AtDFB、AtDFC、AtDFD:叶酰聚谷氨酸合成酶的3个同工酶基因; GTPCHI:GTP环化水解酶基因;THFS:10-甲酰四氢叶酸合成酶基因;ADCS:氨基脱氧分支酸合成酶基因;ACTIN2:内参基因。
从图5B中可以看出,不同的氮源条件对于各个株系的鲜重都有较大影响,0.3 N条件下的WT、Atdfb-3、dfb-DFB.1(1-1、1-2)、dfb-DFB.2(2-1、2-2)的鲜重只有9.4N条件下的33%、14%、30%、27%、24%、23%;无论在9.4N还是0.3N条件下,dfb-DFB.1(1-1、1-2)、dfb-DFB.2(2-1、2-2)的鲜重与WT均无显著性差异,说明其鲜重已恢复至野生型水平。根长结果显示(图5C、图5D),氮源条件对于WT、dfb-DFB.1(1-1、1-2)、dfb-DFB.2(2-1、2-2)的根部伸长影响不大,但是培养12 d时Atdfb-3突变体的根长在0.3 N条件下只有9.4 N的16% ;两种氮源条件下,dfb-DFB.1(1-1、1-2)、dfb-DFB.2(2-1、2-2)的根长与WT均无显著性差异。
2.3.3 实验植株的叶酸含量分析 如图6(彩图见图版二)所示,将WT、Atdfb-3、dfb-DFB.1(1-1、1-2)、dfb-DFB.2(2-1、2-2)各株系分别在9.4 N、0.3 N条件下培养,光照6 d 时取材测量叶酸含量。测定结果显示:WT、dfb-DFB.1(1-1、1-2)、dfb-DFB.2(2-1、2-2)中 5-M-THF的含量均高于5-F-THF,成为叶酸的主要形式。5-M-THF的测定结果(图6A),dfb-DFB.1(1-1、1-2)、dfb-DFB.2(2-1、2-2)含量较Atdfb-3都有所提高,与野生型差距缩小,其中低氮条件时dfb-DFB.2(2-1、2-2)分别是野生型含量的195%和179%。5-F-THF的测定结果表明(图6B),在氮限制条件下WT、Atdfb-3、dfb-DFB.1(1-1、1-2)的含量较9.4 N条件都有所降低,dfb-DFB.2(2-1、2-2)含量升高,其中dfb-DFB.2(2-1)含量为野生型含量的134%。此实验结果显示,两个转录本对5-M-THF、5-F-THF的合成都起到一定作用,其中DFB CDS.2转录本对其影响更为显著。同时,在氮限制条件下可能触发某种机制,使得Atdfb-3、dfb-DFB.1(1-1、1-2)、dfb-DFB.2(2-1)株系的5-M-THF含量较9.4 N条件下有所提高。
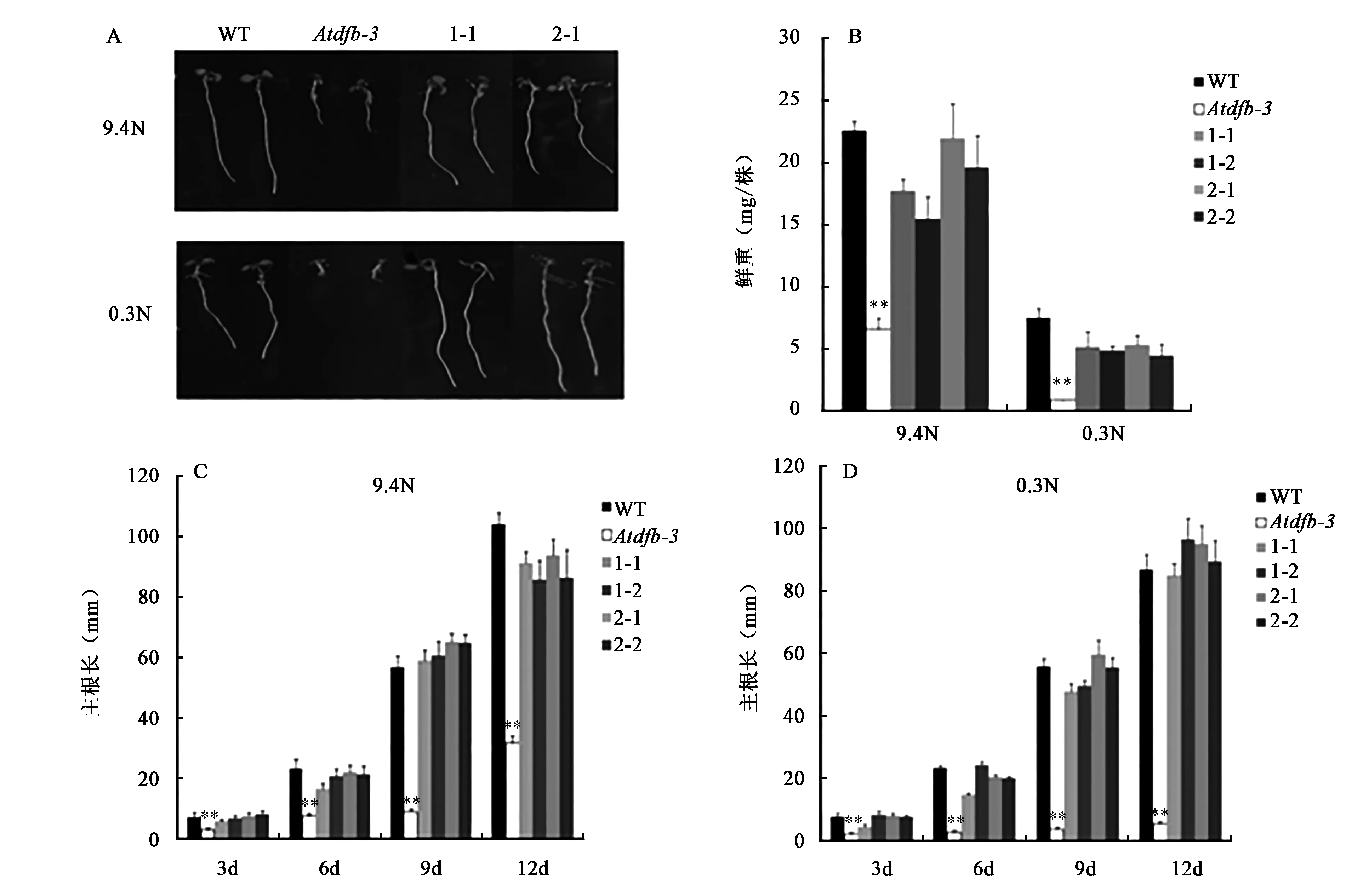
图5 转基因株系在不同氮源条件下的表型分析Fig.5 The phenotype analysis of transgenic plants under different nitrogen conditions.注:A.Atdfb-3突变体及AtDFB过表达转基因植株根长表型比较;B.Atdfb-3突变体及AtDFB过表达转基因植株在不同氮源条件下鲜重比较;C.Atdfb-3突变体及AtDFB过表达转基因植株9.4N条件下主根长比较;D.Atdfb-3突变体及AtDFB过表达转基因植株0.3N条件下主根长比较;WT:野生型拟南芥;Atdfb-3:AtDFB基因的T-DNA插入突变体;1-1、1-2、2-1、2-1:Atdfb-3突变体过表达AtDFB纯合株系dfb-DFB.1(1-1、1-2)、dfb-DFB.2(2-1、2-2);9.4N:含9.4 mmol/的特殊氮源培养基;0.3N:含0.3 mmol/的特殊氮源培养基;**:表示同组数据中与WT相比差异极显著(P<0.01)。(彩图见图版一)
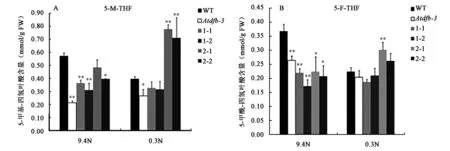
图6 转基因株系在不同氮源条件下的叶酸5-M-THF(A)和5-F-THF(B)含量Fig.6 5-M-THF(A) and 5-F-THF(B) contents of transgenic plants under different nitrogen conditions.注:WT:野生型拟南芥;Atdfb-3:AtDFB基因的T-DNA插入突变体;1-1、1-2、2-1、2-1:Atdfb-3突变体过表达AtDFB的两个纯合株系dfb-DFB.1(1-1、1-2)、dfb-DFB.2(2-1、2-2);5-M-THF:5-甲基-四氢叶酸;5-F-THF:5-甲酰-四氢叶酸;*和**表示同组数据与WT相比差异显著(P<0.05)和极显著(P<0.01)。(彩图见图版二)
3 讨论
根的生长发育是一系列生命活动的结果,包括细胞分裂、细胞伸长、细胞分化等协调活动,拟南芥中根的生长发育如分裂的时间和细胞伸长程度是由复杂的发育机制来调控的[10]。同时,一系列化学信使包括糖、营养素、氨基酸、植物激素等对调控根长也起到了重要作用[11~13]。其中,外界氮源的供给对于根的生长发育有一定程度的影响,同时低氮条件(0.1~0.6 mmol/L 氮浓度)限制了植物生长[14]。
本研究是通过在不同氮源条件下对WT和Atdfb-3进行平板培养,实验结果表明在相同氮源培养条件下Atdfb-3与WT在根长及鲜重方面具有极显著差异;同时发现随着氮源浓度的不断下降,Atdfb-3突变体的生长发育被极大地抑制,在表型方面主要体现在:氮源浓度降低时,主根根长明显缩短、子叶颜色发紫、真叶发育受阻;鲜重和根长下降的幅度比WT大,例如9.4 N条件下12 d时Atdfb-3突变体为野生型的30%,而0.3 N条件下12 d 时Atdfb-3突变体只有野生型的6%。以上结果表明,AtDFB基因的缺失可能导致内源性氮缺乏,并且氮源减少对于Atdfb-3突变体的影响更加剧烈,突变体低氮条件的不适应可能是由于叶酰聚谷氨酸合成酶AtDFB加尾功能的缺失,从而引起了拟南芥植物体内叶酸加尾数量的减少,使得依赖多尾形式叶酸的酶活性改变,这些酶直接或间接地参与或调控植物体内的氮代谢,因此Atdfb-3突变体表现出低氮条件下不耐受的表型。通过对WT和Atdfb-3突变体进行转录水平分析可以发现,当AtDFB基因缺失时,AtDFC基因的表达量明显上调,AtDFD基因有一定幅度的下调,这表明三个基因之间可能存在着某种途径上的关联性。
过表达AtDFB基因两个转录本的植株在表型、鲜重、根长和叶酸含量方面与WT均无明显差异,说明这两个转录本对于上述四个生理指标均无明显作用。生命活动是一个复杂庞大的系统,有文献报道叶酸合成的调控包括转录水平和翻译后水平的前馈调控(feedforward regulation)及反馈调控(feedback regulation)[15]。不难理解,植物体内的代谢途径涉及物质的吸收、转运、还原、同化、分解等多个过程,调控机制步骤繁多,网络复杂,仅仅依靠过表达AtDFB基因是否能起到调节植株鲜重、根长、叶酸含量的作用尚不确定,但本实验对在不同氮源下了解AtDFB基因功能做出了积极尝试。
转pH2GW7-DFB.1/pH2GW7-DFB.2载体植株在不同氮源条件下叶酸代谢和氮代谢之间的关系及AtDFB基因2个转录本的生物学功能分析显示,低氮条件明显减轻了WT的鲜重,但对于WT根长的影响较为微弱;氮源浓度的降低对Atdfb-3的影响幅度明显大于WT;2个转录本的互补植株无论是在表型、鲜重、根长方面都恢复到了WT水平,表明两个转录本在拟南芥体内都执行AtDFB基因的生物学功能。
在叶酸生物强化的前期研究中,科研工作者更多地关注了叶酸合成代谢途径中的初始催化酶[16,17]。随着研究的不断深入,叶酰聚谷氨酸合成酶FPGS渐渐进入人们的视线,董薇[18]在水稻作物中转入拟南芥的FPGS基因发现转基因水稻的叶酸含量比野生型水稻提高了10.1%。本实验中对于Atdfb-3突变体的叶酸含量分析表明AtDFB功能缺失会导致叶酸含量下降,在9.4 N条件下互补植株的5-M-THF含量有所提高但依然没有达到WT水平,而5-F-THF的含量没有达到Atdfb-3突变体水平;0.3 N条件下转pH2GW7-DFB.2的互补植株的5-M-THF和5-F-THF含量都超过了WT,其中5-M-THF的含量与Atdfb-3突变体有显著性差异。分析其产生原因可能有两点,一是氮胁迫条件下过表达的DFBCDS.2影响叶酸合成过程中的内源基因、酶或者其他代谢途径;二是AtDFB基因的两个转录本在功能或亚细胞定位方面存在差异,导致短序列的转录本产生叶酸的含量提高幅度大。叶酸代谢过程涉及众多的基因、酶和代谢途径,目前关于叶酰聚谷氨酸合成酶如何调节叶酸含量的分子机制尚不清楚,需要在以后的工作中加以研究。
[1] Hanson A D, Roje S. One-carbon metabolism in higher plants[J]. Ann. Rev. Plant Biol., 2001, 52(1): 119-137.
[2] Hossain T, Rosenberg I, Selhub J,etal.. Enhancement of folates in plants through metabolic engineering[J]. Proc. Natl. Acad. Sci. USA, 2004, 101(14): 5158-5163.
[3] Tang H M, Liu S, Hill-Skinner S,etal.. The maize 561 brown midrib2 (bm2) gene encodes a methylenetetra-hydrofolate reductase 562 that contributes to lignin accumulation[J]. Plant J., 2014,77:380-392.
[4] Takaaki I, Chiyoko M, Yasushi Y,etal.. TheGLOBULARARREST1 gene, which is involved in the biosynthesis of folates, is essential for embryogenesis inArabidopsisthaliana[J]. Plant J.,2003, 33:235-244.
[5] Jiang L, Liu Y, Sun H,etal.. The mitochondrial folylpolyglutamate synthetase gene is required for nitrogen utilization during early seedling development inArabidopsis[J]. Plant Physiol., 2013, 161: 971-989.
[6] de Crécy-Lagard V, El Yacoubi B, de la Garza R D,etal.. Comparative genomics of bacterial and plant folate synthesis and salvage: predictions and validations[J]. BMC Genom., 2007, 8(1): 245.
[7] Mehrshahi P, Gonzalez-Jorge S, Akhtar T A,etal.. Functional analysis of folate polyglutamylation and its essential role in plant metabolism and development[J]. Plant J., 2010, 64: 267-279.
[8] Srivastava A C, Ramos-Parra P A, Bedair M,etal.. The folylpolyglutamate synthetase plastidial isoform is required for postembryonic root development inArabidopsis[J]. Plant Physiol., 2011, 155: 1237-1251.
[9] 孟红岩.拟南芥质体定位的叶酰聚谷氨酸合成酶AtDFB生物学功能研究[D]. 北京:中国农业科学院作物科学研究所,博士学位论文,2014.
[10] Srivastava A C, Tang Y, de la Garza R I,etal.. The plastidial folylpolyglutamate synthetase and root apical meristem maintenance[J]. Plant Signal. Behav., 2011, 6: 751-754.
[11] Benkova E, Hejatko J. Hormone interactions at the root apical meristem[J]. Plant Mol. Biol., 2009, 69(4): 383-396.
[12] Forde B G, Walch-Liu P I A. Nitrate and glutamate as environmental cues for behavioural responses in plant roots[J]. Plant Cell Environ., 2009, 32(6): 682-693.
[13] Iyer-Pascuzzi A, Simpson J, Herrera-Estrella L,etal.. Functional genomics of root growth and development inArabidopsis[J]. Curr. Opin. Plant Biol., 2009,12(2): 165-171(A).
[14] Martin T, Oswald O, Graham I A.Arabidopsisseedling growth, storage lipid mobilization, and photosynthetic gene expression are regulated by carbon:Nitrogen availability[J]. Plant Physiol., 2002, 128:472-481.
[15] Hanson A D, Gregory J R. Folate biosynthesis, turnover, and transport in plants[J]. Annu. Rev. Plant Biol., 2011, 62: 105-125.
[16] Diaz D L G R, Gregory J R, Hanson A D. Folate biofortification of tomato fruit[J]. Proc. Natl. Acad. Sci. USA, 2007,104(10): 4218-4222.
[17] Storozhenko S, Navarrete O, Ravanel S,etal.. Cytosolic hydroxymethyldihydropterin pyrophosphokinase/dihydropteroate synthase fromArabidopsisthalianaa specific role in early development and stress response [J]. J. Biol. Chem., 2007, 282(14): 10749-10761.
[18] 董 薇. 水稻叶酸合成途径代谢改造及稻米叶酸含量QTL分析[D]. 北京:中国农业科学院作物科学研究所,博士学位论文,2011.
Functional Analysis of Plastidial Folylpolyglutamate Synthetase inArabidopsisUnder N-limited Conditions
XU Bosi1, MENG Hongyan2, ZHANG Chunyi1*, JIANG Ling1
1.BiotechnologyResearchInstitute,ChineseAcademyofAgriculturalSciences,Beijing100081,China; 2.FujianProvincialKeyLaboratoryofSubtropicalPlantPhysiologyandBiochemistry,FujianInstituteofSubtropicalBotany,FujianXiamen361006,China
Folylpolyglutamatesynthetase(FPGS)catalyzestheadditionofglutamateresiduestotheγ-carboxyloftetrahydrofolateindifferentpositions,toformfolylpolyglutamates.AtDFBistheFPGSthatlocatedinplastidofArabidopsis thaliana.InthisstudytheArabidopsisT-DNAinsertionmutant(Atdfb-3)ofAtDFBgenewasusedtoexplorethefunctionofAtDFBgenebycomparingthephenotypeofwildtypeandatdfb-3undervariousnitrogenconditions.TheresultsshowedthatAtdfb-3mutantdisplayedshorterprimaryrootlengthanddecreasedfolatecontent,comparedwiththewildtypeunderthenitrogen-limitedcondition.ThephenotypeofAtDFBoverexpressionlineunderAtdfb-3backgroundrestoredtothewild-typelevel,andthefolatecontentincreasedunderthenitrogen-limitedcondition.Inconclusion, Arabidopsis AtDFBgeneplaysanimportantroleinfolatebiosynthesispathway,andaffectstheprimaryrootdevelopmentunderthenitrogen-limitedcondition.
folate;AtDFBgene; nitrogen-limited condition; development;Arabidopsis
2016-10-23; 接受日期:2016-12-02
国家973计划项目(2013CB127003)资助。
许博思,硕士研究生,研究方向为植物功能基因组学。E-mail: xbs2000@126.com。*通信作者:张春义,研究员,博士生导师,主要从事植物发育与营养代谢的分子生物学研究。E-mail:chunyi.zhang @163.com
10.3969/j.issn.2095-2341.2017.01.06

