2016年血液系统疾病临床进展
常英军,张圆圆
(北京大学人民医院北京大学血液病研究所造血干细胞移植治疗血液病北京市重点实验室,北京100044)
2016年血液系统疾病临床进展
常英军,张圆圆
(北京大学人民医院北京大学血液病研究所造血干细胞移植治疗血液病北京市重点实验室,北京100044)
2016年血液系统疾病基础和临床研究取得重大进展。本文就造血干细胞移植供者来源、移植物抗宿主病防治、急慢性白血病靶向治疗新突破以及免疫性血小板治疗再认识等血液病临床进展进行了总结和评价。
血液和淋巴系统疾病;白血病;血小板减少;造血干细胞移植

常英军,北京大学人民医院、北京大学血液病研究所、北京市造血干细胞移植重点实验室主任医师,教授,硕士研究生导师。北京大学血液学系主任,中华医学会血液学分会第九届青年委员会副主任委员,美国免疫学会国际会员,中国病理生理学会实验血液学会委员,中华医学会细胞生物学分会青年委员等。长期从事恶性血液病诊治及造血干细胞移植临床及基础研究工作。目前承担“863”项目、国家自然科学基金面上项目、北京市自然科学基金、首都特色项目及国际合作项目等课题。获国家科技进步二等奖1项,中华医学科技一、二等奖各1项及中国抗癌协会科技二等奖1项。现为N Engl J Med,Oncotarget,J Hematol&Oncol,Clin Exp Immunol,Immunobiology,Ann Hematol,Hum Immunol以及BMC Hematol等杂志审稿专家;《中华血液学杂志》、《临床荟萃》等杂志编委。目前共发表学术论文近100余篇,其中在J Clin Oncol,Blood,Leukemia,Blood Reviews等期刊上发表论文60余篇。
2016年是血液系统疾病(简称血液病)发病机制、诊断、预后评估、危险分层防治等取得快速进展的一年[1-11],包括基本解决造血干细胞移植(allogeneic stem cell transplantation,Allo-SCT)供者来源缺乏问题、迎来人人都有供者的新时代、建立急性移植物抗宿主病分层防治新模式、急性早幼粒细胞白血病(APL)早期死亡及治疗相关第二肿瘤备受关注、急慢性白血病靶向治疗取得新突破、长期随访为达沙替尼和尼罗替尼作为CML的一线治疗提供了新证据、对免疫性血小板减少治疗的再认识、世界卫生组织关于髓系和淋系肿瘤2016版的发表及系列血液病治疗指南的发布和更新等[1-14],必将对血液病的治疗产生深远的影响。现将2016年度血液病主要临床进展总结如下。
1 Allo-SCT迎来人人都有供者的新时代
Allo-SCT是治愈恶性血液病的有效乃至唯一手段,供者来源缺乏限制了其广泛应用。目前脐带血和无同胞供者以外的重要干细胞来源[15],未能从根本上解决供者来源缺乏问题,虽然每个人都有单倍型相合的供者,但由于人类白细胞抗原(human leukocyte antigen,HLA)不合免疫屏障的存在,单倍型相合移植一直是移植领域的“禁区”[15]。经过10余年的努力,国内外学者建立了多种单倍型相合移植体系,并形成3种主要移植方案[15]:①意大利和德国学者建立的体外去除体细胞的单倍型相合移植方案(去T方案);②北京大学建立的非体外去除T细胞的单倍型相合移植体系(被国内外学者称为北京方案);③美国学者建立的移植后应用环磷酰胺诱导免疫耐受的单倍型相合移植模式(又称为巴尔地摩方案)。目前,北京方案和巴尔地摩方案已逐渐取代去T方案,成为单倍型相合移植的主流方案。北京大学牵头的一项多中心、前瞻性研究显示骨髓增生异常综合征患者接受HLA相合同胞移植、HLA3个位点不合和1~2个位点不合单倍型移植后的4年无病生存率分别为58%、63%和71%(P=0.14)[10]。该团队一项基于生物学的随机对照临床研究显示,对于Ph染色体阴性的高危急性淋巴细胞白血病患者而言,单倍型相合移植可以取得与同胞相合移植相当的疗效,3年无病生存率分别为61%和60%(P =0.91)[9]。在另一项前瞻性多中心研究中,Xu等[11]报道作为挽救治疗手段,单倍型相合移植治疗重型再生障碍性贫血的疗效与同胞相合移植差异无统计学意义,3年预计总体生存率分别为89%和91%(P=0.56)。以上结果提供的强有力的证据表明单倍型相合移植可以作为缺乏HLA相合同胞供者病人的可靠替代干细胞来源,因此,Allo-SCT迎来了人人都有供者的新时代。
2 建立急性移植物抗宿主病分层防治新模式
尽管单倍型相合移植取得了与HLA相合同胞移植相当的疗效,但是急性移植物抗宿主病(GVHD)发生率仍高于后HLA相合同胞或无关供者移植。为进一步降低Allo-SCT后急性GVHD发生率,北京大学团队开展了一项基于生物学标记(骨髓移植物中CD4/CD8比值,阈值为1.16)的、危险分层指导激素预防GVHD的单中心、前瞻性、随机对照、开放研究。入组228例患者,其中标危组(A组)83例,高危组145例再按照1∶1随机分为试验组(小剂量激素预防组,B组)72例和对照组73例(C组)。作者发现B组患者100天急性GVHD的累计发生率为21% (95%CI=11%~31%),与A组26%(95%CI=16%~36%)相当,显著低于C组48%(95%CI=32%~60%,P<0.001)。危险分层指导的小剂量激素预防显著降低了2~4度急性GVHD的发生率(HR= 0.66,95%CI=0.49~0.89,P=0.007)、加速了血小板重建(HR=0.30,95%CI=0.23~0.47,P<0.001)。B组患者中、重度慢性GVHD发生率(21%)低于A组(50%,P=0.025)和C组(0.36,P =0.066)。B组患者100天内的激素用量(205 mg)显著低于C组(289 mg,P=0.016),与A组患者相当(229 mg,P=0.256)。与C组患者相比,B组患者股骨头坏死(P=0.034)和高血压(P=0.015)的发生率显著降低。3组患者感染发生率差异无统计学意义。本研究提示危险分层指导的小剂量激素预防可显著减低2~4度急性GVHD发生率,促进血小板重建,降低激素相关不良反应,且不增加感染。《临床肿瘤杂志》同期配发的评论认为:“Chang等的创新性设计证实激素预防可降低GVHD发生率,该研究的优点是危险分层不仅使激素预防更有效的靶向高危人群,降低临床试验患者入组数量,并使低危患者避免不必要激素应用”。
3 APL患者早期死亡及治疗相关第二肿瘤备受关注
APL是急性髓细胞白血病的一个特殊亚型,全反式维甲酸(ATRA)与化疗联合使完全缓解(CR)率超过90%,治愈率达到80%;基于ATRA与三氧化二砷(arsenic trioxide,ATO)和(或)小剂量化疗的方案使疗效进一步改善。然而,APL患者的早期病死率仍达9.4%~14%,主要死亡原因有严重出血、分化综合征以及感染。2016年12月5日在美国召开的第58届血液学年会上,Abedin等[1]学者推荐的减少APL患者早期死亡的支持治疗手段,见表1。此外,对于APL病人还应该定期随访、行如下检测:全血细胞分析及白细胞分类计数、钼靶检查、结肠镜检查以及前列腺特异抗原等,已筛查继发性白血病、乳腺癌、肠癌以及前列腺癌等第二肿瘤。

表1 推荐的减少APL早期死亡的支持治疗策略
4 急慢性淋巴细胞白血病靶向治疗取得新突破
2016年8月25日发表在N Engl J Med上的一项Ⅲ期、多中心、随机对照研究显示[6],与标准的化疗方案(包括FLAG方案、Ara-C+MIT以及HD Ara-C方案,对照组)相比,耦合卡奇霉素的CD22单克隆抗体(inotuzumabozogamicin,试验组)治疗难治/复发急性淋巴细胞白血病(ALL)的完全缓解率(CR)显著增高(80.7%vs 29.4%,P<0.001),CR患者中白血病微小残留病变(minimal residual desease,MRD)水平低于0.01%的患者比例也显著增高(78.4%vs 28.1%,P<0.001);试验组患者中位疾病无进展生存期显著高于对照组(5个月vs 1.8个月,P<0.001)。此外,试验组患者能够成功接收Allo-SCT的比例也显著高于对照组(41%vs 11%,P<0.001)。该项研究预示着对于难治/复发ALL患者而言,inotuzumabozogamicin极有可能成为一线挽救治疗,并为患者进一步接收Allo-SCT提供更多的机会。2016年9月15日发表在N Engl J Med上另一项多中心、随机对照研究显示,中位随访30个月后,CD20单克隆抗体(美罗华)联合化疗治疗CD20+的Ph阴性ALL的4年无事件生存率显著高于对照组(55%vs 43%,P=0.04)[7],该研究提示CD20+的Ph阴性ALL获益于美罗华联合化疗,从而使针对CD19、CD20、CD22靶向治疗的药物以及嵌合抗原受体细胞免疫疗法(CART)成为当前恶性血液病领域治疗的热点。
依鲁替尼(Brouton’s酪氨酸抑制剂,BTK)代表慢性淋巴细胞白血病细胞(CLL)治疗的重要进展,是生存的关键蛋白之一。Acalabrutinib(ACP-196)是一种高度选择、不可逆的BTK抑制剂,在一项非随机、Ⅰ~Ⅱ期多中心研究共纳入65例治疗后复发的CLL患者,患者中位年龄为62岁,31%患者存在17p13.1缺失。Ⅰ期试验接受100 mg、175 mg、250 mg或400 mg(均为每日1次)的剂量递增治疗,Ⅱ期试验接受100 mg每日2次的ACP-196治疗。剂量递增试验没有出现需要剂量调整的不良反应,最常见的为头痛(43%)、腹泻(39%)和体重增加(26%),多数为1~2级。中位随访总反应率为95%,包括85%部分缓解、10%的部分缓解伴淋巴细胞增加,5%患者疾病稳定。亚组分析发现17p13.1缺失患者的有效率为100%[16]。该研究提示acalabrutinib是复发CLL患者,包括17p13.1缺失病人,颇具前途的安全、有效治疗药物。上述结果在随机、对照、多中心研究证实将为复发CLL患者的治疗带有福音。
5 长期随访为达沙替尼和尼罗替尼作为CML的一线治疗提供了新证据
酪氨酸激酶抑制剂(TKI)是CML的手段治疗,Cortes等[17]报道了一项随机、对照、临床试验结果,该研究中初诊CML患者被随机分为达沙替尼100 mg每日1次组(n=259)和伊马替尼组400 mg每日1次组(n=260),5年长期随访后作者发现达沙替尼和伊马替尼两组患者达到MR4.5(BCR/ABL≤0.0012%IS)的比例分别为42%和33%(P= 0.0251),5年无疾病进展生存(PFS)和总体生存(OS)差异无统计学意义,两组患者加速/急变率分别为5%和7%,胸腔积液达沙替尼组更高(28%vs 0.8%),两组均未见新的不能预见的不良反应,结果提示达沙替尼100 mg每日1次安全、有效,可以作为CML的长期有效一线治疗。另一项研究中18 846例初诊CML慢性期患者被随机分为3组:尼罗替尼300 mg/d,每日2次(A组,n=282);尼罗替尼400 mg/d,每日2次(B组,n=281)或伊马替尼400 mg/ d,每日1次(C组,n=283),随访5年发现,A、B两组达到MR4.5的比例分别为54%、52%,显著高于C组(31%,P<0.001);5年PFS差异无统计学意义,分别为92.2%、95.8%和91%;尼罗替尼患者心脏血管事件(高血糖、高胆固醇)高于伊马替尼组。该长期随访研究表明尼罗替尼300 mg每日2次可做为CMLCP患者治疗的一线选择。
关于CML患者接受靶向治疗还是Allo-SCT的选择问题,欧洲学者1997-2004完成了一项多中心、随机、对照研究,669例CML患者入组该研究,其中427例有Allo-SCT适应症的病人按照是否具有HLA相合同胞供者被随机分为Allo-SCT组(n=166,A组)和TKI治疗组(n=261,B组);随访10年后,作者发现A组患者存活且不需要治疗病人的比例显著高于B组(56%vs 6%,P<0.001),分子学缓解的比例A组患者也显著高于B组(56%vs 39%,P= 0.005)。有趣的是A组EBMT积分0~1患者的生存率为85%,显著高于Euro积分高危(41%,P<0.001)和非高危A组患者41%,P=0.047)[5]。基于该研究,作者认为:①对于TKI治疗失败的EBMT积分0~1分的患者,应早期考虑Allo-SCT作为挽救治疗手段;②对于EBMT积分2分以上的患者,应继续药物治疗或最佳的支持治疗。
6 新药应用显著改善多发性骨髓瘤(MM)预后
2016年4月28日发表在N Engl J Med上的一项Ⅲ期、双盲、安慰剂、随机对照研究将722例难治/ MM患者随机分为埃莎唑米组(n=360)和安慰剂组(n=362),两组患者的基础治疗均为来那度胺联合地塞米松,结果埃莎唑米组和安慰剂组患者的总体有效率分别为78%和72%,CR+非常好的部分缓解(VGPR)率分别为48%和39%;周围神经病变的发生率分别为27%和22%。中位随访14.7个月后,作者发现埃莎唑米组患者的无疾病进展生存期显著长于安慰剂组(20.6月vs 14.7月,P=0.01),结果提示埃莎唑米联合来那度胺、地塞米松可显著延长难治/复发MM患者的生存期,并有较好的耐受性[19]。另外,8月25日和10月6日的N Engl J Med还分别报道了CD38单克隆抗体联合硼替佐米+地塞米松治疗初诊MM患者以及CD38单克隆抗体联合来那度胺+地塞米松治疗难治复发MM患者的随机、对照临床试验结果,感兴趣的读者可以去阅读相关文献原文[20-21]。
7 对免疫性血小板减少(ITP)治疗的再认识
糖皮质激素是治疗ITP的一线药物,然而,是选用泼尼松还是地塞米松目前缺乏循证证据。山东大学齐鲁医院侯明教授牵头的一项前瞻性、随机、对照临床研究将192例成人ITP患者分为地塞米松组,40 mg/d,连用4天,如果无反应,再用4天(A组,n= 92),泼尼松组,1 mg/(kg·d),用4周后逐渐减量(B组,n=97)。结果显示A、B两组患者的总体有效率分别为82.1%和67.4%(P=0.044),CR率分别为50.5%和26.8%(P=0.001),A组具有起效快、避免糖皮质激素长期应用、不增加不良反应等特点[22]。该研究表明大剂量地塞米松可以作为成人ITP患者的一线治疗。
难治性ITP是临床难题之一,ITP国际工作组将难治性ITP定义为:脾脏切除无效或有效后复发,且需要治疗减低临床严重出血风险的患者。Cuker等[4]将难治性ITP的治疗选择分为3个等级:1级包括小剂量激素、美罗华、罗米司亭和艾曲波帕;2级包括硫唑嘌呤、环孢素A、环磷酰胺、达那唑以及霉酚酸酯等;3级包括ATRA、自体Allo-SCT、干扰素-α、血浆置换以及大剂量维生素C等(上述药物用量详见文献[4])。作者推荐的难治性ITP的治疗方法见图1。
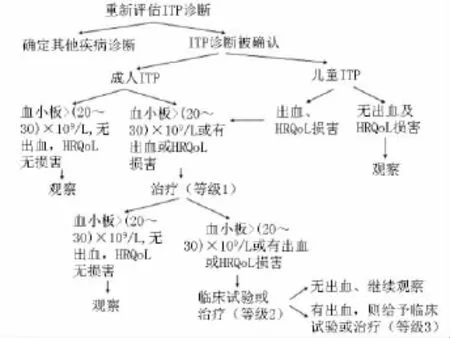
图1 难治性免疫性血小板减少诊治流程图HRQoL:健康相关生活质量
此外,还有研究者就达那唑治疗端粒酶病[包括重型再生障碍性贫血(SAA)、非重型再生障碍性贫血(MAA)和骨髓增生异常综合征(MDS)]、抗胸腺球蛋白预防慢性GVHD、CART在Allo-SCT领域的应用、针对CLL患者BCL-2以及血栓性血小板减少性紫癜vWF的靶向治疗进行了报道,都显示出良好的前景[23-29]。
8 国内外血液病诊治指南的颁布或更新
2016年5月19日,美国血液学会会刊Blood发布了世界卫生组织关于髓系和淋系肿瘤2016版更新[2,8];Br J Haematol还发表了包括《成人再生障碍性贫血诊治指南》,该指南推荐马抗胸腺球蛋白联合环孢素A是SAA、需要治疗的MAA、缺乏移植供者的SAA和极重型AA以及年龄大于35~50岁的SAA和极重型AA的一线联合免疫抑制剂治疗,推荐级别为IA;有适应症的病人应该在确诊后行HLA相合的同胞或无关供者移植,推荐级别为IB;以及《恶性血液病患者治疗或造血干细胞移植后肺部病毒感染诊治指南》等在内的系列指南[12-14]。此外,国内公布和更新的指南有《中国慢性髓细胞白血病诊断与治疗指南(2016版)》、《中国成人淋巴细胞白血病诊断与治疗指南(2016版)》、《成人原发免疫性血小板减少症诊治的中国专家共识(2016版)》以及《中国异基因造血干细胞移植治疗血液系统疾病专家共识(Ⅱ)—移植后白血病复发(2016年版)》等。上述国内外血液病诊治指南为临床血液学治疗实践提供了规范和指导,必将促进我国血液病临床治疗水平的不断提升。
总之,随着基础和转化医学研究及随机、对照、临床试验的不断取得高水平的成果,血液病的诊治一定会逐步实现疾病预后的个体化预测以及基于个体化预测的危险分层指导的防治新模式,最终造福广大的血液病患者。
[1]Abedin S,Altman JK.Acute promyelocytic leukemia:preventing early complications and late toxicities[J].Hematology Am Soc Hematol Educ Program,2016,2016(1):10-15.
[2]Arber DA,Orazi A,Hasserjian R,et al.The 2016 revision to the World Health Organization classification of myeloid neoplasms and acute leukemia[J].Blood,2016,127(20):2391-2405.
[3]Chang YJ,Xu LP,Wang Y,et al.Controlled,randomized,openlabel trial of risk-stratified corticosteroid prevention of acute graftversus-host disease after haploidentical transplantation[J].J Clin Oncol,2016,34(16):1855-1863.
[4]CukerA,NeunertCE.HowItreatrefractoryimmune thrombocytopenia[J].Blood,2016,128(12):1547-1554.
[5]Gratwohl A,Pfirrmann M,Zander A,et al.Long-term outcome of patients with newly diagnosed chronic myeloid leukemia:a randomized comparison of stem cell transplantation with drug treatment[J].Leukemia,2016,30(3):562-569.
[6]Kantarjian HM,DeAngelo DJ,Stelljes M,et al.Inotuzumab ozogamicinversusstandardtherapyforacutelymphoblastic leukemia[J].N Engl J Med,2016,375(8):740-753.
[7]Maury S,Chevret S,Thomas X,et al.Rituximab in B-lineage adult acute lymphoblastic leukemia[J].N Engl J Med,2016,375 (8):1044-1053.
[8]Swerdlow SH,Campo E,Pileri SA,et al.The 2016 revision of theWorld Health Organization classification of lymphoid neoplasms[J].Blood,2016,127(20):2375-2390.
[9]Wang Y,Liu QF,Xu LP,et al.Haploidentical versus matchedsibling transplant in adults with philadelphia-negative high-risk acute lymphoblastic leukemia:a biologically phaseⅢrandomized study[J].Clin Cancer Res,2016,22(14):3467-3476.
[10]Wang Y,Wang HX,Lai YR,et al.Haploidentical transplant for myelodysplastic syndrome:registry-based comparison with identical sibling transplant[J].Leukemia,2016,30(10):2055-2063.
[11]Xu LP,Wang SQ,Wu DP,et al.Haplo-identical transplantation for acquired severe aplastic anaemia in a multicentre prospective study[J].Br J Haematol,2016,175(2):265-274.
[12]Dignan FL,Clark A,Aitken C,et al.BCSH/BSBMT/UK clinical virology network guideline:diagnosis and management of common respiratory viral infections in patients undergoing treatment for haematological malignancies or stem cell transplantation[J].Br J Haematol,2016,173(3):380-393.
[13]Killick SB,Bown N,Cavenagh J,et al.Guidelines for the diagnosis and management of adult aplastic anaemia[J].Br J Haematol,2016,172(2):187-207.
[14]McKay P,Fielding P,Gallop-Evans E,et al.Guidelines for the investigation and management of nodular lymphocyte predominant Hodgkin lymphoma[J].Br J Haematol,2016,172(1):32-43.
[15]Kanakry CG,Fuchs EJ,Luznik L.Modern approaches to HLA-haploidentical blood or marrow transplantation[J].Nat Rev Clin Oncol,2016,13(2):132.
[16]Byrd JC,Harrington B,O'Brien S,et al.Acalabrutinib(ACP-196)in Relapsed Chronic Lymphocytic Leukemia[J].N Engl J Med,2016,374(4):323-332.
[17]Cortes JE,Saglio G,Kantarjian HM,et al.Final 5-year study results of DASISION:the dasatinib versus imatinib study in treatment-naive chronic myeloid leukemia patients trial[J].J Clin Oncol,2016,34(20):2333-2340.
[18]Hochhaus A,Saglio G,Hughes TP,et al.Long-term benefits and risks of frontline nilotinib vs imatinib for chronic myeloid leukemia in chronic phase:5-year update of the randomized ENES Tnd trial[J].Leukemia,2016,30(5):1044-1054.
[19]Moreau P,MassziT,GrzaskoN,etal.Oralixazomib,lenalidomide,and dexamethasone for multiple myeloma[J].N Engl J Med,2016,374(17):1621-1634.
[20]Palumbo A,Chanan-Khan A,Weisel K,et al.Daratumumab,bortezomib,and dexamethasone for multiple myeloma[J].N Engl J Med,2016,375(8):754-766.
[21]Dimopoulos MA,OriolA,NahiH,etal.Daratumumab,lenalidomide,and dexamethasone for multiple myeloma[J].N Engl J Med,2016,375(14):1319-1331.
[22]Wei Y,Ji XB,Wang YW,et al.High-dose dexamethasone vs prednisone for treatment of adult immune thrombocytopenia:a prospective multicenter randomized trial[J].Blood,2016,127 (3):296-302.
[23]Kroger N,Solano C,Wolschke C,et al.Antilymphocyte globulin for prevention of chronic graft-versus-host disease[J].N Engl J Med,2016,374(1):43-53.
[24]Peyvandi F,Scully M,Kremer Hovinga JA,et al.Caplacizumab for acquired thrombotic thrombocytopenic purpura[J].N Engl J Med,2016,374(6):511-522.
[25]Roberts AW,Davids MS,Pagel JM,et al.Targeting BCL2 with venetoclax in relapsed chronic lymphocytic leukemia[J].N Engl J Med,2016,374(4):311-322.
[26]Townsley DM,Dumitriu B,Liu D,et al.Danazol treatment for telomere diseases[J].N Engl J Med,2016,374(20):1922-1931.
[27]Brudno JN,Somerville RP,Shi V,et al.Allogeneic T cells that express an anti-CD19 chimeric antigen receptor induce remissions of B-Cell malignancies that progress after allogeneic hematopoietic stem-cell transplantation without causing graft-versus-host disease[J].J Clin Oncol,2016,34(10):1112-1121.
[28]Larsen EC,Devidas M,Chen S,et al.Dexamethasone and highdose methotrexate improve outcome for children and young adults with high-risk B-acute lymphoblastic leukemia:a report from children's oncology group study AALL0232[J].J Clin Oncol,2016,34(20):2380-2388.
[29]Santini V,Almeida A,Giagounidis A,et al.Randomized phaseⅢstudy of lenalidomide versus placebo in RBC transfusiondependent patients with lower-risk non-del(5q)myelodysplastic syndromes andineligiblefororrefractorytoerythropoiesisstimulating agents[J].J Clin Oncol,2016,34(25):2988-2996.
Progress on treatment of hematological disease in 2016
Chang Yingjun,Zhang Yuanyuan
Peking University People's Hospital&Peking University Institute of Hematology,Beijing Key Laboratory of Hematopoietic Stem Cell Transplantation,Beijing 100044,China Corresponding author:Chang Yingjun,Email:pk200608@126.com
Great progress was made in the basic and clinical research of hematological diseases in 2016.Here,we summarized donor selection of allogeneic stem cell transplantation,graft-versus-host disease prophylaxis,target therapies for acute and chronic GVHD,and treatment of immune thrombocytopenia and gave related comments.
hematological diseases;leukemia;thrombocytopenia;hematopoietic stem cell transplantation
R55
A
1004-583X(2017)02-0102-05
10.3969/j.issn.1004-583X.2017.02.002
2016-01-18编辑:张卫国
常英军,Email:pk200608@126.com

