球孢白僵菌对葱蝇成虫血淋巴蛋白质及游离氨基酸的影响
张慧,吴圣勇,王晓青,雷仲仁
(1中国农业科学院植物保护研究所植物病虫害生物学国家重点实验室,北京 100193;2北京市植物保护站,北京 100029)
球孢白僵菌对葱蝇成虫血淋巴蛋白质及游离氨基酸的影响
张慧1,吴圣勇1,王晓青2,雷仲仁1
(1中国农业科学院植物保护研究所植物病虫害生物学国家重点实验室,北京 100193;2北京市植物保护站,北京 100029)
【目的】球孢白僵菌(Beauveria bassiana)是一种重要的昆虫病原真菌,在毁灭性害虫葱蝇(Delia antiqua)的防治上具有重大潜力。研究旨在明确球孢白僵菌侵染葱蝇成虫后,血淋巴中蛋白质和游离氨基酸的变化及其致病的关系,揭示球孢白僵菌对葱蝇的生理调控机制。【方法】基于球孢白僵菌对葱蝇成虫的室内生物测定的研究基础,使用菌株 GZGY-1-3,采用点滴法,用浓度为 1×108个孢子/mL的孢子悬浮液处理葱蝇初羽化成虫,采用BCA法及高效液相色谱——串联质谱法(HPLC-MS/MS)测定球孢白僵菌侵染不同时间(12、24、36、48、60和72 h)后,侵染组与对照组葱蝇成虫血淋巴中蛋白质总量及20种游离氨基酸含量;分析不同处理时间蛋白质和游离氨基酸总量和重要氨基酸的含量变化。【结果】球孢白僵菌侵染12—36 h,侵染组与对照组血淋巴蛋白浓度变化趋势相近,均呈先下降后小幅度上升趋势。但侵染组血淋巴中蛋白含量高于对照组,侵染24 h后,侵染组血淋巴内蛋白质是对照组的1.20倍;侵染48 h后,侵染组中蛋白含量下降到最低,仅为对照组的0.83倍。侵染60—72 h,血淋巴蛋白含量升高。葱蝇成虫血淋巴中共检测出20种游离氨基酸。侵染12—36 h,葱蝇成虫血淋巴中游离氨基酸总量下降;侵染36 h,游离氨基酸总量下降到最低,仅为对照组的0.63倍;侵染48—60 h,游离氨基酸总量持续上升;侵染60 h后,游离氨基酸总量上升到最高,为对照组的2.01倍;感染72 h,游离氨基酸总量下降。侵染后,血淋巴内游离氨基酸种类没有变化,各种游离氨基酸的含量波动差异较大。球孢白僵菌对血淋巴重要氨基酸的含量变化有显著影响。【结论】球孢白僵菌的侵染引起葱蝇成虫血淋巴中蛋白质和游离氨基酸的一系列变化,严重阻碍了葱蝇成虫的正常生理活动,在葱蝇生物防治中具有应用潜力。
葱蝇;球孢白僵菌;血淋巴;蛋白质;游离氨基酸
0 引言
【研究意义】 葱蝇(Delia antiqua)主要危害百合科葱属作物,是一种毁灭性的害虫[1]。广泛分布于北半球温带地区,如中国北方大部分区域以及北美的西部地区[2-3]。目前葱蝇对常用化学药剂如对拟菊酯类、毒死蜱等产生了抗性[4]。球孢白僵菌(Beauveria bassiana)是一种重要的广谱性昆虫病原真菌,也是当前研究和应用最多的虫生真菌之一[5],对葱蝇成虫有很好的防治效果[6-7]。昆虫虫体内蛋白质和游离氨基酸是寄主生存及球孢白僵菌增殖的限制因子[8-9]。球孢白僵菌在成虫血淋巴中的不断增殖,会引起葱蝇虫体内蛋白质和游离氨基酸含量的动态变化,因此明确球孢白僵菌侵染不同时间后葱蝇成虫血淋巴中蛋白质及游离氨基酸总量及重要氨基酸的含量变化,探索球孢白僵菌对葱蝇成虫的致病机理,对提高球孢白僵菌在葱蝇生物防治中的作用具有重要意义。【前人研究进展】昆虫病原真菌依靠血淋巴中的游离氨基酸不断增殖,并触发寄主昆虫的免疫防御,免疫蛋白和防御酶类的大量合成造成血淋巴中游离氨基酸的含量降低,但由于昆虫病原真菌的入侵,造成其他组织和血细胞等合成和分泌的蛋白质和酶类进入虫体血淋巴中[10]。关于昆虫病原真菌侵染寄主后引起寄主体内蛋白质与游离氨基酸含量变化已有一些报道,薛皎亮等[11]采用分光光度法测定了油松毛虫(Dentrolimus tabulaeformis)3—5龄幼虫被病原物白僵菌感染后,其体内蛋白含量的变化,结果表明被白僵菌感染1—8 d虫体内蛋白质含量持续下降,而未感染的则变化不大;张仙红等[12]对菜青虫(Pieris rapae)感染玫烟色拟青霉后血淋巴蛋白质含量分析显示,感病的3、4龄菜青虫血淋巴中蛋白质含量明显低于同期未感染的幼虫;RAHUTHA等[13]研究发现家蚕(Bombyx mori)感染球孢白僵菌后1—3 d,蛋白含量呈先上升后下降的趋势;王龙江等[14]对感染球孢白僵菌后红火蚁(Solenopsis invicta)体内蛋白质含量的变化进行分析,结果显示球孢白僵菌感染能显著降低红火蚁各虫态体内蛋白质含量;李会平等[15]对桑天牛(Apriona germari)幼虫感染球孢白僵菌后蛋白质和游离氨基酸含量的变化进行了分析,发现处理 2 d时桑天牛幼虫血淋巴内蛋白质含量明显升高,5 d后体内蛋白质含量呈现持续下降,直至昆虫死亡。感染后1 d游离氨基酸含量下降,感染4 d虫体内游离氨基酸含量逐渐上升;付丽君等[10]通过高效液相色谱(HPLC)对感染球孢白僵菌的小菜蛾(Plutella xylostella)血淋巴游离氨基酸含量进行测定,结果表明染菌后小菜蛾幼虫体内氨基酸含量明显低于对照组,并且各处理组间各种游离氨基酸在量上存在一定差异;王达等用高效液相色谱法对光肩星天牛(Anoplophora glabripennis)和桑天牛幼虫血淋巴游离氨基酸含量进行了分析,氨基酸总量的变化呈先下降后上升的趋势[16-17]。【本研究切入点】目前国内外对球孢白僵菌在葱蝇上的应用研究较少,且多集中在高毒力菌株的筛选。对葱蝇成虫感染球孢白僵菌后血淋巴中蛋白质和游离氨基酸含量的变化未见报道。【拟解决的关键问题】明确葱蝇成虫感染球孢白僵菌后血淋巴中蛋白质和游离氨基酸的变化,分析血淋巴中蛋白质和游离氨基酸含量变化与球孢白僵菌侵染致病的关系,以及重要氨基酸在侵染防御过程中的作用,评估球孢白僵菌在葱蝇防治中的应用潜力。
1 材料与方法
试验于 2015年在中国农业科学院植物保护研究所完成。
1.1 供试虫源与菌种
葱蝇于 2014年采自北京飞虎队绿色生态韭菜防控示范基地,成虫饲养于30 cm×30 cm×30 cm的纱网养虫笼中,分别在脱脂棉中添加清水、牛奶、10%—15%的蜂蜜水,分别放入直径为6 cm的培养皿中,置于养虫笼中,供成虫取食;幼虫使用半人工饲料饲养[18]。在恒温培养箱(SANYO MLR-351H)中连续继代饲养,饲养温度为(22±1)℃,相对湿度(65±5)%,光周期L﹕D=16 h﹕8 h。供试成虫为连续饲养8代的初羽化成虫。
球孢白僵菌菌株 GZGY-1-3分离自被感染的亚洲玉米螟(Ostrinia furnacalis)幼虫虫体,保藏在中国普通微生物菌种保藏中心(CGMCC)(No. 9254),该菌株经过毒力测定对葱蝇成虫有高效致病力,1×108个孢子/mL的浓度下,致死中时(LT50)为3.32 d,致死中浓度(LC50)为(2.07±0.06)×105个孢子/mL。
1.2 菌株培养与孢子悬浮液配制
用接种环挑取4℃保存的GZGY-1-3菌株,接种于产孢培养基,于26℃恒温培养箱(GXZ-9240A)光周期L﹕D=12 h﹕12 h培养7 d,活化备用。试验前挑取活化培养14 d内的成熟的孢子,与0.05%的吐温80无菌水混合,并用玻璃组织研磨器研磨均匀,用血球计数板计数,配制浓度为1×108个孢子/mL的孢子悬浮液,用于测定。
1.3 孢子接触感染
取当日羽化的成虫,用恒定CO2气流使其麻醉,用微量移液器取 5 µL孢子悬浮液点滴于成虫前翅与身体的结合处,放入有纱网养虫笼中饲养(饲养方式同1.1)。对照组用0.05%的吐温80无菌水点滴。
1.4 葱蝇成虫血淋巴收集
血淋巴的收集采用双管离心法[19]。分别于侵染12、24、36、48、60、72 h取侵染组葱蝇成虫,用蒸馏水冲洗3—4次,滤纸吸干,在冰浴条件下剪去双翅,双管离心,每管10头成虫,在4℃、500 r/min下离心10 min,每个处理约80头成虫(试验测得每头成虫血淋巴体积约为0.416 µL),用微量进样器吸取收集血淋巴液30 µL于干净离心管中,迅速向血淋巴液中加入60 µL 3%的磺基水杨酸溶液(以上处理均在冰浴下进行)于4℃、12 000 r/min下离心15 min,取上清液保存于-20℃冰箱中,7 d内上机分析。对照组血淋巴收集方式和侵染组相同。每个时间点取3个样品。
1.5 蛋白质含量测定
采用南京建成生物科技公司的总蛋白定量测定试剂盒(BCA法)[20],参照说明书的步骤进行测定,每个样品重复3次。
1.6 游离氨基酸含量测定
取标准品混标、待测样本 50 µL加50 µL蛋白沉淀剂,混匀后4℃、13 200 r/min下离心4 min。取上清10 µL,加50 µL标记缓冲液混匀,瞬时离心。再加20 µL衍生液混匀、瞬时离心后置55℃恒温衍生15 min。衍生后样本置冰箱冷却后混匀瞬离,取50 µL上机检测。每个样品重复3次。仪器:高效液相色谱-四级杆离子阱串联质谱仪 HPLC-MS/MS API3200 Q-TRAP。色谱条件:色谱柱MSLab 45+AAC18(150 mm×4.6 mm,5 µm),流动相:A水相:水(1‰甲酸) B有机相:乙腈(1‰甲酸)0—37℃梯度洗脱。柱温50℃,流速1 mL·min-1时检测,进样量为5 µL。
1.7 数据分析
采用SPSS 19.0软件对蛋白质含量与游离氨基酸含量进行Tukey HSD统计分析。数据表示方式为平均值±标准误(mean±SE)。采用Excel 2010作图。
2 结果
2.1 球孢白僵菌侵染对葱蝇成虫血淋巴蛋白质含量的影响
葱蝇成虫感染球孢白僵菌后,侵染后12—36 h,侵染组与对照组的蛋白含量的变化趋势相近,均呈先下降后小幅度上升的趋势,但侵染组蛋白含量显著高于对照组;48—60 h,则显著低于对照组;侵染后72 h,蛋白含量又上升。不同处理时间的侵染与未侵染的葱蝇血淋巴的蛋白含量均存在显著性差异(F=264.996;df=35,11;P<0.05)。侵染24 h后,血淋巴内蛋白质含量显著高于对照组,是对照组含量的1.20倍,侵染48 h后,蛋白质含量下降到最低,仅为对照组蛋白含量的0.83倍(图1)。
2.2 球孢白僵菌侵染对葱蝇成虫血淋巴游离氨基酸总量的影响
葱蝇成虫感染球孢白僵菌后,侵染组与对照组游离氨基酸总量变化趋势差异较大。处理组中游离氨基酸总量波动较大。不同处理时间下侵染与未侵染的葱蝇血淋巴中游离氨基酸总量均存在显著差异(F=1458.34;df=35,11;P<0.05)。侵染36 h后,游离氨基酸总量下降至最低,仅为对照组的0.63倍;侵染60 h后,游离氨基酸总量达到最高,是对照组含量的2.01倍(图2)。
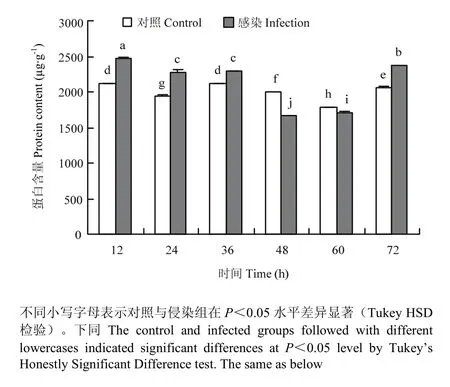
图1 葱蝇感染球孢白僵菌后血淋巴蛋白质含量的变化Fig. 1 Changes of the content of protein in haemolymph of D. antiqua adult infected with B. bassiana
2.3 球孢白僵菌侵染对葱蝇成虫血淋巴必需氨基酸和非必需氨基酸总量的影响
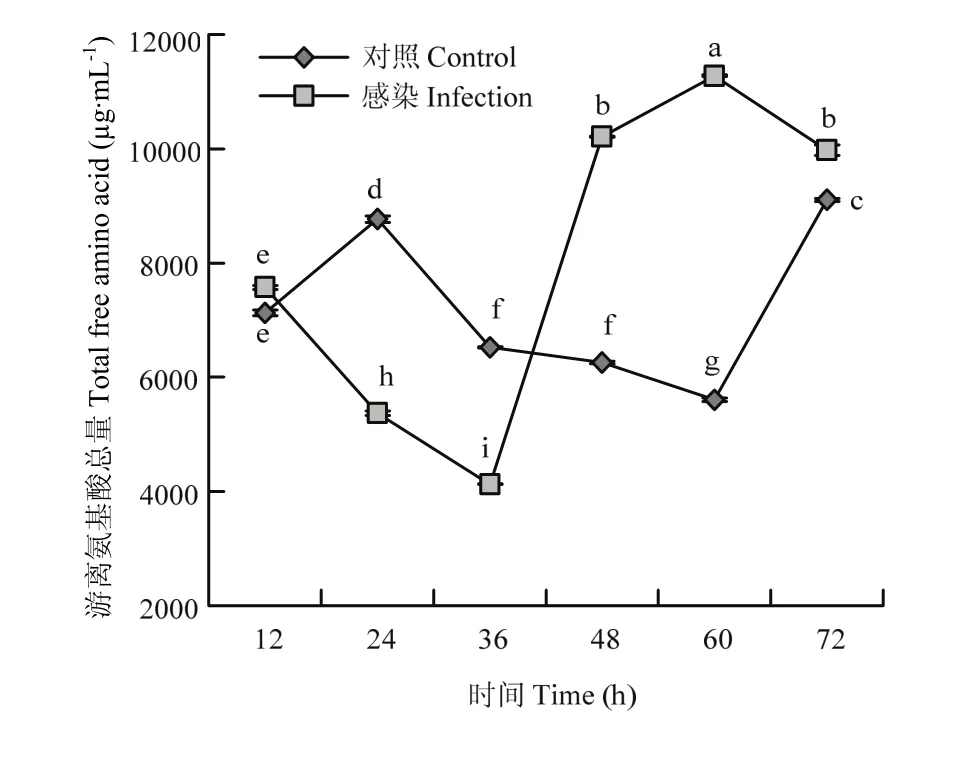
图 2 葱蝇感染球孢白僵菌后血淋巴游离氨基酸总量的变化Fig. 2 Changes of the content of total free amino acid in haemolymph of D. antiqua adult infected with B. bassiana
葱蝇血淋巴中的必需氨基酸和非必需氨基酸的含量大体一致,并且两者含量的变化和游离氨基酸总量的含量变化一致。图3-A中,侵染组中必需氨基酸变化幅度较大,侵染36 h后,必需氨基酸含量下降到最低,仅为对照组的0.61倍。侵染60 h后,必需氨基酸含量达到最高,是对照组含量的2.08倍。图3-B中,侵染36 h后,非必需氨基酸含量下降到最低,仅为对照组的0.57倍;侵染60 h后,非必需氨基酸总量达到最高,是对照组的1.94倍;但在侵染72 h时,侵染组与对照组的非必需氨基酸的含量基本相同。
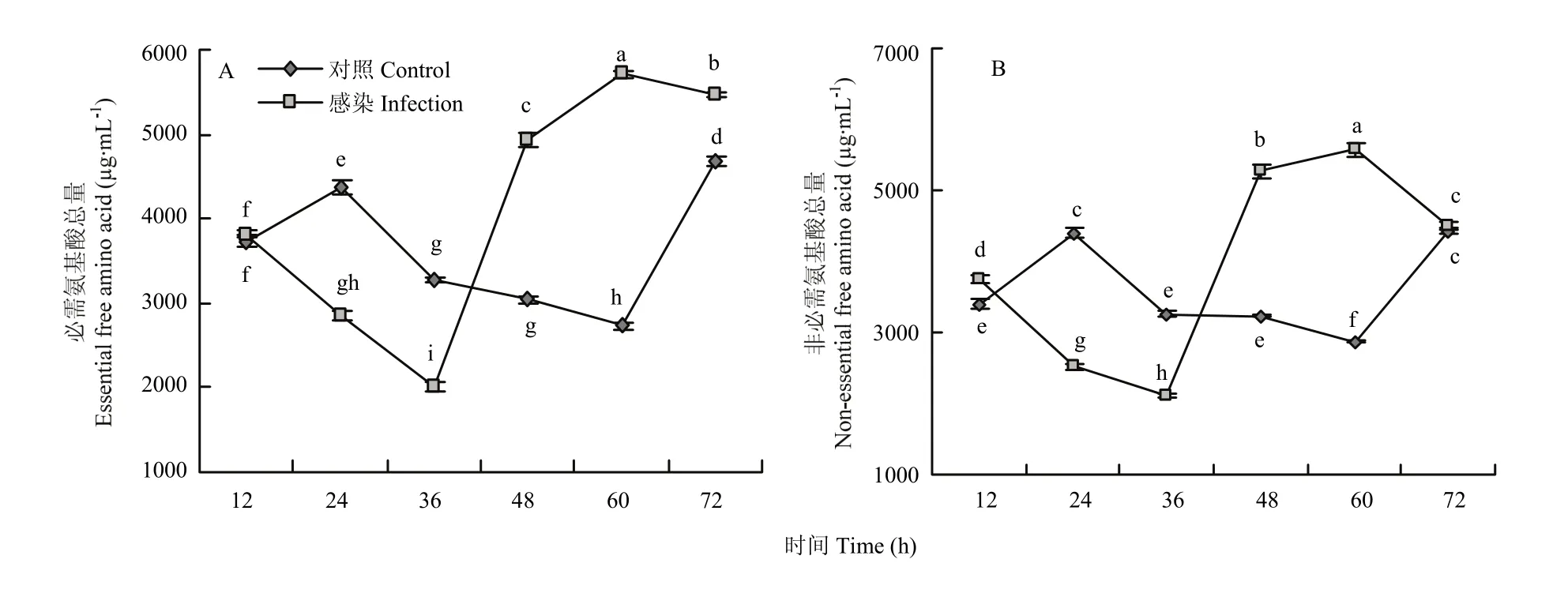
图3 葱蝇感染球孢白僵菌后血淋巴必需氨基酸(A)与非必需氨基酸(B)总量的变化Fig. 3 Changes of the content of essential amino-acid (A) and non-essential amino-acid (B) in haemolymph of D. antiqua adult infected with B. bassiana
2.4 葱蝇成虫体内重要氨基酸含量变化
含硫氨基酸中,侵染组中甲硫氨酸呈先下降后上升然后又下降的趋势,24、36及72 h侵染组甲硫氨酸的含量低于对照组,36 h下降到最低水平,仅为对照组的0.28倍。半胱氨酸是葱蝇成虫血淋巴中的稀有氨基酸,侵染组中半胱氨酸的含量基本没有变化,在72 h含量略有上升。而对照组中半胱氨酸的含量的变化较大,并且始终高于侵染组的半胱氨酸含量(表1)。
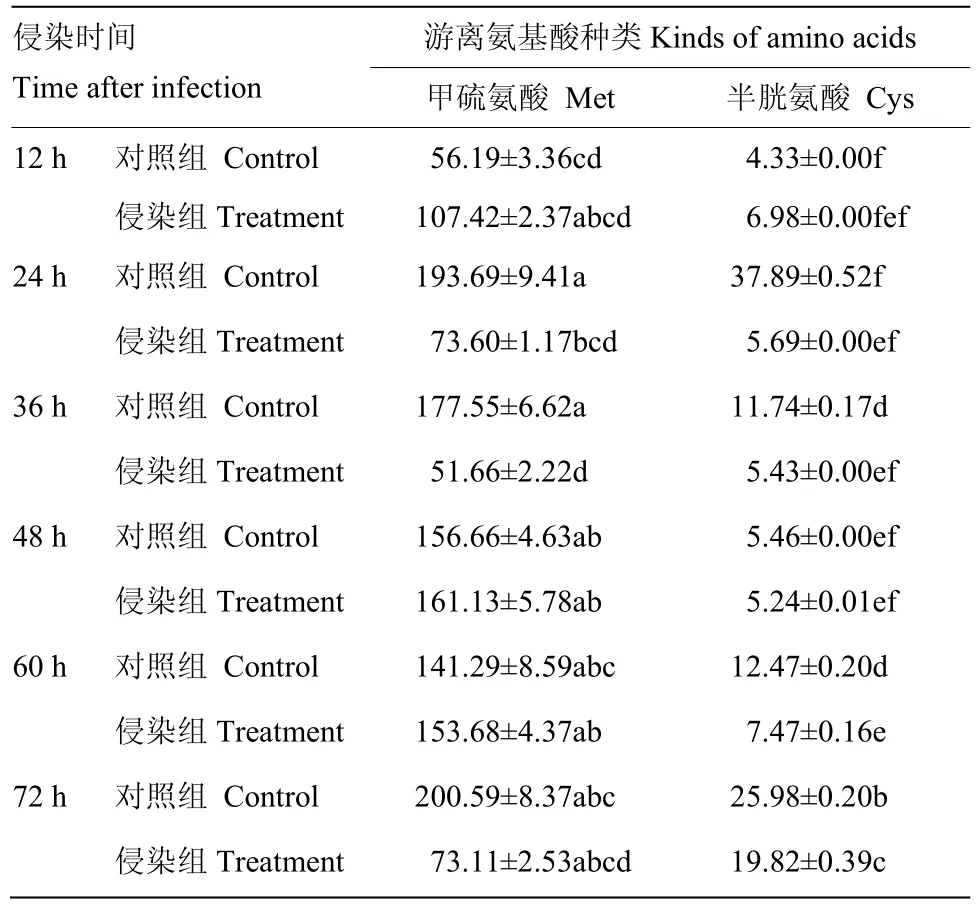
表1 球孢白僵菌对葱蝇成虫血淋巴含硫氨基酸浓度的影响Table 1 Influence of B. bassiana on content of sulfur-containing amino acid in haemolymph of D. antiqua adult (µg·mL-1)
其他的重要氨基酸中,侵染组中脯氨酸的变化与游离氨基酸总量的变化趋势相同,但侵染组血淋巴中脯氨酸的含量波动较大,而对照组在36—72 h后脯氨酸含量基本没有变化。侵染组中精氨酸含量呈先上升后下降的趋势,始终高于对照组的精氨酸含量,侵染36 h后,精氨酸含量下降至最低,为对照组的1.04倍;侵染60 h后,精氨酸含量上升至最大值,为对照组的3.62倍。侵染组中苏氨酸的含量变化与游离氨基酸总量的变化趋势相同,侵染36 h后,苏氨酸含量下降至最低,为对照组的0.54倍;侵染48 h,上升至最大值,为对照组的 1.39倍。侵染组中色氨酸的含量变化与游离氨基酸总量的含量变化相同。36 h下降至最低,为对照组的0.42倍;60 h上升至最大值,为对照组的 1.72倍。侵染组谷氨酰胺的变化趋势与游离氨基酸总量的变化趋势相同,但是侵染组血淋巴中谷氨酰胺的含量始终高于对照组,侵染48 h后,谷氨酰胺的含量达最大值,为对照组血淋巴中谷氨酰胺含量的2.08倍(表2)。
3 讨论
昆虫血淋巴是昆虫代谢的重要场所,也是代谢过程中各种物质储存和交换的场所[21],在昆虫的防御、抗冻、免疫、损伤应答等方面起重要作用。昆虫为维持其正常的生命活动,其血淋巴中的蛋白质、游离氨基酸等重要代谢物必须维持在一个较为恒定的水平。通过对感病昆虫血淋巴蛋白和游离氨基酸的研究可以了解球孢白僵菌在寄主虫体内增殖时寄主昆虫生理生化可能存在的变化。

表2 球孢白僵菌对葱蝇成虫血淋巴其他重要氨基酸浓度的影响Table 2 Influence of B. bassiana on content of other important free amino acids in haemolymph of D. antiqua adult (µg·mL-1)
由于初羽化成虫的取食飞行、成虫性成熟及交配等行为,对照组血淋巴中蛋白和游离氨基酸含量存在幅度变化[22],羽化12—24 h,成虫大量取食并消化吸收,大量游离氨基酸在血淋巴中累积,在羽化后36—60 h,由于成虫在性腺发育、求偶和交配过程及卵黄发生和卵黄蛋白合成中消耗大量蛋白质和游离氨基酸等物质,血淋巴中蛋白质和游离氨基酸含量均下降,这与笔者观察到成虫在羽化36 h后开始交配,6 d后开始产卵的结果相符。
球孢白僵菌侵染会影响葱蝇成虫的蛋白质代谢。感染后12—36 h,血淋巴中蛋白含量高于对照组,这是由于球孢白僵菌的侵入会触发昆虫免疫反应,产生大量免疫蛋白,如抗菌蛋白(肽)和相关防御酶(超氧化物歧化酶(SOD)、谷胱甘肽-S-转移酶(GSTs)等),引起葱蝇血淋巴中蛋白含量增加。感染48 h后,由于球孢白僵菌的增殖和生长,消耗血淋巴中大量的蛋白质等营养物质,并且由于葱蝇自身免疫调节功能的逐步丧失和球孢白僵菌体外分泌酶以及昆虫水解酶类的破坏等原因,血淋巴中的蛋白质大量降解,导致蛋白含量下降;感染60—72 h,由于组织解离释放大量蛋白质,同时由于葱蝇对食物消化和吸收功能降低甚至丧失,使血淋巴中蛋白转运受到抑制而滞留,从而导致血淋巴蛋白含量升高。这与李会平等[15]对白僵菌侵染桑天牛幼虫后,蛋白含量先上升后持续下降的结果存在差异,但是与其在电泳试验中发现侵染后期新的蛋白质条带产生结果吻合。
昆虫血淋巴中含有大量的游离氨基酸,一些学者曾报道昆虫被病原物侵染以及重要外界条件如CO2影响后,其血淋巴中游离氨基酸总量呈先下降后上升的变化趋势[23-24]。葱蝇成虫被球孢白僵菌侵染后,血淋巴中游离氨基酸总量的变化趋势为先下降后上升最后下降。侵染12—36 h,葱蝇成虫血淋巴中游离氨基酸总量下降,主要是由于球孢白僵菌侵入后利用昆虫血淋巴中的游离氨基酸进行增殖,同时免疫蛋白和防御酶类的合成大量消耗了血淋巴中的游离氨基酸;侵染36—60 h,游离氨基酸总量持续上升,是因为免疫调节能力下降,对游离氨基酸的利用降低,同时球孢白僵菌的侵入导致组织解体,大量蛋白质降解为游离氨基酸;感染72 h,游离氨基酸含量下降,主要是由于球孢白僵菌在虫体内的大量增殖消耗大量游离氨基酸,直至成虫死亡。总体上,游离氨基酸含量的变化总是朝着有利于球孢白僵菌生长发育增殖致病的方向进行。这也与上述血淋巴中蛋白质含量变化相吻合。
葱蝇成虫血淋巴中检测出20种游离氨基酸,表明其血淋巴成分具备球孢白僵菌大量繁殖的条件[25]。其中必需氨基酸与非必需氨基酸的含量变化和游离氨基酸总量的变化大致相同,且两者含量大体相同。球孢白僵菌的侵染对其影响是同步的。本研究也发现,球孢白僵菌的侵染没有改变葱蝇血淋巴中游离氨基酸的种类,但是对各类游离氨基酸含量变化的影响相对较大。
含硫氨基酸中甲硫氨酸和半胱氨酸具有重要的免疫调节作用。含硫氨基酸可以形成许多重要的衍生物,最具代表性的是谷胱甘肽,从而间接参与细胞内氧自由基的解毒反应,在防治过氧化物对细胞的损伤中具有重要作用[26]。甲硫氨酸是昆虫产卵必需的氨基酸。甲硫氨酸在整个侵染过程中,略有上升,然后降至最低,表明球孢白僵菌的侵染阻碍了虫体对甲硫氨酸的利用,对葱蝇成虫的繁殖产生不利影响,这与笔者研究白僵菌侵染葱蝇后明显降低了其产卵和繁殖能力的结果一致。半胱氨酸是葱蝇成虫血淋巴中的稀有氨基酸,是昆虫体内抗真菌肽的重要组成成分[27]。侵染组中半胱氨酸的含量始终低于对照组的半胱氨酸含量;侵染前期,球孢白僵菌的侵入触发葱蝇的免疫反应,大量抗真菌肽的合成消耗了大量的半胱氨酸。侵染后期真菌的大量增殖,大量消耗了血淋巴中的半胱氨酸。
脯氨酸是昆虫的主要能源物质,具有参与渗透压的调节,稳定生物大分子结构、降低细胞酸性、调节细胞氧化还原势和提高抗逆性的作用[28]。侵染组葱蝇血淋巴中脯氨酸的含量变化和游离氨基酸总量的变化相同,但是低于对照组的脯氨酸含量,表明球孢白僵菌的入侵破坏了葱蝇成虫的正常生理代谢,脯氨酸的正常生理作用受到抑制。精氨酸是微生物免疫反应的效应因子,对机体的生长、繁殖和氮平衡有重要影响[29],精氨酸是合成生物活性物质NO的底物,NO通过多种途径直接或者间接地调控免疫反应。侵染组中精氨酸含量呈先降低后上升的趋势。侵染36 h后,精氨酸含量降至最低,大量用于免疫蛋白、酶及NO的合成,参与免疫反应;侵染48—72 h,葱蝇的免疫系统崩溃,相关酶与蛋白的合成受阻,精氨酸不能有效利用,在血淋巴中滞留。苏氨酸是免疫蛋白中含量最为丰富的一种必需氨基酸,也是免疫蛋白分子合成的第一限制性氨基酸,其对免疫的影响主要表现在体液免疫[30]。侵染12—36 h,虫体内相关免疫蛋白和酶的产生,造成苏氨酸含量下降,侵染48 h后,免疫系统的崩溃,导致苏氨酸滞留。色氨酸是一种重要的芳香族氨基酸,通过分解产生中间代谢物,生成自由基清洁剂和抗氧化剂,在体液免疫中发挥重要作用[31]。球孢白僵菌的侵入引起免疫反应,色氨酸参与免疫蛋白的产生和自由基的清除,导致含量降低,随着球孢白僵菌的大量增殖,免疫失衡,大量色氨酸富集。谷氨酰胺对氮素代谢中氨基的传递有重要作用,含量上升表明组织分解相当剧烈。谷氨酰胺含量呈先上升后下降的趋势,并且始终高于对照组谷氨酰胺含量。侵染0—36 h,谷氨酰胺参与免疫反应,含量下降;谷氨酰胺的上升表示虫体内组织分解非常剧烈,白僵菌的侵染导致虫体的大量组织和器官的分解,这与本试验中侵染后成虫脂质含量持续下降相吻合。
4 结论
球孢白僵菌侵染葱蝇成虫后,血淋巴中的蛋白质和氨基酸含量发生系列变化,有利于球孢白僵菌的侵染致病,球孢白僵菌在葱蝇的生物防治中有应用的潜力。
[1] 张云霞, 薛明, 宋增明. 葱蝇 Delia antique (Meigen)的研究进展.山东农业大学学报(自然科学版), 2003, 34(3): 455-458.
ZHANG Y X, XUE M, SONG Z M. Progresses in Delia antique (Meigen) study. Journal of Shandong Agricultural University (Natural Science), 2003, 34(3): 455-458. (in Chinese)
[2] NAULT B A, WERLING B P, STRAUB R W, NYROP J P. Delaying onion planting to control onion maggot (Diptera: Anthomyiidae): efficacy and underlying mechanisms. Journal of Economic Entomology, 2011, 104(5): 1622-1632.
[3] WILSON R G, ORLOFF S B, TAYLOR A G. Evaluation of insecticides and application methods to protect onions from onion maggot, Delia antiqua, and seedcorn maggot, Delia platura, damage. Crop Protection, 2015, 67: 102-108.
[4] NAULT B A, STRAUB R W, TAYLOR A G. Performance of novel insecticide seed treatments for managing onion maggot (Diptera: Anthomyiidae) in onion fields. Crop Protection, 2006, 25(1): 58-65.
[5] FENG M G, Poprawski T J, KHACHATOURIANS G G. Production, formulation and application of the entomopathogenic fungus Beauveria bassiana for insect control: current status. Biocontrol Science and Technology, 1994, 4: 3-34.
[6] ZHANG H, WU S Y, XING Z L,WANG X Q, LEI Z R. Bioassay and scanning electron microscopic observations reveal high virulence of entomopathogenic fungus, Beauveria bassiana, on the onion maggot (Diptera: Anthomyiidae) adults. Journal of Economic Entomology, 2016, 109(6): 2309-2316.
[7] DAVIDSON G, CHANDLER D. Laboratory evaluation of entomopathogenic fungi against larvae and adults of onion maggot (Diptera: Anthomyiidae). Journal of Economic Entomology, 2005, 98(6): 1848-1855.
[8] 王国超, 傅强, 赖凤香, 陈铭学, 牟仁祥, 张志涛. 褐飞虱体内类酵母共生菌与氨基酸营养的关系. 昆虫学报, 2005, 48(4): 483-490.
WANG G C, FU Q, LAI F X, CHEN M X, MOU R X, ZHANG Z T. Relationship between yeast-like symbiotes and amino acid requirements in the rice brown planthopper, Nilaparvata lugens Stål (Homoptera: Delphacidae). Acta Entomologica Sinica, 2005, 48(4): 483-490. (in Chinese)
[9] 彭忠魁. 昆虫血淋巴中的游离氨基酸. 湖南师范大学学报 (自然科学学报) , 1985(1): 83-87.
PENG Z K. Free amino acids in the hemolymph of insects. Journal of Natural Science of Hunan Normal University, 1985(1): 83-87. (in Chinese)
[10] 付丽君, 尤民生, 戴小华. 小菜蛾感染球孢白僵菌后血淋巴游离氨基酸的测定. 华东昆虫学报, 2001, 10(1): 34-38.
FU L J, YOU M S, DAI X H. Determination of free amino acids in the hemolymph of Plutella xylostella after infecting with Beauveria bassiana. Entomological Journal of East China, 2001, 10(1): 34-38. (in Chinese)
[11] 薛皎亮, 牛宇, 谢映平. 油松毛虫感染白僵菌后体内蛋白质、酯酶和多酚氧化酶的变化. 应用与环境生物学报, 2006, 12(6): 814-818.
XUE J L, NIU Y, XIE Y P. Changes of protein, esterase and PPO in Dentrolimus tabulaeformis infected by Beauveria bassiana. Chinese Journal of Applied & Environmental Biology, 2006, 12(6): 814-818. (in Chinese)
[12] 张仙红, 王宏民, 李文英, 贺运春, 郝赤. 菜青虫感染玫烟色拟青霉后血淋巴蛋白质含量及几种保护酶活力的变化. 昆虫学报, 2006, 49(2): 230-234.
ZHANG X H, WANG H M, LI W Y, HE Y C, HAO C. Changes in the protein content in haemolymph and activities of protective enzymes of Pieris rapae infected by Paecilomyces fumosoroseus (Deuteromycotina: Hyphomycetes). Acta Entomologica Sinica, 2006, 49(2): 230-234. (in Chinese)
[13] RAHUTHA K, SAVITHRI G. Correlative studies of protein and protease activity in silkworm Bombyx mori L. infected with fungal pathogen Beauveria bassiana (Bals.) Vuill. International Journal of Recent Scientific Research, 2013, 4(11): 1789-1792.
[14] 王龙江, 吕利华, 谢梅琼, 何余容. 感染球孢白僵菌后红火蚁体内蛋白质含量的变化. 昆虫学报, 2010, 53(11): 1314-1318.
WANG L J, LÜ L H, XIE M Q, HE Y R. Changes of protein content in the red imported fire ant (Solenopsis invicta) infected by Beauveriabassiana. Acta Entomologica Sinica, 2010, 53(11): 1314-1318. (in Chinese)
[15] 李会平, 黄大庄, 唐秀光. 桑天牛幼虫感染球孢白僵菌后蛋白质和氨基酸含量的变化. 林业科学, 2012, 48(5): 159-163.
LI H P, HUANG D Z, TANG X G. Changes in the contents of proteins and amino acids of Apriona germari larvae infected by Beauveria bassiana. Scientia Silvae Sinicae, 2012, 48(5): 159-163. (in Chinese)
[16] 王达, 苏筱雨, 黄大庄, 张爽, 郑建伟, 刘春延, 毕华明. 光肩星天牛幼虫感染绿僵菌后血淋巴中游离氨基酸含量的变化. 农药学学报, 2008, 10(4): 483-486.
WANG D, SU X Y, HUANG D Z, ZHANG S, ZHENG J W, LIU C Y, BI H M. Changes of the contents of free amino acids in haemolymph of Anoplophora glabripennis larvae infected with Metarhizium anisopliae. Chinese Journal of Pesticide Science, 2008, 10(4): 483-486. (in Chinese)
[17] 苏筱雨, 黄大庄, 贝蓓, 黄秋娴, 李振波. 球孢白僵菌侵染对桑天牛幼虫血淋巴游离氨基酸含量的影响. 蚕业科学, 2008, 34(3): 518-520.
SU X Y, HUANG D Z, BEI B, HUANG Q X, LI Z B. Change of free amino acids content in haemolymph of the Apriona germari larvae infected with Beauveria bassiana. Science of Sericulture, 2008, 34(3): 518-520. (in Chinese)
[18] 雷仲仁, 张慧, 王海鸿, 邢振龙. 一种葱地种蝇幼虫的人工饲料及其制备方法和饲养方法: CN106036259A[P/OL]. 2016-10-26[2017-01-03]. http://epub.sipo.gov.cn/pam.action.
LEI Z R, ZHANG H, WANG H H, XING Z L. The synthetic and operational method of the artificial diet of Delia antiqua (Diptera: Anthomyiidae): CN106036259A[P/OL]. 2016-10-26[2017-01-03]. http://epub.sipo.gov.cn/pam.action. (in Chinese)
[19] XU W Y, HUANG S F, HAO H X, DUAN J H, QIU Z W. Two serine proteases from Anopheles dirus haemocytes exhibit changes in transcript abundance after infection of an incompatible rodent malaria parasite, Plasmodium yoelii. Veterinary Parasitology, 2006, 139(1/3): 93-101.
[20] BAINOR A, CHANG L, MCQUADE T J, WEBB B, GESTWICKI J E. Bicinchoninic acid (BCA) assay in low volume. Analytical Biochemistry, 2011, 410(2): 310-312.
[21] WANG C T, CAO Y Q, WANG Z K, YIN Y P, PENG G X, LI Z L, ZHAO H, XIA Y X. Differentially-expressed glycoproteins in Locusta migratoria, hemolymph infected with Metarhizium anisopliae. Journal of Invertebrate Pathology, 2007, 96(3): 230-236.
[22] 陈洁. 异色瓢虫卵子发生及饲料对其卵黄发生的影响[D]. 保定:河北农业大学, 2011.
CHEN J. Oogenesis and effect of diets on vitellogenesis of Harmonia axyridis Pallas[D]. Baoding: Hebei Agricultural University, 2011. (in Chinese)
[23] 王茂先, 王国秀, 李志强, 李杨, 杨红丽. 棉铃虫感染中华卵索线虫后血淋巴游离氨基酸含量的变化. 昆虫学报, 2004, 47(2): 277-280.
WANG M X, WANG G X, LI Z Q, LI Y, YANG H L. Change in the contents of free amino acids in haemolymph of Helicoverpa armigera infected by Ovomermis sinensis (Nematoda). Acta Entomologica Sinica, 2004, 47(2): 277-280. (in Chinese)
[24] 黄建利, 石宝坤, 胡朝兴, 侯茂林, 廖晓兰. CO2浓度倍增对水稻和褐飞虱蜜露中游离氨基酸浓度的影响. 植物保护, 2013, 39(5): 123-127.
HUANG J L, SHI B K, HU C X, HOU M L, LIAO X L. Influence of elevated CO2concentration on contents of free amino acids in rice plants and honeydew of the brown planthopper. Plant Protection, 2013, 39(5): 123-127. (in Chinese)
[25] SAFAVI S A, SHAH F A, PAKDEL A K, RASOULIAN G R, BANDANI A R, BUTT T M . Effect of nutrition on growth and virulence of the entomopathogenic fungus Beauveria bassiana. FEMS Microbiology Letters, 2007, 270(1): 116-123.
[26] GRIMBLE R F. The effects of sulfur amino acid intake on immune function in humans. The Journal of Nutrition, 2006, 136(Suppl. 6): 1660-1665.
[27] LAMBERTY M, ZACHARY D, LANOT R, BORDEREAU C, ROBERT A, HOFFMANN J A, BULET P. Insect immunity. Constitutive expression of a cysteine-rich antifungal and a linear antibacterial peptide in a termite insect. The Journal of Biological Chemistry, 2001, 276(6): 4085-4092.
[28] SZABADOS L, SAVOURE A. Proline: a multifunctional amino acid. Trends in Plant Science, 2010, 15(2): 89-97.
[29] PAVANELLI W R, GUTIERREZ F R S, SILVA J J N, COSTA I C, MENEZES M C N D, OLIVEIRA F J A, ITANO E N, WATANABE M A E. The effects of nitric oxide on the immune response during giardiasis. Brazilian Journal of Infectious Diseases, 2010, 14(6): 606-612.
[30] HABTETSIONH M, REN M, LIU B,GE X, XIE J, CHEN R L. Threonine modulates immune response, antioxidant status and gene expressions of antioxidant enzymes and antioxidant-immune-cytokinerelated signaling molecules in juvenile blunt snout bream (Megalobrama amblycephala). Fish & Shellfish Immunology, 2016, 51: 189-199.
[31] PLATTEN M, HO P P, YOUSSEF S, FONTOURA P, GARREN H, HUR E M, GUPTA R, LEE L Y, KIDD B A, ROBINSON W H, SOBEL R A, SELLEY M L, STEINMAN L. Treatment of autoimmune neuroinflammation with a synthetic tryptophan metabolite. Science, 2005, 310(5749): 850-855.
(责任编辑 岳梅)
Changes in the Contents of Proteins and Free Amino Acid in Haemolymph of Delia antique Adult Infected by Beauveria bassiana
ZHANG Hui1, WU ShengYong1, WANG XiaoQing2, LEI ZhongRen1
(1State Key Laboratory for Biology of Plant Diseases and Insect Pests, Institute of Plant Protection, Chinese Academy of Agricultural Sciences, Beijing 100193;2Plant Protection Station of Beijing, Beijing 100029)
【Objective】Beauveria bassiana is an important biological agent for control of Delia antiqua. The objective of this study is to assess the changes of proteins and free amino acid in haemolymph of D. antiqua adult infected by B. bassiana at different times, understand the relationship between the contents of proteins and free amino acids and the infection of B. bassiana.【Method】Based on the result of dose-response bioassay against D. antiqua adults infected by B. bassiana, individual newly enclosed D. antiqua adults were inoculated with 5 µL 1×108conidia/mL conidial suspension of the GZGY-1-3 strain by micro-drop method. Then the contents of proteins and free amino acid of at different times (12, 24, 36, 48, 60 and 72 h) were measured in infected and uninfected D. antiqua adult using BCA and HPLC-MS/MS. Finally, the relationship between the infection and the contents of the keyfree amino acid was analyzed. 【Result】 The content of proteins declined first and then increased at 12-36 h. The treatment group and control group showed similar changes. However the contents of proteins of the treatment group were higher than the control group. The content of proteins increased to the maximum in 24 h after inoculation, was 1.20 times greater than the control group. The content of proteins of the treatment group declined to the minimum at 48 h, was only 0.83 lower times than the control group, and increased at 60-72 h. The results of amino acids analysis showed that there were no different of free amino acid between the treatment and control groups of D. antiqua adult. The content of free amino acids decreased in 12-36 h, increased in 48-60 h and decreased in 72 h again after inoculation. The content of free amino acids declined to the minimum in 36 h after inoculation, was 0.63 times lower than the control group and increased to the maximum in 60 h after inoculation, was 2.01 times greater than the control group. After infection, there was no change in the type of free amino acids in the haemolymph, free amino acid content of various fluctuations was quite different. The infection of B. bassiana had significant influence on the contents of important amino acids in the haemolymph.【Conclusion】 The B. bassiana invaded into the insect body affected the balance of the proteins and amino acids in the haemolymph. It seriously hampered the normal physiological activity of the D. antiqua adult. The results of the experiment indicated that B. bassiana strains could effectively control D. antiqua adult.
Delia antique; Beauveria bassiana; haemolymph; protein; free amino acid
2016-06-13;接受日期:2016-08-18
国家大宗蔬菜产业技术体系(CARS-25-B-07)、韭菜安全生产关键技术研究及科技示范基地建设(Z151100001215009)
联系方式:张慧,E-mail:huizhang0926@sina.com。通信作者雷仲仁,Tel:010-62815930;E-mail:leizhr@sina.com

