一株非酿酒酵母的菌种诱变选育
刘鑫楠,宗倩倩,李金鹏,张惠玲*
(宁夏大学农学院食品系,宁夏银川750021)
一株非酿酒酵母的菌种诱变选育
刘鑫楠,宗倩倩,李金鹏,张惠玲*
(宁夏大学农学院食品系,宁夏银川750021)
将全美梅奇酵母作为出发菌株,进行紫外诱变和微波诱变,得到最佳诱变条件为:紫外线(30 W)照射5 min,微波(2 450 MHz,700 W)辐照30s。初筛与复筛后获得耐受性较好的突变菌株2株,最终通过气相色谱-质谱法进行香气成分测定,对比香气种类和含量,获得一株发酵力好,可耐受300 g/L葡萄糖、9%vol酒精度和300 mg/L二氧化硫环境的突变菌株W1。其发酵液总酯含量为85.97%,总醇含量2.33%,二者高于出发菌株和突变菌株W2。菌株W1发酵液香气饱满,以果香为主,具有赤霞珠葡萄酒的色泽,适合葡萄酒的酿造应用。
非酿酒酵母;酒精;诱变;挥发性物质
酿酒酵母(Saccharomycescerevisiae)是葡萄酒的灵魂,用不同的酵母菌株发酵的葡萄酒,可以使葡萄酒的色泽、香气成分及感官品质均有所不同[1]。非酿酒酵母菌的研究为研究葡萄酒的香气成分方面奠定了重要基础,极大的促进了葡萄酒产业的发展[2]。近年来,人们对非酿酒酵母在葡萄酒生产中的应用越来越关注。非酿酒酵母的酿酒特性、生物多样性、分类鉴定及其潜在应用价值研究成为国内外的研究热点和研究趋势[3]。
选育优良的酵母菌株一直是葡萄酒研究的重点[4]。选育耐受性较强的酵母菌,尤其是某些可产生特殊香气或利于葡萄酒质量的次生代谢产物的非酿酒酵母菌株,将其应用于酿酒过程中,在保证葡萄酒质量的同时又能最大限度地发挥酵母菌的发酵性能[5]。本研究采用紫外照射(30 W)照射5 min及微波辐照(2 450 MHz,700 W)30 s的方式对非酿酒酵母进行物理诱变,通过对比诱变前后菌种特性,选育具有良好发酵性能且产酒精能力低、香气好的突变菌株,使其能够应用在葡萄酒的生产中。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株来源
全美梅奇酵母(Metschnikowia pulcherrima),由宁夏大学微生物实验室分离自银广夏基地葡萄表皮得到。葡萄来源:赤霞珠葡萄品种,2015年9月取自宁夏银川市蒲尚酒庄。保存于-34℃超低温冰箱,实验用时,取出并解冻。
1.1.2 培养基
酵母浸出粉胨葡萄糖(yeast peptone dextrose,YPD)培养基:酵母浸粉10 g/L、蛋白胨20 g/L、葡萄糖20 g/L。
酵母浸出粉胨葡萄糖嘌呤(yeast peptone dextrose adenine hemisulfate,YPDA)培养基:酵母浸粉10 g/L、蛋白胨20 g/L、葡萄糖20 g/L、腺嘌呤硫酸盐0.03 g/L。
发酵培养基:10°B葡萄汁。
1.1.3 主要试剂
甲醇、无水乙醇(色谱纯):天津市大茂化学试剂厂;葡萄糖、硫酸铜(分析纯):北京化工厂;次甲基蓝、氯化钠(分析纯):天津市凯通化学试剂有限公司。
1.2 仪器与设备
7230J型分光光度计:上海精密科学仪器有限公司;LG微波炉:乐金电子(天津)电器有限公司;GC-2010气相色谱仪:日本岛津公司;固相微萃取纤维头:美国SUPELCO公司;GC-MS-QP2010气相色谱-质谱联用(gas chromatography-massspectrometer,GC-MS)仪:日本岛津公司。
1.3 试验方法
1.3.1 菌种诱变
(1)菌种的活化
将保藏的菌株解冻后,用接种针挑取一环菌体培养于10 mL YPDA液体培养基中,28℃条件下培养24 h,制成种子液。
(2)生长曲线测定
将非酿酒酵母活化后,以2%的接种量接种于YPDA液体培养基中,28℃条件下培养。每隔2 h测定其吸光度值,以未接种的YPDA培养基作为空白对照,在波长600nm处测定菌悬液的OD600mm值,每个样品平行测定3次[6]。
(3)菌悬液的制备
取出发菌株一环,接入到YPDA液体培养基中,28℃条件下培养16 h,至对数期中期。将菌悬液稀释至浓度为105CFU/mL,进行诱变处理。
(4)紫外诱变
将菌悬液均匀涂布于YPD固体培养基上,放置于30W的紫外灯下距离30cm,分别对平板进行不同时间的紫外照射[7],时间分别为0、1 min、2 min、3 min、4 min、5 min、6 min、7 min、8 min,辐照处理后,用黑布包裹培养基在28℃条件下培养2 d,进行菌落计数,计算致死率。其计算公式如下:
致死率=(对照菌落数-处理菌落数)/对照菌落数×100%
(5)微波诱变
取5 mL菌悬液于直径9 cm的培养皿内,选用最大功率700 W[8]、脉冲功率2 450 MHz的家用微波炉进行照射,照射5 s,在冰上快速冷却5 s,重复此步骤,累计照射时间为5 s、10 s、15 s、20 s、25 s、30 s、35 s、40 s、45 s[8],取上述处理液0.5 mL均匀涂布于YPD固体培养基上,在28℃条件下培养2 d,进行菌落计数,计算致死率。
1.3.2 诱变菌种初筛
根据致死曲线,在最佳紫外和微波时间诱变条件下,挑取菌落比较大的6个菌株,进行发酵实验。其中出发菌株标记为CF,微波诱变菌株标记为W1、W2、W3、W4、W5、W6,紫外诱变菌株标记为Z1、Z2、Z3、Z4、Z5、Z6。
(1)突变菌株发酵实验
用接种针挑取一环突变的菌株的菌体培养于10 mL YPDA液体培养基中,28℃条件下培养24 h,制成种子液。取2%种子液培养于50 mL YPDA液体培养基中扩大培养24 h。以2%的接种量将扩大培养液接种于糖度为10°Bx灭菌葡萄汁中,28℃条件下培养,每日测定其含糖量,直至糖度不再变化为发酵终止。
(2)乙醇含量测定
样品前处理:取发酵液2.5 mL于10 mL容量瓶中,用甲醇稀释至刻度。样品上机前必须用0.22 μm针孔滤膜过滤。
检测条件:岛津GC-2010气相色谱仪,DB-Wax色谱柱(30 m×0.25 mm×0.25 μm),流速为24 mL/min;升温程序:34~210℃程序升温,34℃保持5 min,30℃/min速率升至210℃,保持5 min;进样口温度200℃;火焰离子化检测仪温度210℃;柱压力:72.3 kPa;总流速:24.0 mL/min;线速度:25.3 cm/s;吹扫流速:3.0 mL/min;分流比20:1;柱流速1.00 mL/min;分流进样模式;进样量0.1 μL。
乙醇标准曲线的绘制:取5个10 mL容量瓶,分别取0.01 mL、0.05 mL、0.10 mL、0.25 mL、0.50 mL、1.00 mL色谱乙醇,再分别用甲醇(色谱级)定容至10 mL,配制成体积分数0.1%、0.5%、1.0%、2.5%、5.0%、10.0%的乙醇标准溶液,通过气相色谱法测定乙醇峰面积绘制乙醇标准曲线。
1.3.3 诱变菌种的复筛
(1)残糖量测定
发酵终止后,测定其残糖量,参照GB/T 15038—2006《葡萄酒、果酒通用分析方法》中的直接滴定法[9]。
(2)耐受性测定
将活化好的菌液以1%的接种量分别加入到不同葡萄糖质量浓度(100g/L、150g/L、200g/L、250g/L、300g/L)、乙醇体积分数(3%、6%、9%、12%、15%)、SO2质量浓度(50mg/L、100 mg/L、150 mg/L、200 mg/L、300 mg/L)的YPDA液体培养基中28℃条件下培养,并同时放入杜氏小管,30 h后观察其杜氏小管中的气体体积[10],测定其菌株耐受性。
(3)挥发性物质测定
利用顶空固相微萃取(headspace solid-phase microextraction,HS-SPME)法进行香气富集,于20 mL顶空瓶,用移液枪加入5mL待分析的葡萄汁或葡萄酒,加入2.0gNaCl,于40℃恒温磁力搅拌器上平衡10 min,插入CAR/DVB/PD MS纤维头40℃吸附30min,GC解吸5min,用于气相色谱-质谱分析[11]。
色谱条件:色谱柱为DB-5MS(30m×0.25mm×0.25μm);程序升温:40℃保持2 min,以5℃/min的速度升至120℃,再以8℃/min的升温速度升至250℃,保持10 min。载气为(He),流速为1 mL/min,进样口温度为250℃。
质谱条件:电子电离(electronic ionization,EI)源,电子能量为70 eV,灯丝电流为0.20 mA,检测器电压为350 V,扫描范围为20~450 amu,离子源温度为200℃。
2 结果与分析
2.1 酵母菌生长曲线
诱变处理的菌株一般要求处于对数生长期,此时群体生长状况比较同步,代谢活性高而稳定,生活力强,易变异,重复性较好,所以选用对数期的细胞进行处理[12]。非酿酒酵母在YPDA中的生长曲线见图1。
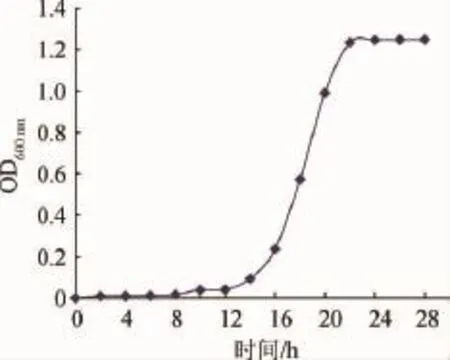
图1 非酿酒酵母在YPDA中的生长曲线Fig.1 Growth curve of non-Saccharomycesstrain cultivated in YPDA medium
由图1可知,该非酿酒酵母在8 h后进入对数生长期,22 h后进入稳定期。故选择18 h处于对数生长中期的菌悬液进行物理诱变。
2.2 紫外诱变致死率确定
不同紫外辐照时间对菌株致死率的影响见图2。由图2所示,随着紫外辐照时间的增加,菌株的致死率不断增大。由于紫外线有较强的杀菌能力和诱变能力,较高的致死率有利于筛选优良菌株,但如果处理时间太长,一些高活性菌株也可能致死,不利于筛选[13]。近年来,通过紫外线、X-射线和乙烯亚胺等多种诱变剂诱变效应的研究发现,正向突变较多的出现在70%~80%致死率中[14]。因此,选择致死率在80%左右时的照射时间为最佳时间进行诱变。故选择照射时间为5 min左右。

图2 紫外辐照时间对致死率的影响Fig.2 Effect of ultraviolet radiation time on lethal rate
2.3 微波诱变致死率确定
采用功率700 W微波小火照射涂有菌悬液的平板,不同微波辐照时间对菌株致死率的影响见图3。由图3所示,随着微波辐照时间的增加,致死率上升较快,当微波辐照处理30 s时,致死率为86.07%,处理35 s时,致死率为96.72%,说明酵母对微波辐照非常敏感。因为选择致死率在80%左右时的照射时间进行诱变,所以判定30 s为最佳诱变时间。

图3 微波辐照时间对致死率的影响Fig.3 Effect of microwave radiation time on lethal rate
2.4 诱变菌种的初筛
不同紫外诱变处理以及微波诱变处理对菌株产乙醇及变化率的影响结果分别见表1及表2。

表1 紫外诱变菌株产乙醇变化Table 1 Mutation results of alcohol yield with ultraviolet irradiation

表2 微波诱变突变菌株产乙醇变化Table 2 Mutation results of alcohol yield with microwave irradiation
由表1可知,紫外诱变得到1株突变菌株Z4的乙醇含量较出发菌低,为3.04%,比出发菌株降低了7.03%。由表2可知,经过微波诱变处理后,得到3株菌株(W1、W2、W4)的乙醇产量比出发菌株CF低,其中突变菌株W2乙醇含量最低,为2.34%,比出发菌株CF的乙醇产量降低28.44%,因此选用菌株Z4、W1、W2、W4进行发酵力及耐受性实验。
2.5 诱变菌种的复筛
2.5.1 发酵力分析
出发菌株及菌株Z4、W1、W2、W4的发酵液残糖含量如图4所示。由图4可知,发酵后菌株W1、W2、Z4的残糖较出发菌株少,其中菌株W1突变菌株所剩残糖最少,说明其发酵能力最强,菌株W4突变菌株所剩残糖最多,说明其对葡萄糖的利用率较低、发酵能力差。

图4 各菌株发酵液的残糖含量Fig.4 Residual sugar contents in fermentation broth by different strains
2.5.2 突变菌株葡萄糖耐受性

表3 突变菌株对葡萄糖的耐受性Table 3 Tolerance of mutant strains on glucose
由表3可知,诱变后的菌株对于葡萄糖的耐受性都有提高。葡萄糖质量浓度100~200 g/L时,突变菌株的耐受性均好于出发菌株,当葡萄糖质量浓度上升至250 g/L,菌株W2、W4耐受性能变差。其中菌株W1、Z4在300 g/L葡萄糖含量下,产气能力强于其他菌株,并且两者的葡萄糖耐受性相同。由此可见,菌株W1、Z4耐受葡萄糖能力较其他突变菌种的耐受性要好。
2.5.3 突变菌种酒精耐受性
由表4可知,诱变后的菌株酒精耐受性能均较出发菌株高。其中,4株突变菌株均可以在酒精度3%vol条件下生长良好,特别是W1对酒精的耐受性明显提高,可以在酒精度9%vol下生长,而菌株W2、W4、Z4只可在酒精度6%vol条件下微量生长。由此可见,菌株W1耐受酒精能力较其他突变菌株的耐受性要好。
2.5.4 突变菌种二氧化硫耐受性

表5 突变菌株对二氧化硫的耐受性Table 5 SO2tolerance of mutant strains
由表5可知,诱变后的菌株对于二氧化硫质量浓度的耐受性均提高。在300 mg/L SO2条件下4株突变菌株均能生长,说明这些突变菌株对SO2都具有很好的耐受性。但是,菌株W1、W2在此条件下产气较其他菌株多,说明菌株W1、W2对SO2的耐受性较其他突变菌种的耐受性要好。
2.6 香气成分测定结果分析
通过对突变菌种进行上述试验,选出产酒精度低且耐性良好的突变菌株W1、W2,与出发菌株CF同时进行香气种类和相对含量的测定,三株菌株发酵液的总离子流色谱图见图5。三株菌纯种发酵产生的挥发性化合物及其含量见表6。
由表6可知,3种菌的发酵液共分析出26种组分,其中出发菌株CF发酵液含有19种,菌株W1发酵液含有23种,菌株W2发酵液含有23种。其中以酯类含量最多,醇类次之,其他组分依次为酸类,醛酮类,杂环、烷烃类。突变菌株的总酯含量明显提高并共产生了出发菌株没有的6种酯类:棕榈酸乙酯、9-十六碳烯酸乙酯、3-甲基辛酸丁酯、2-甲基丁基乙酸酯、硬脂酸乙酯和2-乙基己基草酸己酯。说明使用突变酵母菌发酵可以在一定程度上提高葡萄酒的香气成分。
酯类是葡萄酒中一类重要的香气物质[15]。大多数酯类化合物是在发酵过程中形成的,这些化合物能够赋予葡萄酒以水果香气,尤其是乙酸酯类和乙基酯类[16]。经诱变后的菌种产生的酯类种类都为14种,含量为85.97%、83.77%,均多于出发菌株,菌株W1、W2发酵液含有酯类14种均多于菌株CF发酵液中的9种,菌株W1、W2产生的总酯含量均高于菌株CF产生的总酯含量。同时,菌株W1发酵液中总酯含量最高,乙酸异戊酯1.95%、辛酸乙酯45.99%、乙酸苯乙酯1.64%的含量均高于其在菌株CF发酵液、菌株W2发酵液中的含量。辛酸乙酯略带有玫瑰、橙子的花果香气,此香味为白兰地酒特有的香气[17]。乙酸异戊酯具有强烈的水果香气,似香蕉味、梨的酸甜味[18]。菌株W1、W2发酵液中生成了菌株CF发酵液中没有的酯类:棕榈酸乙酯、3-甲基辛酸丁酯、2-甲基丁基乙酸酯、硬脂酸乙酯、2-乙基己基草酸己酯、硬脂酸乙酯、9-十六碳烯酸乙酯。酯类的增多使得香气更加饱满,结构更加立体。

图5 出发菌株(A)、菌株W1(B)、菌株W2(C)发酵液中挥发性物质GCMS分析总离子流色谱图Fig.5 Total ion chromatogram of volatile compounds in fermentation broth of parent strain(A),W1(B)and W2(C)strains by GC-MS
醇类主要来源于发酵、氨基酸的转化及亚麻酸降解物的氧化[19]。其是葡萄酒发酵的主要产物,葡萄果实中的醇类物质含量较少,多数出现在葡萄酒中,并对香气起重要作用[10]。高级醇是由酵母通过氨基酸代谢生成的香气物质[20]。菌株W1产生的总醇含量为2.33%,高于菌株CF和W2的总醇含量,其分别是2.13%、1.40%。菌株W1发酵液中苯乙醇含量1.24%,高于菌株CF和W2酵母发酵液中苯乙醇的含量。苯乙醇是由苯丙氨酸代谢产生的,具有愉快的玫瑰花香、蔷薇香气、茉莉香、丁香、花粉味,它是葡萄酒中重要的呈香物质,与其他成分之间存在增效的效果,可以赋予葡萄酒浓郁优雅的风味特征[21]。

表6 菌株CF、W1、W2纯种发酵产生的挥发性化合物及其含量Table 6 Volatile compounds produced by strains CF,W1,W2 during pure fermentation
酸类、醛酮类、杂环及烷烃类占比相对较少,菌株CF发酵液中含有己酸、辛酸,而菌株W1、W2发酵液中只有己酸。菌株W2产酮能力高于出发菌株CF和W1。菌株W1、W2发酵液中杂环、烷烃含量均较出发菌株CF发酵液低。
3 结论
将全美梅奇酵母作为出发菌种,通过紫外诱变和微波诱变,30 W紫外照射5 min及2 450 MHz,700 W微波辐照30 s后,获得四株性能良好的突变菌株W1、W2、W4、Z4,其产乙醇分别为2.63%、2.34%、3.01%、3.04%。同时突变菌株W1、W2、Z4发酵力增强,残糖含量分别为13.6g/L、14.5g/L、15.2 g/L,使得葡萄糖利用率得到提高并且菌株W1、W2的各方面耐受性表现良好,两株突变菌可耐受300 g/L葡萄糖以及300 mg/L二氧化硫,另外,菌株W1酒精耐受可达到9%vol,与出发菌株相比都有一定提升。香气物质的测定结果表明菌株W1产生23种香气成分,酯类、醇类、醛酮类含量均比出发菌株发酵液高,酯类、醇类含量比菌株W2发酵液高。产酯含量最高占总香气含量的85.97%,同时产生了6种出发菌发酵液中没有产生的酯类,香气成分更加丰富、饱满。综合来看,突变菌株W1具有良好的耐受性和发酵性能,可以为酿造提供理想菌种。
[1]孙悦.ARISA和T-RFLP技术分析葡萄酒相关酵母菌多样性[D].杨凌:西北农林科技大学,2011.
[2]李新菊.非酿酒酵母的筛选及多样性研究[D].石河子:石河子大学,2015.
[3]刘景.非酿酒酵母发酵苹果汁的研究[D].杨凌:西北农林科技大学,2015.
[4]程雷.葡萄自然发酵过程中酵母的分离鉴定及优良葡萄酒酵母筛选[D].哈尔滨:东北林业大学,2010.
[5]王汝瑱.陕西泾阳酿酒酵母与非酿酒酵母酿酒特性的比较研究[D].杨凌:西北农林科技大学,2011.
[6]董亚晨,戴忆宁,蔡瑾,等.无花果内源酵母的筛选、鉴定及发酵性能测试[J].中国食品学报,2014,14(8):240-247.
[7]曾庆梅,李志强,司文攻,等.紫外-微波复合诱变选育高产酿酒酵母菌株[J].微波学报,2010(S2):329-332.
[8]宋丽,刘晓风,刘培旺,等.微波诱变选育耐酸高效厌氧产氢菌[J].应用与环境生物学报,2008,14(3):427-431.
[9]中华人民共和国质量监督检验检疫总局,中国国家标准化管理委员会.GB/T15038—2006葡萄酒、果酒通用分析方法[S].北京:中国标准出版社,2006.
[10]于洋,粟春燕,陈晶瑜.3株葡萄酒非酿酒酵母的生长与发酵特性[J].食品科学,2015,36(9):106-111.
[11]张明霞.顶空固相微萃取分析白酒香气物质的条件优化[J].食品科学,2011,32(12):49-53.
[12]牛春华,高岩,李玉秋,等.紫外诱变选育高产蛋白酶枯草芽孢杆菌[J].中国酿造,2011,30(12):67-69.
[13]张丽萍,程辉彩,田连生,等.植酸酶高产菌株的紫外线-空气等离子体复合诱变选育[J].中国饲料,2006(9):13-15.
[14]赵祥杰,杨荣玲,肖更生,等.桑椹果酒酵母的诱变选育研究[J].食品科技,2007,32(2):33-37.
[15]鲍瑞峰.刺葡萄果实与刺葡萄酒香气成分的研究[D].长沙:湖南农业大学,2010.
[16]刘峻溪,张将,史涛涛,等.不同商品酵母对葡萄酒香气成分的影响[J].中国酿造,2015,34(4):42-46.
[17]刘亚娜,杨华,郭德军.3种酵母发酵生产红树莓酒香气成分的GC-MS分析[J].食品科学,2015,36(12):160-165.
[18]盖禹含,辛秀兰,杨国伟,等.不同酵母发酵的蓝莓酒香气成分GC-MS分析[J].食品科学,2010,31(4):171-174.
[19]徐亚男,刘秋萍,李琦,等.GC-MS对非酿酒酵母菌发酵赤霞珠葡萄酒香气成分的检测[J].中国酿造,2014,33(6):135-139.
[20]ROMAGNOLI G,LUTTIK M A,TTER P,et al.Substrate specificity of thiamine pyrophosphate-dependent 2-oxo-acid decarboxylase inSaccharomyces cerevisiae[J].Appl Environ Microbiol,2012,78(21): 7538-7548.
[21]李艳,康俊杰,成晓玲,等.3种酿酒酵母酿造赤霞珠干红葡萄酒的香气成分分析[J].食品科学,2010,31(22):378-382.
Mutation breeding of a non-Saccharomyces cerevisiaestrain
LIU Xinnan,ZONG Qianqian,LI Jinpeng,ZHANG Huiling*(Department of Food Science,College of Agriculture,Ningxia University,Yinchuan 750021,China)
Metschnikowia pulcherrimaas a parent strain was treated by ultraviolet(UV)mutagenesis and microwave mutagenesis.The results showed that the optimum mutation conditions were as follows:UV(30 W)irradiation 5 min,microwave irradiation(2 450 MHz,700 W)30 s.Two strains with better tolerance were obtained by primary screening and secondary screening.After aroma determination by GC-MS,by comparing the aroma types and contents,mutant strain W1 with tolerance of 300 g/L glucose,9%vol ethanol,300 mg/L SO2was obtained.The total ester content of the mutant strain W1 fermentation broth was 85.97%,and the total alcohol content was 2.33%,which were both higher than that of the parent strain and the mutant strain W2.The fermentation broth of strain W1 was full of fruit-based aroma,with Cabernet Sauvignon wine color,and suitable for application of wine-making.
Non-Saccharomyces cerevisiae;alcohol;mutagenesis;volatile substances
TS261.1
0254-5071(2017)01-0049-06
10.11882/j.issn.0254-5071.2017.01.010
2016-08-19
国家自然科学基金(地区科学基金项目)(31360402)
刘鑫楠(1994-),女,本科生,研究方向为微生物发酵。
*通讯作者:张惠玲(1963-),女,教授,本科,研究方向为食品生物技术。

