酱香大曲微生物菌群结构及微生物功能研究概述
李豆南,邱树毅*
(1.贵州大学酿酒与食品工程学院,贵州贵阳550025;2.贵州省发酵工程与生物制药重点实验室,贵州贵阳550025)
酱香大曲微生物菌群结构及微生物功能研究概述
李豆南1,2,邱树毅1,2*
(1.贵州大学酿酒与食品工程学院,贵州贵阳550025;2.贵州省发酵工程与生物制药重点实验室,贵州贵阳550025)
酱香大曲是优质酱香白酒重要的糖化、发酵剂,按制曲工艺划分其属于高温大曲。酱香大曲中以细菌、霉菌、酵母菌为代表的各种微生物类群混合生长,共同推动了酿造过程的顺利进行,对酱香白酒品质、风味的形成有重要贡献。该文从酱香大曲微生物菌群结构与微生物功能性分析两个方面综述了酱香型大曲微生物的研究进展,分析酱香型大曲微生物类群与酱香白酒品质之间的联系,并对未来的研究提出展望。
酱香大曲;菌群结构;功能分析
我国传统白酒生产的历史可以追溯到千年以前,是世界上最古老的蒸馏酒之一,其主要以富含淀粉质的粮食为原料,经过固态、半固态及液态等方式发酵、蒸馏而成。在这之中,以茅台酒为代表的酱香型大曲酒以其香气幽雅、酒体醇厚丰满、回味悠长、空杯留香持久的特点深受广大消费者的青睐,迅速成为了中国优质白酒的典范。酱香大曲是高品质酱香白酒之骨,重要的糖化发酵剂和生香剂,酱香型大曲的微生物类群分布及其数量消长变化影响了各阶段产物的生成,对白酒的品质及风格特征定型有突出贡献[1],通过微生物菌群的代谢作用,可以有效将原料中的淀粉、蛋白质等大分子物质转化为酒精以及特征风味物质。
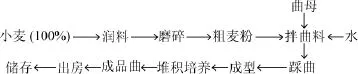
酱香大曲具有原料易得、工艺简单、功能性强的特点[2],其实质为高温大曲,采用100%纯小麦为原料,常以4%~5%的优质曲母作为接种源,制曲温度达60~65℃,使用前还要经过长达3~6个月的贮存,整个制曲过程完全在开放式的环境下进行,不同来源的各种微生物不断更替富集,经长期自然选择过程,在大曲中形成独特的菌群结构,进而对白酒的品质特征造成影响[3]。其制作工艺如下:
1 酱香大曲微生物菌群结构研究
1.1 传统培养方法
传统可培养分离技术是分析微生物的基本方法,通过合适的纯化分离条件可以得到纯种菌株,进行形态学、代谢功能以及分子生物学的分析,是全面了解菌株特性的重要方式,虽然在广泛的使用过程中存在着耗时较长、精确性不高、只能对可培养性的菌种进行分离鉴定等技术缺陷[4],但在白酒酒曲微生物类群研究领域,该技术一直是无法替代的主要分析手段。1981年,贵州省轻工业局科学研究所采用可培养分离技术,对茅台酱香大曲中的微生物进行多次分离,共得到95种微生物,其中细菌47株、霉菌29株、酵母菌19株,通过菌株纯种及混种制曲实验,进一步发现嗜热芽胞杆菌、曲霉、毛霉、红曲霉为酱香大曲中的有益菌类,对大曲品质的强化有利[5];而接下来,采用菌落计数法针对大曲中微生物类群进行的初步分析也表明了大曲中细菌数量最多,霉菌次之,酵母菌数量最少的规律。有学者[6]对茅台高温大曲制曲过程各阶段的微生物类群进行跟踪,发现高温大曲微生物数量以细菌占优,酵母菌整体较少,制曲前期细菌为主,中后期霉菌类群占据优势的酱香大曲微生物消长规律。WANG C L等[7]也采用可培养法对不同成熟阶段的茅台酱香大曲中的微生物菌群进行分析,从大曲中共分离出超过200种菌株,发现了以芽孢杆菌属为主,醋酸菌属、乳酸菌属和梭菌属所组成大曲细菌菌群结构,以曲霉属为主,毛霉属、根霉属、红曲霉属和木霉属所组成霉菌菌群结构,以酿酒酵母属为主的酵母菌菌群结构,同时表明大曲位置的不同,细菌、酵母菌、霉菌三大类微生物类群结构的分布也会呈现差异。
一系列可培养分离鉴定的结果无疑表明酱香大曲是一种以细菌、酵母菌和霉菌三大类群为主的微生物混合生长体系,在不同的制曲阶段和曲块分布位置,三大类微生物会呈现出不同的消长规律,但总体表现出细菌种类数量最为丰富、霉菌次之、酵母菌数量较少的特点,这正如著名学者方心芳所言,酱香大曲的实质为一种细菌曲;而芽孢杆菌、曲霉、毛霉以及根霉总体为酱香大曲中的优势微生物类群,这些微生物的分布、生长代谢与酱香大曲的品质息息相关,深入探求其功能机理将十分有助于酿造工艺的改进。
1.2 结合现代分子生物学技术的免培养方法
近年来随着技术的进步,菌种分析方法从传统的经典分类学逐渐发展到现代分子生物学方法,在传统可培养分离技术的基础上,一系列诸如聚合酶链式反应-变性梯度凝胶电泳(polymerase chain reaction-denaturing gradient gel electrophoresis,PCR-DGGE)技术、16S或18S rRNA基因序列同源性分析技术、聚合酶链式反应-限制性内切酶片段长度多态性(polymerase chain reaction-restriction fragmentlengthpolymorphism,PCR-RFLP)技术、Biolog微平板技术、荧光定位杂交技术(fluorescence in situ hybridization,FISH)、高通量测序技术等以现代分子生物技术为基础的免培养分析方法开始应用于酱香大曲的微生物菌群分析,取得了更为全面精确的分析结果;陈林[8]在传统分离技术的基础上结合Biolog微平板技术对武陵酱香酒酿造过程中微生物群落结构进行探究,结果显示大曲中的微生物总量最为丰富。LI H[9]运用扩增核糖体DNA限制性分析(amplifed ribosomal DNA restriction analysis,ARDRA)技术针对茅台酱香大曲进行分析,发现Actinobacteria和Firmicutes门下的枯草芽孢杆菌、地衣芽孢杆菌和解淀粉芽孢杆菌为优势细菌类群,并通过代谢分析表明这些菌种能够有效产生丙酸、1,3-丁二醇、醋酸、甲基酯类风味前体物质。LIU X等[10]则运用PCR-DGGE技术对茅台大曲整个制曲阶段曲块中的微生物多样性进行分析,表明在大曲成型、成熟以及晾干时期微生物类群结构呈现明显差异,其中成型阶段乳酸菌与多数真菌多样性水平较高,成熟阶段真菌类群多样性下降,芽孢杆菌数量占优,在晾干时期,芽孢杆菌、产酸细菌以及真菌的多样性显著下降,还首次从酱香大曲中发现Lactococcussp.、Microbacterium testaceum、Cochliobolussp.、Thermoascus crustaceus等未培养微生物类群。ZHANG L Q等[11]同样采用PCR-DGGE技术对郎酒高温大曲中的微生物类群进行分析,发现细菌类群中乳酸菌及芽孢杆菌为大曲中的优势菌群,霉菌类群则以曲霉菌为主,酵母类群以扣囊复膜酵母菌等非酿酒酵母菌为主,同时还鉴定出了研究较少的耐热芽孢杆菌。在最新的研究中,黄晓宁等同样采用聚合酶链式反应-变性梯度凝胶电泳法(PCR-DGGE)对某酱香型大曲微生物群落组成进行分析鉴定,共鉴定出14种菌,发现其中以葡萄球菌、高温放线菌、地衣芽孢杆菌和多枝横梗霉为优势菌[12]。
虽然研究表明免培养分析技术会由于序列读取精准度的问题存在一定的缺陷,但更多的研究无疑揭示了该技术所展现出的巨大优势,进一步验证了由可培养法得出的酱香大曲微生物菌群结构组成,在原先可培养法的基础上,发现了许多未培养微生物菌群,并对其功能特性完成初探。同时还能与可培养技术进行互补,探究各种微生物类群的变化规律,为今后大曲微生物研究提供了新的思路。
1.3 酱香大曲中细菌的菌群结构分析
很早就有研究者提出细菌是酱香大曲的生香动力,研究也认为主要来自细菌菌群的代谢产物经过一系列复杂的反应最终生成了各种风味物质,是酱香风味形成的主要途径;在这其中,菌群结构特征直接影响到了代谢产物的形成,被视为酱香风味产生的根源,因此多年来针对酱香大曲中细菌类群结构的分析一直是研究热点,基于传统可培养分离技术的运用,研究者对酱香大曲中的细菌菌群进行分离筛选,逐步确立了以芽孢杆菌为酱香大曲中主要的细菌菌群的规律,见表1。
多年的研究已经表明,芽孢杆菌为酱香大曲细菌类群中的十分普遍的优势种属,耐高温的特性使得其能够在高温、高湿、偏酸的制曲环境下广泛分布于大曲之中,在多种细菌被大量淘汰的情况下生长繁殖,代谢产生高温蛋白酶以及淀粉酶类,辅助霉菌对于大曲原料的降解,同时能够生成多种游离氨基酸,经过发酵体系中一系列复杂的反应,产生白酒酱香风味[2]。对于不同地区及不同时期制作的酱香大曲而言,具体的芽孢杆菌种类会存在一定的差异,考虑到酱香大曲完全开放式的制作环境,制曲原料、制曲微环境、水质、母曲种类、工艺参数等因素对于大曲细菌菌群结构的形成均有很大的影响,出现这样的结果也就显而易见。

表1 酱香大曲细菌菌群结构研究Table 1 Bacterial community structure in Moutai-flavorDaqu
此外,随着分子生物学鉴定方法的进一步发展,除16S rDNA序列同源分析鉴定技术外,更多先进的鉴定技术也逐渐运用起来,快速、精确的检测鉴定大曲微生物成为可能,同时发现了许多新型细菌种类,拓展了学界对于大曲细菌类群的认识。高亦豹等[20]运用PCR-DGGE免培养技术对江苏某酱香型高温大曲中的细菌菌群进行分析,发现很少报道的高温放线菌Thermoactinomyces sanguinis,同时检测到Weissella cibaria、L.helveticus、L.fermentum、L.panis四种乳酸菌及一些葡萄球菌、克雷伯氏菌,为酱香大曲细菌菌群结构的研究开辟了新思路。有学者[21]以PCR-DGGE技术研究某酱香型白酒制曲过程中的细菌菌群结构及消长规律,结果表明酱香母曲、翻仓曲和出仓成品曲细菌菌群结构存在明显的差异,随着大曲的发酵成熟,细菌群落结构多样性变化明显,发现了以芽孢杆菌属、魏斯氏菌属和乳酸杆菌属为主的10个细菌属以及未研究报道过的丙酸杆菌属、棒状杆菌属和鞘氨醇单胞菌属下的Sphingomonas yabuuchiae等细菌。王彩虹[22]采用克隆文库技术与PCR-RFLP联用手段对不同香型大曲中细菌群落进行分析,发现酱香型大曲优势细菌为枝芽孢杆菌属和高温放线菌属,分别占全部克隆子的比例为44.83%、43.10%,其中枝芽孢杆菌属为酱香大曲的特有菌种。在最新的研究中,王晓丹等[23]采用第二代454 FLX+高通量测序平台对贵州省遵义地区3个酱香型大曲中细菌群落进行比较分析,共检测出以厚壁菌门为主的6个门49个属细菌,其中高温放线菌属、芽孢杆菌属含量均高于30%,为主要优势菌属,还发现了棒状杆菌属、魏斯氏菌属等稀有细菌属,进一步丰富了酱香大曲功能性细菌类群的研究范围。
上述研究表明,除芽孢杆菌外,高温放线菌、乳酸菌、丙酸杆菌以及棒状杆菌等多种细菌同样广泛地存在于酱香大曲中,这些菌种通过传统可培养分离方法几乎无法分离得到,但新型免培养技术的结果又揭示其的确为酱香大曲整体细菌菌群结构的组成部分,同芽孢杆菌一起发挥着重要的作用。其中高温放线菌属已在芝麻香型白酒高温大曲中首次分离得到,经鉴定为Thermoactinomyces vulgaris,具有产碱性磷酸盐酶、酯酶、类脂酯酶及萘酚-AS-BI-磷酸水解酶的活性;乳酸菌则是衡量大曲品质的重要标志之一,决定着大曲的质量,也是白酒增已降乳改进工艺的控制性菌种;而进一步明确这些细菌菌种功能性作用对于深入了解酱香大曲品质的来源就显得很有价值。
1.4 酱香大曲中霉菌的菌群结构分析
在酱香大曲中,霉菌也是一类重要的功能性微生物,被视为大曲糖化降解动力的主要来源,曲中的霉菌种类往往十分繁多,制曲过程中,通过独特制曲环境的控制,促使有益的霉菌在曲中着生繁殖,推动大曲的发酵成熟,其特殊的细胞结构、功能分化及生长特性对大曲质量以及功能特征的形成起着关键的作用,可以说霉菌的特征性功能在一定程度上决定了大曲的质量特征。针对大曲霉菌菌群的研究很早就已开展,一直是白酒研究领域的重点,具体的研究结果见表2。
研究分析表明,曲霉属、毛霉属、根霉属、犁头霉属、红曲霉属、青霉属、拟青霉属等为酱香大曲中常见的霉菌种属,在各种类型的酱香大曲中均能分离得到,被认为是大曲的霉菌主要类群组成。其中曲霉属为大曲中种类最丰富的霉菌,也是主要的产酶菌源,具有很好的耐热、耐酸特性,能在酿造环境中生长代谢,推动大曲原料的降解发酵,目前酱香大曲中检测出的曲霉种类主要包括黑曲霉、黄曲霉、米曲霉几种;毛霉属同样也是一类重要的霉菌,其主要着生于大曲的低温培菌期,能够代谢产生蛋白酶促进大曲的分解;根霉往往与毛霉菌共存,其菌丝体能够深入到大曲基质中生长,形成网状菌丝体,对大曲的成型有一定贡献[2],在酱香大曲中主要存在米根霉,是糖化型淀粉酶的主要来源;红曲霉属于嗜酸霉菌,同样均有耐高温特性,能够代谢产生色素造成酱香大曲曲心出呈现红色;青霉属过去一度被认为是白酒酿造过程中的有害菌,应尽量控制,但近年来研究表明青霉菌在各种大曲中均占有一定的比例,同时HEIN I等[27]的研究也显示青霉能分泌聚糖酶系,对木质纤维具有良好的降解能力,故使得学界对于大曲中的青霉属有了新的认识。犁头霉属在酱香大曲中广泛存在,数量较多,随着该菌属的生长大曲完成了“穿衣”过程,有效防止了曲块裂口的现象[2]。而对于最新发现的阿姆斯特丹散囊菌、Thermomucor indicae seudaticae等霉菌来说,针对其在酿造过程中代谢特性的分析也成为了今后大曲霉菌菌群研究的新方向。

表2 酱香大曲霉菌菌群结构研究Table 2 Mould community structure in Moutai-flavorDaqu
酱香大曲中的霉菌是易受环境影响的类群,同时与接种母曲中霉菌种类也有重要的关系,可以说酱香大曲中霉菌类群结构的形成是制曲环境和接种母曲共同作用,经过长期富集自然分离筛选的结果,只有从这些方面入手,才能了解到酱香大曲独特霉菌菌群的来源以及演变规律,从而指导我们对其功能特性进行深入的研究。
1.5 酱香大曲中酵母菌的菌群结构分析
酵母菌也是酱香大曲中一类重要的微生物,在固态发酵的过程中,被视为发酵动力的来源,是酒精发酵过程的核心菌种,能够产生大量酒精以及高级酯类物质。酵母菌存在于酱香大曲制曲的各个时期,对酱香型白酒风格的形成具有重要作用。多年来,针对酱香大曲中酵母的研究,揭示了制曲工艺中酵母消长规律及类群结构特征,为深入探究酱香白酒发酵机理、呈香机制提供了理论依据。具体的研究情况见表3。

表3 酱香大曲酵母菌菌群结构研究Table 3 Yeast community structure in Moutai-flavorDaqu
一般而言,在酱香大曲制曲过程中,酵母菌类群在早期低温培菌阶段会快速生长繁殖,占大曲微生物总量的2%~5%,随着制曲阶段进入高温转化期,堆积曲块温度迅速上升达到60℃以上,对于耐热性不佳的酵母菌来说,其类群会被大量淘汰,早期针对其消长规律的研究也进一步证实了这一规律;而近年来深入的研究又表明高温成品大曲中确实有一定数量的酵母菌存在,本课题组通过可培养菌落技术的手段,对五种酱香大曲中的酵母进行计数,发现其数量虽然较少,但能够达到103CFU/g,这说明高温阶段虽然降低了大曲中酵母的数量,但仍有部分耐热性较好的酵母菌存活或处于休眠状态,同时从制曲工艺上分析,在成品曲出房及贮存的过程中,大曲可以重新富集微环境中的酵母,也会导致一定数量酵母菌的存在。
除常见的酿酒酵母外,还有多种诸如产酯酵母、假丝酵母、伊萨酵母以及毕赤酵母等菌种被陆续分离得到,对酱香型大曲中酵母菌群结构组成而言是极大的补充,这表明酱香大曲中的酵母菌虽然数量不多,但同样具有高度多样性的特征,而针对这些菌种的功能性分析也将成为今后的重点研究方向。
2 酱香大曲微生物的产酶及代谢研究
2.1 酱香大曲中细菌的产酶及代谢研究
细菌在大曲都具有十分重要的地位,被形象的描述为白酒酿造的生香动力来源,因此深入剖析大曲中各种细菌的产酶、代谢特征,对于了解酱香白酒独特风味的形成将有巨大的帮助,具体的研究情况见表4。

表4 酱香大曲细菌功能性研究Table 4 Functional research of bacteria in Moutai-flavorDaqu
目前,针对酱香大曲中细菌菌群功能性的研究主要集中于芽孢杆菌类群的研究上,通过一系列固态发酵实验以及GC-MS挥发性成分分析,证实地衣芽孢杆菌、解淀粉芽孢杆菌以及枯草芽孢杆菌的确能够在固态发酵过程中代谢产生苯乙醛、4-甲基-2,6-二叔丁基-苯酚、吲哚、糠醛、四甲基吡嗪、庚醇、苯甲醛、2-戊基呋喃、三甲基吡嗪、呋喃扭尔、异戊酸、2-甲基-2-丁烯酸、2,3-丁二醇、β-苯乙醇和苯乙酸等多种风味物质,几乎囊括了学术界讨论的所有有关酱香型白酒的主体香味成分,这说明大曲中的芽孢杆菌类群的确对于酱香风味的产生有突出贡献;同时发现了芽孢杆菌较为突出的蛋白质分解能力,在促进大曲酱香风味生成的一系列美拉德反应中,芽孢杆菌可以降解大分子蛋白质,发酵产生乙偶姻以及各种游离氨基酸等美拉德反应前驱物质[35],推动整个生香过程的进行。
2.2 酱香大曲中霉菌的产酶及代谢研究
霉菌是除细菌之外,大曲中十分重要的另一大类微生物,在酱香大曲制曲前期以及储存阶段,其类群大曲微生物中占据了很大的比重。一般而言,大曲霉菌类群被视为降解动力及产酶来源,虽然说法并不十分准确,但确实反映出了霉菌在代谢产酶方面的主要功能,因此,多年来针对酱香大曲霉菌产酶代谢功能性一直是热点领域,具体的研究情况见表5。

表5 酱香大曲霉菌功能性研究Table 5 Functional research of mould in Moutai-flavorDaqu
在大曲产酶方面,霉菌类群的确扮演了非常重要的角色,对于根霉、曲霉、毛霉、青霉、红曲霉以及新发现的散囊菌类群来说均具有很好的产酶代谢能力,但相互间的产酶特征存在差异。在制曲过程中,多种霉菌分工明确,产生一系列以酸性蛋白酶、中性蛋白酶、液化酶、糖化酶、纤维素酶、酯化酶为主的水解酶系,共同推动原料的的降解和酿造过程的顺利进行。
除产酶特性外,近年来的研究也显示大曲霉菌同时还具有一定的产香功能,参与到生成多种高级醇、醛、酮、酯等呈香物质的发酵过程之中,与大曲细菌类群互为协同,促进酱香白酒风味特征的形成。对于新发现的散囊菌而言,同样也具有产香的功能,王晓丹等[26]对酱香大曲中分离的一株阿姆斯特丹散囊菌采用固相微萃取-气质联用技术对其固态发酵挥发性香味物质进行分析,发现该菌固态发酵具有很强花香和果蔬香,挥发性香味物质以高级醇、酮和呋喃类酱香成分为主,其中L-芳樟醇、1-辛烯-3-醇、3-辛酮、2-戊基呋喃的相对含量较高,从而证实该菌为一株产酱香霉菌。
2.3 酱香大曲中酵母菌的产酶及代谢研究
酵母菌虽然在大曲中的数量不多,但仍是一类重要的大曲微生物,被称为酒类发酵的动力,一般而言,大曲酵母菌直接关系到产酒率,同时能够代谢产生不同的风味物质,对酱香型白酒风格的形成具有重要作用[2]。针对大曲中酵母菌具体的研究情况见表6。

表6 酱香大曲酵母菌功能性研究Table 6 Functional research of yeast in Moutai-flavorDaqu
根据功能性的区别,白酒酿造过程中的酵母菌又可以总体分为两类,一类是产酒酵母,另一类则为产香酵母(非产酒酵母),均为酿造环境中长期驯化产生的高耐受性菌种,主要的功能性研究也围绕着这两类酵母菌展开,目前来说,针对酱香白酒酿造过程中酵母菌类群的功能性研究主要集中在酒醅以及糟醅菌种上,但少数研究也反映出大曲中数量很少的酵母菌群同样在产香以及产酒方面有重要的贡献,除常见的产酒菌群——酿酒酵母外,已发现如假丝酵母、裂殖酵母等高耐受性类群能够产生大量具有挥发性风味的醇、酸、酯类等物质,同时拥有优良的产酒能力,对酱香白酒风味的形成有一定的贡献,开辟了酱香白酒酿造过程中酵母菌类群功能性研究的新方向。
3 展望
曲乃酒之骨,大曲本身作为一种选择性培养基质,对各类酿造环境微生物进行富集筛选,形成了独特的大曲菌群结构,对于酱香型白酒而言,大曲是必不可少的糖化剂,同样也是发酵剂和生香剂,对白酒品质的定型有重要作用;通过酒曲微生物菌群和功能的分析,对于酱香白酒工艺的改进、酒质的提升及均有重要的影响。
细菌、霉菌和酵母菌被称为大曲中的三大微生物类群,三者数量占据绝对优势,酱香大曲也不例外;而随着现代分子生物学技术的发展,菌种分析手段正向着新老技术联用的方向快速发展,在弥补方法缺陷的同时,拓展大曲微生物的研究范围,做到对大曲中的各种菌群结构及多样性进行更为全面、实时、精确的分析,更加合理的解释酱香白酒发酵生香机理;多年的研究针对酱香大曲细菌、霉菌以及酵母菌类群结构均进行了较为系统的分析,在基本类群结构的基础上,不断有全新菌种的发现,对数量庞大的大曲不可培养微生物资源的开发有十分重要的意义;从类群功能性研究上看,除霉菌类群得到了较为全面的研究外,细菌和酵母菌类群的功能性研究仍不够全面,随着新技术的运用,新的细菌、霉菌、酵母菌种正在不断涌现,因此采用基因组学、代谢组学、蛋白组学等先进手段进行功能性探究,利用新型功能菌株完成酱香白酒生产工艺的强化在今后也就显得尤为必要。
目前,大曲分离的微生物在一些领域已经得到运用。而酱香大曲中的微生物数量庞大、种类繁多,其中具有良好代谢特性的菌种不在少数,将这些菌种运用于酶制剂、风味添加剂的生产具有巨大的潜力,也成为了未来大曲微生物应用的重要发展方向之一。
[1]尚柯,韩兴林,王德良,等.酱香白酒高温堆积酒醅挥发性风味物质的检测分析[J].中国酿造,2016,35(2):139-143.
[2]沈怡方.白酒生产技术全书[M].北京:中国轻工业出版社,2015:45-111.
[3]刘晓光,谢和,屈直.酱香型白酒风味物质的形成与微生物关系的研究现状与进展[J].贵州农业科学,2007,35(2):131-134.
[4]潘虎,卢向阳,董俊德,等.未培养微生物研究策略概述[J].生物学杂志,2012,29(1):79-83.
[5]贵州省轻工业局科学研究所.茅台酒大曲微生物的研究[J].微生物学通报,1981,30(1):261-264.
[6]胡宝东,王晓丹,王婧,等.酱香型大曲生产工艺与大曲品质的关系研究[J].食品工业,2016(2):260-264.
[7]WANG C L,SHI D J,GONG G L.Microorganisms inDaqu:a starter culture of Chinese Maotai-flavor liquor[J].World J Microb Biot,2008, 24(10):2183-2190.
[8]陈林.酱香型白酒发酵过程中微生物群落结构分析[D].北京:北京林业大学,2012.
[9]LI H.Bacterial diversity in the central black component of MaotaiDaqu and its flavor analysis[J].Ann Microbiol,2014,64(4):1659-1669.
[10]LIU X,GUO K L,ZHANG H X.Determination of microbial diversity in Daqu,a fermentation starter culture of Maotai liquor,using nested PCR-denaturing gradient gel electrophoresis[J].World J Microb Biot, 2012,28(6):2375-2381.
[11]ZHANG L Q,WU C D,DING X F,et al.Characterisation of microbial communities in Chinese liquor fermentation startersDaquusing nested PCR-DGGE[J].World J Microb Biot,2014,30(12):3055-3063.
[12]黄晓宁,黄晶晶,李兆杰,等.浓香型和酱香型大曲微生物多样性分析[J].中国酿造,2016,35(9):33-37.
[13]庄名扬,王仲文.酱香型高温大曲中功能B3-1菌株的分离、选育及其分类学鉴定[J].酿酒,2003,30(1):81-82
[14]张荣.产酱香功能细菌的筛选及其特征风味化合物的研究[D].无锡:江南大学,2009.
[15]鲁珍,余中华,李恩中.酱香型高温大曲酶系的研究进展[J].食品安全导刊,2016(9):51-53.
[16]赵兴秀,何义国,赵长青,等.产酱香功能菌的筛选及其风味物质研究[J].食品工业科技,2016,37(6):196-200.
[17]徐佳,邱树毅,周鸿翔,等.酱香大曲中可培养的冠突散囊菌的初步研究[J].中国酿造,2016,35(6):55-59.
[18]王俊,陈仁远,赵文武,等.仁怀大曲酱香轮次基酒质量状况研究[J].中国酿造,2016,35(11):103-107.
[19]王婧,王晓丹,罗晓叶,等.酱香大曲中高产蛋白酶功能细菌的筛选及鉴定[J].中国酿造,2015,34(10):43-46.
[20]高亦豹,王海燕,徐岩.利用PCR-DGGE未培养技术对中国白酒高温和中温大曲细菌群落结构的分析[J].微生物学通报,2010,37(7):999-1004.
[21]潘玲玲,王媚,罗明有,等.浓香型白酒黄水、窖泥中微生物总DNA提取方法比较[J].中国酿造,2016,35(4):42-46.
[22]王彩虹.基于克隆文库法研究不同香型大曲微生物群落结构[D].自贡:四川理工学院,2014.
[23]王晓丹,班世栋,邱树毅,等.贵州省遵义地区3个酱香型大曲细菌群落的比较分析[J].食品科学,2016,37(7):110-116.
[24]FAN G X,WANG H Y,CUI T B.Researching development of Maotai microorganisms[J].Liquor-making Sci Technol,2006,10(148): 75-77.
[25]班世栋,王晓丹,陈孟强,等.酱香型大曲中具产酶功能霉菌的分离筛选[J].酿酒,2014,41(4):31-35.
[26]王晓丹,徐佳,周鸿翔,等.酱香型大曲中分离到的阿姆斯特丹散囊菌产酶产香特性[J].食品科学,2016,37(11):154-159.
[27]HEIN I,J RGENSEN H J,LONCAREVIC S,et al.Quantification of Staphylococcus aureus in unpasteurised bovine and caprine milk by real-time PCR[J].Res Microbiol,2005,156(156):554-563.
[28]荣瑞金,李祖明,王德良,等.中国酒曲微生物研究进展[J].中国酿造,2009,28(6):5-8.
[29]孔维兵,王晓丹,邱树毅,等.酱香型大曲中酵母的分离与鉴定[J].酿酒,2015,42(1):57-62.
[30]吴徐建.酱香型白酒固态发酵过程中酵母与细菌群落结构变化规律的研究[D].无锡:江南大学,2013.
[31]罗小叶,邱树毅,王晓丹,等.酱香大曲产香酵母的分离及鉴定[J/OL].食品与发酵工业,http://www.cnki.net/kcms/detail/11.1802.TS.2016102 4.1403.070.html
[32]袁庆云.酱香型白酒发酵过程中微生物的功能研究[J].酿酒,2016(4):15-20.
[33]张荣.地衣芽孢杆菌固态发酵产地衣素及风味活性物质对白酒品质的影响[D].无锡:江南大学,2014.
[34]武思齐.产酱香芽孢杆菌的代谢产物及其研究[D].贵阳:贵州大学,2009.
[35]庄名扬.乙偶姻与美拉德反应[J].酿酒,2010,37(2):99-100.
[36]王新惠,李再新,刘达玉,等.米根霉糖化酶酶促反应条件的研究[J].食品科技,2008,33(5):26-29.
[37]刘鸿,方尚玲,陈茂彬,等.大曲中放线菌和青霉产酶初探[J].酿酒,2010,37(2):38-41.
[38]张琳,张也,王如福,等.大曲中高产糖化酶菌株的筛选及环境耐受性分析[J].山西农业大学学报:自然科学版,2016(10):740-744.
[39]郭晓旭,袁朝琪,李国莹,等.高产Monacolin K纯种红曲培养条件的研究[J].工业微生物,2016(1):27-30.
[40]黄永光.酱香型白酒酿造中Aspergillus hennebergii及其分泌酸性蛋白酶的研究[D].无锡:江南大学,2014.
[41]申孟林,张超,王玉霞.白酒大曲微生物研究进展[J].中国酿造,2016,35(5):1-5.
[42]陈良强,吴群,徐岩.酱香型白酒低产杂醇油粟酒裂殖酵母特性的研究[J].工业微生物,2013,43(3):1-6.
[43]陈美竹.酱香白酒大曲与酿造过程酵母动态变化研究[D].贵阳:贵州大学,2016.
Overview of microbial community structure and function in Moutai-flavorDaqu
LI Dounan1,2,QIU Shuyi1,2*(1.College of Liquor and Food Engineering,Guizhou University,Guiyang 550025,China;2.Key Laboratory of Fermentation Engineering and Biological Pharmaceutical,Guiyang 550025,China)
Moutai-flavorDaquis an important saccharifying agent and fermentation starter for high quality Moutai-flavorBaijiu(liquor).According to theDaqu-making process,it belongs to the high temperatureDaqu.A variety of microbial community represented by bacteria,moulds and yeasts are mixed grown in Moutai-flavorDaquand play different role,they jointly promote the whole brewing process smoothly,and have important contribution to the quality and flavor formation of Moutai flavorBaijiu.The research progress from two aspects of microbial community structure and function of Moutai-flavorDaquwere reviewed,the relationship between microbial community andBaijiu's quality were analyzed.What's more,the prospect for the future research direction was also put forward.
Moutai-flavorDaqu;microbial structure;functional analysis
TS261.1
0254-5071(2017)01-0005-07
10.11882/j.issn.0254-5071.2017.01.002
2016-11-03
贵州省工业攻关项目(黔科合GZ字[2014]3012);贵州省重大专项项目(黔科合重大专项字[2013]6009号)
李豆南(1991-),男,硕士研究生,研究方向为发酵工程。
*通讯作者:邱树毅(1963-),男,教授,博士,研究方向为应用生物技术。

