黄酒发酵过程中乳酸菌的分离及对其产生物胺能力的评价
王然然,李晓敏,陈柳,卞小稳,蔡国林,陆健*
1(江南大学,工业生物技术教育部重点实验室,江苏 无锡,214122) 2(江南大学,粮食发酵工艺与技术国家工程实验室,江苏 无锡,214122) 3(江南大学 生物工程学院,江苏 无锡,214122) 4(上海华润雪花啤酒(上海)有限公司,上海,200949)
黄酒发酵过程中乳酸菌的分离及对其产生物胺能力的评价
王然然1,2,3,李晓敏1,2,3,陈柳4,卞小稳1,2,3,蔡国林1,2,3,陆健1,2,3*
1(江南大学,工业生物技术教育部重点实验室,江苏 无锡,214122) 2(江南大学,粮食发酵工艺与技术国家工程实验室,江苏 无锡,214122) 3(江南大学 生物工程学院,江苏 无锡,214122) 4(上海华润雪花啤酒(上海)有限公司,上海,200949)
对黄酒酿造过程中乳酸菌进行分离,并对乳酸菌产生物胺能力进行检测。利用脱羧培养基对分离出的82株乳酸菌进行培养,结合反相高效液相色谱技术(reversed-phase high-performance liquid chromatography, RP-HPLC)测定发酵液中生物胺含量,具体色谱条件如下:使用丹磺酰氯(Dansyl Chloride,Dns-CL)进行柱前衍生,以乙腈-乙腈(φ=50%)为流动相梯度洗脱,流速1.0 mL/min,254 nm紫外波检测。该方法在给定浓度范围内线性关系良好(R2>0.996),平均回收率为94.46%~105.20%,相对偏差(RSD)均小于5%。检测到组胺产生菌株11株,最大生成量为18.19 mg/L,高产菌株分离自黄酒前酵第2天;酪胺产生菌株28株,最大生成量为30.38 mg/L,高产菌株分离自黄酒前酵第2天;腐胺产生菌株51株,最大生成量为299.94 mg/L,高产菌株分离自浸米水。由此表明,有必要控制黄酒发酵过程中的乳酸菌,采用低产或不产生物胺的乳酸菌作为强化菌株,可降低黄酒中的生物胺含量。
黄酒;乳酸菌;生物胺;反相高效液相色谱技术
生物胺(biogenic amine,BAs)是一类含氮的低分子量碱性化合物的总称,根据结构可将其分为3类:脂肪类(腐胺、尸胺、精胺、亚精胺等)、芳香类(酪胺、苯乙胺等)、杂环类(组胺、色胺等)。食品中常见的生物胺主要有腐胺、尸胺、组胺、酪胺等[1]。
微量生物胺是人体内的正常活性成分,但也具有潜在毒性。人体摄入过量的生物胺会产生头痛、心悸、呼吸紊乱等中毒性症状,其中,组胺对人体的毒害最大,其次是酪胺。人体摄入过多酪胺和β-苯乙胺会引起偏头痛;组胺摄入量在8~40 mg,40~100 mg和高于100 mg时,分别会引起轻微、中等和严重中毒,如腹部痉挛、呕吐和腹泻等症状[2];腐胺、尸胺、精胺和亚精胺虽然未发现明确的危害,但其与亚硝酸盐反应会生成致癌物质亚硝基胺[3],且腐胺和尸胺的存在会抑制生物胺分解酶活性,从而间接增强组胺和酪胺对于人体健康的危害[4]。一些国家食品中生物胺的限量标准详见表1,我国尚未规定酒类中生物胺的限量标准。

表1 不同国家及地区生物胺的限量标准
注:在酒类中,目前只有葡萄酒限量标准的报道;-没有文献报道。
黄酒是我国特有的古老酒种,其富含乳酸菌和曲霉的三边发酵过程中会产生许多对人体有益的功能性成分,但同时也会积累大量的生物胺等有害物质。研究指出,黄酒中总生物胺的平均含量高达115 mg/L[5],远高于世界各国对葡萄酒的限量标准。酒中的乙醇会降低胺类氧化酶活力,体积分数为12%的乙醇存在时最高可抑制91%的胺类氧化酶活性[6],从而增强生物胺的毒性。目前,黄酒中检测到的主要生物胺包括组胺、酪胺和腐胺等,其中,腐胺的检出率最高,且含量相对较高[7]。
发酵食品中的生物胺主要由微生物细胞内氨基酸的脱羧反应形成,以乳酸菌的作用最为突出[1, 8]。然而,乳酸菌是黄酒酿造过程中不可或缺的重要微生物之一,不仅可以抑制杂菌的生长,其主要代谢产物乳酸也是黄酒风味物质的重要来源。在黄酒发酵过程中,发酵液pH维持在4.0左右,有利于诱导乳酸菌内氨基酸脱羧酶的合成[9],加之黄酒原料中丰富的游离氨基酸,为生物胺的形成提供了大量底物来源。研究表明,乳酸菌积累生物胺的能力具有菌株特异性,即使相同种属的乳酸菌,其产生生物胺的能力也不尽相同[10-13]。因此,研究黄酒发酵过程不同阶段乳酸菌的组成,检测各菌株产生物胺的能力,培养驯化发酵过程中低产生物胺的乳酸菌为优势菌株,将有利于在不影响其风味物质和发酵过程的前提下,降低成品黄酒中的生物胺含量。
1 实验材料与方法
1.1 材料
1.1.1 样品
从黄酒酿造过程中各阶段取样,取浸米水、前酵第2天、后酵第1、4、7、14天的未过滤黄酒(绍兴某黄酒厂提供),4 ℃保存。
1.1.2 试剂
生物胺标准品组胺、酪胺、腐胺以及色谱纯试剂丹磺酰氯(Dansyl Chloride,Dns-CL)、乙腈均购自美国Sigma化学公司。
1.1.3 培养基
MRS液体培养基:蛋白胨10 g,酵母浸提物10 g,牛肉膏5 g,柠檬酸胺2 g,葡萄糖20 g,吐温-80 1 mL,乙酸钠5 g,K2HPO42 g,MgSO40.58 g,MnSO40.25 g,CuSO40.28 g,加水至1 000 mL,pH调至6.2~6.3,1×105Pa灭菌20 min,制备固体培养基质时另加15 g琼脂粉配制。
液体脱羧培养基:蛋白胨5 g,酵母浸提物5 g,牛肉膏5 g,NaCl 2.5 g,葡萄糖0.5 g,吐温-80 1 mL,MgSO40.2 g,FeSO40.4 g,柠檬酸铵0.05 g,K2HPO42 g,CaCO31 g,5-磷酸吡多醛0.05 g,L-组氨酸5 g,L-酪氨酸0.4 g,L-鸟氨酸5 g,加水至1 000 mL,pH调到5.5,1×105Pa灭菌20 min。
1.1.4 主要仪器与设备
日立Chromaster CM5110高效液相色谱仪(示差检测器/紫外检测器);QSC-12T氮吹仪,上海泉岛公司;KQ-300DE型数控超声波清洗器,上海书培实验设备有限公司;XMTD-8222型数显恒温水浴锅,上海精宏实验设备有限公司;QT-1漩涡混合器,上海琪特分析仪器有限公司;分析天平,梅特勒EL204型;H1850R低温离心机,长沙湘仪离心机仪器有限公司。
1.2 实验方法
1.2.1 实验菌种分离及分子生物学鉴定
取工厂浸米水(记为0-n),前酵第2天(记为1-2-n),后酵第1天(记为2-1-n)、第4天(记为2-4-n)、第7天(记为2-7-n)、第14天(记为2-14-n)未过滤的黄酒,用滤纸过滤后,梯度稀释(10-1,10-2,10-3,10-4,10-5),并于各梯度取200 μL分别涂布于含放线菌酮(100 μg/mL)的MRS平板上,放入厌氧罐内于30 ℃恒温培养3~4 d,在菌落密度适中的平板上挑取单个乳白色,表面光滑,边缘整齐,不透明的菌落进行编号,挑取编号菌落在MRS培养基上划线进行传代培养,反复划线至单菌落。
1.2.2 乳酸菌的鉴定
将单菌株接种于MRS培养基中30 ℃培养12 h,吸取1 mL菌液,8 000 r/min离心5 min收集菌体,提取基因组DNA。
以各菌株基因组为模板利用通用引物27F(5′-AGAGTTTGATCCTGGCTCAG-3′)/1492R(5′-GGTTACCTTGTTACGACTT-3′)扩增16S rDNA。PCR扩增体系(50 μL):10×buffer 5 μL;dNTP 4 μL;引物各2 μL;rTaq酶0.6 μL;模板2 μL;加水34.4 μL补充至50 μL。PCR扩增程序:95 ℃预变性5 min,95 ℃变性1 min,52 ℃退火1 min,72 ℃延伸1 min 30 s,共35个循环,最后72 ℃延伸5 min。对PCR产物进行测序后(由上海生工生物工程有限公司完成)进行BLAST序列比对,根据序列同源性确定其种属信息。
1.2.3 菌体活化及脱羧培养基培养
待试菌株在MRS培养基中活化2次,接种于液体脱羧培养基中,30 ℃静止培养4 d,每个氨基酸底物做3组平行,利用不添加氨基酸底物的空白培养基作为对照。
1.2.4 反相高效液相色谱检测生物胺
培养液离心去菌体后,取1 mL上清,加入200 μL饱和Na2CO3溶液,20 μL NaOH溶液(2 mol/L),2 mL Dns-cL溶液(10 mg/mL丙酮中),混合后于70 ℃中水浴10 min进行衍生。待混合液冷却后,加入1 mL氨水(50 mg/mL)终止反应。终止反应结束后,加入2 mL饱和NaCl混匀,随后加入3 mL乙醚进行萃取,室温下200 r/min振荡30 min,4 ℃ 3 000 r/min离心15 min后将上清液转移至离心管中吹干,最后用1 mL乙腈定容,过0.45 μm偏氟膜后用于高效液相色谱分离检测。
使用安捷伦ZORBAX Eclipse AXBD-C18色谱柱(4.6 mm×250 mm,5 μm)。采用梯度洗脱,洗脱程序见表2,流速:1.0 mL/min;检测波长:254 nm;进样量:20 μL;柱温:28 ℃;流动相A:乙腈,流动相B:乙腈(φ=50%)。
1.2.5 标准曲线的绘制
准确称取标准品酪胺、组胺、腐胺各100 mg,用超纯水定容至100 mL,制成浓度为1 000 mg/L混合标准储备液。量取上述标准储备液,用超纯水配制成终浓度分别为0.1、0.5、1、5、10、30、60、90、120、150、200 mg/L的混合标液。
1.2.6 回收率和精密度实验
向发酵液样品中加入样品生物胺浓度为80%、100%和120%的标准品。每个添加做6个平行,做空白样品2份,按照上述衍生方法和色谱条件进行回收率及精密度试验。
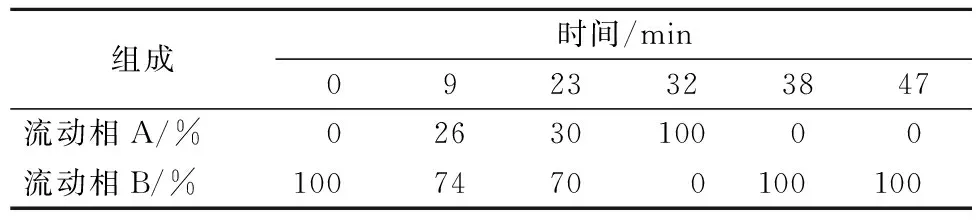
表2 HPLC法检测生物胺的梯度洗脱程序
2 实验结果分析
2.1 实验菌种分离及分子生物学鉴定结果
为了探索黄酒中乳酸菌的微生态系统组成,在黄酒酿造过程中,取浸米水、前酵、后酵中未过滤的黄酒酒液,分离出82株菌,通过16SrDNA扩增、测序、BLAST比对后得到如表3所示的鉴定结果,其中主要为乳酸杆菌属(Lactobacillus)、明串珠菌属(Leuconostoc)、乳球菌(Lactococcus)和魏斯氏菌属(Weissella)的乳酸菌,其中乳酸杆菌属共58株,占绝对优势,明串珠菌属16株,是除乳酸杆菌属外的优势菌种,乳球菌4株,此外还有个别魏斯氏菌株。具体实验结果见表3以及图1。
2.2 色谱条件的选择
参照沈念原[14]等的衍生方法,由于该方法对样品预处理采用酸提,不适用于本实验条件下生物胺的检测,因此对其方法进行修改:对样品衍生后加入氨水终止反应,并用乙醚抽提,改变流动相和洗脱程序。实验条件下腐胺的保留时间为20.90±0.02 min、组胺的保留时间为25.12±0.02 min、酪胺的保留时间为32.34±0.00 min。3种样品均可以在40 min内有效分离出来(图2),峰形对称无拖尾。结果说明3种生物胺的分离效果良好,使用此方法可以实现对3种生物胺的快速准确检测。

表3 黄酒中分离乳酸菌的鉴定结果
2.3 方法的线性范围和检测限
选择不同浓度的生物胺标准溶液进行检测,确定腐胺、组胺的浓度在0~200 mg/L范围内是线性相关的、酪胺在0~160 mg/L内线性相关。标准品色谱图见图2,标准曲线见图3,其相关系数均大于0.996,说明组胺、酪胺和腐胺的峰面积与相应浓度呈良好的线性关系。用信噪比(S/N)为3确定方法检测限(LOD),具体参数见表4。
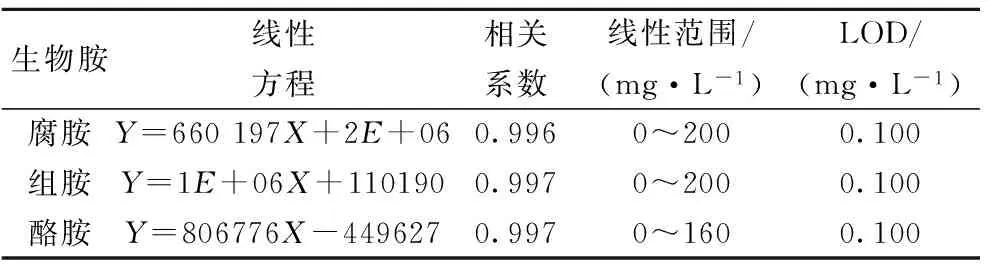
表4 生物胺标准品线性方程及检测限(LOD)
2.4 回收率及精密度实验
回收率及精密度试验结果见表5。由表5可以看出酪胺、组胺和腐胺在不同浓度(低、中、高)精密度良好,相对标准偏差(RSD)值均小于5%。Dns-CL衍生物稳定,但为了保证实验结果准确性,在样品衍生结束后最好立即上样检测。

图1 黄酒发酵不同阶段乳酸段菌株分布Fig.1 The distribution of BA producing LAB strains during Chinese rice wine fermentation

1-腐胺(20.95 min);2-组胺(25.11 min);3-酪胺(32.34 min)图2 生物胺混合标准品(浓度为90 mg/L)色谱图Fig.2 Chromatogram for a standard mixture of BAs (90 mg/L)

图3 生物胺含量标准曲线Fig.3 Standard curves of BAs content
2.5 菌体培养液中生物胺含量的测定
采用以氨基酸为底物的培养基对分离的各菌株进行培养,并检测其产生物胺能力,其部分结果见表6,黄酒生产各阶段产生物胺菌株分布详见图4。结果显示,产生组胺的菌株有11株(生成量为4.02~18.19 mg/L),产生酪胺的菌株有28株(生成量为9.20~30.38 mg/L),产生腐胺的菌株有51株(生成量为20.26~299.94 mg/L)。

表5 生物胺检测方法的回收率及精密度测定(n=6)

图4 黄酒生产各阶段产生物胺菌株分离分布Fig.4 The distribution of BA producing LAB strains during Chinese rice wine fermentation

菌株腐胺组胺酪胺含量/(mg·L-1)转化率/%含量/(mg·L-1)转化率/%含量/(mg·L-1)转化率/%生物胺总量/(mg·L-1)L.sakei0-4299.946.00nd0nd0299.94L.fermentum1-2-1289.795.80nd0nd0289.79Leu.citreum0-19229.854.60nd0nd0229.85L.curvatus0-18202.434.05nd0nd0202.43L.paralimentarius1-2-11191.693.83nd0nd0191.69L.fermentum2-14-20165.663.312.560.0518.834.70187.06L.sp.1-2-22177.643.55nd0nd0177.64L.sp.2-4-19132.382.652.500.0519.964.98154.84L.fermentum1-2-20123.632.4718.190.362.940.74144.76L.fermentum2-28135.522.71nd0nd0135.52W.sp.2-1-2658.991.183.060.0613.913.4775.96L.fermentum2-1-1444.610.892.690.0515.483.8762.78L.brevis2-4-1520.580.410.000.0023.095.7743.68L.fermentum2-1-1227.470.554.020.084.291.0735.78L.brevis1-2-2924.780.50nd030.387.5955.16L.plantarum2-14-820.260.41nd024.486.1144.74L.fermentum2-7-1422.770.462.600.059.202.3034.57L.fermentum1-2-3216.350.332.220.0415.113.7733.69L.sp.2-14-1329.510.59nd04.131.0333.64L.sp.2-7-919.840.40nd0nd019.84Leu.citreum0-819.440.39nd0nd019.44L.coryniformissubsp.1-2-1319.380.39nd0nd019.38Leu.mesenteroides0-1517.880.36nd0nd017.88Leu.pseudomesenteroides0-516.990.34nd0nd016.99Leu.citreum2-14-1615.820.32nd0nd015.82
注:nd:未检测到。
3 讨论
本文从黄酒发酵各阶段发酵液中分离出82株乳酸菌,并对其进行了鉴定,主要有乳酸杆菌属和明串珠球菌属,乳酸杆菌属包括发酵乳杆菌(Lb.fermentum)、植物乳杆菌(Lb.plantarum)、弯曲乳杆菌(Lb.curvatus)、短乳杆菌(Lb.brevis)、棒状乳杆菌(Lb.coryniformis)等;明串珠菌属包括柠檬明串珠菌(Leu.citreum)和肠系膜明串珠菌(Leu.mesenteroides)两种;此外,还存在少量乳球菌和魏斯氏菌。
在黄酒开放式发酵过程中,来自浸米水、麦曲以及空气中的乳酸菌均会进入发酵液,除形成乳酸维持发酵液的pH外,还可利用原料中的氨基酸进行脱羧反应产生生物胺。本文进一步利用改进的RP-HPLC方法对分离的各菌株进行了产生物胺能力的评价。在实验室培养条件下,检测到产组胺的菌株11株,其中生成组胺最高菌株为分离自前酵第2天的发酵乳杆菌(18.19 mg/L,转化率0.36%);检测到产生酪胺的菌株28株,其中生成酪胺最高菌株为分离自前酵第2天的短乳杆菌(30.38 mg/L,转化率7.59%);检测到能够产生腐胺的菌株51株,其中生成腐胺最高菌株为分离自浸米水的清酒乳杆菌(299.94 mg/L,转化率6.00%)。在浸米阶段,环境中较多组胺和腐胺生成菌株进入浸米水;在前酵阶段,随着麦曲和浸米水带入,以及周围环境的影响,发酵液中存在大量组胺、腐胺和酪胺生成菌株;在后酵过程中,发酵液中组胺生成菌株逐渐减少,但仍存在腐胺和酪胺生成菌株。因此,有必要控制黄酒发酵过程中的乳酸菌,如采取净化制曲工艺、对浸米水进行灭菌处理、在前酵过程强化不产生物胺的乳酸菌等手段,实现在不改变乳酸产量和发酵液pH的前提下,降低生物胺的目的。文章中仅是对分离出菌株进行了实验室条件下的发酵实验,未对发酵过程中各菌株的数量及生物胺含量进行检测,这方面有待进一步的研究。
[1] SPANO G, RUSSO P, LONVAUD-FUNEL A, et al. Biogenic amines in fermented foods [J]. European Journal of Clinical Nutrition, 2010, 64:95-100.
[2] PARENTE E, MARTUSCELLI M, GARDINI F, et al. Evolution of microbial populations and biogenic amine production in dry sausages produced in Southern Italy [J]. Journal of Applied Microbiology, 2001, 90(6): 882-891.
[3] SHALABY A R. Significance of biogenic amines to food safety and human health [J]. Food Research International, 1996, 29(7): 675-690.
[4] HERN NDEZ-ORTE P, LAPE A A, PE A-GALLEGO A, et al. Biogenic amine determination in wine fermented in oak barrels: factors affecting formation [J]. Food Research International, 2008, 41(7): 697-706.
[5] ZHONG Jian-jun, YE Xing-qian, FANG Zhong-xiang, et al. Determination of biogenic amines in semi-dry and semi-sweet Chinese rice wines from the Shaoxing region [J]. Food Control, 2012, 28(1): 151-156.
[6] GARC A-RUIZ A, GONZ LEZ-ROMPINELLI E M, BARTOLOM B, et al. Potential of wine-associated lactic acid bacteria to degrade biogenic amines [J]. International Journal of Food Microbiology, 2011, 148(2): 115-120.
[7] 谢铭. 黄酒中生物胺的分析研究 [J]. 广州化工, 2010, 38(4): 139-141.
[8] 周景文, 堵国成, 陈坚. 发酵食品有害氨 (胺) 类代谢物: 形成机制和消除策略 [J]. 中国食品学报, 2012, 11(9): 8-25.
[9] LI Zhi-jun, WU Yong-ning, ZHANG Gong , et al. A survey of biogenic amines in chinese red wines [J]. Food Chemistry, 2007, 105(4): 1 530-1 535.
[10] FERNNDEZ M, ZUNIIGM. Amino acid catabolic pathways of lactic acid bacteria [J]. Critical Reviews in Microbiology, 2006, 32(3): 155-183.
[12] COTON M, ROMANO A, SPANO G, et al. Occurrence of biogenic amine-forming lactic acid bacteria in wine and cider [J]. Food Microbiology, 2010, 27(8): 1 078-1 085.
[13] PESSIONE E, MAZZOLI R, GIUFFRIDA M G, et al. A proteomic approach to studying biogenic amine producing lactic acid bacteria [J]. Proteomics, 2005, 5(3): 687-698.
[14] 沈念原, 王秀芹. 高效液相色谱法测定葡萄酒中生物胺的含量 [J]. 食品工业科技, 2011,32(4): 394-396.
Detection of biogenic amines produced by lactic acid bacteria isolated from the fermentation process of Chinese rice wine
WANG Ran-ran1,2,3, LI Xiao-min1,2,3, CHEN Liu4, BIAN Xiao-wen1,2,3,CAI Guo-lin1,2,3, LU Jian1,2,3*
1(The Key Laboratory of Industrial Biotechnology, Jiangnan University,Wuxi 214122,China) 2(National Engineering Laboratory for Cereal Fermentation Technology, Jiangnan University, Wuxi 214122,China) 3 (School of Biotechnology, Jiangnan University, Wuxi 214122,China) 4(China Resources Snow Breweries, Shanghai 200949,China)
The performance of biogenic amine (BA) production which was conducted by lactic acid bacteria (LAB) isolated from the fomentation process of Chinese rice wine was explored in this paper. A collection of 82 LAB strains cultured in decarboxylation medium were screened for potential producers and BA content of each medium culture was determined by reversed-phase high-performance liquid chromatography (RP-HPLC) after derivatized with dansyl chloride (Dns-cL). The RP-HPLC analysis for the samples were conducted as follows: mobile phase was a gradient elution program of acetonitrile and acetonitrile (φ=50%) with a flow rate of 1 mL/min and the column effluent was monitored at 254 nm with a UV detector. It turned out that the method for BA production presented good linearity (R2>0.996) at given concentrations and a recovery rate of 94.46%-105.20%, together with a relative standard deviation (RSD) of less than 5%. Furthermore, there were 11 strains detected for histamine production (maximum=18.19 mg/L) and the max-histamine producing strain were isolated on the 2nd day of pre-fermentation. 9 strains for tyramine (maximum=30.38 mg/L) and the max- tyramine producing strain were isolated on the 2nd day of pre-fermentation. 51 strains for putrescine (maximum=299.94 mg/L) and the max-putrescine producing strain were isolated from the rice immersion water. The results suggested that it was necessary to control LAB during Chinese rice wine fermentation to reduce the content of BA.
Chinese rice wine; lactic acid bacteria; biogenic amine; reversed-phase high performance liquid chromatography
10.13995/j.cnki.11-1802/ts.201701003
硕士研究生(陆健教授为通讯作者,E-mail: jlu@jiangnan.edu.cn)。
工业过程高效转化与系统集成的科学基础研究,973项目(2013CB733602);黄酒发酵过程中乳酸菌积累有害胺类物质代谢物的机制解析,江苏省自然科学基金(BK20140144);江苏高校优势学科建设工程资助项目
2016-08-04,改回日期:2016-09-18

