复治肺结核患者对氟喹诺酮类药物交叉耐药情况的体外研究
崔振玲 陆俊梅 杨华 黄晓辰 肖和平
·论著·
复治肺结核患者对氟喹诺酮类药物交叉耐药情况的体外研究
崔振玲 陆俊梅 杨华 黄晓辰 肖和平
目的 分析复治肺结核患者结核分枝杆菌临床分离株对氟喹诺酮类药物体外交叉耐药情况。 方法 收集2009—2010年来自全国13个地区的结核病防治机构的175例未治疗前的复治结核病患者。使用BACTEC MGIT 960系统(简称“MGIT 960”)和最低抑菌浓度法(MIC)两种方法检测结核分枝杆菌分离株对氧氟沙星(Ofx)、左氧氟沙星(Lfx)和莫西沙星(Mfx)药物的敏感性,分析3种氟喹诺酮类药物的交叉耐药情况。 结果 MGIT 960检测结果显示,100.0%(132/132)对Ofx敏感的菌株对Lfx和Mfx敏感;100.0%(131/131)对Mfx敏感的菌株对Lfx敏感,99.2%(130/131)对Ofx敏感;对Lfx敏感的菌株中85.7%(132/154)对Ofx敏感,85.1%(131/154)对Mfx敏感。对Ofx耐药的菌株中48.8%(21/43)同时耐Lfx,97.7%(42/43)同时耐Mfx;对Lfx耐药的菌株中100.0%(21/21)同时耐Mfx与Ofx;耐Mfx的菌株中95.5%(42/44)同时耐Ofx,47.7%(21/44)同时耐Lfx。MIC值检测结果显示,对Ofx耐药的菌株中86.0%(37/43)同时耐Lfx,7.0%(3/43)同时耐Mfx;对Lfx耐药的菌株中8.1%(3/37)同时耐Mfx,100.0%(37/37)同时耐Ofx;3株对Mfx耐药的菌株均同时耐Ofx和Lfx。结论 复治肺结核患者临床分离株对Ofx与Lfx具有较高的双向交叉耐药;但Ofx和Lfx两种药物与Mfx之间的正向交叉耐药率较低,临床治疗时最好结合MIC值检测结果而择优选药。
结核, 肺; 喹诺酮类; 微生物敏感性试验; 评价研究
近年来,由于耐药结核病的蔓延,常规一线抗结核药物化疗效果不佳,加剧了耐药结核病尤其耐多药结核病(MDR-TB)的流行。研究显示,氟喹诺酮类药物对结核分枝杆菌具有较好的杀菌效果[1-3],因此,其用于治疗耐药结核病或者复治结核病患者倍受关注[4]。随着耐药结核分枝杆菌的传播,氟喹诺酮类药物在结核病治疗中遇到了较大的挑战,如何更有效合理地使用氟喹诺酮类药物是临床亟待解决的问题。氧氟沙星(Ofx)、左氧氟沙星(Lfx)和莫西沙星(Mfx)均属于氟喹诺酮类药物,其中,Lfx和Mfx作为新一代氟喹诺酮类药物被广泛使用。已有研究显示,Mfx治疗MDR-TB患者效果优于Lfx,治疗初治结核病患者优于Ofx[4-6],但是对复治结核病患者临床分离株对上述3种氟喹诺酮类药物之间的交叉耐药情况尚不清楚。本研究将复治肺结核患者结核分枝杆菌临床分离株进行体外氟喹诺酮类药物的药物敏感性试验(简称“药敏试验”),以观察交叉耐药情况,为临床合理使用氟喹诺酮类药物提供实验室依据。
材料和方法
一、 菌株来源
选取2009—2010年来自全国13个地区结核病防治机构的175例尚未开始治疗的复治肺结核患者作为研究对象,患者来源见表1。175例复治肺结核患者中,28例患者有氟喹诺酮类药物用药史,147例患者无氟喹诺酮类药物用药史。共分离得到175株菌株,所有分离株均经过对硝基苯甲酸(PNB)菌种鉴定,结果为结核分枝杆菌。以H37Rv菌株作为标准株[上海市肺科医院结核病(肺)重点实验室菌株库提供]。
二、试剂与仪器
BACTEC MGIT 960系统(简称“MGIT 960”)7 ml 培养管和分枝杆菌营养添加剂(OADC)均购自美国BD公司; Ofx、Lfx药粉购自美国Sigma公司;Mfx原药药粉由德国拜耳公司提供;96孔无菌U型板购自浙江拱东医疗科技有限公司。3种氟喹诺酮类药物原粉在配制使用时均根据试剂标识的纯度计算有效浓度。
三、MGIT 960进行药敏试验的程序
所有菌株进行对Ofx、Lfx和Mfx的药敏试验。检测方法参照WHO推荐的MGIT 960采用的药物浓度进行[7-9]。Ofx、Lfx和Mfx的终浓度分别为2 μg/ml、2 μg/ml和0.25 μg/ml。检测管:向7 ml MGIT 960内加入0.8 ml OADC、0.1 ml药物储存液,再加入0.5 ml的菌液(0.5 mg/ml)。对照管:向7 ml MGIT 960培养管加入0.8 ml OADC,再加入0.5 ml的菌液(0.005 mg/ml)。放入MGIT 960仪器中,选择未知药敏试验程序,由仪器自动判读结果,时间4~13 d。

表1 175例复治肺结核患者来源及背景资料
四、最低抑菌浓度(MIC)检测
MIC检测在96孔U型板中进行,具体操作参考文献[10],每个药物共设8个浓度,由高到低进行倍比稀释,Ofx 浓度为0.125~16 μg/ml;Lfx浓度为0.125~16 μg/ml;Mfx浓度为0.0625~8 μg/ml。设置1%菌量为对照孔,加药孔内菌量<1%对照孔内菌量判定为结核分枝杆菌生长受到抑制,能抑制结核分枝杆菌生长的最低药物浓度判定为MIC值。根据文献[11-12],Ofx、Lfx和Mfx的药敏试验判断界值均设定为2 μg/ml,即当MIC值≥判定界值时判断为耐药,反之则为敏感。
五、交叉耐药分析
Ofx耐药株同时耐Lfx、Ofx耐药株同时耐Mfx、Lfx耐药株同时耐Mfx的百分率定义为正向交叉耐药率;反之,Mfx耐药株同时耐Lfx、Mfx耐药株同时耐Ofx、Lfx耐药株同时耐Ofx的百分率定义为反向交叉耐药率。
六、统计学分析
采用SPSS 11.5统计学软件进行统计处理,不同药物耐药率的比较采用卡方检验,以P<0.05为差异有统计学意义。
结 果
一、MGIT 960法药敏试验及交叉耐药分析
MGIT 960法药敏试验结果显示,175株结核分枝杆菌临床分离株对Ofx、Lfx和Mfx的耐药率分别为24.6%(43/175)、12.0%(21/175)和25.1%(44/175);Ofx耐药率明显高于Lfx,差异有统计学意义(χ2=6.41,P=0.014);与Mfx耐药率相比,差异无统计学意义(χ2=0.09,P=1.000)。
147株无氟喹诺酮类用药史患者的临床分离株,对Ofx、Lfx和Mfx的耐药率分别为23.8%(35/147)、10.9%(16/147)和23.8%(35/147);28株有用药史患者的临床分离株,对Ofx、Lfx和Mfx的耐药率分别为28.6%(8/28)、17.9%(5/28)和32.1%(9/28);有无用药史患者的分离株对Ofx、Lfx和Mfx的耐药率比较,差异均无统计学意义(χ2=0.17,P=0.652;χ2=0.82,P=0.361;χ2=0.50,P=0.502)。
175例复治肺结核患者中,耐多药肺结核患者60例,对Ofx、Lfx和Mfx的耐药率分别为53.3%(32/60)、30.0%(18/60)、55.0%(33/60);对4种一线抗结核药物链霉素、异烟肼、利福平和乙胺丁醇全敏感患者81例,其对Ofx、Lfx和Mfx的耐药率分别为3.7%(3/81)、1.2%(1/81)、3.7%(3/81);耐多药患者与全敏感患者结核分枝杆菌临床分离株对Ofx、Lfx和Mfx耐药率比较,差异均有统计学意义(χ2=26.85,P<0.01;χ2=18.25,P<0.01;χ2=27.74,P<0.01)。
根据MGIT 960药敏试验结果分析,对Ofx耐药的菌株有43株,其中21株同时耐Lfx,42株同时耐Mfx;对Lfx耐药的菌株有21株,21株均同时耐Ofx,也同时耐Mfx;对Mfx耐药的菌株有44株,其中42株同时耐Ofx,21株同时耐Lfx。Ofx和Lfx、Ofx和Mfx、Lfx和Mfx正向交叉耐药率分别为48.8%(21/43)、97.7%(42/43)和100.0%(21/21);反向交叉耐药率分别为100.0%(43/43)、95.5%(42/44)和47.7%(21/44)。132株对Ofx敏感的菌株均对Lfx和Mfx敏感;154株对Lfx敏感的菌株中,有132株对Ofx同时敏感,131株同时对Mfx敏感;131株对Mfx敏感的菌株中,130株对Ofx敏感,所有Mfx敏感株均同时对Lfx敏感。
二、MIC法药敏试验及交叉耐药分析
43株对Ofx耐药的菌株用MIC法进行药敏试验,Ofx的MIC值分布位于2~>16 μg/ml 之间,Lfx的MIC值分布位于1~16 μg/ml之间,Mfx的MIC值分布位于0.25~4 μg/ml之间(表2)。43株对Ofx耐药的菌株采用MIC法进行药敏试验,结果对Lfx和Mfx的耐药率分别为86.0% (37/43)和7.0%(3/43)。
43株对Ofx耐药的菌株中,Lfx与Ofx相同的MIC菌株仅1株(2.3%);35株(81.4%)菌株对Ofx的MIC值为Lfx的2倍,7株(16.3%)菌株对Ofx的 MIC值为Lfx的4倍(表3)。无对Ofx与Mfx的MIC值相同的菌株,且无对Lfx与Mfx的MIC值相同的菌株。5株(11.6%)菌株对Lfx的 MIC值为Mfx的2倍,25株(58.1%)菌株对Lfx的 MIC值为Mfx的4倍,13株(30.2%)菌株对Lfx的MIC值为Mfx的8倍及以上(表4)。

表2 43株对Ofx耐药的菌株对3种氟喹诺酮类药物的MIC值分布情况(株)

表3 对Ofx耐药菌株的Ofx和Lfx 的MIC值分布(株)
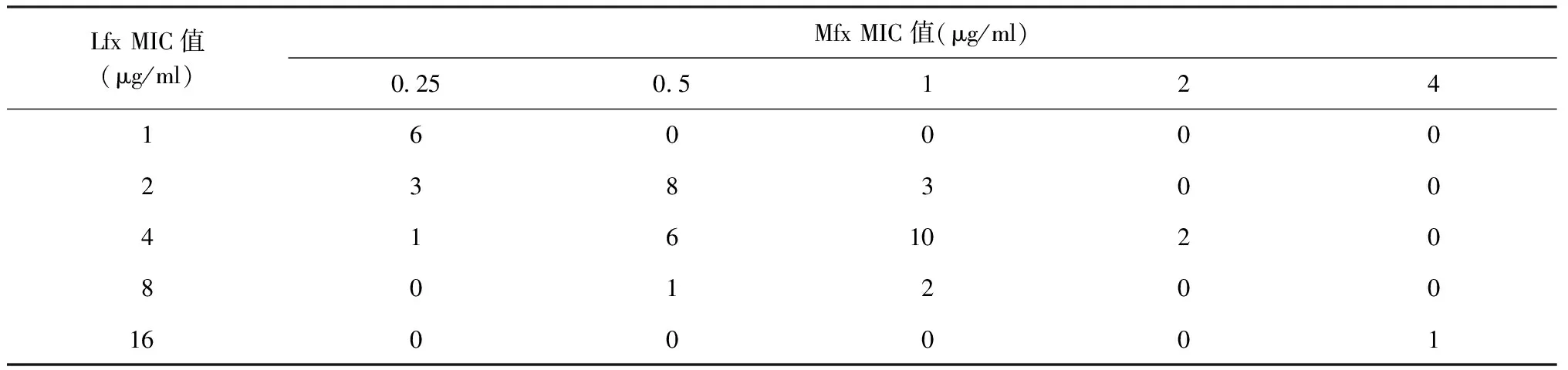
表4 对Ofx耐药菌株的Lfx和Mfx 的MIC值分布(株)
根据MIC药敏试验结果分析,耐Ofx同时耐Lfx的菌株有37株,同时耐Mfx的菌株有3株;耐Lfx同时耐Ofx的菌株有37株,同时耐Mfx的菌株有3株;耐Mfx同时耐Ofx的菌株有3株,同时耐Lfx的菌株有3株。Ofx和Lfx、Ofx和Mfx、Lfx和Mfx正向交叉耐药率分别为86.0%(37/43)、7.0%(3/43)和8.1%(3/37);反向交叉耐药率均为100.0%(37/37、3/3和3/3)。
讨 论
氟喹诺酮类药物因其与一线抗结核药物的杀菌机制不同,因此被广泛用于耐药结核病的治疗[13-14]。目前,已知氟喹诺酮类药物的耐药机制基本一致,均为编码DNA螺旋酶的基因发生突变导致耐药[15]。 它作为有效的抗结核药物,已经被写入耐药结核病化学治疗指南,目前也正被作为治疗复治肺结核的候选药物进行研究。我国新版《耐药结核病化疗指南 2015年》中将氟喹诺酮类药物作为治疗MDR-TB的重要药物, WHO在《耐药结核病规划管理指南》中建议优先选用Mfx及加替沙星等新一代氟喹诺酮类药物,同时指出要根据药敏试验结果选用氟喹诺酮类药物。尽管WHO认为在选用氟喹诺酮类药物治疗耐药结核病时,新一代药物Mfx和Lfx对Ofx耐药的菌株可能有效,但仍缺乏可信的研究予以证明[16-17]。随着氟喹诺酮类药物在复治肺结核治疗中的广泛应用,越来越多的医疗机构根据临床需求开展氟喹诺酮类药物的药敏试验,其中多数医疗机构仅对其中1种或2种药物进行药敏试验,对氟喹诺酮类药物的交叉耐药情况缺乏系统的研究。
目前,氟喹诺酮类药物药敏试验的方法有MGIT 960、BACTEC 460、罗氏培养、米氏7H10培养等,但仅有WHO推荐的MGIT 960法可以同时进行3种氟喹诺酮类药物的药敏试验[7]。为了避免方法学的不一致性而导致的研究差异,本研究首先采用MGIT 960对上述3种药物进行药敏试验。MGIT 960药敏试验结果显示,对Ofx敏感的菌株对Lfx和Mfx同时敏感;对Mfx敏感的菌株对Ofx和Lfx也基本全部敏感,提示在采用MGIT960进行药敏试验时,如果Ofx或者Mfx检测结果为敏感,则该菌株基本对3种氟喹诺酮类药物均敏感。但是对Lfx敏感的菌株,不一定对Ofx和Mfx同时敏感,应对临床用药进行有针对性的药敏试验检测。对于耐药株,MGIT 960药敏试验交叉耐药结果显示Ofx与Lfx虽然正向存在交叉耐药,但Ofx耐药菌株仍有可能对Lfx敏感,可以通过对Lfx进行药敏试验来判断是否可以选用Lfx治疗;但是Ofx和Mfx、Lfx和Mfx正向交叉耐药率接近100%,这与目前WHO和我国耐药结核病推荐用药指南差异较大[4,16]。为了进一步确认上述3种药物的交叉耐药率,笔者选用MIC法进一步对3种氟喹诺酮类药物的交叉耐药情况进行分析。
MIC法结果显示,大多数菌株对Lfx的MIC值低于Ofx;对Mfx的MIC值低于Lfx,与报道的Lfx抗结核效果优于Ofx,Mfx优于Lfx一致[4-6]。MIC检测交叉耐药结果显示,除Ofx和Lfx存在较高的正向交叉耐药外,Ofx和Mfx、Lfx和Mfx尽管存在正向交叉耐药,但交叉耐药率较低,此结果支持目前WHO和我国的耐药结核病指南推荐用药方案[4-6,16],提示临床治疗中Ofx和Lfx耐药的患者仍可能采用Mfx进行有效治疗。但是上述3种药物的反向交叉耐药率则均为100%。尽管本方法中Mfx耐药株较少,还需要扩大标本进行验证,但是100%的反向耐药率提示临床治疗中如果患者对Mfx耐药,则最好不要考虑再用Ofx和Lfx。
本研究采用了两种药敏检测方法对3种氟喹诺酮类药物的交叉耐药进行分析,两种方法对Ofx与Lfx的正向交叉耐药率分析较为一致,Mfx与另外2种药物交叉耐药率存在较大的差异。原因主要是由两种方法中检测Mfx耐药的浓度不一致所致。MGIT 960中Mfx的药物浓度远低于其他2种药物的浓度,从而导致Mfx的耐药率高于MIC法的耐药率,最终导致交叉耐药率的不同。在已有的研究报道中,判断对Ofx和Lfx耐药的MIC判断界值较一致,但对Mfx耐药的判断界值在不同研究中存在较大差异。有研究显示,当3种氟喹诺酮类药物使用量均为400 mg时,Lfx最大血药浓度(Cmax)约为7.463 μg/ml,Ofx的Cmax 约为3.3 μg/ml,Mfx的Cmax约为3.11 μg/ml[16,19]。据此推测,正常药物摄入量时,3种药物的有效血药浓度相近。因此,笔者认为在3种药物血药浓度相似的情况下体外药敏试验的检测浓度也应该相近,体外药敏试验判断界值选用同一浓度更为适宜。本研究MIC检测中对Ofx耐药菌株对Mfx的耐药率低于王前等[18]的报道,主要是由于本研究对Mfx 的MIC耐药判断界值设定不同导致。
另外,本研究显示有氟喹诺酮类药物用药史患者来源的菌株较无用药史患者来源的菌株对3种药物的耐药率更高,但差异无统计学意义,可能与样本量较小且分布欠均衡有关,有待进一步研究。尽管如此,仍需规范氟喹诺酮类药物的使用,防范不规范使用氟喹诺酮类药物对结核病患者治疗所产生的影响。同时,本研究显示MDR-TB患者对氟喹诺酮类药物耐药的菌株明显高于对一线药物全敏感的结核病患者的耐药率,提示采用氟喹诺酮类药物治疗复治MDR-TB患者时需根据药敏试验结果选择用药。
综上所述,复治肺结核患者结核分枝杆菌临床分离株对Ofx与Lfx存在较高的双向交叉耐药,但对Ofx与Mfx、Lfx和Mfx的正向交叉耐药率较低,大部分耐Ofx或者Lfx的菌株对Mfx仍敏感,在临床治疗选择上述3种氟喹诺酮类药物时,最好结合MIC值检测结果进行择优选药。
志谢 本研究得到了国家结核病参比实验室赵雁林教授的指导,以及以下合作单位的大力支持:解放军第八五医院、长春市传染病医院、成都市传染病医院、广西壮族自治区龙潭医院、 广州市胸科医院、杭州红十字会医院、河南省胸科医院、湖南省结核病医院、江苏省疾病预防控制中心、江西省胸科医院、南通市疾病预防控制中心、南通市第六人民医院、山东省胸科医院、太原市结核病医院、天津海河医院、新疆维吾尔自治区胸科医院
[1] Sulochana S, Mitchison DA, Kubendiren G, et al.Bactericidal activity of moxifloxacin on exponential and stationary phase cultures ofMycobacteriumtuberculosis.J Chemother,2009, 21(2):127-134.
[2] Johnson JL, Hadad DJ, Boom WH, et al. Early and extended early bactericidal activity of levofloxacin, gatifloxacin and Moxifloxacin in pulmonary tuberculosis. Int J Tuberc Lung Dis, 2006,10(6): 605-612.
[3] Kohno S, Koga H, Kaku M, et al. Prospective comparative study of ofloxacin or ethambutol for the treatment of pulmonary tuberculosis. Chest, 1992,102 (6):1815-1818.
[4] World Health Organization. Guidelines for the programmatic management of drug-resistant tuberculosis. Geneva:World Health Organization,2006.
[5] Rustomjee R, Lienhardt C, Kanyok T, et al. A Phase II study of the sterilising activities of ofloxacin, gatifloxacin and Moxifloxacin in pulmonary tuberculosis. Int J Tuberc Lung Dis,2008, 12(2):128-138.
[6] Lee J, Lee CH, Kim DK, et al. Retrospective comparison of levofloxacin and moxifloxacin on multidrug-resistant tuberculosis treatment outcomes. Korean J Intern Med,2011, 26(2):153-159.
[7] World Health Organization. Guidelines for surveillance of drug resistance in tuberculosis. Geneva:World Health Organization, 2009.
[8] Sharma M, Thibert L, Chedore P, et al. Canadian multicenter laboratory study for standardized second-line antimicrobial susceptibility testing ofMycobacteriumtuberculosis. J Clin Microbiol,2011, 49(12):4112-4116.
[9] Sanders CA, Nieda RR, Desmond EP. Validation of the use of Middlebrook 7H10 agar, BACTEC MGIT 960, and BACTEC 460 12B media for testing the susceptibility ofMycobacteriumtuberculosisto levofloxacin. J Clin Microbiol,2004, 42(11):5225-5228.
[10] 王洁,陆俊梅,黄晓辰,等.微量MIC检测判断结核分枝杆菌药敏的方法学研究.中华检验医学杂志,2010,33(4): 315-319.
[11] Nosova EY, Bukatina AA, Isaeva YD, et al. Analysis of mutations in the gyrA and gyrB genes and their association with the resistance ofMycobacteriumtuberculosisto levofloxacin, moxifloxacin and gatifloxacin. J Med Microbiol, 2013,62 (Pt1):108-113.
[12] World Health Organization. Companion handbook to the WHO guidelines for the programmatic management of drug-resistant tuberculosis. Geneva:World Health Organization, 2014.
[13] Ziganshina LE, Squire SB. Fluoroquinolones for treating tuberculosis. Cochrane Database Syst Rev,2008, 23(1):CD004795.
[14] Yew WW, Chan CK, Chau CH, et al. Outcomes of patients with multidrug-resistant pulmonary tuberculosis treated with ofloxacin/levofloxacin-containing regimens. Chest, 2000,117(3):744-751.
[15] Malik S, Willby M, Sikes D, et al. New insights into fluoroquinolone resistance inMycobacteriumtuberculosis: functional genetic analysis of gyrA and gyrB mutations. PLoS One, 2012, 7(6):e39754.
[16] 中国防痨协会. 耐药结核病化学治疗指南(2015). 中国防痨杂志, 2015,37(5): 421-469.
[17] World Health Organization. Guidelines for the programmatic management of drug-resistant tuberculosis. Geneva: World Health Organization,2008.
[18] 王前,宋媛媛,逄宇,等. 耐氧氟沙星结核分枝杆菌对五种氟喹诺酮类药物交叉耐药的研究. 中国防痨杂志,2014, 36(6):453-457.
[19] 唐神结,高文.临床结核病学.北京:人民卫生出版社,2011:177-178.
(本文编辑:王然 李敬文)
Analysis ofinvitrocross-resistance to fluoroquinolones among retreatment patients with pulmonary tuberculosis
CUIZhen-ling,LUJun-mei,YANGHua,HUANGXiao-chen,XIAOHe-ping.
ShanghaiKeyLaboratoryofTuberculosis,TuberculosisClinicalResearchCenter,ShanghaiPulmonaryHospitalAffiliatedtoTongjiUniversity,Shanghai200433,ChinaCorrespondingauthor:XIAOHe-ping,Email:xiaoheping_sars@163.com
Objective To analyze the situation ofinvitrocross-resistance to fluoroquinolones inMycobacteriumtuberculosis(MTB) clinical isolates obtained from retreatment pulmonary tuberculosis (PTB) patients. Methods All MTB clinical isolated strains were collected from 175 retreatment PTB patients who were registered in the TB health facilities of 13 provinces in China from 2009 to 2010. Drug susceptibility testing (DST) was performed to ofloxacin (Ofx), levofloxacin (Lfx) and moxifloxacin (Mfx) by using MGIT 960 system and MIC value assay. Cross-resistances of fluoroquinolones were analyzed according to the results of MGIT 960 system and MIC value assay. Results According to the results of MGIT 960, 100.0% (132/132) strains susceptible to Ofx were also susceptible to Lfx and Mfx. 100.0% (131/131) and 99.2% (130/131) strains susceptible to Mfx were susceptible to Lfx and Ofx, respectively. 85.7% (132/154) and 85.1% (131/154) strains susceptible to Lfx were susceptible to Ofx and Mfx, respectively. 48.8% (21/43) and 97.7% (42/43) strains resistant to Ofx were resistant to Lfx and Mfx respectively. 100.0% (21/21) strains resistant to Lfx were also resistant to Mfx and Ofx. 95.5% (42/44) and 47.7% (21/24) strains resistant to Mfx were resistant to Ofx and Lfx. According to the results of MIC value assay, 86.0% (37/43) and 7.0% (3/43) strains resistant to Ofx were resistant to Lfx and Mfx. 8.1% (3/37)strains resistant to Lfx were resistant to Mfx. Conclusion In MTB clinical isolated strains obtained from retreatment PTB, the cross-resistance rates between Ofx and Lfx were high while the positive cross-resistant rate of between Mfx and Ofx or Lfx was low. So the fluoroquinolones should be chosen according to MIC values when they are used for PTB treatment.
Tuberculosis, pulmonary; Quinolones; Microbial sensitivity tests; Evaluation studies
10.3969/j.issn.1000-6621.2017.01.014
“十二五”国家科技重大专项(2013ZX10003009)
200433 同济大学附属上海市肺科医院结核临床研究中心 上海市结核病(肺)重点实验室
肖和平,Email:xiaoheping_sars@163.com
2016-06-07)

