初治耐多药肺结核患者采用初治标准方案治疗的前瞻性临床研究
闫丽萍 吴哲渊 张祖荣 沙巍 陈静 潘启超 沈鑫 袁政安 张青 肖和平
·论著·
初治耐多药肺结核患者采用初治标准方案治疗的前瞻性临床研究
闫丽萍 吴哲渊 张祖荣 沙巍 陈静 潘启超 沈鑫 袁政安 张青 肖和平
目的 探讨一线抗结核药物在初治耐多药肺结核(MDR-PTB)的治疗中是否仍有应用的空间,为正确处理初治MDR-PTB提供依据。方法 对2011年1月至2013年12月上海市所有登记的肺结核患者(共19 042 例)采用“全面筛查”方式,共发现168例初治MDR-PTB患者,将具有上海市户籍或工作居住证并签订了知情同意书的114例患者纳入本次研究。经上海市MDR-PTB防治专家组分析讨论后对所有研究对象进行初治标准方案治疗。以患者强化期治疗不同效果进行分组,显效者继续完成12H-R-Z-E方案治疗(简称“标准治疗组”),无效者则给予耐多药方案治疗(简称“耐多药治疗组”)24个月,标准治疗组治疗成功的患者在疗程结束后每2个月随访1次,至信息采集截止时平均随访了16个月。观察两组治疗成功率、患者失访率、死亡率、药物不良反应发生率。结果 58例强化期显效者继续给予12H-R-Z-E方案治疗,56例无效者给予耐多药方案治疗,基本方案为6Cm-Lfx-Pto-PAS-Z/18Lfx-Pto-PAS-Z。标准治疗组和耐多药治疗组的治疗成功率、患者失访率分别为69.0%(40/58)和67.9%(38/56)、5.2%(3/58)和7.1%(4/56),差异均无统计学意义(χ2=0.01,P=0.899;χ2=0.66,P=0.192);标准治疗组和耐多药治疗组的死亡率、药物不良反应发生率分别为0.0%和10.7%(6/56)、13.8%(8/58)和53.6%(30/56),差异均有统计学意义(χ2=6.56,P=0.010;χ2=20.29,P<0.01)。其中标准治疗组中15例治疗失败者转入耐多药治疗组治疗,其治疗成功率为73.3%(11/15)、死亡率6.7%(1/15);标准治疗组40例治愈者有2例在疗程结束6个月后复发,经药物敏感性试验再次确诊为MDR-PTB。结论 初治MDR-PTB 患者采用12H-R-Z-E标准化疗方案治疗在治疗成功率、患者失访率方面与“延迟”进行耐多药治疗(初始未采用耐多药治疗方案,无效后使用)的患者差异无统计学意义,说明一线抗结核药物治疗初治MDR-PTB仍有一定的空间,延迟进行耐多药方案治疗不影响治疗效果,且分类治疗有助于患者减少药物不良反应和死亡率。
结核,肺; 结核, 抗多种药物性; 药物疗法, 联合; 治疗结果
据WHO[1]报道,2015年3.9%的新发结核病患者为耐多药结核病(multi-drug resistant tuberculosis,MDR-TB),在中国约6.6%的初治肺结核患者为耐多药肺结核(MDR-PTB),其绝对患者例数远多于复治肺结核,正确治疗初治MDR-PTB已经成为当前迫切需要解决的焦点问题之一。MDR-PTB是指肺结核患者感染的结核分枝杆菌(MTB)经体外药物敏感性试验(简称“药敏试验”)证实至少同时对异烟肼和利福平耐药,主要来源于耐多药结核分枝杆菌(MDR-MTB)的传播和获得性耐药[1-2]。MDR-TB的治疗疗程一般为18~24个月,其中强化期6个月。强化期内至少使用4种有效的二线抗结核药物(含一种注射类抗结核药物)和吡嗪酰胺,对于病变范围广泛或强化期末痰菌仍阳性者,强化期注射用药可延长至8个月[3-4]。尽管长疗程地使用昂贵的二线抗结核药物,MDR-TB的治疗成功率仍较低。据WHO报道,全球MDR-TB治疗成功率仅为52%,且因疗程长、费用昂贵、药物不良反应大,导致失访率(15%)及死亡率(17%)均较高[1]。但是,经初步研究发现,抗结核治疗用药史的不同可直接影响MDR-TB的治疗效果[5]。是否一线抗结核药物在初治MDR-PTB的治疗中仍有一定的应用空间?针对这个问题,笔者于2011年1月针对上海市初治MDR-PTB患者进行了前瞻性临床治疗研究。
对象和方法
一、研究对象
1.对象选择:对2011年1月至2013年12月上海市登记的所有肺结核患者采用“全面筛查”方式,将所有首次痰培养鉴定为MDR-MTB的具有上海市户籍或获得上海市居住证并自愿签订知情同意书的初治MDR-PTB患者纳入本次研究。研究经同济大学附属上海市肺科医院伦理委员会批准。
2.患者分组:经上海市MDR-PTB防治专家组集体分析讨论后对研究对象进行治疗分组[6]。(1)初治标准方案(12H-R-Z-E)治疗组(简称“标准治疗组”):对初治MDR-PTB患者以初治标准方案(12H-R-Z-E)治疗2个月(强化期),显效者(连续2个月痰涂片阴性且影像学检查发现病灶无恶化者)完成12H-R-Z-E方案治疗;(2)耐多药方案治疗组(简称“耐多药治疗组”):对初治MDR-PTB患者以初治标准方案(H-R-Z-E)治疗2个月强化期无效者(初治标准方案治疗第1个月末或第2个月末痰涂片阳性者,或前述2个治疗时间段痰涂片均为阳性者,或影像学检查发现病灶恶化),给予耐多药方案治疗。基本方案为6Cm-Lfx-Pto-PAS-Z/18Lfx-Pto-PAS-Z(Cm:卷曲霉素;Lfx:左氧氟沙星;Pto:丙硫异烟胺;PAS:对氨基水杨酸;Z:吡嗪酰胺[6])。
二、研究方法
1.采用全面筛查的方式:将上海市所有综合性医疗机构或社区卫生服务中心发现的疑似肺结核患者转诊至结核病定点医院,全部进行胸部X线摄影、痰涂片和痰培养检查;除上海市肺科医院对本院就诊的首次培养阳性菌株的患者进行链霉素(Sm)、异烟肼(INH)、利福平(RFP)、乙胺丁醇(EMB)的药敏试验和菌种鉴定,其他结核病定点医院培养阳性的菌株均送至上海市疾病预防控制中心结核病实验室进行药敏试验和菌种鉴定。
2.实验室检查方法:(1)痰标本MTB的分离、培养与菌种鉴定参照《结核病诊断细菌学检验规程》[7]。(2)应用BACTEC MGIT 960快速液体培养法检测搜集的MTB临床分离株,对Sm、INH、RFP、EMB(均为美国BD公司产品)进行药敏试验,所采用的药物浓度分别为1.0、0.1、1.0、5.0 mg/L,耐药比率>1%则认为受试菌对该药物耐药。
3.治疗期间观察项目:所有患者治疗期间每个月行痰涂片及痰培养检查1次,每2个月行胸部X线摄影或CT检查1次,每月行1~2次血常规、血电解质、肝功能、肾功能、血糖及尿常规检查。记录患者在治疗过程中出现的所有药物不良反应。
4.治疗转归:本研究采用《耐多药肺结核防治管理工作方案》[8]和《耐药结核病化学治疗指南(2015年版)》[6]推荐的转归定义。(1)治疗成功包括:①治愈:患者完成疗程,连续3次以上痰培养阴性,每次间隔至少30 d,且不伴有临床症状的加重;②完成治疗:患者完成疗程,但由于缺乏细菌学检查结果,未达到治愈的标准。(2)不良转归包括:①死亡:在治疗过程中由于任何原因导致死亡的患者;②失败:因严重药物不良反应导致被迫中止治疗或永久性更改治疗方案(更换方案中2种以上药物)或痰培养再次出现阳性并经药敏试验证实为耐多药或影像学检查发现病灶进展并排除感染等其他可能因素;③丢失:由于任何原因治疗中断连续2个月或以上者。(3)复发:痰培养连续2次阳性或痰培养1次阳性,菌种鉴定为MTB,药敏试验提示为耐多药,且影像学检查发现病灶较疗程结束时有进展经诊断性抗感染治疗后新增病灶无吸收或恶化者定义为复发。
5.治疗结束后随访:标准治疗组治疗成功的患者,在12个月疗程结束后进行随访,每次随访时复查痰涂片、痰培养、胸部X线摄影或CT扫描检查,每2个月随访1次,直至信息采集截止时平均随访16个月。耐多药治疗组患者在24个月疗程结束后未进行随访。
三、统计学分析
采用Excel 2007软件整理录入患者信息,使用SPSS 17.0软件进行统计学分析。计数资料的比较采用卡方检验;当理论频数<1时,采用Fisher确切概率法检验,以P<0.05为差异有统计学意义。
结 果
1.初治MDR-PTB患者的一般情况:上海市2011年1月至2013年12月期间共登记初治肺结核病患者19 062例,其中168例(0.9%)患者检出MDR-MTB,符合入组标准者114例,筛选及分组治疗流程见图1。初治MDR-PTB患者中耐多药治疗组与标准治疗组治疗成功与治疗失败在年龄、性别、耐药情况等方面分布差异均无统计学意义;其中57.0%为20~40岁的青壮年,男∶女约为2∶1,52.6%的患者对Sm、INH、RFP、EMB均耐药,见表1。

表1 不同因素对114例初治MDR-PTB患者的影响情况
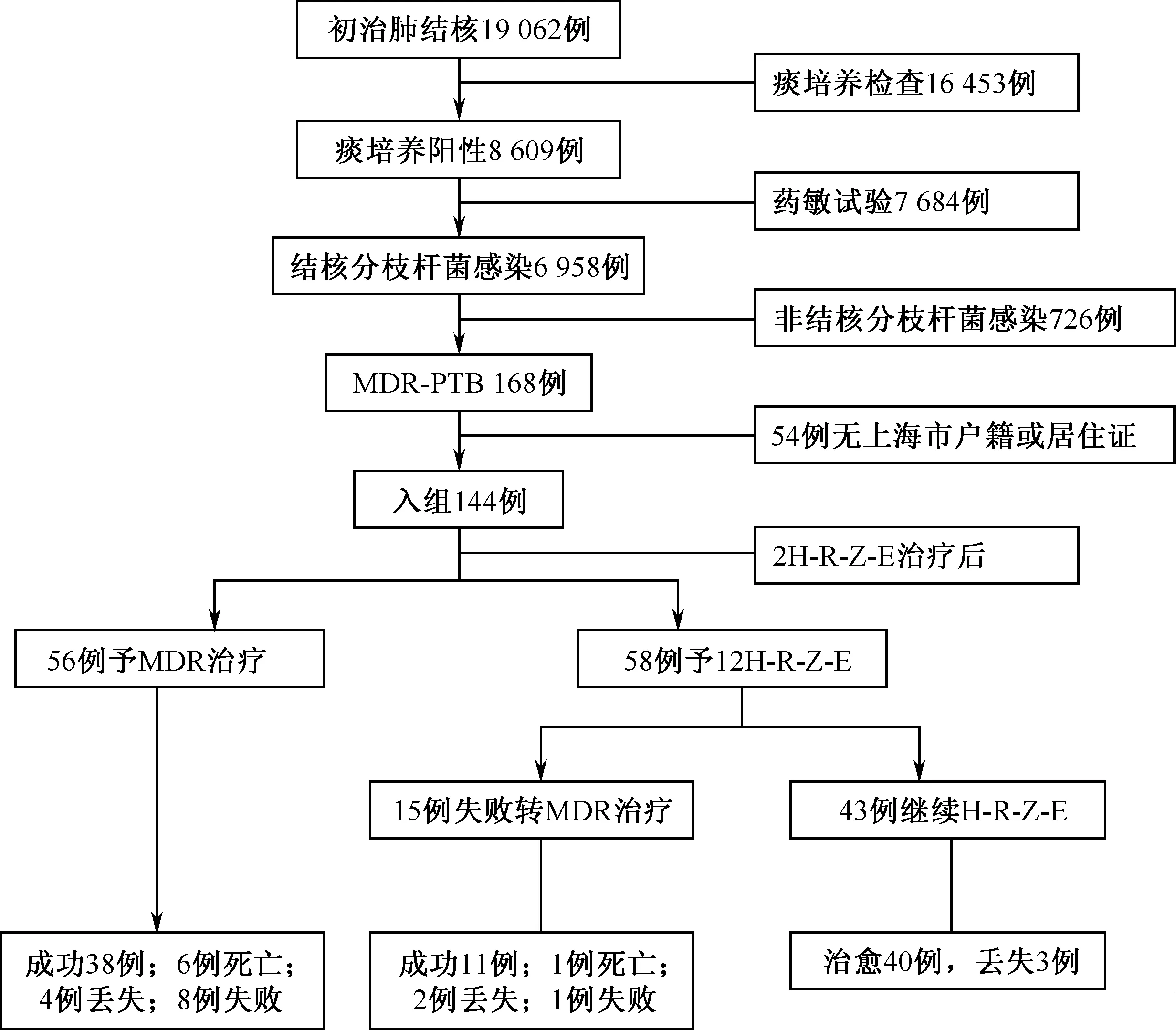
图1 初治耐多药肺结核患者的筛选及分组治疗流程图
2.初治MDR-PTB治疗耐药情况分析:标准治疗组和耐多药治疗组的耐药情况虽然存在一定的差异,但差异无统计学意义(χ2=6.74,P=0.080)。标准治疗组40例治愈,15例治疗失败,治愈与治疗失败患者的耐药情况也存在一定差异,但差异亦无统计学意义(χ2=6.28,P=0.099),见表1。
3.初治MDR-PTB患者治疗及转归情况(表2):标准治疗组和耐多药治疗组患者治疗成功率、丢失率差异均无统计学意义(χ2=0.01,P=0.899;χ2=0.66,P=0.192)。标准治疗组死亡率明显低于耐多药治疗组,标准治疗组失败率明显高于耐多药治疗组,差异均有统计学意义(χ2=6.56,P=0.010;χ2=2.37,P=0.124)。标准治疗组中有15例治疗失败者转为耐多药方案治疗,其中9例(60.0%)治愈,2例(13.3%)完成治疗,死亡与失败各1例(6.7%),丢失2例。标准治疗组40例治愈者2例患者在疗程结束6个月后复发,经药敏试验确诊为MDR-PTB。
4.药物不良反应:耐多药治疗组的患者出现药物不良反应的发生率为53.6%(30/56),主要表现为肝功能损伤(血清转氨酶升高)和胃肠道反应(胃部不适、恶心、食欲减退等),以及关节酸痛、耳鸣、血小板减少、尿常规异常、皮疹等,以肝功能损伤为最多(表3);标准治疗组患者出现药物不良反应的发生率为13.8%(8/58),主要有肝功能损伤(血清转氨酶升高)和白细胞减少以及关节酸痛。两组不良反应发生率的差异具有统计学意义(χ2=20.29,P<0.01)。

表2 不同转归情况在标准组与耐多药组患者中的分布

表3 两组患者的药物不良反应发生情况
讨 论
一、 应用一线抗结核药物可以治愈部分MDR-PTB 患者
以往一些学者发现应用一线抗结核药物可以治愈部分MDR-PTB患者[6-8]。张日东等[9]应用2~3 H-R-Z-E(S)/4~7 H-R-E方案治疗16例初治MDR-PTB患者,疗程结束时痰菌阴转率达到87.5%,肺部病灶吸收有效率达75.0%,肺部空洞闭合及缩小率达69.2%;王甦民等[10]在耐药监测中发现应用2H-R-Z-S/4H-R方案治疗62例MDR-PTB患者,治愈率可达88.7%;李群等[11]发现应用标准初治方案治疗36例初治MDR-PTB患者,治愈率为72.0%。本次研究对于首次痰培养鉴定为MDR-MTB的初治肺结核患者进行了标准初治方案强化期2个月的疗效评估,58例显效者继续维持H-R-Z-E治疗至12个月,无效者给予耐多药方案治疗。结果表明,标准组治愈率高达69.0%,疗效明显,仅有2例在疗程结束后6个月复发。
二、应用一线抗结核药物治疗部分MDR-PTB患者有效的机制
本研究显示,在抗结核药物治疗过程中已经产生耐药的肺结核患者仍可获得较高的治愈率[9-11],其原因可能为以下几个方面:首先,在试管和宿主体内两个系统中,药物代谢、细菌行为及环境等因素存在本质的差别。(1)在试管系统中,药物是单药,且一次加入;而在患者体内,往往是多种药物、多次服用,因此会出现药物协同和蓄积效应。(2)药物在体内和体外的衰减过程也不同,在试管内的衰减是氧化还原反应所致,而在体内则存在一些药物失活机制(如肝细胞P450药物代谢酶的作用等),药物增益效应(如RFP的肝肠循环增加了可吸收的药物浓度及巨噬细胞内药物富集等)。(3)体外药敏试验是单纯的细菌与药物的相互作用;而在宿主系统中,细菌面临着巨噬细胞、保护性免疫因子等免疫学系统压力,且体内还存在干酪样、纤维化组织的药物微代谢动力学,增加了药物行为的复杂性。(5)在患者体内,细菌群体处于自然多态,至少存在非同步的活性生长代谢菌和休眠菌等不同状态的菌群,各种状态间往往出现相互转换;而试管系统的接种物通常是一定数量的对数期代谢活性培养物[12]。因此,一个简单的体外试管药敏测验系统无法真正模拟体内复杂的药物代谢、细菌生长及药物与细菌的相互作用过程。其次,常规药敏试验本身就存在系统误差和实验误差,如建立临界值时所用临床分离培养物数目的多寡,阈值的人为确定,接种菌量难以标化,耐药判定系统的人为因素等。重复和解读一些最低抑菌浓度(MIC)和临界药物浓度相近的药敏试验结果更为困难[13]。
三、本次研究结果分析
因本研究的意义在于研究12H-R-Z-E标准方案治疗初治MDR-PTB的近期及远期疗效,故只进行标准治疗组治疗成功者的复发情况随访。本研究中标准治疗组和耐多药治疗组患者治疗成功率、失败率比较差异均无统计学意义,各类耐药发生情况的差异也无统计学意义。且标准治疗组中15例治疗失败而转为耐多药方案治疗,最终9例治愈,2例完成治疗,治疗成功率仍然高达73.3%,说明该部分患者并未因延迟进行耐多药方案治疗而影响治疗效果。Harris等[14]对64篇文献的研究结果进行了系统分析,并未发现及早治疗(≤4周)和延后治疗(>4周)对于MDR-TB和广泛耐药结核病(XDR-TB)的治疗结果有任何影响,与本研究相符。
本研究还发现应用12H-R-Z-E方案治疗患者的死亡率及失访率均低于接受耐多药方案治疗的患者。后者死亡率高达10.7%,而前者为0,两组数据的差异有统计学意义;失访率同样是后者(7.1%)高于前者(5.2%),但差异无统计学意义;耐多药治疗组的患者出现药物不良反应的发生率明显高于标准治疗组,差异具有统计学意义。以上情况的发生可能与耐多药方案疗程长,注射用药时间长、二线抗结核药物的不良反应多、价格昂贵不能坚持治疗等因素有关。
综上所述,本研究首次提出对于初治MDR-PTB患者采用分类治疗的方法,研究结果提示:一线抗结核药物治疗初治MDR-PTB仍有一定的空间;初治MDR-PTB的分类治疗方法有助于患者获得更合理的治疗,有助于减少不必要的药物不良反应,有助于提高患者的治疗依从性;初治MDR-PTB患者延迟进行耐多药方案治疗不影响治疗效果。
本研究中尚存在以下不足之处:纳入研究的患者例数偏少,故所得结论有待在后续多中心大样本的研究中得到进一步证实;因部分患者未行二线抗结核药物的药敏试验,故部分XDR-TB患者未予以剔除,可能对研究结论的准确性有一定的影响;患者本身的免疫因素及病灶的严重程度可能对治疗效果也有一定的影响,本研究未包含上述两项内容的调查。当然,本文仅提供了该研究的阶段性资料和结果,研究还在继续中,今后将会有更多的研究信息展现。
志谢 上海市耐多药肺结核防治管理模式的建立和运行受到了上海市耐多药肺结核病诊治、防控专家组,以及全市结核病定点医院、各区县疾病预防控制中心、社区卫生服务中心工作人员的大力支持
[1] World Health Organization. Global tuberculosis report 2016. Geneva: World Health Organization, 2016.
[2] Gandhi NR, Nunn P, Dheda K, et al. Multidrug-resistant and extensively drug-resistant tuberculosis: a threat to global control of tuberculosis. Lancet,2010,375(9728):1830-1843.
[3] World Health Organization. Guidelines for the programmatic management of drug-resistant tuberculosis, 2011. Geneva: World Health Organization, 2013.
[4] Mukherjee JS, Rich ML, Socci AR, et al. Programmes and principles in treatment of multidrug-resistant tuberculosis. Lancet, 2004, 363(9407):474-481.
[5] 吴哲渊,张青,张祖荣,等.上海市耐多药肺结核防治管理模式效果评价.中国防痨杂志, 2015, 37(11):1118-1125.
[6] 肖和平. 耐药结核病化学治疗指南(2015年). 北京: 人民卫生出版社, 2015.
[7] 中国防痨协会.结核病诊断细菌学检验规程.中国防痨杂志, l996,18(1):28-31;18(2):80-85.
[8] 王宇. 耐多药肺结核防治管理工作方案. 北京: 军事医学科学出版社, 2012.
[9] 张日东,陈小燕,吴智龙.40例初治复治耐多药肺结核临床疗效分析. 临床肺科杂志,2009,14(4):471-472.
[10] 王甦民,王雪静,赵新平,等.浙江、广东省耐药监测项目中耐药肺结核治疗现况研究.中国防痨杂志,2005,27(6):370-373.
[11] 李群,王晓萌,何海波,等.WHO浙江省结核病耐药监测研究报告.中华结核和呼吸杂志,2000,23(12):718-721.
[12] 潘毓萱.结核分枝杆菌持留性和持留菌的界定.中华结核和呼吸杂志,2004,27(4):264-266.
[13] 潘毓萱,陆宇.《结核分枝杆菌持留性、潜伏性和药物耐受性》一文读后感.中华结核和呼吸杂志,2005,28(2):141-143.
[14] Harris RC, Grandjean L, Martin LJ, et al. The effect of early versus late treatment initiation after diagnosis on the outcomes of patients treated for multidrug-resistant tuberculosis: a systematic review. BMC Infect Dis,2016,16:193.
(本文编辑:孟莉 范永德)
Treatment of newly diagnosed multi-drug resistant pulmonary tuberculosis: a prospective clinical study
YANLi-ping*,WUZhe-yuan,ZHANGZu-rong,SHAWei,CHENJing,PANQi-chao,SHENXin,YUANZheng-an,ZHANGQing,XIAOHe-ping.
*ClinicandResearchCenterofTuberculosis,ShanghaiKeyLabofTuberculosis,ShanghaiPulmonaryHospital,TongjiUniversitySchoolofMedicine,Shanghai200433,ChinaCorrespondingauthors:XIAOHe-ping,Email:xiaoheping_sars@163.com;ZHANGQing,Email:zhqi709851@sohu.com
Objective To discuss whether first-line anti-tuberculosis drugs could still be used to treat newly diagnosed multi-drug resistant pulmonary tuberculosis (MDR-PTB) and to provide evidence for treatment of newly-diagnosed MDR-PTB correctly. Methods From January 2011 to December 2013, all 19 042 registered PTB patients in Shanghai were screened. 168 newly diagnosed MDR-PTB patients were found, among whom 114 patients who has household registration in Shanghai or temporary residential permit of Shanghai were enrolled in the study and their informed consent had signed. Standard original chemotherapy regimen was given for each MDR-PTB patient designed by the expert panel. The group was divided by the treatment effect in the intensive phase. The standard group with 12H-R-Z-E regimen had a favorable treatment reaction. And the MDR-PTB group with 6Cm-Lfx-Pto-PAS-Z/18Lfx-Pto-PAS-Z had a unfavorable treatment reaction at the end of the intensive phase. In standard treatment group, patients with a favorable treatment were followed up every 2 months after the period of treatment, and the average follow-up period was 16 months. The success rate of treatment, the loss rate of patients, mortality rate and incidence of adverse drug reactions were observed in 2 groups. Results The success rate of treatment and the loss rate of patients in two groups was 69.0% (40/58),67.9% (38/56)and 5.2% (3/58),7.1% (4/56), respectively. The difference was not statistically significant (χ2=0.01,P=0.899;χ2=0.66,P=0.192). The mortality rate and incidence of adverse drug reactions in two groups was 0.0%,10.7% (6/56) and 13.8% (8/58),53.6% (30/56),respectively. The difference was statistically significant (χ2=6.56,P=0.010;χ2=20.29,P<0.01). 15 (25.9%) patients in standard group were transferred to MDR-PTB regimen. Out of them, 73.3% (11/15) were cured,one patient died.Relapse happened in 2 patients of standard group 6 months after the end of the course of treatment with DST result of MDR-PTB again. Conclusion First-line drugs can still be used in the treatment of some newly diagnosed MDR-PTB patients because of the similar treatment effect in first-line drugs and delayed treatment. The classification treatment of newly diagnosed MDR-PTB patients make patients get reasonable treatment, reduce unnecessary adverse drug reactions and improve patient compliance.
Tuberculosis,pulmonary; Tuberculosis, multidrug-resistant; Drug therapy, combination; Treatment outcome
10.3969/j.issn.1000-6621.2017.01.010
“十二五”国家科技重大专项(2013ZX10004903;2013ZX10003009);上海市卫生系统优秀人才培养计划(XYQ2011051)
200433 同济大学附属上海市肺科医院结核科 上海市结核病(肺)重点实验室(闫丽萍、沙巍、张青、肖和平);上海市疾病预防控制中心结核病防治科(吴哲渊、张祖荣、陈静、潘启超、沈鑫、袁政安)
肖和平,Email:xiaoheping_sars@163.com;张青,Email: zhqi709851@sohu.com
2016-11-09)
注:闫丽萍与吴哲渊对本研究具有同等贡献,为并列第一作者

