蛇床子素对肾脏缺血-再灌注损伤的作用研究
赵佰桥,刘剑华
蛇床子素对肾脏缺血-再灌注损伤的作用研究
赵佰桥,刘剑华*
目的 探讨蛇床子素对肾脏缺血-再灌注损伤(Renal ischemia reperfusion injury,IRI)的作用及其机制。方法 通过夹闭左侧肾蒂并切除右肾的方法构建大鼠IRI模型。观察各组尿素氮(BUN)、血清肌酐(Cr)、肾脏病理形态、肿瘤坏死因子α(TNF-α)、单核细胞趋化蛋白-1(MCP-1)和白细胞介素-6(IL-6)、丙二醛(MDA)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GPx)和超氧化物歧化酶(SOD)的表达,评估蛇床子素对大鼠肾脏缺血-再灌注损伤的作用。结果 蛇床子素可增加CAT、GPx和SOD表达,减少Cr、BUN、MDA、TNF-α、MCP-1和IL-6的表达以及肾脏病理形态的改变。结论 蛇床子素可通过抑制炎症和氧化应激反应而减轻肾脏缺血-再灌注损伤。
蛇床子素;肾脏缺血-再灌注损伤;炎症;氧化应激
0 引言
肾脏缺血-再灌注损伤(Renal ischemia reperfusion,IRI)是临床上常见的危重症,严重影响肾功能乃至生命。随着肾脏移植、体外大循环手术和心脏移植等手术的广泛开展,其发病率越发增高,因此,减轻IRI具有重要的临床现实意义[1-4]。蛇床子素是从蛇床、欧前胡等传统中草药植物中提取的香豆素类物质[5-6],最新研究发现,其具有抗炎[7]、抗凋亡[8]、抗氧化应激[9]、抗肿瘤等生物学活性[10]。本实验探讨了蛇床子素对IRI的作用及机制,现将结果报道如下。
1 材料与方法
1.1 主要试剂和仪器 蛇床子素(Sigma,USA,经HPLC鉴定纯度超过99%)、水合氯醛(武汉谷歌)、白介素-6(IL-6),肿瘤坏死因子-α(TNF-α)、单核细胞趋化蛋白-1(MCP-1),ELISA检测盒(Ebioscience,USA),逆转录聚合酶链反应(RT-PCR)试剂盒购自美国GeneCopoeia公司,RT-PCR引物由擎科生物技术有限公司合成。显微镜(Olympus BX51)及成像系统(HITMAS-30)和HE染色均为连云港医院病理科提供。
1.2 实验动物分组和模型构建 50只雄性SD大鼠,体重(230±20)g,由北京华福康实验动物中心提供。放置在SPF动物饲养室内喂养。适应性喂养1周后,状态良好,随机分为假手术组(Sham组)、肾脏缺血-再灌注损伤组(IRI组)和蛇床子素(Osthole)预处理组,每组10只。Osthole组术前1 h给予蛇床子素腹腔注射(5、10、20 mg/kg)。Sham组和IRI组则给予等量生理盐水腹腔注射,IRI组和Osthole组施予肾缺血-再灌注手术。肾缺血-再灌注手术方式如下:大鼠水合氯醛麻醉状态下行腹部正中切口,游离组织,分离暴露肾蒂,用血管夹夹闭左侧肾蒂,纱布覆盖切口置于37 ℃温箱45 min,然后松开血管夹,恢复肾脏血流灌注,去除右侧肾脏,缝合腹部,术毕放回动物房。假手术组与上述方法类似,仅开腹而不夹闭左侧肾蒂。松开血管夹24 h后处死大鼠,收集血清和肾脏标本。实验中,动物状态较好,苏醒较快,无死亡动物,术后给予正常饮食饮水。具体手术方法参考文献[11]。
1.3 标本收集 各组大鼠在肾脏再灌注24 h后,行腹主动脉取血,室温下3 000 r/min离心10 min后,取上清液送仁和医院检验科检测血尿素氮(BUN)和血清肌酐(Cr)。开腹取左肾;三分之一肾置于多聚甲醛做石蜡切片,其余肾组织冻于-80 ℃冰箱保存。
1.4 肾脏病理检查 左肾蜡块4 μm切片,脱蜡透明后由病理科实验室行PAS染色,光镜下观察形态结构并评分。分级评分标准:损伤<10%,病理评分为0分;损伤10%~25%,病理评分为1分;损伤25%~50%,病理评分为2分;损伤50%~75%,病理评分为3分;损伤75%~100%,病理评分为4分,具体评分标准参考文献[11]。
1.5 RT-PCR检测肾脏促炎症细胞因子mRNA水平 采用RT-PCR法检测肾脏TNF-α、MCP-1和IL-6的mRNA表达水平。称取适量肾脏组织,于液氮中研磨成粉末状,提取总RNA,紫外分光光度计测量浓度。引物序列见表1。采用两步法PCR反应,扩增条件95 ℃预变性30 s;95 ℃变性5 s,60 ℃退火延伸1 min。共40个循环,得到每个样本的Ct(Cycle threshold)值法,用得到的各样本的Ct值按公式2-ΔΔCt计算相对表达量。
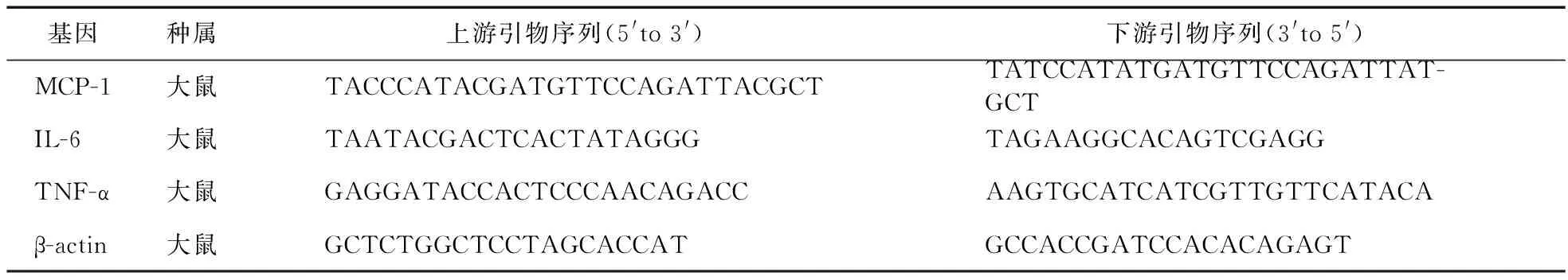
表1 基因引物序列
1.6 检测指标 按照ELISA试剂盒说明书操作步骤,检测血清中TNF-α、MCP-1和IL-6的蛋白表达水平。利用硫代巴比妥酸(Thiobarbituric acid,TBA)法检测肾组织丙二醛(Malondialdehyde,MDA)含量,按照说明书操作。按照试剂盒说明书,用比色法测定肾组织过氧化氢酶(Catalase,CAT)、谷胱甘肽过氧化物酶(Glutathione peroxidase,GPx)、超氧化物歧化酶(Superoxide dismutase,SOD)活性。
2 结果
2.1 蛇床子素对肾脏缺血-再灌注损伤的影响 与Sham组比较,IRI组Cr和BUN明显增加(P<0.05)。与IRI组比较,Osthole组Cr和BUN呈剂量依赖性降低(P<0.05),提示蛇床子素在5~20mg/kg的范围内,呈剂量依赖性减轻肾脏缺血-再灌注损伤,其最佳剂量为20mg/kg,见表2。
2.2 蛇床子素对肾脏病理改变的影响 与Sham组比较,IRI组肾小管上皮细胞裂解,肿胀,透明管型形成,肾小管扩张以及肾小管坏死明显增加,其损伤评分为(3.0±0.5)分,而Sham组为(0.5±0.5)分,提示病理改变明显增加(P<0.05)。
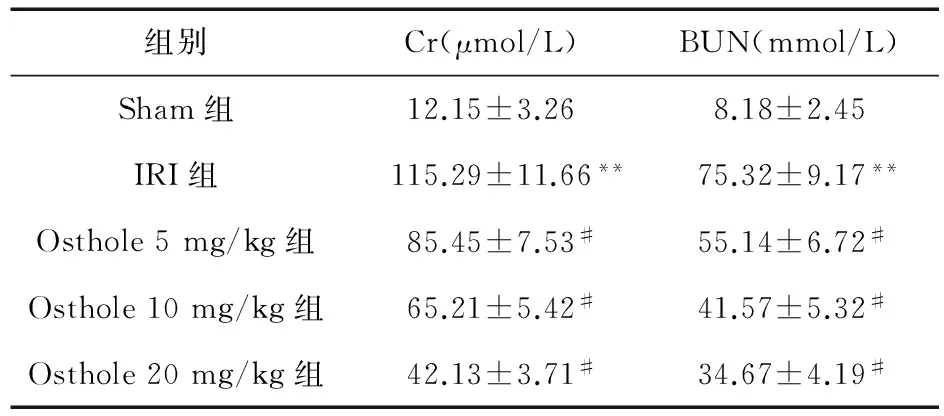
表2 蛇床子素对肌酐和尿素氮的影响
注:与Sham组比较,**P<0.01;与IRI组比较,#P<0.05
Osthole组与IRI组相比,肾小管上皮细胞裂解,肿胀,透明管型形成,肾小管扩张以及肾小管坏死明显减少,其损伤评分为(1.5±0.5)分,提示蛇床子素可明显减轻肾脏损伤(P<0.05)。蛇床子素在最佳浓度可明显减轻IRI导致的肾脏病理改变,见图1。

图1 PAS染色检测蛇床子素对肾脏形态的影响
2.3 蛇床子素对肾组织促炎症细胞因子表达的影响 与Sham组比较,IRI组肾脏TNF-α、MCP-1和IL-6 mRNA表达明显增加(P<0.05);与IRI组比较,Osthole 20 mg/kg组肾脏TNF-α、MCP-1和IL-6 mRNA表达明显减少(P<0.05),提示蛇床子素可减轻肾脏促炎症细胞因子的表达。见表3。

表3 蛇床子素对肾脏促炎症细胞因子mRNA表达水平的影响
注:与Sham组比较,**P<0.01;与IRI组比较,#P<0.05
2.4 蛇床子素对血清促炎症细胞因子分泌的影响 与Sham组比较,IRI组血清中TNF-α、MCP-1和IL-6表达水平明显增高(P<0.05)。与IRI组比较,Osthole 20 mg/kg组血清TNF-α、MCP-1和IL-6表达水平明显降低(P<0.05)。提示蛇床子素可减少促炎症细胞因子的分泌。见表4。

表4 蛇床子素对血清中促炎症细胞因子表达水平的影响(pg/mL)
注:与Sham组比较,**P<0.01;与IRI组比较,#P<0.05
2.5 蛇床子素对肾脏丙二醛含量的影响 与Sham组比较,IRI组MDA表达水平明显增高(P<0.05)。与IRI组比较,Osthole组MDA水平明显降低(P<0.05)。提示蛇床子素可明显减少促氧化应激酶丙二醛的表达,见表5。

表5 蛇床子素对肾脏MDA表达的影响
注:与Sham组比较,**P<0.01;与IRI组比较,#P<0.05
2.6 蛇床子素对肾脏氧化应激酶活性的影响 与Sham组比较,IRI组CAT、GPx和SOD活性明显降低(P<0.05)。与IRI组比较,Osthole组CAT、GPx和SOD活性明显增高(P<0.05)。提示蛇床子素可增加抗氧化应激酶的活性,见表6。

表6 蛇床子素对氧化应激酶CAT、GPx和SOD活性的影响(U/mg)
注:与Sham组比较,**P<0.01;与IRI组比较,#P<0.05
3 讨论
急性肾功能衰竭是临床上常见危重疾病,其最主要的致病原因是肾缺血-再灌注损伤。肾缺血-再灌注损伤是指肾脏在缺血的基础上,重新恢复肾脏血供导致肾脏损伤进一步加重的临床危象[1-2]。其好发于心脏移植、心脏体外大循环手术、休克患者等[3-4]。目前,对肾缺血-再灌注损伤的病理生理过程已经有较多研究,但尚缺乏有效的治疗方法。目前,对IRI的药物干预治疗研究主要集中在对动物模型进行实验研究,包括术前、术中和术后的药物干预研究。黄亮等[12]研究显示,表没食子儿茶素没食子酸酯(EGCG)术前给药,能减轻肾脏缺血-再灌注损伤,保护肾脏功能。此外,姜黄素单体术前给药也能减轻肾脏缺血-再灌注损伤[13]。蛇床子素具有抗炎、抗凋亡、抗氧化、抗肿瘤作用,可清除体内各种活性氧自由基[5],保护GPx、CAT、谷胱甘肽-S-转移酶等[6],对肠[14]、心[15]、脑[16]等器官缺血-再灌注损伤具有保护作用。因此,本研究选用蛇床子素对肾缺血-再灌注损伤大鼠术前用药,以探讨蛇床子素的保护作用及潜在机制。
既往大量研究显示,氧化应激、炎症反应、钙超载、中性粒细胞聚集、凋亡等是IRI重要的发病机制[1-4]。尽管目前构建肾脏缺血-再灌注损伤模型有夹闭双侧肾蒂以及单侧肾蒂两种方式,因单侧肾蒂夹闭更接近临床,因此,本研究选择夹闭左侧肾蒂,并切除右肾构建肾脏缺血-再灌注损伤模型。研究显示,肾脏缺血-再灌注损伤可明显减少CAT、GPx和SOD表达,但可明显增加Cr、BUN、MDA、TNF-α、MCP-1和IL-6的表达以及肾脏病理形态的改变,进一步证实了炎症和氧化应激是导致肾脏损伤的重要致病因素[1-4]。因此,抑制炎症和氧化应激可能是减轻IRI的有效治疗途径之一。本研究显示,蛇床子素术前给药,可明显增加CAT、GPx和SOD表达,减少Cr、BUN、MDA、TNF-α、MCP-1和IL- 6的表达以及肾脏病理形态的改变,提示蛇床子素可通过抑制炎症和氧化应激而减轻IRI。
综上所述,我们推测蛇床子素术前给药,可通过抑制炎症和氧化应激反应而减轻IRI。但除抑制炎症和氧化应激外,是否还有其他信号途径涉及蛇床子素减轻肾脏缺血-再灌注损伤,以及蛇床子素如何调节炎症和氧化应激,尚需进一步研究。
[1] Glodowski SD,Wagener G.New insights into the mechanisms of acute kidney injury in the intensive care unit[J].J Clin Anesth,2015,27(2):175-180.
[2] Chatauret N,Badet L,Barrou B,et al.Ischemia-reperfusion:from cell biology to acute kidney injury[J].Prog Urol,2014,24(Suppl 1):S4-S12.
[3] Malek M,Nematbakhsh M.Renal ischemia/reperfusion injury:from pathophysiology to treatment[J].J Renal Inj Prev,2015,4(2):20-27.
[4] Kusch A,Hoff U,Bubalo G,et al.Novel signalling mechanisms and targets in renal ischaemia and reperfusion injury [J].Acta Physiol (Oxf),2013,208(1):25-40.
[5] Zhang ZR,Leung WN,Cheung HY,et al.Osthole:a review on its bioactivities,pharmacological properties,and potential as alternative medicine[J].Evid Based Complement Alternat Med,2015:919616.
[6] Li YM,Jia M,Li HQ,et al.Cnidium monnieri:a review of traditional uses,phytochemical and ethnopharmacological properties[J].Am J Chin Med,2015,43(5):835-877.
[7] Wang XL,Shang X,Cui Y,et al.Osthole inhibits inflammatory cytokine release through PPARα/γ-mediated mechanisms in LPS-stimulated 3T3-L1 adipocytes[J].Immunopharmacol Immunotoxicol,2015,37(2):185-192.
[8] Li K,Ding D,Zhang M.Neuroprotection of osthole against cerebral ischemia/reperfusion injury through an anti-apoptotic pathway in Rats[J].Biol Pharm Bull,2016,39(3):336-342.
[9] Tsai YF,Yu HP,Chung PJ,et al.Osthol attenuates neutrophilic oxidative stress and hemorrhagic shock-induced lung injury via inhibition of phosphodiesterase 4[J].Free Radic Biol Med,2015,89:387-400.
[10]Wang L,Yang L,Lu Y,et al.Osthole induces cell cycle arrest and inhibits migration and invasion via PTEN/Akt pathways in osteosarcoma[J].Cell Physiol Biochem,2016,38(6):2173-2182.
[11]Jia Y,Zhao J,Liu M,et al.Brazilin exerts protective effects against renal ischemia-reperfusion injury by inhibiting the NF-κB signaling pathway[J].Int J Mol Med,2016,38(1):210-216.
[12]黄亮,刘建军,董丽华,等.表没食子儿茶素没食子酸酯对肾缺血再灌注损伤的保护作用[J].中国现代应用药学,2016,33(6):716-721.
[13]Najafi H,Changizi Ashtiyani S,Sayedzadeh SA,et al.Therapeutic effects of curcumin on the functional disturbances and oxidative stress induced by renal ischemia/reperfusion in rats[J].Avicenna J Phytomed,2015,5(6):576-586.
[14]Zhang Z,Pan C,Wang HZ,et al.Protective effects of osthole on intestinal ischemia-reperfusion injury in mice[J].Exp Clin Transplant,2014,12(3):246-252.
[15]Wang XY,Dong WP,Bi SH,et al.Protective effects of osthole against myocardial ischemia/reperfusion injury in rats[J].Int J Mol Med,2013,32(2):365-372.
[16]Li K,Ding D,Zhang M.Neuroprotection of osthole against cerebral ischemia/reperfusion injury through an anti-apoptotic pathway in rats[J].Biol Pharm Bull,2016,39(3):336-342.
Effect of osthole on renal ischemia reperfusion injury
ZHAO Bai-qiao,LIU Jian-hua*
(Department of Nephrology,Lianyungang First People′s Hospital,Lianyungang 222002,China)
Objective To study the effect of osthole on renal ischemia reperfusion injury(IRI) and its potential mechanism.Methods The model of IRI was induced by clamping the left renal pedicles with right nephrectomy.The effect of osthole on IRI was examined by evaluating the BUN,Cr,the morphology of kidney and the expression of TNF-α,IL-6,MCP-1,MDA,CAT,GPx and SOD.Results Osthole could significantly increase the expression of CAT,GPX and SOD while attenuating the morphological change of kidney and the expression of Cr,BUN,MDA,TNF-α,MCP-1 and IL-6.Conclusion Osthole can suppress renal ischemia reperfusion injury by reducing inflammation and oxidative stress
Osthole;Renal ischemia reperfusion injury;Inflammtion;Oxidative stress
2016-06-11
连云港市第一人民医院肾内科,江苏 连云港 222002
连云港市科技基金(A1302-31)
10.14053/j.cnki.ppcr.201701004
*通信作者

