A2AR/D2DR在运动调节帕金森病基底神经节功能紊乱中的作用研究进展
王 弘 乔德才 刘晓莉
(北京师范大学体育与运动学院,北京 100875)
A2AR/D2DR在运动调节帕金森病基底神经节功能紊乱中的作用研究进展
王 弘 乔德才 刘晓莉
(北京师范大学体育与运动学院,北京 100875)
腺苷A2A型受体;多巴胺D2型受体;帕金森病;纹状体;运动调控
帕金森病(PD)是一种神经系统退行性疾病,主要病理性改变为黑质致密部多巴胺(DA)能神经元变性、坏死,纹状体DA投射减少,引发黑质-纹状体通路对基底神经节的调节功能紊乱〔1〕。DA替代治疗在PD早期能够缓解其临床症状〔2〕,但随着病情发展,患者会对以左旋多巴(L-DOPA)为主的DA能抗PD药物产生耐药性、引发异动症等并发症〔3〕。近年来研究证实,腺苷A2A型受体(A2AR)拮抗剂具有增强多巴胺D2型受体(D2DR)活性的作用〔4〕,能有效缓解PD的临床症状〔5〕,且副作用较小〔6〕,迅速成为PD治疗的新策略。坚持规律运动可以减缓由于增龄引发A2AR活性增高的过程〔7,8〕,这可能与近年来文献报道的运动疗法显著改善PD 病人行为功能障碍有关,提示A2AR/D2DR在运动调节PD状态下基底神经节功能紊乱中起重要作用。
1 A2AR/D2DR与基底神经节运动调节环路
基底神经节是参与运动行为调控的皮层下中枢,它主要通过直接通路(direct pathway)与间接通路(indirect pathway)实现对运动功能的调节。直接通路是从包括尾状核和壳核在内的新纹状体(Str)向黑质网状部(SNr)和苍白球内侧部(GPi)发出单突触的γ-氨基丁酸(GABA)能神经投射,该通路激活会导致输出核团中神经元的抑制,从而使丘脑的抑制解除,并增强对运动皮层的兴奋性驱动。相反,GABA能纹状体-苍白球神经元是从纹状体到黑质网状部这一间接通路的起始端,它的兴奋会增强丘脑底核(STN)向黑质网状部投射的谷氨酸(Glu)能神经传递,继而增加对丘脑的抑制性输入,导致皮层的兴奋性驱动减少〔9〕。因此,间接通路的过度激活或直接通路与间接通路的平衡失调均可导致运动功能障碍。
纹状体是基底神经节直接与间接两条通路的起始部位,其神经元构筑约95%为GABA能中等多棘神经元(MSNs),其余为大胆碱能无棘中间神经元和快放电中间神经元。MSNs分为两类:即表达D1DR的GABA能强啡肽神经元和表达D2DR 的GABA能脑啡肽神经元〔10〕。纹状体MSNs树突棘的“头”接收来自大脑皮层Glu能的兴奋性投射,而树突棘的“颈部”接受来自黑质致密部的DA能投射〔11〕。黑质-纹状体通路的DA信号可通过上述解剖结构调节Glu能突触传递、激活直接通路(D1-MSNs介导)和抑制间接通路(D2-MSNs介导)发挥对运动的调控功能。
腺苷是一种内源性嘌呤核苷酸,分布于哺乳动物的多种组织中,它作为一种神经调质参与多种神经递质的释放或突触后神经元电活动的调节,被认为是调节神经系统稳态的重要物质。腺苷有4种受体亚型,分别是A1、A2A、A2B和A3,存在于中枢神经系统以及心脏、肾脏、睾丸等不同组织,A2AR在基底神经节纹状体、苍白球外侧部分布密度较高〔12〕。逆转录多聚酶链反应技术检测结果表明,A2AR mRNA在皮层、杏仁核、海马、丘脑、小脑等部位也有低水平表达〔13〕。单克隆抗体超微结构分析结果显示,A2AR多分布于突触后膜,少量分布于突触前膜;位于突触前的A2AR起负反馈调节作用,抑制Ca2+内流及神经递质的释放,而位于突触后的A2AR通过与其他受体形成二聚体发挥生物作用〔14〕。纹状体D2-MSNs的胞膜上〔15〕、皮层-纹状体Glu能神经元的轴突末梢和纹状体-苍白球外侧部GABA能神经元的轴突末梢都分布有A2AR-D2DR异源二聚体,见图1。
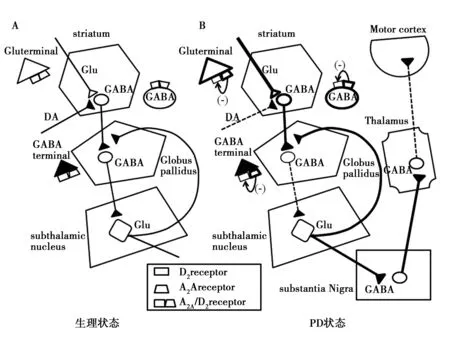
A:生理状态,B:PD状态;实线的加粗表示兴奋性或抑制性变强,虚线表示变弱图1 PD基底神经节A2AR/D2DR共定位及运动环路活性变化模式图
A2AR/D2DR都属于胞膜上的一种G蛋白耦联受体(GPCR),通过变构与配体结合或与其他受体相互作用形成多聚体聚合物,后者又被称为受体群岛或受体马赛克,具有不同的生物化学效能〔16~19〕。本实验室前期研究表明,A2AR/D2DR共表达于纹状体D2-MSNs 的胞膜上,运动过程中A2AR与D2DR通过独立或相互作用影响各自配体与受体结合,对腺苷酸环化酶(AC)产生互为拮抗的作用,生成环磷酸腺苷(cAMP),调节蛋白激酶(PK)A活性,最终影响纹状体内细胞信号整合因子 DARPP-32 的磷酸化〔20〕,这一DA和cAMP调节的磷蛋白可被钙调磷酸酶(PP-2B)去磷酸化,起到抑制胞外Ca2+内流的作用〔21〕。激活A2AR可兴奋纹状体-苍白球通路的GABA能神经元、激活间接通路,从而起到抑制运动的作用。相反,激动D2DR可抑制纹状体-苍白球通路的GABA能神经元、抑制间接通路,从而起到易化运动的作用,见图2。
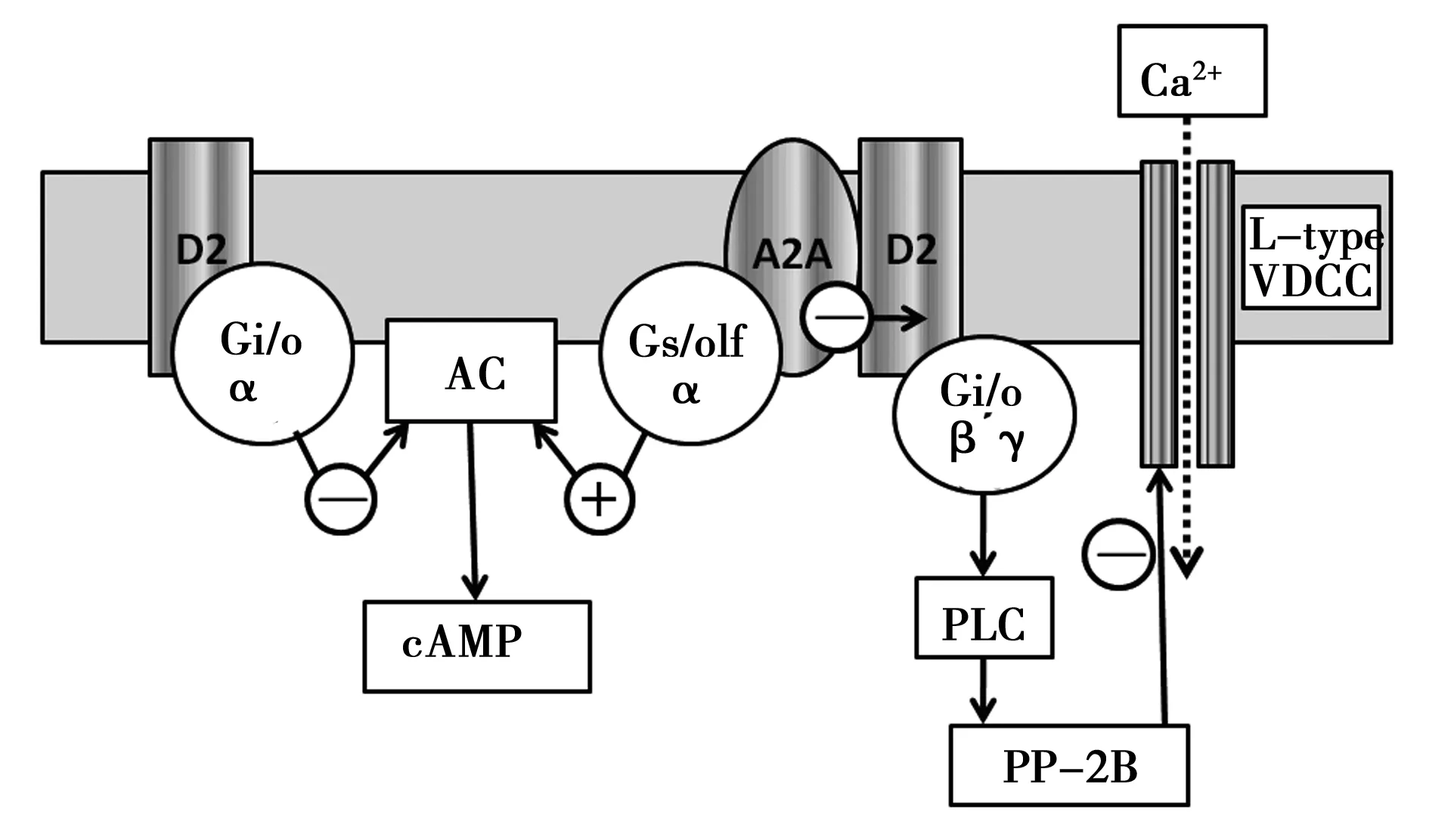
+:兴奋作用,-:抑制作用图2 纹状体A2AR/D2DR胞内信号转导机制模式图
2 A2AR/D2DR与PD
研究表明,PD状态下纹状体A2AR mRNA表达显著升高〔22,23〕、D2DR密度显著降低〔24〕。核磁共振成像(MRI)结果表明,PD患者接受A2AR拮抗剂SYN115治疗后,丘脑血流量显著下降,说明苍白球外侧部对丘脑的过度抑制得到明显缓解〔25〕。研究还发现,PD患者采用A2AR拮抗剂治疗后,能够有效缓解L-DOPA药物毒作用引发的异动症等并发症〔26,27〕,表明L-DOPA和A2AR拮抗剂的协同作用对PD治疗有重要的临床意义〔28〕。此外,新近的研究证实,拮抗A2AR对DA能神经元具有保护作用。Fox等人发现,A2AR拮抗剂可抑制单胺氧化酶的活性,减轻神经毒素MPTP对黑质DA能神经元的损伤〔29,30〕。有研究发现,A2AR参与DA合成代谢的调节,咖啡因和A2AR拮抗剂MSX-3均可促进PD模型动物纹状体DA合成限速酶酪氨酸羟化酶(TH)的合成〔31,32〕。
PD状态下纹状体DA的损耗和丢失对皮层-纹状体Glu能突触传递产生去抑制作用〔33,34〕,增强了该通路Glu能突触传递效能,因此Glu的兴奋性毒作用也是导致PD状态下出现行为功能障碍和异动症等并发症的原因之一〔35〕。A2AR和mGluR5在皮层-纹状体Glu能突触末梢共定位,A2AR对纹状体Glu能神经输入也具有调节作用〔36〕,阻断A2AR能减少皮层Glu的释放和纹状体Glu的内流〔29〕。Peterson等〔37〕的研究表明,A2AR拮抗剂SCH-58261可以显著改善DA缺失小鼠D2-MSNs的兴奋性、抑制突触后电流、减轻Glu的兴奋性毒性作用。近来有人利用光遗传技术进一步证实,用光刺激注射了荧光蛋白标记的腺病毒ChR2的野生型小鼠纹状体 D2-MSNs时,出现了震颤等PD症状且行走和精细动作显著减少,而双侧光照纹状体D1-MSNs则震颤现象得到缓解,与静止相比,行走等运动的时长所占总时长的百分比明显增加,初步证实了PD病理状态下间接通路兴奋性升高、直接通路兴奋性降低可能是导致行为功能障碍的原因,并提出激活直接通路可以作为今后PD的一种治疗方案〔38〕。
3 A2AR/D2DR在运动改善PD基底神经节功能紊乱中的作用
流行病学调查发现,体力活动能够提高PD患者的日常生活能力,降低PD的发生率和致死率〔8〕。PD患者通过太极拳〔39〕、探戈和拳击〔40〕等运动可明显改善行为功能障碍。大量的研究证实,运动防治PD的神经生物学机制与运动的神经保护作用有关〔41〕。Gerecke等〔42〕的研究表明,跑轮运动可降低PD模型大鼠黑质DA能神经元的死亡率;Yoon等〔43〕对6-OHDA模型大鼠连续进行30min/d、14d的跑台运动训练后发现,黑质-纹状体DA神经元的损伤程度明显降低;Tillerson等〔44〕的研究发现,6-OHDA模型大鼠进行运动干预后,黑质和纹状体区域的TH阳性表达均明显提高;Fisher等〔45〕的研究发现,MPTP小鼠接受运动训练后,纹状体多巴胺转运体(DAT)表达下降,而D2DR表达增加;采用同位素标记的受体显像技术观察发现,运动增加PD小鼠纹状体D2DR结合潜能〔46〕。本实验室前期研究也表明,4周跑台运动可上调6-OHDA大鼠纹状体D2DR表达水平〔35〕;抑制黑质DA能神经元的放电频率和爆发式放电活动,改善黑质-纹状体DA能通路的功能〔47〕。上述结果可能均与运动的神经保护作用调节了黑质-纹状体DA能神经传递过程有关。有关运动防治PD的神经可塑性机制也有相关文献报道,他们大多数集中在纹状体MSNs的突触可塑性方面。Toy等〔48〕的研究表明,持续6周的递增负荷跑台运动可明显增加MPTP 小鼠纹状体MSNs突触后致密物和突触囊泡的数量,并明显增加MSNs树突棘分支和密度;本实验室前期研究也发现,4周跑台运动干预,明显减少了PD模型大鼠纹状体MSNs树突棘的脱落〔49〕;降低了纹状体Glu能突触活性,抑制了皮层-纹状体Glu能通路的过度兴奋,显著改善了皮层-纹状体突触可塑性〔50〕。
众所周知,咖啡因是一种中枢神经系统兴奋剂〔51〕,补充咖啡因能够促进高强度运动能力和运动表现力〔52〕,缩短大强度运动后疲劳的恢复时间,有利于提高耐力和抗疲劳能力〔53〕。有研究发现,咖啡因摄取量与PD发病呈负相关〔54〕;6-OHDA模型大鼠给予两周低剂量咖啡因治疗后自主行为活动明显改善,A2AR拮抗剂也有类似的作用效果〔55〕。目前的研究已经证实,咖啡因是一种非特异性腺苷受体拮抗剂,进入体内后通过抑制纹状体A2AR的活性,下调苍白球外侧部GABA水平,使丘脑底核的兴奋性减弱,对皮层起到去抑制作用,从而达到改善PD大鼠行为功能和运动障碍的效果〔56〕。由此推测,运动改善PD大鼠行为功能障碍的机制可能是通过纹状体D2-MSNs胞膜上的A2AR/D2DR相互作用,抑制A2AR或激活D2DR的活性,纠正PD状态下纹状体-苍白球通路GABA神经元的过度兴奋,抑制间接通路的活性,调节了基底神经节功能紊乱。但目前仍缺乏直接的实验证据,有待进一步研究考证。
4 小 结
A2AR/D2DR共存于基底神经节纹状体D2-MSNs突触后膜,通过变构与配体结合或与其他受体相互作用形成多聚体聚合物调节突触后神经元功能。A2AR拮抗D2DR的表达是导致间接通路过度激活的重要原因,这与PD状态下运动障碍发生密切相关。运动可能通过抑制A2AR或激活D2DR的活性,纠正PD状态下纹状体-苍白球通路GABA神经元的过度激活,调节间接通路的兴奋性和基底神经节直接与间接通路的平衡,达到改善PD病人行为功能障碍的治疗效果。A2AR可能成为今后运动干预防治PD研究的新靶向。
1 Chou KH,Lin WL,Lee PL,etal.Structural covariance networks of striatum subdivision in patients with Parkinson's disease〔J〕.Human Brain Mapping,2014;36(4):1567-84.
2 Paolo C,Massimiliano DF,Antongiulio G,etal.New Synaptic and Molecular Targets for Neuroprotection in Parkinson's Disease〔J〕.Mov Disord,2013;28(1):51-60.
3 Raja M,Bentivoglio AR.Impulsive and compulsive behaviors during dopamine replacement treatment in Parkinson's Disease and other disorders〔J〕.Curr Drug Saf,2012;7(1):63-75.
4 Patrick H,Mark S.Adenosine A2A Antagonists in Parkinson's Disease:What's Next?〔J〕.Curr Neur Neurosci Rep,2012;12(4):376-85.
5 Yoshikuni M,Tomoyoshi K.Adenosine A2A receptor antagonist istradefylline reduces daily OFF time in Parkinson's disease〔J〕.Mov Disord,2013;28(8):1138-41.
6 Uchida S,Tashiro T,Kawai-Uchida M,etal.The adenosine A2A-receptor antagonist istradefylline enhances the motor response of L-DOPA without worsening dyskinesia in MPTP-treated common marmosets〔J〕.J Pharmacol Sci,2014;124(4):480-5.
7 Costa MS,Ardais AP,Fioreze GT,etal.Treadmill running frequency on anxiety and hippocampal adenosine receptors density in adult and middle-aged rats〔J〕.Prog Neurol Psychopharmac Biol Psychiatry,2012;36(1):198-204.
8 Archer T,Fredriksson A,Johansson B.Exercise alleviates Parkinsonism:clinical and laboratory evidence〔J〕.Acta Neurol Scand,2011;123(2):73-84.
9 Calabresi P,Picconi B,Tozzi A,etal.Direct and indirect pathways of basal ganglia:a critical reappraisal〔J〕.Nat Neurosci,2014;17(8):1022-30.
10 Gerfen CR,Engber TM.D1 and D2 dopamine receptor-regulated gene expression of striatonigral and striatopallidal neurons〔J〕.Science,1990;250(4986):1429-32.
11 Deutch AY,Colbran RJ,Winder DJ.Striatal plasticity and medium spiny neuron dendritic remodeling in parkinsonism〔J〕.Parkinson Relat Disord,2007;13 Suppl 3(8):S251-S258.
12 Ferré S,Bonaventura J,Tomasi D,etal.Allosteric mechanisms within the adenosine A2A-dopamine D2 receptor heterotetramer〔J〕.Neuropharmacology,2016;104:154-60.
13 Lee YC,Chien CL,Sun CN,etal.Characterization of the rat A2A adenosine receptor gene:a 4.8-kb promoter-proximal DNA fragment confers selective expression in the central nervous system〔J〕.Eur J Neurosci,2003;18(7):1786-96.
14 Zuzana J,Redhi GH,Goldberg SR,etal.Differential effects of presynaptic versus postsynaptic adenosine A2A receptor blockade on Δ9-tetrahydrocannabinol(THC)self-administration in squirrel monkeys〔J〕.J Neurosci,2014;34(19):6480-4.
15 Fernández-Dueas V,Taura JJ,Cottet M,etal.Untangling dopamine-adenosine receptor-receptor assembly in experimental parkinsonism in rats〔J〕.Dis Mode Mech,2015;8(1):57-63.
16 Ferré S.The GPCR heterotetramer:challenging classical pharmacology〔J〕.Trend Pharmacol Sci,2015;36(3):145-52.
17 Ferré S,Casadó V,Devi L A,etal.G Protein-coupled receptor oligomerization revisited:functional and pharmacological perspectives〔J〕.Pharmacol Rev,2014;66(2):413-34.
18 Maurice P,Kamal M,Jockers R.Asymmetry of GPCR oligomers supports their functional relevance〔J〕.Trend Pharmacol Sci,2011;32(9):514-20.
19 Smith NJ,Milligan G.Allostery at G protein-coupled receptor homo- and heteromers:uncharted pharmacological landscapes〔J〕.Pharmacol Rev,2010;62(4):701-25.
20 刘 军,刘晓莉,乔德才.纹状体神经元的生理功能及其对运动中枢疲劳调控研究进展〔J〕.天津体育学院学报,2014;29(2):161-4.
21 Zhen Q,Miller GW,Voit EO.The internal state of medium spiny neurons varies in response to different input signals〔J〕.System Biol,2010;4(11):26.
22 Varani K,Vincenzi F,Tosi A,etal.A2A adenosine receptor overexpression and functionality,as well as TNF-alpha levels,correlate with motor symptoms in Parkinson's disease〔J〕.FASEB J,2010;24(2):587-98.
23 Hodgson RA,Bedard PJ,Varty GB,etal.Preladenant,a selective A(2A)receptor antagonist,is active in primate models of movement disorders〔J〕.Experiment Neurol,2010;225(2):384-90.
24 Blesa J,Przedborski S.Parkinson's Disease:animal models and dopaminergic cell vulnerability〔J〕.Front Neuroanat,2014;8(1):155.
25 Black KJ,Koller JM,Campbell MC,etal.Quantification of indirect pathway inhibition by the adenosine A 2a antagonist SYN115 in Parkinson disease〔J〕.J Neurosci,2010;30(48):16284-92.
26 Ramlackhansingh AF,Bose SK,Ahmed I,etal.Adenosine 2A receptor availability in dyskinetic and nondyskinetic patients with Parkinson disease〔J〕.Neurology,2011;76(21):1811-6.
27 Mishina M,Ishiwata K,Naganawa M,etal.Adenosine A2A Receptors Measured with〔11 C〕TMSX PET in the Striata of Parkinson's Disease Patients〔J〕.PLoS One,2011;6(2):e17338.
28 Fuzzati-Armentero MT,Cerri S,Levandis G,etal.Dual target strategy:combining distinct non-dopaminergic treatments reduces neuronal cell loss and synergistically modulates l -DOPA-induced rotational behavior in a rodent model of Parkinson's disease〔J〕.J Neurochem,2015;134(4):740-7.
29 Fox SH.Non-dopaminergic treatments for motor control in Parkinson's disease〔J〕.Drugs,2013;73(13):1405-15.
30 Xu K,Xu YH,Chen JF,etal.Neuroprotection by caffeine:time course and role of its metabolites in the MPTP model of Parkinson's disease〔J〕.Neuroscience,2010;167(2):475-81.
31 Gammella E,Cairo G,Tacchini L.Adenosine A(2)A receptor but not HIF-1 mediates Tyrosine hydroxylase induction in hypoxic PC12 cells〔J〕.J Neurosci Res,2010;88(9):2007-16.
32 Machado-Filho JA,Correia AO,Montenegro ABA,etal.Caffeine neuroprotective effects on 6-OHDA-lesioned rats are mediated by several factors,including pro-inflammatory cytokines and histone deacetylase inhibitions〔J〕.Behav Brain Res,2014;264(5):116-25.
33 Max FO,Edmund WR,Merry CC,etal.D2 receptors receive paracrine neurotransmission and are consistently targeted to a subset of synaptic structures in an identified neuron of the crustacean stomatogastric nervous system〔J〕.J Comparat Neurol,2010;518(3):255-76.
34 Galvan A,Wichmann T.Pathophysiology of parkinsonism〔J〕.Clin Neurophysiol,2008;119(7):1459-74.
35 陈 巍,魏 翔,刘晓莉,等.运动对PD模型大鼠皮层-纹状体Glu能神经传递的影响〔J〕.北京体育大学学报,2015;28(2):61-6.
36 Nuria C,Jorge G,Bertarelli DCG,etal.Metabotropic glutamate type 5,dopamine D2 and adenosine A2a receptors form higher-order oligomers in living cells〔J〕.J Neurochem,2009;109(5):1497-507.
37 Peterson JD,Goldberg JA,Surmeier DJ.Adenosine A2a receptor antagonists attenuate striatal adaptations following dopamine depletion〔J〕.Neurobiol Dis,2012;45(1):409-16.
38 Kravitz AV,Freeze BS,Parker PRL,etal.Regulation of parkinsonian motor behaviours by optogenetic control of basal ganglia circuitry〔J〕.Nature,2010;466(7306):622-6.
39 Bloem BR,de Vries NM,Ebersbach G,etal.Nonpharmacological treatments for patients with Parkinson's disease〔J〕.Mov Disord,2015;30(11):1504-20.
40 Lötzke D,Ostermann T,Büssing A.Argentine tango in Parkinson disease-a systematic review and meta-analysis〔J〕.BMC Neurol,2015;15(1):1-18.
41 陈 巍,乔德才,刘晓莉.纹状体神经元可塑性与帕金森病的运动防治研究进展〔J〕.中国运动医学杂志,2014;33(7):729-34.
42 Gerecke KM,Yun J,Pani A,etal.Exercise protects against MPTP-induced neurotoxicity in mice〔J〕.Brain Res,2010;1341(6):72-83.
43 Yoon MC,Shin MS,Kim TS,etal.Treadmill exercise suppresses nigrostriatal dopaminergic neuronal loss in 6-hydroxydopamine-induced Parkinson's rats〔J〕.Neurosci Lett,2007;423:12-7.
44 Tillerson JL,Caudle WM,Reverón ME,etal.Exercise induces behavioral recovery and attenuates neurochemical deficits in rodent models of Parkinson's disease〔J〕.Neuroscience,2003;119(3):899-911.
45 Fisher BE,Petzinger GM,Nixon K,etal.Exercise-induced behavioral recovery and neuroplasticity in the 1-methyl- 4 -phenyl -1,2,3,6 -tetrahydropyridine -lesioned mouse basal ganglia〔J〕.Neurosci Res,2004;77:378-90.
46 Vucckovic MG,Li Q,Beth F,etal.Exercise elevates dopamine D2 receptor in a mouse model of Parkinson's disease:in vivo imaging with〔18F〕fallypride〔J〕.Mov Disord,2010;25(16):2777-84.
47 王宗兵,乔德才,刘晓莉.早期运动干预对帕金森病模型大鼠黑质多巴胺能神经元电活动的影响〔J〕.中国运动医学杂志,2014;33(9):876-82.
48 Toy WA,Petzinger GM,Leyshon BJ,etal.Treadmill exercise reverses dendritic spine loss in direct and indirect striatal medium spiny neurons in the 1-methyl-4-phenyl- 1,2,3,6- tetrahydropyridine(MPTP)mouse model of Parkinson's disease〔J〕.Neurobiol Dis,2014;63(1):201-9.
49 陈 巍,时凯旋,刘晓莉.运动干预通过纹状体MSNs结构可塑性改善PD模型大鼠行为功能〔J〕.中国运动医学杂志,2015;34(3):228-34.
50 陈 巍.运动对PD大鼠纹状体MSNs可塑性及Glu能突触传递调节机制研究〔D〕.北京:北京师范大学,2015.
51 Goldstein ER,Ziegenfuss T,Kalman D,etal.International society of sports nutrition position stand:caffeine and performance〔J〕.J Int Soc Sport Nutr,2010;7(1):5.
52 Kasper AM,Cocking S,Cockayne M,etal.Carbohydrate mouth rinse and caffeine improves high-intensity interval running capacity when carbohydrate restricted〔J〕.Eur J Sport Sci,2016;16(5):560-8.
53 ACSM.2015 Abstract session A-G〔J〕.Med Sci Sport Exerc,2015;46(5):S1-S778.
54 Alberto A,Zhang S,Miguel AH,etal.Prospective study of caffeine consumption and risk of Parkinson's disease in men and women〔J〕.Ann Neurol,2001;50(1):56-63.
55 Hodgson RA,Bertorelli R,Varty GB,etal.Characterization of the potent and highly selective A2A receptor antagonists preladenant and SCH 412348 in rodent models of movement disorders and depression〔J〕.Pharmacol Exp Ther,2009;330(1):294-303.
56 Ferraro L,Beggiato S,Tomasini MC,etal.A(2A)/D-2 receptor heteromerization in a model of Parkinson's disease.Focus on striatal aminoacidergic signaling〔J〕.Brain Res,2012;1476(1):96-107.
〔2016-02-04修回〕
(编辑 李相军)
国家自然科学基金资助项目(31571221);北京市自然科学基金资助项目(5142012)
刘晓莉(1958-),女,博士,教授,博士生导师,主要从事体育保健与运动康复研究。
王 弘(1991-),女,在读硕士,主要从事运动人体科学研究。
R322.8
A
1005-9202(2017)01-0222-05;
10.3969/j.issn.1005-9202.2017.01.098

