帕金森病伴发不宁腿综合征的临床特征及神经病理生化机制
朴英善 扈杨 李丽霞 连腾宏 余舒扬 左丽君 余秋瑾 王瑞丹 郭鹏 金朝 刘丽 张巍
帕金森病伴发不宁腿综合征的临床特征及神经病理生化机制
朴英善 扈杨 李丽霞 连腾宏 余舒扬 左丽君 余秋瑾 王瑞丹 郭鹏 金朝 刘丽 张巍
目的 初步探讨帕金森病(PD)伴发不宁腿综合征(RLS)的临床特征以及神经病理蛋白和神经递质水平的变化。 方法 收集连续就诊于北京天坛医院老年病科和神经内科的PD患者186例,将患者分为PD伴发RLS组(简称RLS组)和PD非伴发RLS(简称NRLS)组,采用不宁腿综合征评定量表(RLS-RS)评价RLS的临床表现及严重程度;采用酶联免疫吸附法检测脑脊液神经病理蛋白(包括α-突触核蛋白寡聚体、总Tau及不同部位磷酸化tau蛋白)水平,采用高效液相色谱检测脑脊液神经递质(包括多巴胺、乙酰胆碱、肾上腺素和5-羟色胺)的水平。分析各神经病理蛋白及神经递质与RLS-RS评分的关系。 结果 (1)186例PD患者RLS的发生率为42.47%;RLS组的病程明显长于NRLS组(P<0.05)。(2)RLS组Hoehn-Yahr分期及UPDRS Ⅲ评分均明显高于NRLS组(均P<0.05)。(3)RLS组患者汉密尔顿焦虑量表(HAMA)、汉密尔顿抑郁量表(HAMD)、匹茨堡睡眠质量指数量表(PSQI)和疲劳严重程度量表(FSS)评分均高于NRLS组(均P<0.01),而两组间蒙特利尔认知评估量表(MoCA)、改良淡漠评定量表(MAES)和爱泼沃斯思睡量表(ESS)评分比较差异无统计学意义(P>0.05)。(4)RLS组脑脊液α-突触核蛋白寡聚体水平明显高于NRLS组〔(0.31±0.09)ng/mL 比(0.21±0.08)ng/mL,P<0.05〕。RLS组RLS-RS评分与脑脊液α-突触核蛋白寡聚体水平呈正相关(r=0.355,P<0.01)。(5)RLS组脑脊液多巴胺和5-羟色胺水平明显低于NRLS组〔(5.53±3.67)pg/mL比(7.97±4.85)pg/mL,P<0.01;(13.23±8.14)pg/mL比(19.21±7.50)pg/mL,P<0.01〕。RLS组RLS-RS严重度评分与脑脊液多巴胺和5-羟色胺水平呈负相关(r=-0.274,P<0.01;r=-0.360,P<0.01)。(6)脑脊液α-突触核蛋白寡聚体水平与多巴胺以及5-羟色胺水平无相关性(r=-0.119,P=0.362;r=-0.127,P=0.327)。结论 RLS是PD常见的非运动症状之一,PD伴发RLS患者的运动症状更重,非运动症状中焦虑、抑郁、疲劳更重,睡眠质量更差。PD-RLS脑内α-突触核蛋白寡聚体沉积可能是PD-RLS的发生机制,多巴胺缺乏可能是PD-RLS的神经生化基础。
帕金森病;不宁腿综合征;临床特征;α-突触核蛋白;神经递质
不宁腿综合征(restless legs syndrome,RLS) 是一种常见的感觉运动性疾病,主要表现为双下肢的不适感,从而有强烈运动下肢的欲望,症状在休息或静止时开始或加重,活动时减轻,并且呈现昼夜节律性,在夜间加重。RLS是帕金森病(Parkinson disease,PD)常见的非运动症状之一[1],是影响睡眠的独立因素,并且影响患者的生活质量。然而,目前对PD伴发RLS(PD-RLS)的重视不够,其确切病理生理学机制尚不十分明确[2-3]。本文对PD患者RLS的相关因素、脑脊液中神经病理蛋白及神经递质的水平进行研究,旨在探讨PD-RLS的临床特点、神经病理及生化机制。
1 对象和方法
1.1 对象 连续收集2012-12—2015-12就诊于北京天坛医院老年病科和神经内科的PD患者186例为研究对象,其中男98例,女88例,年龄41~85岁,平均(61.45±8.79)岁,病程中位数为2.5年,四分位数间距为2.5年。PD诊断标准:符合2015年国际运动障碍协会制定的原发性PD诊断标准[4]:必须存在运动迟缓,同时存在下列主征中的1项:静止性震颤或肌强直;符合支持性标准;并除外9项绝对排除标准,所有PD患者符合临床确诊的PD和临床很可能的PD。根据国际不宁腿综合征研究委员会(The International Restless Legs Syndrome Study Group,IRLSSG)的诊断标准,将患者分为伴发RLS组(以下简称RLS组)和非伴发RLS组(以下简称NRLS组)。
1.2 方法
1.2.1 RLS症状的评价:采用不宁腿综合征评定量表(restless legs syndrome-rating scale,RLS-RS)评价患者RLS的表现及严重程度。
1.2.2 临床症状评价:采用统一帕金森病评定量表-Ⅲ (Unified Parkinson’s Disease Rating Scale Ⅲ,UPDRSⅢ)和Hoehn-Yahr分期量表评价患者的运动症状和病情分期。采用下列量表评价PD患者的非运动症状:(1)汉密尔顿焦虑量表(Hamilton anxiety scale,HAMA)评价焦虑:0~14分为非焦虑组,>14分为焦虑组,分值越高,表示焦虑更严重;(2)24项汉密尔顿抑郁量表(24 items Hamilton depression scale,HAMD-24)评价抑郁:<8分为无抑郁;≥8分为抑郁,其中8~16分为轻度抑郁,17~23分为中度抑郁,≥24分为重度抑郁;(3)蒙特利尔认知评估量表 ( Montreal cognitive assessment,MoCA)北京版:评价认知功能,分值越低,表示认知越差;(4)改良淡漠评定量表(modified indifference rating scal, MAES):评价淡漠,分值越高,表示淡漠越严重;(5)疲劳严重程度量表(fatigue severity scale,FSS):评价主观疲劳,分值越高,表示疲劳越严重;(6)匹茨堡睡眠质量指数量表(Pittsburgh sleep quality index,PSQI):评估总体睡眠质量,分值越高,表示睡眠质量越差,PSQI>5分为存在睡眠障碍;(7)爱泼沃斯思睡量表(Epworth sleeping scale,ESS):评估日间思睡程度,分值越高,表示思睡越严重。
1.2.3 采集脑脊液:在患者病情允许的情况下,停用治疗PD及认知障碍的药物12~14 h,上午7:00至10:00于患者空腹下采用腰椎穿刺术抽取脑脊液3 mL。将0.5 mL脑脊液加至单独的冻存管,于-80℃储存待测。每一个冻存管避免反复冷冻及融解,以免蛋白质降解。最终采集了RLS组和NRLS组的脑脊液例数分别为31例和41例。
1.2.4 脑脊液神经病理蛋白检测:采用酶联免疫吸附法检测脑脊液中α-突触核蛋白寡聚体、β淀粉样蛋白(amyloid protein β,Aβ)1-42、总Tau(T-Tau)及不同部位磷酸化Tau蛋白,包括threonine 181(P-tau181t)、threonine 231(P-tau231t)、serine 396 (P-tau396s)和serine 199(P-tau199s)。使用CUSABIO 公司(武汉,中国)试剂盒CSB-E18033h、CSB-E10684h和CSBE12011h分别检测α-突触核蛋白寡聚体、Aβ1-42和T-Tau。使用美国Invitrogen公司 (Carlsbad,CA,USA)试剂盒 KHB7031、KHB7041、KHB8051和 KHO0631分别检测 P-tau396s、P-tau199s、P-tau231t和P-tau181t的水平。
1.2.5 脑脊液神经递质的检测:采用高效液相色谱法(high performance liquid chromatography,HPLC)检测PD患者脑脊液中多巴胺(dopamine,DA)、乙酰胆碱(acetylcholine,ACh)、肾上腺素(adrenaline,NE)和5-羟色胺(5-hydroxytryptaphane,5-HT)等神经递质的水平。使用美国Agilent公司的LC-MS-MS 6410色谱仪和Phenomenex 150 mm×2 mm和150 mm×3 mm层析柱。标准液为美国Sigma公司产品。
1.3 统计学处理 采用SPSS20.0软件进行统计学分析,符合正态分布的计量资料用均数±标准差表示,采用t检验;非正态分布的计量资料以中位数和四分位数间距表示,采用秩和检验;采用双变量相关分析法对计量资料进行相关性分析;采用多重线性回归分析法对计量资料进行多重线性回归分析;计数资料采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 一般资料比较 186例PD患者中伴发RLS者79例(42.47%),其中男46例,女33例,平均年龄(61.64±8.21)岁,发病年龄中位数58.0岁,四分位数间距11.0岁,病程中位数4.0年,四分位数间距3.0年, RLS-RS的平均评分为(18.50±8.99)分。NRLS组107例,其中男52例,女55例,平均年龄(61.05±9.20)岁,发病年龄中位数58.0岁,四分位数间距12.7岁,病程中位数2.0年,四分位数间距2.0年。RLS组的病程长于NRLS组(P<0.05),而两组间性别构成、年龄、发病年龄以及病程比较无统计学差异(均P>0.05)。
2.2 两组运动症状的评价 RLS组UPDRS Ⅲ评分为(2.28±0.86)分,高于NRLS组的(1.65±0.78)分(P<0.01)。RLS组Hoehn-Yahr分期中位数为25.00,四分位数间距为16.50,NRLS组Hoehn-Yahr分期中位数为22.00,四分位数间距为20.50,RLS组Hoehn-Yahr分期亦明显高于NRLS组(P<0.05)。
2.3 两组非运动症状相关量表评分的比较 RLS组患者HAMA、HAMD、PSQI和FSS评分均高于NRLS组(均P<0.01),而两组间MoCA、MAES和ESS评分比较差异无统计学意义(P>0.05)。结果见表1。
2.4 两组脑脊液神经病理蛋白水平比较 RLS组脑脊液α-突触核蛋白寡聚体水平明显高于PD-NRLS组(P<0.01),余神经病理蛋白水平两组间比较无统计学差异(P>0.05)。结果见表2。RLS组 RLS-RS 评分与脑脊液α-突触核蛋白寡聚体水平呈正相关(r=0.355,P=0.001),而与脑脊液Aβ1-42(r=-0.167,P=0.308)、T-tau(r=-0.108,P=0.714)、P-tau181t(r=-0.231,P=0.074)、P-tau231t(r=-0.013,P=0.959)、P-tau396s(r=-0.186,P=0.461)和P-tau199s(r=-0.262,P=0.294)均无相关性。
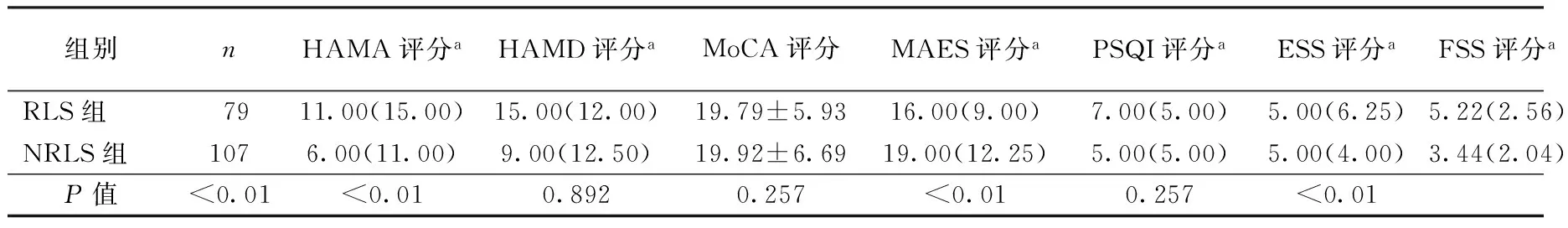
表1 两组患者非运动症状评分的比较
注:RLS:不宁腿综合征,NRLS:未伴发不宁腿综合征,表2~3同;HAMA:汉密尔顿焦虑量表;HAMD :汉密尔顿抑郁量表;MoCA:蒙特利尔认知评估量表;MAES:改良淡漠评定量表;PSQI:匹茨堡睡眠质量指数量表;ESS:爱泼沃斯思睡量表;FSS:疲劳严重程度量表;a数据以中位数(四分位数间距)形式表示
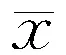
表2 两组患者脑脊液神经病理蛋白水平的比较(±s,ng/mL)
注:Aβ:β淀粉样蛋白;T-Tau:总Tau蛋白;P-tau181t、P-tau231t、P-tau396s、P-tau199s:为不同部位磷酸化Tau蛋白,依次为threonine 181、threonine 231、serine 396、serine 199
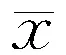
表3 两组患者脑脊液神经递质水平比较(±s,pg/mL)
注:DA:多巴胺;5-HT:5-羟色胺;ACh:乙酰胆碱;NE:肾上腺素
2.5 脑脊液神经递质水平比较 RLS组脑脊液DA和5-HT水平明显低于NRLS组(均P<0.01),而两组间ACh和NE水平比较差异无统计学意义(表3)。RLS组RLS-RS严重度评分与脑脊液DA和5-HT水平呈负相关(r=-0.274,P=0.007;r=-0.360,P=0.000),而与脑脊液ACh和NE水平均无相关性(r=0.005,P=0.981;r=-0.018,P=0.911)。
2.6 脑脊液神经病理蛋白与神经递质水平的相关性 RLS组和NRLS组脑脊液α-突触核蛋白寡聚体水平与DA(r=-0.119,P=0.362)以及5-HT(r=-0.127,P=0.327)递质水平未见相关性。
3 讨论
PD的运动症状已为人们所熟知,随着病理学研究的进展,学者们发现PD存在多种非运动症状,其中RLS常见。目前有关PD-RLS的研究尚不多。自2003年IRLSSG确定了RLS的诊断标准,临床医师逐渐提高了对其诊治的认识[5]。本研究采用 RLS-RS评价186例PD患者RLS的临床症状及严重程度,其中伴发RLS占42.47%,提示RLS是PD的常见非运动症状之一。目前研究发现,PD-RLS患者的RLS-RS严重程度范围为轻-中度,可能由于多数研究中患者已接受DA能药物治疗,PD-RLS 症状得到缓解有关。本研究PD-RLS患者的RLS-RS平均评分为(18.50±8.99)分,RLS组UPDRSⅢ评分及Hoehn-Yahr分期均明显高于NRLS组,提示PD-RLS与运动症状评分及病情的严重程度密切相关,这与既往研究结果一致。有研究发现PD的严重程度与RLS有关,认为PD和RLS与DA能神经递质系统的病变有关,当PD发展到一定程度,DA的合成与代谢降低,导致RLS加重[6-7]。
抑郁和焦虑是PD患者常伴发的情感障碍。本研究发现RLS组抑郁和焦虑的程度明显高于NRLS组,表明伴有RLS的PD患者容易罹患抑郁和焦虑。Krishnan等[8]和Fereshtehnejad等[9]研究结果显示PD-RLS 组抑郁发生率和焦虑评分较不伴RLS组更高。认知功能障碍是影响PD患者生活质量的重要非运动症状之一。本研究发现PD-RLS组和PD-NRLS组间MoCA评分未见统计学差异,考虑可能与纳入中-重度患者较少有关。因为PD认知障碍出现较晚,有待于扩大样本纳入中-重度患者进一步研究。淡漠是PD常见的精神症状之一,本研究通过对MAES量表的评测发现RLS组淡漠评分较NRLS组高。研究发现淡漠可能与额叶前部、眶面-纹状体腹侧环路的机能受损有关,提示其发生可能与脑内DA水平有关,而RLS亦与DA递质有关,表明RLS与淡漠在神经生化方面存在共享机制。睡眠障碍和觉醒障碍常见于PD患者,其发生率高达70%。Nomura等[10]研究发现RLS组PSQI评分较NRLS组明显增高,表明伴有RLS的PD患者睡眠障碍更重。本研究中RLS组与NRLS组间PSQI比较具有统计学差异,表明RLS组睡眠质量更差。本研究采用ESS评分评价患者白天嗜睡情况发现RLS组与NRLS组间未见统计学差异。这与以往的报道一致[11]。
以往研究认为,PD的主要病理学特征为中脑黑质DA能神经元进行性变性、丢失,残余的神经元内出现路易小体。近年研究发现,随着PD病情的进展,其脑内出现阿尔茨海默病的病理变化,包括以Aβ1-42 为主要成分的神经炎性斑和以P-Tau为主要成分的神经原纤维缠结。本研究观察了PD患者上述神经病理蛋白水平,结果发现RLS组α-突触核蛋白寡聚体水平较NRLS组显著增高,进一步分析发现RLS组患者RLS严重度评分与脑脊液中α-突触核蛋白寡聚体水平的升高有关,提示RLS程度越严重,脑内α-突触核蛋白寡聚体水平越高。目前研究证实RLS与DA递质的减少有关,但在散发性RLS患者脑内未发现路易体形成[12],其病理学特征与PD有差别。本研究发现伴有RLS的PD患者病程更长,运动症状及非运动症状更重,RLS-RS严重度评分与其脑脊液中α-突触核蛋白寡聚体水平呈正相关,推测伴有RLS的PD患者脑内病理改变的范围更广,α-突触核蛋白寡聚体沉积更多,从而导致RLS症状更重。因此,提示脑内过量α-突触核蛋白寡聚体可能是PD患者出现RLS的潜在机制,而非导致RLS的直接原因。本研究进一步发现脑脊液中α-突触核蛋白寡聚体水平与DA水平无明显相关性,证实PD-RLS的发生与α-突触核蛋白寡聚体的沉积无直接相关性。过度P-Tau能引起微管塌陷和轴突运输障碍。有研究发现PD伴发痴呆患者的认知功能障碍与脑脊液中 T-Tau 和 P-Tau(T231)水平的升高有关[13]。但目前尚无关于 PD-RLS与脑脊液中 T-Tau 或 P-Tau 水平关系的研究。本研究发现,RLS组和NRLS组间Aβ1-42、T-Tau及不同部位磷酸化Tau比较无统计学差异,考虑PD-RLS与上述神经病理蛋白的沉积无关。
目前认为,PD和RLS与中枢DA能系统功能异常均有联系,PD主要累及黑质-纹状体DA能系统,黑质DA能神经元进行性退变导致纹状体以及中脑皮质系统的DA水平明显降低。散发性RLS的病变部位较广,黑质、纹状体、间脑、下丘脑和脊髓的DA能系统功能障碍发挥重要作用[14]。本研究发现,RLS组脑脊液DA水平较NRLS组显著降低,RLS-RS评分与脑脊液DA水平呈负相关,提示脑内DA的缺乏可能导致PD患者RLS的发生。既往研究发现,左旋多巴能有效改善RLS患者的症状,表明DA缺乏可能与RLS有关。然而,也有临床研究认为,PD患者的RLS发生是DA能药物的使用导致。PD-RLS的神经生化机制虽然不清楚,但有研究认为其可能与基底节功能障碍有关[15]。Moccia等采用SPECT成像研究发现,PD-RLS组在发病4年内DA转运体的结合率较对照组明显升高[16]。上述研究通过影像学方法间接反映了PD-RLS组较NRLS组多巴胺水平的降低,与本研究结果一致。
该研究结果显示,RLS组脑脊液5-HT水平较NRLS组降低,两组ACh和NE水平未见统计学差异;相关性分析发现RLS-RS评分与脑脊液中5-HT水平呈负相关。目前,RLS发病机制的研究中与5-HT递质水平相关性的研究较少。案例对照研究和病例报告的研究表明5-HT再摄取抑制剂可能会增加或加重散发性RLS的症状,也有可能会减轻RLS的症状[17]。该研究发现PD-RLS组5-HT水平较NRLS组显著降低,而且RLS-RS评分与5-HT水平呈负相关,推测5-HT能神经系统可能参与PD-RLS的发病。既往研究发现抑郁、焦虑及疲劳均与5-HT降低有关,提示上述3种症状可能与5-HT递质的变化有关[18]。本研究发现RLS组的5-HT水平较NRLS组显著降低,推测5-HT能神经系统可能参与PD-RLS的发病,PD-RLS患者脑内病变更广泛,患者抑郁、焦虑和疲劳更严重,考虑这些非运动症状加重与5-HT水平的降低有关。但是,5-HT递质在PD-RLS中的发病机制还不很明确,有待于进一步的研究。
综上所述,PD患者RLS的发生率较高,可能与中枢神经系统多部位进行性变性导致的神经生化异常有关。PD-RLS患者的运动障碍更重,非运动症状发生率更高。PD-RLS患者脑内α-突触核蛋白寡聚体大量沉积,可能是PD-RLS潜在发生机制。脑内DA、5-HT缺乏可能是PD-RLS的神经生化异常机制,而5-HT水平的降低可能与PD-RLS患者更严重的抑郁、焦虑和疲劳有关。
[1]Pont-Sunyer C, Hotter A, Gaig C, et al.The onset of nonmotor symptoms in Parkinson’s disease (the ONSET PD study)[J].Mov Disord, 2015, 30(2): 229-237.
[2]Rijsman RM, Schoolderman LF, Rundervoort RS, et al.Restless legs syndrome in Parkinson’s disease[J].Parkinsonism Relat Disord, 2014, 20(Suppl 1): S5-S9.
[3]Verbaan D, van Rooden SM, van Hilten JJ, et al.Prevalence and clinical profile of restless legs syndrome in Parkinson’s disease[J].Mov Disord, 2010, 25(13): 2142-2147.
[4]Postuma RB, Berg D, Stern M, et al.MDS clinical diagnostic criteria for Parkinson’s disease[J].Mov Disord,2015,30(12):1591-1601.
[5]Allen RP, Picchietti D, Hening WA, et al.Restless legs syndrome: diagnostic criteria, special considerations, and epidemiology.A report from the restless legs syndrome diagnosis and epidemiology workshop at the National Institutes of Health[J].Sleep Med,2003,4(2):101-119.
[6]Svensson E, Beiske AG, Loge JH, et al.Sleep problems in Parkinson’s disease: a community-based study in Norway[J].BMC Neurol,2012,12:71.
[7]Möller JC, Unger M, Stiasny-Kolster K, et al.Restless legs syndrome(RLS) and Parkinson’s disease(PD)-related disorders or different entities?[J].J Neurol Sci, 2010, 289(1-2): 135-137.
[8]Krishnan PR, Bhatia M, Behari M.Restless legs syndrome in Parkinson’s disease: a case-controlled study[J].Mov Disord, 2003,18(2):181-185.
[9]Fereshtehnejad SM, Shafieesabet M, Shahidi GA,et al.Restless legs syndrome in patients with Parkinson’s disease:a comparative study on prevalence, clinical characteristics,quality of life and nutritional status[J].Acta Neurol Scand,2015,131(4):211-218.
[10]Nomura T, Inoue Y, Nakashima K.Clinical characteristics of restless legs syndrome in patients with Parkinson’s disease[J].J Neurol Sci,2006,250(1-2):39-44.
[11]Gómez-Esteban JC, Zarranz JJ, Tijero B, et al.Restless legs syndrome in Parkinson’s disease[J].Mov Disord,2007,22(13):1912-1916.
[12]Puschmann A, Bhidayasiri R, Weiner WJ.Synucleinopathies from bench to bedside[J].Parkinsonism Relat Disord, 2012,18 Suppl 1:S24-27.
[13]Hirano S, Shinotoh H, Eidelberg D.Functional brain imaging of cognitive dysfunction in Parkinson’s disease[J].J Neurol Neurosurg Psychiatry, 2012, 83(10): 963-969.
[14]Kedia S,Moro E,Tagliati M,et al.Emergence of restless legs syndrome during subthalamic stimulation for Parkinson’s disease[J].Neurology,2004,63(12):2410-2412.
[15]Eisenstein SA,Koller JM,Black KD,et al.Functional anatomy of subthalamic nucleus stimulation in Parkinson’s disease[J].Ann Neurol,2014,76(2):279-295.
[16]Moccia M, Erro R, Picillo M, et al.A four-year longitudinal study on restless legs syndrome in Parkinson’s disease[J].Sleep,2016,39(2):405-412.
[17]Bayard M, Bailey B, Acharya D, et al.Bupropion and restless legs syndrome: a randomized controlled trial[J].J Am Board Fam Med,2011,24(4):422-428.
[18]Pavese N, Metta V, Bose SK, et al.Fatigue in Parkinson’s disease is linked to striatal and limbic serotonergic dysfunction[J].Brain,2010,133(11):3434-3443.
(本文编辑:时秋宽)
Parkinson’s disease with restless legs syndrome: clinical features, pathological proteins and neurotransmitters
PIAOYingshan,HUYang,LILixia,LIANTenghong,YUShuyang,ZUOLijun,YUQiujin,WANGRuidan,GUOPeng,JINZhao,LIULi,ZHANGWei*.
*DepartmentofGeriatrics,DepartmentofNeurology,BeijingTiantanHospital,CapitalMedicalUniversity;NationalClinicalResearchCenterforNeurologicalDiseases,Beijing100050,China;CoreLaboratoryforNeurodegenerativeDiseaseofMinistryofEducation,Beijing100069,China;CenterofParkinson’sDisease,BeijingInstituteforBrainDisorders,BeijingKeyLaboratoryonParkinsonDisease,Beijing100053,China
ZHANGWei,Email:ttyyzw@163.com
Objective To explore the relationships between restless legs syndrome (RLS) and clinical features, pathological proteins and neurotransmitters in patients with Parkinson’s disease (PD).Methods 186 PD patients were collected and divided into the RLS group and non-RLS (NRLS) groups according to the scores of RLS-rating scale (RLS-RS) and a comparison study was conducted by measuring pathological proteins(α-synuclein oligomer, total-Tau, phosphorylation-Tau)using enzyme linked immunosorbent assay (ELISA),and neurotransmitters(dopamine, acetylcholine, adrenaline and 5-hydroxytryptaphane)using high-performance liquid chromatography. Results (1) 42.47% of PD patients were accompanied with RLS.The RLS group had significantly longer disease duration than the NRLS group(P<0.05).(2)There were significant differences in Hoehn-Yahr Stage and UPDRS Ⅲ score between the RLS and NRLS groups(P<0.05).(3) The scores of Hamilton anxiety scale(HAMA), Hamilton depression scale(HAMD), fatigue severity scale(FSS) and Pittsburgh Sleep Quality Index (PSQI) in the RLS group were significantly increased comparing with those in the NRLS group(P<0.05).The scores of Montreal Cognitive Assessment(MoCA), modified indifference rating scal(MAES) and Epworth Sleeping Scale(ESS) were not significantly different between the two groups(P>0.05).(4)α-synuclein oligomer levels in cerebrospinal fluid(CSF) in the PD-RLS group were elevated compared to PD-NRLS group[(0.31±0.09)ng/ mLvs. (0.21±0.08)ng/mL,P<0.05).RLS-RS score was increased with the elevated α-synuclein oligomer level in CSF(r=0.355,P<0.01).(5)Dopamine(DA) and serotonin(5-HT) levels in CSF in the PD-RLS group were decreased compared to PD-NRLS group[(5.53±3.67)pg/mLvs. (7.97±4.85)pg/mL,P<0.01;(13.23±8.14)pg/mLvs.(19.21±7.50)pg/mL,P<0.01; respectively].RLS-RS score was increased with the decreased DA and 5-HT levels in CSF(r=-0.274,P<0.01;r=-0.360,P<0.01; respectively).(6)The level of α-synuclein oligomers in CSF was not significantly correlated with the levels of DA and 5-HT transmitters(r=-0.119,P=0.362;r=-0.127,P=0.327).Conclusions RLS is one of the common non-motor symptoms (NMS) in PD, which is associated with the severity of motor symptoms.PD patients with RLS have more NMS, among them, anxiety, depression, fatigue and sleep disorder are more prominent than the PD-NRLS group.PD patients with RLS present deposition of α-synuclein, which may be the potential mechanism of PD in patients with RLS.The lack of DA in the brain may be the main transmitter disturbance of RLS in PD patients.
Parkinson’s disease; restless legs syndrome; clinical features; pathological proteins; neurotransmitters
10.3969/j.issn.1006-2963.2017.01-003
国家重点研发计划重大慢性非传染性疾病防控研究项目(2016YFC1306000、2016YFC1306300);国家重点基础研究发展计划项目(2011CB504100);国家自然科学基金资助项目(81571229、81071015、30770745);北京市科学基金资助项目(7082032);中国科学技术部国家关键技术研究与开发项目(2013BAI09B03);北京脑重大疾病研究院项目(BIBD-PXM2013_014226_07_000084);北京市卫生系统高层次卫生技术人才培养计划资助项目(2009-3-26);北京市属高等学校创新团队建设与教师职业发展计划项目(IDHT20140514);首都临床特色应用研究项目(Z12110700100000、Z12110700112161);北京市保健办课题(JING-15-2、JING-15-3);北京优秀人才培养计划(20071D0300400076);国家重大科技专项(2011ZX09102-003-01);国家自然科学基金重点项目(81030062);北京市自然科学基金(kz200910025001);首都医科大学基础-临床科研合作基金(10JL49、14JL15、2015-JL-PT-X04);首都医科大学北京天坛医院青年科研基金(2014-YQN-YS-18、2015-YQN-05、2015-YQN-14、2015-YQN-15、2015-YQN-17)
100050 首都医科大学附属北京天坛医院老年病科(朴英善、扈杨、李丽霞、余舒扬、郭鹏、刘丽、张巍),神经病学中心(连腾宏、左丽君、余秋瑾、王瑞丹、金朝、张巍);100050国家神经系统疾病临床医学研究中心(张巍);100069教育部神经变性疾病重点实验室(张巍);100053北京脑重大疾病研究院帕金森病研究所(张巍);100053 北京帕金森病重点实验室(张巍)
张巍,Email:ttyyzw@163.com
R742.5
A
1006-2963(2017)01-0007-06
2016-11-30)

