肺腺癌患者血清癌胚抗原表达水平对化疗疗效的影响
邱 冬 张 芩 凌春华 徐 宁 陆依岭 刘玉凤 江丽阳
肺腺癌患者血清癌胚抗原表达水平对化疗疗效的影响
邱 冬 张 芩 凌春华 徐 宁 陆依岭 刘玉凤 江丽阳
目的 探讨血清癌胚抗原(CEA)表达水平对中晚期肺腺癌患者化疗疗效的影响。方法 回顾性分析88例中晚期肺腺癌患者的临床资料及化疗疗效,分析血清CEA水平的影响因素及其对化疗疗效的影响。结果 吸烟史是影响中晚期肺腺癌患者血清CEA表达水平的独立影响因素(χ2=4.503,P=0.034)。血清CEA阳性组患者近期化疗疗效优于血清CEA阴性组患者,差异有统计学意义(χ2=4.477,P=0.034)。血清CEA阳性组患者平均无进展生存期及中位无进展生存期均优于血清CEA阴性组患者,差异有统计学意义(χ2=4.548,P=0.033)。结论 血清CEA阳性的中晚期肺腺癌患者化疗疗效优于血清CEA阴性的患者。
癌胚抗原;肺腺癌;化疗;疗效
(ThePracticalJournalofCancer,2017,32:005~008)
恶性肿瘤在全球范围内已经成为人类死亡的主要病因,其中肺癌的发病率及死亡率均居全球癌症的首位[1]。根据2013年世界卫生组织(WHO)国际癌症研究机构(IARC)公布的2012全球统计结果显示:2012年全球范围内共有180万例新发肺癌,占所有新发恶性肿瘤的13%,同年有159万人死于肺癌,占当年所有恶性肿瘤死亡人数的19.5%,其发病率及死亡率均居2012年所有恶性肿瘤首位,其中大部分为非小细胞肺癌[1]。目前已发现多种与肺癌相关的血清肿瘤标志物[2],其中癌胚抗原(CEA)在肺腺癌的早期诊断中有着极大的意义[3],进展期肺癌病人多出现血清CEA水平升高[4]。对于晚期肺癌病人系统化疗在一定程度上有助于延长其生存期。含铂类药物的二药联合方案已经成为晚期非小细胞肺癌标准化疗方案。然而,我们发现有一部分晚期肺腺癌患者并不出现血清CEA水平的升高。本课题就88例晚期肺腺癌患者血清CEA水平对化疗疗效的影响展开研究。
1 材料与方法
1.1 一般资料
收集2013年1月至2014年12月期间,首次经病理学确诊的中晚期肺腺癌88例,其中男性59例,女性29例,年龄31~79岁,TNM分期:Ⅲa期4例、Ⅲb期12例、Ⅳ期72例。根据患者初诊时血清CEA检查结果将患者分为血清CEA阴性组(CEA<5 ng/ml)和血清CEA阳性组(CEA>5 ng/ml)。纳入标准:①所有病例均经病理学确诊为肺腺癌;②所有病例均为初诊患者且确诊时已处于中晚期,失去手术机会或不能耐受手术;③至少有1个可测量病灶,根据实体瘤的疗效评价(RECIST)[5]标准定义的可测量病灶为靶病灶;④确诊后初治仅接受化疗治疗。排除标准:①非肺腺癌;②初诊为早期肺腺癌可行手术治疗;③患者曾接受治疗,包括手术、放化疗等非初诊患者;④确诊后化疗同时还接受放疗或是靶向治疗等治疗。
1.2 方法
1.2.1 血清CEA的测定 治疗前清晨空腹采集外周静脉血3 ml,3 000转/min,离心5 min,分离血清,应用罗氏Cobase 601电化学发光法。CEA试剂盒为瑞典CanAg公司,仪器为罗氏CobasE601全自动电化学发光免疫分析仪。CEA正常值0.0~5.0 ng/ml。
1.2.2 治疗方案、疗效评价及随访 根据NCCN指南,88例肺腺癌患者初治均采用一线化疗方案:培美曲塞+铂类(培美曲塞500 mg/m2·1天+铂类·1天),每21天为一个周期,每2个周期结束后即第3个周期开始前评估疗效。化疗疗效的评价按照实体瘤的疗效评价(RECIST)标准[5],分为完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)和疾病进展(PD)。评估病情若为PD则换为肺腺癌二线化疗方案(多西他赛75 mg/m2·1天+铂类·1天)继续化疗治疗,若疾病控制则继续原方案化疗。依次每两个周期评估一次病情。4~6个周期后如若没有出现疾病进展,使用至少一种在一线治疗中使用过的药物维持治疗。两组患者化疗的近期疗效通过疾病控制率DCR进行评价。疾病控制率DCR=(CR+PR+SD) /总人数×100%。两组患者化疗的长期疗效通过无疾病进展生存期(progression-free survival,PFS)进行评价。化疗过程中若出现二线方案化疗失败或因死亡而终止治疗则停止随访。所有病例均以12个月为研究终点。
1.3 统计学分析
应用SPSS 17.0统计软件进行统计分析,计数资料采用率表示,两组数据率的比较采用卡方检验,两组患者PFS采用Kaplan-Meier生存曲线进行分析,Log-rank检验组间差异,以P<0.05为差异有统计学意义。
2 结果
2.1 一般临床资料
两组患者一般临床资料见表1。两组一般临床资料除吸烟史有统计学差异(χ2=4.503,P=0.034),其他均无统计学意义。
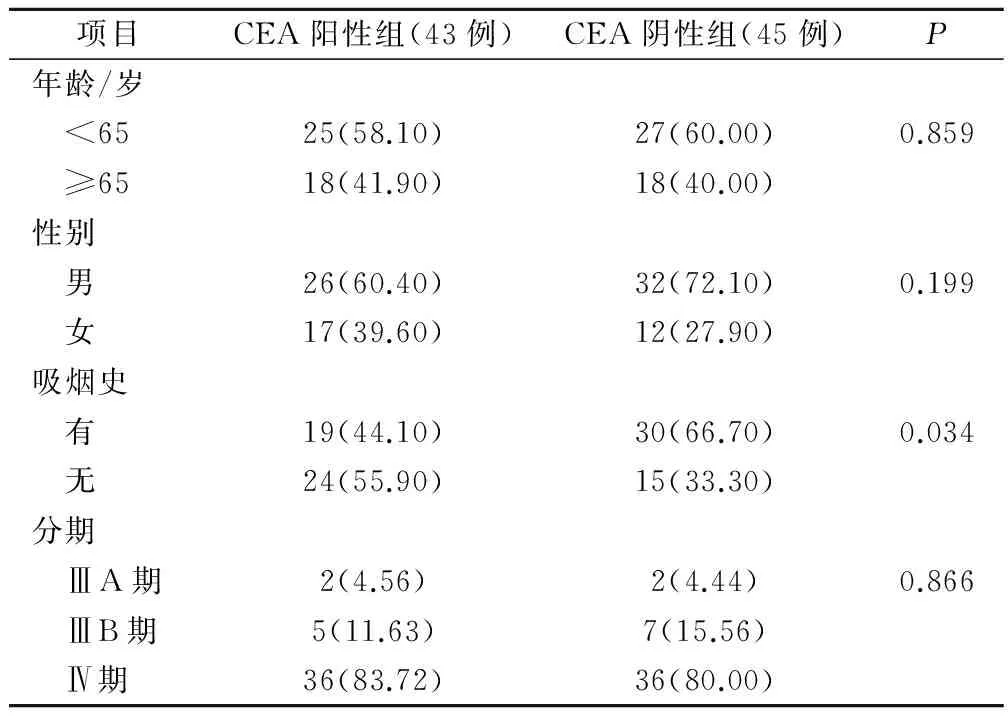
表1 两组一般临床资料比较(例,%)
2.2 近期化疗疗效
所有患者化疗近期疗效均可以得到评价,结果见表2、表3。化疗2个周期后进行评价,两组疾病控制率(DCR)比较差异无统计学意义(χ2=1.152,P=0.283);化疗4个周期后进行评价,两组疾病控制率(DCR)差异有统计学意义(χ2=4.477,P=0.034),其中CEA阴性组化疗2个周期后进展的9例中有4例改用或附以靶向药物治疗退出随访,血清CEA阳性组近期化疗疗效优于血清CEA阴性组。

表2 两组患者治疗2个周期后疗效比较/例
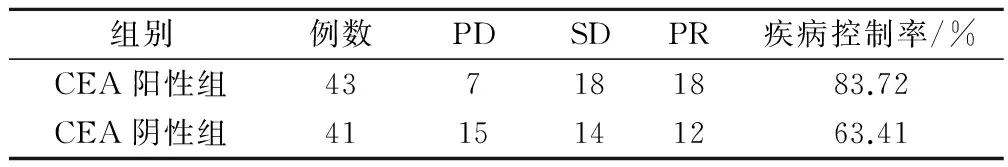
表3 两组患者治疗4个周期后疗效比较/例
2.3 生存分析
所有患者均得到随访。CEA阳性组患者:共43例,其中有1例于化疗第4个周期结束后死亡,2例于化疗第6个周期结束后辅以靶向治疗,1例于化疗第6个周期结束后失访,1例于化疗第7个周期结束后辅以病灶局部放疗,2例于化疗第8个周期结束后失访。CEA阳性组平均无进展生存时间为(7.66±0.59)个月,中位无进展生存时间为7.0个月[95%CI:(5.61,8.39)]。CEA阴性组患者:共45例,其中有4例于化疗第2个周期结束评估病情进展后改用或辅以靶向治疗,1例于化疗第4个周期结束后死亡,4例于化疗第8个周期结束后失访。CEA阴性组平均无进展生存时间为(6.12±0.52)个月,中位无进展生存时间为5.4个月[95%CI:(3.49,7.35)]。两组患者化疗的长期疗效比较差异有统计学意义(χ2=4.548,P=0.033)。两组患者生存函数见图1。

图1 两组患者生存函数图
3 讨论
CEA作为一个广谱性血清肿瘤标志物,在非小细胞肺癌(NSCLC)特别是肺腺癌的诊断中有着重要地位[3]。近年来,随着对其研究的逐渐增多,越来越多的文献报道证明血清CEA水平在非小细胞肺癌(NSCLC)靶向治疗疗效中有着重要的预测作用[6-7]。血清CEA阴性患者表皮生长因子受体(EGFR)突变率明显小于血清CEA阳性患者[8-9],且EGFR酪氨酸激酶抑制剂(EGFR-TKIs)疗效与血清CEA水平呈负相关[6]。具体机制尚未完全明确,有报道EGFR下游通路可以上调CEA的表达,而CEA的过表达可以抑制肿瘤细胞的凋亡[10-11]。因此,CEA是一个与突变型EGFR(特别是19外显子突变的EGFR)相关的抗凋亡因子[9]。血清CEA阴性很可能提示患者EGFR无突变,且EGFR-TKIs疗效差[6-9]。在晚期非小细胞肺癌患者中EGFR突变患者化疗疗效明显优于EGFR野生型患者[12]。上述证据提示我们,在晚期肺腺癌患者中血清CEA水平或许可以作为化疗疗效预测的重要参考因素。
我们对88例中晚期肺腺癌患者的化疗疗效进行回顾性分析。根据其血清CEA水平,分为CEA阳性组及CEA阴性组。对88例患者的一般临床资料分析示:CEA阳性组及CEA阴性组患者在年龄、性别、分期上的差异均无统计学意义,而CEA阴性组患者中有吸烟史的比例明显高于CEA阳性组:CEA阳性组 vs CEA阴性组=66.7% vs 44.1%,差异有统计学意义(P=0.034)。这一结果也与目前所知的有吸烟史的肺癌患者EGFR突变率低,EGFR-TKIs治疗效果差相符[13-14]。
两组患者的近期化疗疗效分别于第2周期及第4周期结束时,根据实体瘤的疗效评价(RECIST)标准[5]进行评估。结果提示:两组患者2周期内疾病控制率DCR的差别无统计学差异。分析其原因可能是样本量不足,或时间过短。两组患者4周期内DCR:CEA阳性组 vs CEA阴性=84.72% vs 63.41%,差异有统计学意义(χ2=4.477,P=0.034)。这一结果提示,CEA阳性组患者的近期化疗疗效优于CEA阴性组患者。
两组患者的远期化疗疗效通过无进展生存期(PFS)来进行对比。CEA阳性组患者平均PFS及中位PFS均大于CEA阴性组,结合两组生存曲线,提示CEA阳性组患者的远期化疗疗效优于CEA阴性组患者。本研究中尚存在样本量不足、失访及退出随访人数偏多等不足,这些有可能对研究的结果造成影响。
综上所述,本课题对88例晚期肺腺癌患者血清CEA水平及化疗疗效的关系进行分析,结果显示有吸烟史的患者更易出现血清CEA阴性,血清CEA阳性组化疗近期疗效及远期疗效均优于血清CEA阴性组。血清CEA对晚期肺腺癌患者化疗疗效有预测意义。因此,对于血清CEA阴性的晚期肺腺癌患者的针对性治疗是以后研究的重点。
[1] Torre LA,Bray F,Siegel RL,et al.Global cancer statistics,2012〔J〕.CA Cancer J Clin,2015,65(2):87-108.
[2] Ando S1,Kimura H,Iwai N,et al.The significance of tumour markers as anindication for mediastinoscopy in non-smallcell lung cancer〔J〕.Respirology,2003,8(2):163-167.
[3] Sakao Y,Tomimitsu S,Takeda Y,et al.Carcinoembryonic antigen as a predictive factor for postoperative tumorrelapse in early-stage lung adenocarcinom〔J〕.Eur J Cardiothorac Surg,2004,25(4):520-522.
[4] Cedres S,Nunez I,Longo M,et al.Serumtumor markers CEA,CYFRA21-1,and CA-125 are associated with worse prognosis in advanced non-small cell lung cancer(NSCLC)〔J〕.Clin Lung Cancer,2011,12(3):172-179.
[5] Kim HS,Kim JH,Yang I.Tumor response assess-ment by measuring the single largest lesionper organ in patient swith advanced non-sm-all cell lung cancer〔J〕.Lung cancer,2014,85(3):385-389.
[6] Jung M,Kim SH,Lee YJ,et al.Prognostic and predictive value of CEA and CYFRA 21-1 levels in advanced non-small cell lung cancer patients treated with gefitinibor erlotinib〔J〕.Exp Ther Med,2011,2(4):685-693.
[7] Okamoto T,Nakamura T,Ikeda J,et al.Serum carcinoembryonic antigen as a predictive marker for sensitivity togefitinib in advanced non-small cell lung cancer〔J〕.Eur J Cancer,2005,41(9):1286-1290.
[8] Pan JB,Hou YH,Zhang GJ.Correlation Between EGFR M- utations and Serum Tumor Markers in Lung Adenocarcinoma Patients〔J〕.Asian Pac J Cancer Prev,2013,14(2):695-700.
[9] Jin B,Dong Y,Wang HM,et al.Correlation between serum CEA levels and EGFR mutations in Chinese nonsmokers with lung adenocarcinoma〔J〕.Acta Pharmacol Sin,2014,35(3):373-380.
[11] Wirth T,Soeth E,Czubayko F.Inhibition of endogenous carcinoembryonic antigen(CEA)increases the apoptotic rate of colon cancer cells and inhibits metastatic tumor growth〔J〕.Clin Exp Metastasis,2001,19(2):155-160.
[12] Qin N,Zhang Q,Wang J,et al.Associatstatus and the efficacy of first-line chemotherapyin patients with advanced non-small cell lung cancer〔J〕.Zhongguo Fei Ai Za Zhi,2015,18(3):131-137.
[13] Zhao LD,Li JL,Wang Y,et al.Factors affecting the sensitivity of EGFR-TKI treatment in advanced non-smal cell lung cancer〔J〕.Zhonghua Zhong Liu Za Zhi,2011,33(3):217-221.
[14] Gao J,Chen JQ,Zhang L,et al.Relationship between EGFR and KRAS mutations and prognosis in Chinese patients with non-small cell lung cancer:a mutation analysis with realtime polymerase chain reaction using scorpion amplification refractory mutation system〔J〕.Zhonghua Bing Li Xue Za Zhi,2012,41(10):652-656.
(编辑:吴小红)
Relationship between Serum CEA Level and Chemotherapeutic Efficacy of Lung Adenocarcinoma
QIUDong,ZHANGQin,LINGChunhua,etal.
TheFirstAffiliatedHospitalofSuzhouUniversity,Suzhou,215006
Objective To investigate the relationship between serum CEA level and chemotherapeutic efficacy of patients with advanced lung adenocarcinoma.Methods Retrospective analysis was conducted in 88 patients with advanced lung adenocarcinoma.The influence factors of serum CEA level,and the relationship between serum CEA level and chemotherapeutic efficacy were analyzed respectively.Results Smoking history was an independent factor influencing serum CEA level of patients with advanced lung adenocarcinoma(χ2=4.503,P=0.034).The short-term curative effect in serum CEA positive group was superior to that in serum CEA negative group.The difference was statistically significant(χ2=4.477,P=0.034).Moreover,average progression-free survival and the median progression-free survival of patients in serum CEA positive group were longer than that of patients in serum CEA negative group,statistically significant difference was also observed(χ2=4.548,P=0.033).Conclusion The effect of chemotherapy on patients with positive serum CEA in intermediate and advanced stage is better compared to patients with negative serum CEA.
CEA;Lung Adenocarcinoma;Chemotherapy;Efficacy
江苏省"六大人才高峰"项目(编号:2012-WS-053);苏州市科技发展计划项目(编号:SYS201322)
215006苏州大学附属第一医院
凌春华
10.3969/j.issn.1001-5930.2017.01.002
R734.2
A
1001-5930(2017)01-0005-04
2016-03-07
2016-11-15)

