金丝桃素抗乙型肝炎病毒作用及机制的体外研究*
蓝天云,范 红,陈勇彬,杨翠萍,赵兴旺,李 岩△
(1.昆明理工大学医学院,昆明 650032;2.云南省第一人民医院消化内科,昆明 650032;3.中国科学院昆明动物研究所,昆明 650223)
金丝桃素抗乙型肝炎病毒作用及机制的体外研究*
蓝天云1,2,范 红1,2,陈勇彬3,杨翠萍3,赵兴旺1,李 岩1,2△
(1.昆明理工大学医学院,昆明 650032;2.云南省第一人民医院消化内科,昆明 650032;3.中国科学院昆明动物研究所,昆明 650223)
目的 从细胞水平评价金丝桃素(HY)的抗乙型肝炎作用,并初步探寻其药物作用靶点。方法 选择可分泌乙型肝炎病毒的肝细胞株HepG2.2.15为实验对象,HY为HY组,拉米夫定(3TC)为3TC组,去离子水为空白对照组,对细胞进行分组给药。给药72h后,采用Southern印记杂交及荧光定量PCR检测病毒HBV-DNA的复制水平;ELISA检测HBV表面抗原(HBsAg)和HBVe抗原(HBeAg)的抑制率;采用Northernblot与荧光定量PCR检测pgRNA的表达水平;Westernblot及荧光定量PCR检测调控因子肝细胞核因子3(HNF3β)、肝细胞核因子4(HNF4α)、过氧化物酶体增殖激活受体/视黄受X受体(PPARα/RXRα)的表达水平。结果 与空白对照组相比,HY组与3TC组对HepG2.2.15细胞中的HBVDNA及HBsAg、HBeAg的表达有明显抑制作用(P<0.05)。与空白对照组相比,HY可显著减少pgRNA的表达(P<0.05),而3TC无明显变化(P>0.05)。与空白对照组和3TC组相比,HY对调控因子HNF3β与HNF4α的表达有显著影响(P<0.05),但对PPARα和PXRα的表达无影响(P>0.05)。结论HY具有强效抗乙型肝炎病毒作用,且其可使负向调控因子HNF3β的表达升高并降低正向调控因子HNF4α的表达。提示其药物作用靶点可能为pgRNA。
肝炎,乙型;肝炎病毒,乙型;金丝桃素;DNA,病毒;pgRNA;肝富集转录因子
乙型病毒性肝炎(简称乙肝)是由乙型嗜肝DNA病毒(hepatitis B virus,HBV)引起的一种世界范围内的传染性疾病,对人类健康危害重大[1]。目前,国际上应用最广泛的抗HBV药物是核苷类化合物,代表药物有拉米夫定(lamivudine,3TC)、替比夫定(sebivo)等[2],其作用靶点为HBV DNA聚合酶/逆转录酶[3-4]。但长期应用核苷类药物时,编码HBV DNA聚合酶/逆转录酶的基因区域发生点突变使酶活性部位变化而产生病毒变异株和耐药株[5],从而使得抗病毒效果大为下降,因此,寻找新的抗病毒药物靶点成为乙肝研究中的重点与热点。HBV前体RNA(pregenomic RNA,pgRNA)是乙肝复制过程中的重要中间体,其表达量下调,不仅可以减少生成核衣壳的核心蛋白的表达,更能直接减少病毒逆转录生成新的HBV DNA[6]。因此,pgRNA是目前HBV复制过程中的关键点,也是目前抗HBV新靶点的研究热点。

表1 荧光定量PCR引物
金丝桃素(hypericin,HY)是贯叶连翘等HY植物的主要活性成分之一。本课题组的前期研究显示,HY具有强效抗HBV活性,但对HBV DNA聚合酶/逆转录酶无抑制作用,而可以明显下调pgRNA表达水平,提示其药物作用靶点可能与pgRNA相关[7]。pgRNA主要是通过肝富集转录因子(liver enriched transcription factor,LETFs)肝细胞核因子3(HNF3),肝细胞核因子4(HNF4),过氧化物酶体增殖激活受体/视黄素X受体(PPARα/RXRα)调控。因此,本实验对HY抗HBV作用进行验证,并在此基础上对HY的可能靶点pgRNA及靶点相关调控因子的表达进行了更加深入的研究。
1 材料与方法
1.1 材料 可分泌HBV活病毒的肝细胞株HepG2.2.15由武汉同济医院肝病研究所馈赠HY(95%,HPLC)购自Sigma公司;3TC由武汉同济医院肝病研究所馈赠。高糖DMEM培养液及胎牛血清购自GIBCO公司;胰酶购自碧云天公司;地高辛标记及检测试剂盒购自Roche;HBV表面抗原(hepatitis B virus surface antigen,HBsAg)和HBV e抗原(hepatitis B virus e antigen,HBeAg)检测试剂盒购自上海科华生物工程公司;反转录试剂盒及SYBRGreen荧光定量PCR检测试剂盒均购自Bio-rad公司;AxyPrep液体病毒DNA/RNA提取试剂盒及总RNA小量制备试剂盒;试验所用抗体一抗及二抗体均购自Abcam公司。
1.2 方法
1.2.1 细胞培养及化合物干预 将细胞以(1~2)×106接种于10 cm培养皿中,所有细胞均使用含有10%小牛血清的培养基培养。细胞培养24 h后,细胞分为3组,分别为空白对照组、HY组及3TC组。去离子水加入空白对照组的细胞的培养基中;3TC以半数有效浓度1.0 μmol/L为终浓度加入3TC组细胞的培养基中;HY以半数有效浓度0.5 μmol/L为终浓度加入HY组细胞的培养基中,HY的配制与给药均在弱光条件下进行,给药后,将HY置于4 000 W/m2光源下照射1 h后,放入37 ℃,5%CO2的培养箱中培养。24 h更换一次培养基,72 h后进行指标检测。
1.2.2 HBV DNA复制水平检测 使用AxyPrep液体病毒DNA/RNA小量制备试剂盒提取HepG.2.2.15细胞培养基中细胞分泌的HBV DNA,具体方法如下:取250 μL样品,加入500 μL裂解液,振荡混匀,静置5 min后加入125 μL蛋白去除液,125 μL蛋白沉淀液,混匀后12 000×g离心5 min,转移入制备管中,5 000×g离心1 min后,弃去滤液,加入700 μL洗涤液,6 000×g离心1 min,并重复洗涤1次,12 000×g离心1 min,用60 μL去离子水洗脱。取各组所提取的DNA样品30 μg,使用Southern印记杂交(Southern blot)检测HBV DNA的复制情况,尼龙膜转印,紫外交联,使用地高辛标记试剂盒标记的HBV DNA探针杂交过夜,化学发光显影。取各组DNA样品,使用染料法荧光定量PCR,检测HBV DNA复制水平,引物列表见表1。使用Bio-rad荧光定量PCR仪进行检测。95 ℃预变性10 min,95 ℃ 15 s;60 ℃ 1 min扩增40个循环。
1.2.3 酶联免疫吸附试验(ELISA)检测HBsAg和HBeAg的抑制率 吸取不同药物处理后的各组细胞上清液,用ELISA 法测定细胞上清液中的HBsAg 和HBeAg抗原量,具体方法为:设置空白对照与阴性、阳性对照组各两孔,每个实验样品设置3个复孔,每孔加入相应样品50 μL,除空白对照孔外每孔加入酶结合物50 μL,加盖封板膜,振荡混匀,37 ℃反应1 h后弃反应液,50 μL洗液反复洗涤5次,加入显色液,加封板膜振荡混匀,37 ℃避光显色15 min,显色终止后在酶标仪450 nm 波长处进行扫描。
1.2.4 总RNA的提取与目标mRNA表达水平检测 收集HepG2.2.15各组细胞,使用 AxyPrep总RNA小量制备试剂盒提取所收集细胞中的总RNA,具体步骤如下。收集各组细胞,加入400 μL细胞裂解液,漩涡振荡,加入150 μL裂解中和液,漩涡振荡,12 000×g离心5 min,取上清液,加入250 μL异丙醇,混合均匀后转移至制备管中,6 000×g离心1 min,弃滤液,加入500 μL洗涤液,12 000×g离心1 min,弃去滤液,加入500 μL去盐液,12 000×g离心1 min,重复洗涤1次后1 200×g离心1 min,使用100 μL RNase-free水洗脱。取各组所提取的总RNA 10 μg,进行Northern印记杂交(Northern blot)检测pgRNA表达水平尼龙膜印迹,地高辛标记试剂盒标记的pgRNA探针杂交,化学发光显影。取各组所提取的总RNA 1 μg进行反转录,得到cDNA,使用染料法荧光定量PCR检测pgRNA及各肝富集因子mRNA的表达水平进行检测,引物列表见表1。
1.2.5 总蛋白提取及指标检测 将收集细胞使用RIPA Lysis Buffer[50 mmol/L Tris-HCl(pH7.4)+150 mmol/L NaCl+1%NP-40+PMSF]进行重悬,冰上放置10 min后,将装有细胞悬液的EP管放入液氮中反复冻融2~3次。4 ℃ 13 000 r/min离心20 min,取上清液。取各组所提取蛋白20 μg,Western blot检测肝富集因子NF3β,HNF4α,PPARα/RXRα的表达水平,β-actin为内参基因,聚偏二氟乙烯(PVDF)膜印迹,所用抗体均购自abcam公司,化学发光法显影。

2 结 果
2.1HY对HBVDNA复制的影响HY作用可分泌活病毒的HepG2.2.15细胞后,对HBVDNA的Southernblot检测表明,与空白对照组相比,HY组与3TC组HBVDNA的表达有明显下调),差异具有统计学意义(P<0.05)。荧光定量PCR的结果同样表明了相同的结果,见图1。
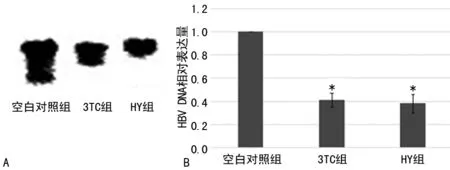
*:P<0.05,与空白对照组比较。A:Southernblot检测HBVDNA表达;B:荧光定量法检测HBVDNA表达。
图1 药物处理后各组HBVDNA的表达变化
2.2HY对HBsAg和HBeAg的抑制率 实验同时用ELISA法检测了各组HBsAg和HBeAg在药物处理后的表达变化。3TC组、HY组与空白对照组相比,HBsAg和HBeAg的抑制率均差异有统计学意义(P<0.05),见表2。
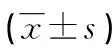
表2 HY对HBsAg和HBeAg的抑制作用
a:P<0.01,b:P<0.05,与空白对照组比较。
2.3HY对pgRNA的表达水平的影响Northernblot结果显示HY组与3TC组及空白对照组相比,HepG2.2.15 细胞株pgRNA下降明显(P<0.05),但3TC组及空白对照组相比,pgRNA差异无统计学意义(P>0.05)。荧光定量PCR的结果显示与Northernblot一致,见图2。
*:P<0.05,与HY组比较。A:Northernblot检测pgRNA表达;B:荧光定量法检测pgRNA的表达。
图2 给药后各组pgRNA的表达变化
2.4HY对各肝富集因子的影响 研究分别从mRNA与蛋白质水平初步探查了HY和调控pgRNA转录的几个相关的肝富集转录因子的表达水平。HepG2.2.15细胞组的Westernblot结果与荧光定量PCR结果(图3)相同,HY组与空白对照组相比,HepG2.2.15细胞株HNF3β的表达明显升高(P<0.05),HNF4α表达降低(P<0.05),而PPARα和RXRα的表达差异无统计学意义(P>0.05);但3TC组与空白对照组相比,4种调控因子均无明显表达差异无统计学意义(P>0.05)。
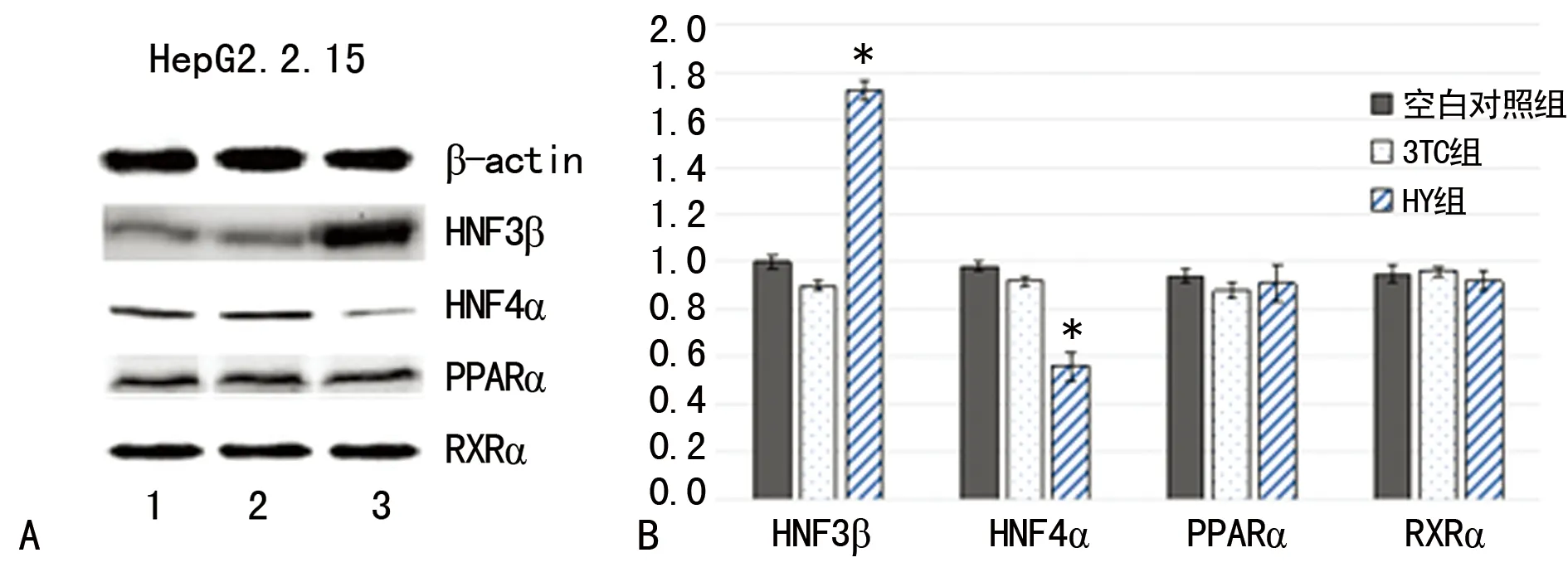
*:P<0.05,与空白对照组比较。1:空白对照组;2:3TC组;3:HY组,β-catin为内参。A:Westernblot检测肝富集因子表达;B:荧光定量法检测肝富集因子表达。
图3 给药后检测各组肝富集因子表达变化
3 讨 论
现有的抗HBV药物中,主要以核苷类化合物为主,在临床的应用过程中,耐药株与变异株的产生导致药物疗效明显下降,所以寻找新的抗病毒药物靶点成为乙肝研究中的重点与热点。许多研究分别从HBV周期中的不同阶段寻找HBV新靶点。Krepstakies等[13]发现人工合成的抗脂多肽端可以结合硫酸乙酰肝素以抑制HBV和HCV等包膜病毒进入宿主细胞。Park等[14]发现shRNA可诱导HBVcccDNA甲基化,从而降低其转录活性。Cai等[15]发现了可抑制RCDNA转化成cccDNA的磺胺类替代物CCC-0975和CCC-0346。有研究筛选对HBVDNA的复制有抑制作用的siRNA,这些siRNA可以作为未来基因治疗的备选方案[16-17]。
在众多新靶点研究中,pgRNA由于其在病毒复制中的多重角色与关键身份成为了研究的热门。因为pgRNA是乙肝复制过程中的重要中间体,其不仅是HBcAg与HBeAg的翻译模板,同时也是HBVDNA的反转录模板[18-19]。因此,如果pgRNA表达量下调,势必会抑制HBVDNA的复制。pgRNA长3.5×103,由Cp启动子转录HBV基因组C开放阅读框生成,Cp启动子含有特异的DNA结合位点,蛋白质调控因子结合特异性与之结合可以直接调节其活性[20]。这些蛋白质调控因子主要有肝富集转录因子,如:HNF3β、HNF4α和PPARα/RXRα[21]。现已有多篇文章报道了通过降低pgRNA的表达来抑制HBVDNA的表达:合成的Phenylpropenamide衍生物AT-130可以通过阻碍胞内pgRNA的壳体化过程[22]。而另一研究发现的缺失一个DNA结合域的小异源二聚体(smallheterodimerpartner,SHP)与Yeo从中国台湾杉芯材中分离出的木酚素化合物(helioxanthin)则是通过影响调控Cp启动子调控因子表达水平,降低Cp启动子的活性来抑制pgRNA的转录[20,23]。
有研究表明,HY有广泛抗包膜病毒的作用,对鼠巨细胞病毒、艾滋病病毒、单纯疱疹病毒以及鸭乙肝病毒均有较好的抑制作用[24]。本课题组前期研究发现,HY对HepG2.2.15中的HBVDNA的复制有明显抑制作用[7]。但其对核苷类药物靶点HBVDNA聚合酶/逆转录酶无抑制作用,证明其作用机制与核苷类药物不同[7]。此次研究结果表明,HY具有强效抗HBV活性,且可引起pgRNA的表达水平的降低;而3TC组,不影响pgRNA的表达,提示HY的药物靶点可能与pgRNA相关。
pgRNA是HBs和HBe蛋白的翻译模板,但众多研究已经证实,下游产物HBs和HBe对pgRNA的生成不具有调节作用[25]。因此pgRNA的表达由上游转录部分调控。肝富集调控因子HNF3β、HNF4α和PPARα/RXRα等蛋白调控因子可以与上游转录部分特定位点结合,调控pgRNA的表达[19]。Tang等[26]在NIH3T3细胞中分别共转染HBVDNA与各肝富集因子表达质粒实验中发现,HNF3β对HBV的复制有抑制作用而HNF4α和PPARα/RXRα对HBV的复制起正向调控的作用[19,27]。本研究为了进一步探究HY如何作用于pgRNA,实验在药物干预后,检测了HepG2.2.15细胞中的四种调控因子表达水平。结果显示,HY在肝脏细胞中能使pgRNA表达下调的肝富集因子HNF3β蛋白表达水平升高,使pgRNA表达上调的HNF4α蛋白表达水平下降。而另外两种调控因子PPARα/RXRα表达无变化。这说明HY有可能作用于调控pgRNA转录的肝富集因子HNF3β、HNF4α,使其表达水平发生变化,从而使pgRNA的表达降低。
本研究对HY抗HBV的靶点进行了初步的探寻,实验结果显示其可能通过调控HNF3β与HNF4α的表达水平以抑制pgRNA的转录活性。下一步拟在非肝源细胞系中通过转染各调控因子来研究HY抗病毒作用机理,对这些机理的深入研究不仅为HY对pgRNA的作用及抗病毒机制得到阐明,也为其将来的临床应用提供实验基础。
[1]ChatterjeeK.AnimprovedNATassaywithenhancedsensitivityforHBVfordonorbloodscreening[J].JLabPhysicians,2012,4(2):127.
[2]AlexanderHK,BonhoefferS.Pre-existenceandemergenceofdrugresistanceinageneralizedmodelofintra-hostviraldynamics[J].Epidemics,2012,4(4):187-202.
[3]GageyD,RavettiS,CastroEF,etal.Antiviralactivityof5′-O-carbonate-2′,3′-dideoxy-3′-thiacytidineprodrugsagainsthepatitisBvirusinHepG2 2.2.15cells[J].IntJAntimicrobAgents,2010,36(6):566-569.
[4]BertoliA,GiovanniniA,RuffoniB,etal.BioactiveconstituentproductioninSt.John′sWortinvitrohairyRoots.Regeneratedplantlines[J].JAgricFoodChem,2008,56(13):5078-5082.
[5]FernandesH,KoniecznaM,KolodziejczykR,etal.CrystallizationandpreliminarycrystallographicstudiesofHyp-1,aStJohn′swortproteinimplicatedinthebiosynthesisofhypericin[J].ActaCrystallogrSectFStructBiolCrystCommun,2008,64(5):405-408.
[6]PourkarimMR,Amini-Bavil-OlyaeeS,VerbeeckJ,etal.Molecularevolutionaryanalysisandmutationalpatternoffull-lengthgenomesofhepatitisBvirusisolatedfromBelgianpatientswithdifferentclinicalmanifestations[J].JMedVirol,2010,82(3):379-389.
[7]李岩,汤敏,安瑛,等.金丝桃素体外抗乙型肝炎病毒的作用[J].中华传染病杂志,2012,30(8):459-462.
[8]XuWS,ZhaoKK,MiaoXH,etal.EffectofoxymatrineonthereplicationcycleofhepatitisBvirusinvitro[J].WorldJGastroenterol,2010,30(16):2028-2037.
[9]PetheP,NagvenkarP,BhartiyaD.Polycombgroupproteinexpressionduringdifferentiationofhumanembryonicstemcellsintopancreaticlineageinvitro[J].BMCCellBiol,2014,15(8):18.
[10]CuiL,ShiY,ZhouX,etal.AsetofmicroRNAsmediatedirectconversionofhumanumbilicalcordlining-derivedmesenchymalstemcellsintohepatocytes[J].CellDeathDis,2013,4(11):e918.
[11]AlexandraR,CarineL,RozennJ,etal.ComparativegeneexpressionprofilesinducedbyPPARcandPPARa/cagonistsinhumanhepatocytes[J].PLoSOne,2011,6(4):e18816.
[12]GuéritD,PhilipotD,ChuchanaP,etal.Sox9-regulatedmiRNA-574-3pinhibitschondrogenicdifferentiationofmesenchymalstemcells[J].PLoSOne,2013,8(4):e62582.
[13]KrepstakiesM,LuciforaJ,NagelCH,etal.Anewclassofsyntheticpeptideinhibitorsblocksattachmentandentryofhumanpathogenicviruses[J].JInfectDis,2012,205(11):1654-1664.
[14]ParkHK,MinBY,KimNY,etal.ShorthairpinRNAinducesmethylationofhepatitisBviruscovalentlyclosedcircularDNAinhumanhepatomacells[J].BiochemBiophysResCommun,2013,436(2):152-155.
[15]CaiD,MillsC,YuW,etal.IdentificationofdisubstitutedsulfonamidecompoundsasspecificinhibitorsofhepatitisBviruscovalentlyclosedcircularDNAformation[J].AntimicrobAgentsChemother,2012,56(8):4277-4288.
[16]KonishiM,WuCH,WuGY.InhibitionofHBVreplicationbysiRNAinastableHBV-producingcellline[J].Hepatology,2003,38(4):842-850.
[17]LiuJ,GuoY,XueCF,etal.Effectofvector-expressedsiRNAonHBVreplicationinhepatoblastomacells[J].WorldJGastroenterol,2004,10(13):1898-1901.
[18]MohamadkhaniA,PourdadashA,TayebiS,etal.ThepotentialroleofAPOBEC3GinlimitingreplicationofhepatitisBvirus[J].ArabJGastroenterol,2012,13(4):170-173.
[19]SeitzG,KrauseR,FuchsJ,etal.Invitrophotodynamictherapyinpediatricepitheliallivertumorspromotedbyhypericin[J].OncolRep,2008,20(5):1277-1282.
[20]OropezaCE,LiL,MclachlanA.Differentialinhibitionofnuclearhormonereceptor-dependenthepatitisBvirusreplicationbythesmallheterodimerpartner[J].JVirol,2008,82(8):3814-3821.
[21]MogilenkoDA,DizheEB,ShavvaVS,etal.RoleofthenuclearreceptorsHNF4alpha,PPARalpha,andLXRsintheTNFalpha-mediatedinhibitionofhumanapolipoproteinA-IgeneexpressioninHepG2cells[J].Biochemistry,2009,48(50):11950-11960.
[22]DelaneyWE,EdwardsR,ColledgeD,etal.PhenylpropenamidederivativesAT-61andAT-130inhibitreplicationofwild-typeandlamivudine-resistantstrainsofhepatitisBvirusinvitro[J].AntimicrobAgentsChemother,2002,46(9):3057-3060.
[23]LiY,FuL,YeoH,etal.InhibitionofhepatitisBvirusgeneexpressionandreplicationbyhelioxanthinanditsderivative[J].AntivirChemChemother,2005,16(3):193-201.
[24]SharmaKV,DavidsLM.Depigmentationinmelanomasincreasestheefficacyofhypericin-mediatedphotodynamic-inducedcelldeath[J].PhotodiagnosisPhotodynTher,2012,9(2):156-163.
[25]MalmstrõmS,LarssonSB,HannounC,etal.HepatitisBviralDNAdeclineatlossofHBeAgismainlyexplainedbyreducedcccDNAload--down-regulatedtranscriptionofPgRNAhaslimitedimpact[J].PLoSOne,2012,7(7):e36349.
[26]TangH,MclachlanA.TranscriptionalregulationofhepatitisBvirusbynuclearhormonereceptorsisacriticaldeterminantofviraltropism[J].ProcNatlAcadSciUSA,2001,98(4):1841-1846.
[27]TangH,RaneyAK,MclachlanA.ReplicationofthewildtypeandanaturalhepatitisBvirusnucleocapsidpromotervariantisdifferentiallyregulatedbynuclearhormonereceptorsincellculture[J].JVirol,2001,75(19):8937-8948.
In vitro study on anti-HBV effects and mechanism of hypericin*
LanTianyun1,2,FanHong1,2,ChenYongbin3,YangCuiping3,ZhaoXingwang1,LiYan1,2△
(1.MedicalCollege,KunmingUniversityofScienceandTechnology,Kunming,Yunnan650032,China;2.DepartmentofGastroenterologyYunnanProvincialFirstPeople′sHospital,Kunming,Yunnan650032,China;3.KunmingInstituteofZoology,ChineseAcademyofSciences,Kunming,Yunnan650223,China)
Objective To evaluate the anti-HBV effect of hypericin from the cellular level and to preliminarily explore its potential drug target point.Methods Liver cell line HepG2.2.15 cells secreting HBV particles were selected as the experimental objects.Hypericin served as the HY group,lamivudine was taken as 3TC group and deionized water as the blank control group.The cells were grouped and administrated.The HBV-DNA copy level was measured at72 h after medication by Southern blot and fluorescent quantitative PCR;the inhibition rate of HBsAg and HBeAg was detected by using ELISA assay;the pgRNA expression level was tested by using Northern blot and fluorescent quantitative PCR;Western blot and fluorescent quantitative PCR were adopted to detect the expression of regulatory factors including HNF3β,HNF4α,PPARα and RXRα.Results Compared to the blank control group,both hypericin and lamivudine had significant inhibiting effect on HBV DNA and expression level of HBsAg and HBeAg in HepG2.2.15 cells (P<0.05).Hypericin could significantly decrease the pgRNA expression compared with the blank control group (P<0.05),while lamivudine had no obvious change (P<0.05).Moreover,hypericin exhibited significant effects on the expression of HNF3β and regulatory factor HNF4α compared with the blank control group and 3TC group(P<0.05).Conclusion Hypericin represents a strong anti-HBV effect,moreover could increase the negative regulatory factor HNF3βn expression and decreases the positive factor HNF4α expression,prompting that its drug target point could be pgRNA.
hepatitis B;hepatitis B virus;hypericin;DNA,viral;pregenomic RNA;liver enriched transcription factor
��·基础研究
10.3969/j.issn.1671-8348.2017.01.007
国家自然科学基金青年科学基金项目(81300324);云南省科技应用基础研究计划项目(2011FZ282)。
蓝天云(1990-), 硕士,主要从事药理学方面研究。△
E-mail:hepatocellular@sina.com。
R
A
1671-8348(2017)01-0040-04
2016-07-18
2016-09-12)

