MiR-214对人乳腺癌MCF-7细胞生物学行为的影响*
田延锋,李 芳,刘 擘,赵增仁,代拥军,魏 明
河北医科大学第一医院普外科 石家庄 050031
MiR-214对人乳腺癌MCF-7细胞生物学行为的影响*
田延锋△,李 芳,刘 擘,赵增仁,代拥军,魏 明
河北医科大学第一医院普外科 石家庄 050031
△男,1969年4月生,硕士,教授,主任医师,研究方向:乳腺癌的基础与临床,E-mail:tianyanfeng1212@163.com
乳腺癌;微小RNA;MCF-7细胞;细胞增殖
目的:探讨微小RNA-214(miR-214)对人乳腺癌MCF-7细胞增殖、凋亡、迁移及周期分布等生物学行为的影响。方法:采用脂质体转染法将miR-214 模拟物转入MCF-7 细胞(实验组),以转入miR-214阴性对照的MCF-7 细胞(阴性对照组)作对照。采用实时荧光定量PCR 法检测miR-214的表达情况;CCK-8法检测细胞增殖能力的改变;流式细胞仪检测细胞凋亡及细胞周期;划痕愈合实验检测细胞的迁移。结果:实验组MCF-7细胞miR-214的表达较阴性对照组明显上调; 实验组细胞的增殖能力明显受到抑制;实验组凋亡细胞所占比例明显高于阴性对照组(P=0.008),G1期细胞数增加,S 期细胞数减少(P<0.05);划痕愈合实验表明,实验组细胞迁移能力明显受到抑制(P<0.001)。结论:MiR-214可能通过抑制乳腺癌MCF-7细胞增殖及迁移、促进细胞凋亡及影响细胞周期的分布而发挥抑癌作用。
乳腺癌是女性最常见的恶性肿瘤[1]。微小RNAs (miRNAs/miRs)是一个保守的小分子非编码RNA家族,长度约22个核苷酸,它们通过碱基配对的方式与靶基因的3’非翻译区 (UTR)互补结合而在转录后水平调控基因的表达,从而导致靶基因mRNA的降解或抑制其翻译[2-3]。有研究[4]表明,miRNAs可以调控人体约1/3基因的表达。miR-214可通过多种信号转导途径发挥抑癌或促癌的作用,并且与多种恶性肿瘤的发生发展及预后密切相关。目前,miR-214 在乳腺癌中的功能尚不清楚[5]。该研究拟采用脂质体转染的方法在乳腺癌细胞中过表达miR-214,观察miR-214过表达对乳腺癌MCF-7细胞增殖、凋亡、周期分布及迁移的影响,为乳腺癌的诊断及治疗提供新的思路。
1 材料与方法
1.1 细胞及主要试剂 人乳腺癌细胞株MCF-7为河北医科大学第一医院中心实验室保存。RPMI 1640 培养液、胎牛血清和胰蛋白酶购自美国Gibco公司;CCK-8 试剂购自同仁化学研究所;碘化丙啶购自索莱宝公司;青链霉素、Trizol 试剂和LipofectamineTM2000细胞转染试剂购自美国Invitrogen公司;miR-214 阴性对照及模拟物购于广州锐博生物科技有限公司;Annexin V-FITC细胞凋亡检测试剂盒购自深圳欣博盛生物科技有限公司;反转录试剂盒、Taqman Universal Master Mix 及相关引物均购自美国ABI公司。
1.2 细胞培养 乳腺癌MCF-7细胞用含体积分数10%胎牛血清及青链霉素的RPMI 1640 培养液于37 ℃、体积分数5%CO2的细胞培养箱中培养。根据细胞生长状况每2~3 d更换新鲜培养液1次。当细胞融合70%~80%时, 用胰蛋白酶消化并进行细胞传代或收集细胞。
1.3 细胞铺板及转染 收集细胞后,重悬混匀,调整细胞浓度至1×105mL-1,铺6孔板,2 mL/孔,混匀后入温箱中继续培养。培养24 h后严格按照LipofectamineTM2000说明书进行细胞转染,实验分为实验组(转染miR-214模拟物)及阴性对照组(转染miR-214阴性对照),每组设3个复孔。转染后6 h,更换无血清培养液为新鲜完全培养液,继续培养并进行后续实验。
1.4 实时荧光定量PCR检测转染后细胞miR-214的表达 转染48 h后,收集细胞,按照Trizol说明书提取的总RNA,应用实时荧光定量PCR(Taqman探针法)检测miR-214,严格按检测试剂盒说明书进行操作。按照TaqMan反转录试剂盒说明书合成cDNA。以cDNA为模板,按照试剂盒说明书提供的方法在Real-time PCR AB7500仪上进行PCR 扩增,以U6 为内参照。20 μL反应体系:TaqMan Universal Master Mix 10 μL,20×TaqMan Assay 1 μL,cDNA模板2 μL,RNase-free water 7 μL。反应条件:50 ℃ 2 min,95 ℃ 10 min,1个循环;然后95 ℃ 15 s,60 ℃ 1 min,40个循环。根据待测标本的Ct值,采用2-ΔCt法计算miR-214的相对表达量,其中ΔCt=目的基因Ct值-内参基因Ct值。
1.5 CCK-8法检测MCF-7细胞的增殖能力 转染48 h后,收集细胞,以新鲜的RPMI 1640培养液重悬细胞并调整浓度至1×104mL-1,铺板,每组均设5个复孔,分别于0、1、2、3及4 d检测细胞活性。检测前1 h每孔加入10 μL CCK-8溶液,在培养箱中培养1 h后用酶标仪测定450 nm处的吸光度(A450)值。以时间为横坐标,A450值为纵坐标绘制细胞生长曲线。
1.6 流式细胞仪检测MCF-7细胞凋亡情况 收集转染48 h后各组细胞,用预冷、4 ℃无菌的PBS液充分洗涤细胞2次。按照Annexin V-FITC试剂盒说明书进行溶液的配制,以250 μL结合缓冲液重新悬浮细胞,取195 μL的细胞悬液加入5 μL Annexin V-FITC,轻轻混匀,间隔3 min后再加入10 μL浓度为20 mg/L的碘化丙啶溶液,混匀后于室温下避光孵育10 min,加300 μL结合缓冲液,轻轻混匀后上流式细胞仪进行检测分析。
1.7 流式细胞仪检测MCF-7细胞周期 收集转染48 h后的细胞,4 ℃无菌PBS漂洗并离心2次,收集沉淀,加体积分数75%冰冻乙醇并振荡,4 ℃固定过夜。次日离心,弃上清,PBS洗涤细胞1次,采用碘化丙啶法检测细胞周期:加入200 μL含有50 mg/L碘化丙啶和100 mg/L RNA酶的PBS染色液,4 ℃避光静置1 h,最后上流式细胞仪检测。
1.8 划痕愈合实验 实验分组如1.3,以4×105细胞/孔均匀铺6孔板,待细胞培养至单层密度达80% ~ 90%时转染,转染方法同前。取转染后24 h的细胞,用200 μL无菌枪头在每孔底部画一条直线,1×PBS洗3 次,然后加入含有体积分数10%胎牛血清的RPMI 1640 培养基,37 ℃、体积分数5% CO2培养箱中培养。使用倒置相差显微镜分别在0 和48 h 时拍照。实验重复3次。运用Image-Pro Plus软件测算划痕宽度。划痕愈合率=(0 h划痕宽度-48 h划痕宽度)/0 h划痕宽度×100%。
1.9 统计学处理 采用SPSS 19.0分析。各组细胞中miR-214的表达、细胞凋亡、细胞周期及划痕愈合实验结果均采用两独立样本t检验。检验水准α=0.05。
2 结果
2.1 各组MCF-7细胞miR-214的表达 实验组miR-214表达水平为(669.00±638.80),阴性对照组为(0.94±0.04),实验组miR-214的表达远高于阴性对照组。
2.2 各组MCF-7细胞增殖情况 结果见图1。 说明转染miR-214模拟物能抑制MCF-7 细胞的增殖。
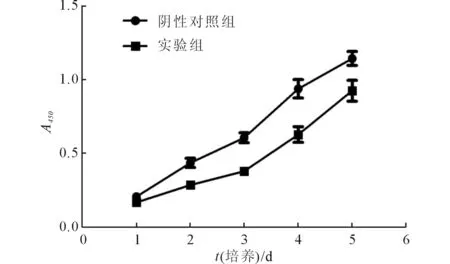
图1 各组MCF-7细胞增殖情况
2.3 各组MCF-7细胞的凋亡情况 实验组MCF-7凋亡细胞所占比例为(3.853±0.911)%,明显高于阴性对照组的(1.243±0.173)%,差异有统计学意义(t=4.887,P=0.008)。
2.4 各组MCF-7细胞周期的情况 结果见表1,实验组G1期细胞所占比例明显增多,S期细胞所占比例明显减少。
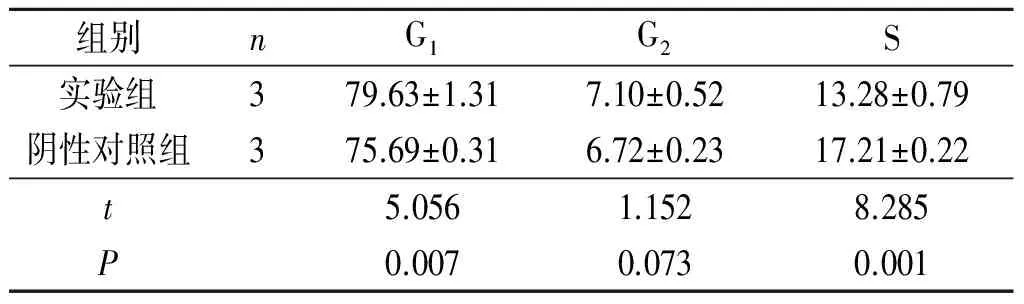
表1 各组MCF-7细胞周期的情况 %
2.5 划痕愈合实验结果 实验组划痕愈合率为(37.48±0.21)%,较阴性对照组[(60.35±2.29)%]明显降低(t=17.225,P<0.001)。见图1。

A:0 h;B:48 h;1:阴性对照组;2:实验组。图2 划痕愈合实验结果
3 讨论
最早被发现的miRNA家族成员lin-4,是在线虫中通过胚胎发育时间控制缺陷性遗传筛选实验[6]所鉴定的。现在被发现的miRNAs已有2 000多种,存在于人类和几乎所有的模式生物中,并在细胞增殖、分化和凋亡等细胞生物学进程中发挥着重要的调控作用[7]。Tang等[8]研究表明,miRNA-1258在乳腺癌组织中低表达,且主要将细胞周期阻滞于G1期而影响细胞的增殖。Liu等[9]发现三阴性乳腺癌组织中的miR-26a明显低表达,并且与淋巴结转移和预后相关,在三阴性乳腺癌细胞株中上调miR-26a的表达可以降低其增殖和侵袭的能力。李秀娟等[10]研究表明miR-34a过表达可增加乳腺癌细胞对阿霉素的药物敏感性。另一方面,一些miRNAs被证实在乳腺癌中表达上调。Zhang等[11]认为miR-155可以促进细胞增殖而起到癌基因的作用。Dong等[12]的研究表明,miR-21在三阴性乳腺癌中高表达,并可通过促进细胞增殖及抑制细胞凋亡而起到癌基因的作用。
多项研究表明,miR-214在肿瘤中低表达。张丽静等[13]采用脂质体转染的方法将miR-214模拟物转入人结肠癌HCT116细胞,通过MTT法、FCM 法及平板克隆形成实验证实,miR-214可抑制人结肠癌HCT116细胞的增殖并促进其凋亡。miR-214过表达可以抑制细胞的增殖、侵袭和迁移[14]。Long等[15]研究表明过表达miR-214可以抑制大肠癌细胞增殖、促进细胞凋亡。该研究结果显示实验组细胞中miR-214的表达明显升高,表明转染成功;miR-214可以抑制细胞的增殖及凋亡,将细胞阻滞在G1期,与Zhang等[11]认为的S期阻滞不同,这可能与细胞特异性有关。划痕愈合实验结果表明实验组较阴性对照组划痕愈合率降低,提示miR-214过表达可以抑制细胞的迁移。
总之,miR-214可能通过抑制乳腺癌细胞MCF-7增殖及迁移,促进细胞凋亡,且主要将细胞周期阻滞于G1期而发挥抑癌作用,但具体调控的靶基因及参与调节的信号通路仍待进一步研究。
[1]SIEGEL R,NAISHADHAM D,JEMAL A.Cancer statistics, 2013[J].CA Cancer J Clin,2013,63(1):11
[2]BARTEL DP.MicroRNAs: genomics, biogenesis, mechanism, and function[J].Cell,2004,116(2):281
[3]ZENG Y,CULLEN BR.Sequence requirements for micro RNA processing and function in human cells[J].RNA,2003,9(1):112
[4]LEWIS BP,BURGE CB,BARTEL DP.Conserved seed pairing, often flanked by adenosines, indicates that thousands of human genes are microRNA targets[J].Cell,2005,120(1):15
[5]HWANG ES,LICHTENSZTAJN DY,GOMEZ SL,et al.Survival after lumpectomy and mastectomy for early stage invasive breast cancer:the effect of age and hormone receptor status[J].Cancer,2013,119(7):1402
[6]LEE RC,FEINBAUM RL,AMBROS V.The C.elegans heterochronic gene lin-4 encodes small RNAs with antisense complementarity to lin-14[J].Cell,1993,75(5):843
[7]ZHAO Y,SRIVASTAVA D.A developmental view of microRNA function[J].Trends Biochem Sci,2007,32(4):189
[8]TANG D,ZHANG Q,ZHAO S,et al.The expression and clinical significance of microRNA-1258 and heparanase in human breast cancer[J].Clin Biochem,2013,46(10/11):926
[9]LIU P,TANG HL,CHEN B,et al.miR-26a suppresses tumour proliferation and metastasis by targeting metadherin in triple negative breast cancer[J].Cancer Lett,2015,357(1):384
[10]李秀娟,赵建华,唐金海.miR-34a可能靶向Notch1影响乳腺癌细胞对阿霉素的敏感性[J].中华肿瘤杂志,2014,36(12):892
[11]ZHANG CM, ZHAO J, DENG HY.MiR-155 promotes proliferation of human breast cancer MCF-7 cells through targeting tumor protein 53-induced nuclear protein 1[J].J Biomed Sci,2013,20:79
[12]DONG GZ,LIANG XL,WANG DG,et al.High expression of miR-21 in triple-negative breast cancers was correlated with a poor prognosis and promoted tumor cell in vitro proliferation[J].Med Oncol,2014,31(7):57
[13]张丽静,吴晨鹏,张志勇,等.MiR-214对人结肠癌HCT116细胞生物学功能的影响[J].肿瘤,2013,33(11):966
[14]WEN Z,LEI Z,JIN-AN M,et al.The inhibitory role of miR-214 in cervical cancer cells through directly targeting mitochondrial transcription factor A (TFAM)[J].Eur J Gynaecol Oncol,2014,35(6):676
[15]LONG LM,HE BF,HUANG GQ,et al.microRNA-214 functions as a tumor suppressor in human colon cancer via the suppression of ADP-ribosylation factor-like protein 2[J].Oncol Lett,2015,9(2):645
(2016-07-13收稿 责任编辑李沛寰)
Effect of miR-214 on biological function in breast cancer MCF-7 cells
TIANYanfeng,LIFang,LIUBo,ZHAOZengren,DAIYongjun,WEIMing
DepartmentofGeneralSurgery,theFirstHospital,HebeiMedicalUniversity,Shijiazhuang050031
breast cancer;microRNA;MCF-7 cell;cell proliferation
Aim: To explore the effect of microRNA-214(miR-214) on the proliferation, apoptosis, migration and cell cycle distribution of human breast cancer MCF-7 cells. Methods: The miR-214 mimics were transfected into MCF-7 cells(experimental group) through liposome transfection, and the MCF-7 cells transfected by miR-214 negative control were used as control. The expression of miR-214 level was detected by real-time fluorogenic quantitative-PCR. The change of proliferation ability of MCF-7 cells was detected by CCK-8 method. The changes of apoptosis and cell cycle distribution were examined by flow cytometry. The change of migration ability was detected by wound healing assay. Results: After transfection with miR-214 mimics, the expression level of miR-214 in MCF-7 cells was up-regulated.Compared with control, the cell proliferation of MCF-7 cells in experimental group was inhibited, the cell apoptosis rate was elevated(P=0.008) and the proportion of cells at G1phase increased, and that of cells at S phase decreased(P<0.05),besides, the migration ability was inhibited(P<0.001). Conclusion: MiR-214 may act as a tumor suppressor in MCF-7 cells through inhibiting cell proliferation and migration, promote cell apoptosis and affect cell cycle distribution.
10.13705/j.issn.1671-6825.2017.01.023
*河北省科技支撑计划项目 14277755D
R737.9

