横纹肌肉瘤的影像表现分析
王维青,张升文
(1.山东省临沂经济技术开发区人民医院放射科,山东临沂276023;2.山东医学高等专科学校附属医院放射科,山东临沂276000)
横纹肌肉瘤的影像表现分析
王维青1,张升文2
(1.山东省临沂经济技术开发区人民医院放射科,山东临沂276023;2.山东医学高等专科学校附属医院放射科,山东临沂276000)
目的:分析横纹肌肉瘤(RMS)的病理特点,探讨其影像特征性表现。方法:回顾性分析37例RMS患者的临床影像资料,观察肿瘤部位、大小、形态、CT及MRI特点、骨质改变、转移,以及增强扫描表现,总结其特征性影像表现。结果:37例中,发生于头颈部14例,占37.8%;四肢13例,占35.1%;CT平扫22例,等低密度9例,等密度13例;CT增强扫描14例,不均匀增强13例,均匀增强1例。T1WI呈等信号18例,T2WI呈高信号15例;DWI呈不均匀高信号4例,b=600 s/mm2时,ADC(1.238+0.158)× 10-3mm2/s;多结节融合征象13.5%(5/37);MRI增强扫描不均匀增强70.6%(12/17),均匀明显增强29.4%(5/17);线样环形、葡萄簇状增强29.4%(5/17);围血管现象81.8%(27/33);骨质破坏29.7%(11/37);淋巴转移29.7%(11/37);脑膜及远处转移24.3%(9/ 37);所有患者均未见出血、钙化。结论:RMS青少年、头颈部多见。CT和MRI可直观了解病变的位置、范围、转移情况及围血管征象、多结节融合、“形成层”、环形、线状葡萄簇状增强等特征性表现。
横纹肌肉瘤;诊断显像
横纹肌肉瘤(rhabdomyosarcoma,RMS)是起源于横纹肌细胞或具横纹肌细胞分化潜能的间叶细胞的一种恶性肿瘤,约占儿童软组织肉瘤的61.5%[1]。根据2002年国际病理学会对软组织和骨肿瘤的诊断标准,将RMS分为胚胎型(embryonal RMS,eRMS)、腺泡型(alveolar RMS,aRMS)和多形型(pleomorphic RMS,pRMS)。目前,RMS多以个案报道为主,其影像表现缺乏特异性[2]。笔者回顾性分析2008年2月至2015年8月临沂经济技术开发区人民医院及山东医学高等专科附属医院经病理及免疫组化确诊的37例RMS临床影像资料,结合病理基础探讨其特征性影像表现。
1 资料与方法
1.1 一般资料37例中,男28例,女9例;年龄7 d~67岁,平均21岁。eRMS 24例,平均发病年龄16.6岁;aRMS 10例,平均发病年龄28.6岁;pRMS 3例,平均发病年龄30.5岁;位置:头颈部14例,躯干及四肢13例,泌尿生殖系统8例,纵隔及肝脏各1例。伴有骨质破坏11例,淋巴转移的11例,睾丸转移、肝转移、肺转移、胸膜转移各1例,1例同时合并肝转移、肺转移及淋巴转移。
1.2 仪器与方法CT平扫22例,其中CT增强扫描14例;MRI平扫21例,其中增强扫描17例;5例行CT及MRI检查。CT扫描采用Philips 16排多层螺旋CT机,扫描参数:125 kV,250 mA,层厚5 mm,矩阵256×256,对比剂为碘佛醇(剂量1.5 mL/kg体质量),行2期或3期扫描。MRI扫描采用GE optima MR 360 1.5 T超导光纤MRI仪,扫描序列包括轴位、矢状位、冠状位平扫SE T1WI(TR 2 000 ms,TE 120 ms);轴位、矢状位、冠状位平扫FSE T2WI(TR 450 ms,TE 15 ms);静脉团注Gd-DTPA(0.25 mmol/kg体质量)行T1WI增强扫描。
1.3 图像评价由2位有经验的放射科诊断医师在不参考临床资料的情况下进行盲法分析。观察病灶的位置、大小、密度、信号、形态、边缘情况,有无颈部淋巴结肿大及围血管现象,渐进式增强、DWI高信号、“形成层”征象、多结节融合、环形、线状葡萄簇增强等征象。意见不一致时,请专家会诊,结合临床及病理结果,达成共识。
1.3.1 围血管现象判断标准在T2图像上可见RMS内多发迂曲流空信号,CT增强扫描图像上可见肿块内多发条状、点状血管影。
1.3.2 形成层征象评定标准CT和MRI增强表现为周围环形致密增强,中心轻度或无明显增强。
1.4 区域淋巴结评价颈部淋巴结Ⅰ、Ⅱ区和腹股沟淋巴结短径>1.5 cm,颈部其他区域淋巴结短径>1 cm,或强化程度明显高于肌肉组织[3],作为淋巴结肿大的诊断标准。
2 结果
2.1 CT与MRI表现37例均表现为软组织肿块,其中实性肿块30例,实性伴囊变7例;20例可见分叶征,5例表现为多结节融合;所有患者均未出现出血、钙化征像。22例CT平扫示:等低密度9例,等密度13例。CT增强扫描14例,不均匀渐进式增强13例,仅1例均匀渐进式增强;CT增强扫描病变内出现血管成像征10例(图1a),环形致密增强(形成层)1例。21例MRI平扫,T1WI呈等信号18例,等高混杂信号2例(图2a),等低信号1例;T2WI呈略高信号15例,其中均匀高信号3例,不均匀高信号12例。17例在T2WI出现血管流空征象(图1b,2b),其中4例行DWI序列检查,均呈明显高信号(图2c);5例均匀明显增强(图2d,2e),12例不均匀增强(其中明显囊变2例,均出现在pRMS);线样环形、簇状增强5例,均位于筛窦区,均出现在eRMS。
2.2 转移情况37例中,11例出现骨质破坏,占29.7%,其中eRMS亚型8例,aRMS亚型2例,pRMS 1例;8例eRMS亚型骨质破坏均出现在头颈部。淋巴结肿大(图3)11例(颈部淋巴结肿大10例,腹股沟淋巴结转移1例),其中eRMS亚型10例,aRMS亚型1例。脑膜转移及脑脊液播撒5例,均出现翼腭窝、眼眶区。睾丸转移、肝转移、肺转移、胸膜转移各1例(图4)。
3 讨论
3.1 临床病理概述RMS起源于不同分化的横纹肌细胞或具备横纹肌分化的原始间叶细胞组成的软组织肿瘤,约占小儿恶性实体肿瘤的10%[4]。由于RMS源自未分化的多能干细胞或源自特有的胚胎肌肉组织,因此,解释了儿童时期发病率高的原因,同时解读了RMS在无横纹肌组织解剖区域出现的理由。
Schurch等[5]报道不同病理类型与发病年龄、部位密切相关。本研究eRMS多好发于青少年,平均发病年龄16.6岁,约占64.8%,多好发于头颈部及泌尿生殖系统,而aRMS及pRMS更多见于四肢躯干部。RMS镜下可见梭型小瘤细胞或卵圆形为主,偶见具备横纹的球拍状或带状瘤细胞,囊内偶见软骨或嗜酸物质,邻近正常组织变薄的上皮,有一层致密肿瘤细胞,称为形成层,其下方可见大量黏液组织;血管周围区域有散在的肿瘤细胞,即为RMS围血管现象。
3.2 CT和MRI特征性影像表现RMS可发生于全身各个部位,发病年龄跨度较大,本组37例年龄7d~67岁,以青少年好发,但年龄对RMS的诊断并无特异性。近年来,很多学者[2,6-7]在研究RMS时均提到影像诊断缺乏特征性表现,为此,笔者结合其病理学基础,总结了37例RMS较典型影像学资料:CT平扫RMS多呈略低于肌肉的软组织肿块,主要是富含黏液成分所致。CT增强扫描后肿瘤强化等于或低于邻近肌肉组织,部分患者肿瘤的中央区强化不明显,而周围区强化明显,呈所谓的环形增强[7],表现为周围环形致密增强,中心轻度或无明显增强。本组仅出现1例,主要发生于肿瘤相对较小的病变,形成原因是RMS在病理上的“形成层”改变,邻近正常部分有一层致密肿瘤细胞所致,本组较大的肿瘤均未出现此现象。CT增强扫描后大部分肿块内可见明显的异常血管,呈点状、条状高密度血管密度影,延时增强扫描呈现渐进式增强,结合围血管现象,说明病变具备绕血管生长的特点,本组出现率较高,具有特征性改变。
本研究17例在T2WI出现多发血管流空信号,有研究者[7-8]也提到可见肿块内见流空血管征象,与CT增强扫描所表现的肿块内多发血管影像相吻合,也解释了病理“围血管现象”。本研究中各型在此征象上无明显差异。同时笔者随机盲选100例软组织肿瘤,仅淋巴瘤和RMS出现此征象,两个疾病均有围血管现象,解释了绕血管生长的特点。具备一定特征性,但并不具备特异性。T2WI上肿块多呈均匀或不均匀高信号,T1WI呈等信号或等高混杂信号,肿瘤成分背景复杂,不均匀高信号形成机制和CT低密度相符合,主要原因是富含黏液基质所致,并非囊变坏死,部分学者提出T1WI内高信号为出血,结合T2WI信号及病理基础,分析为黏液成分所致,黏液中富含蛋白成分,在T1WI上及T2WI均呈高信号。肿块多可见分叶征象,以及多结节融合征象[7],说明病变具备多中心生长的特点,具备较强侵袭性,笔者认为和肿瘤“围血管现象”关系密切,aRMS更多见,结节周围可见短T2信号强度,Allen等[9]提出镜下为纤维组织间隔所致,本组5例,4例为aRMS,1例为pRMS。DWI序列呈明显高信号,ADC呈低信号,与肿瘤细胞的胞浆稀少、细胞一致有关。MRI增强扫描呈均匀或不均匀明显增强,各型间无明确差异[2]。褚静其等[2]报道葡萄簇状增强,王玲等[6]提到环形线状增强特点比较典型,均出现在筛窦eRMS病例中,符合eRMS亚型葡萄簇型病理特点,形成机制可能与鼻窦较大发展空间及较小阻力有关,筛窦小房为其提供了息肉样生长条件。有研究[10-11]认为在胆道、膀胱、阴道或子宫等中空器官腔内的RMS同样呈葡萄簇状增强,是由肿瘤沿黏膜下多发息肉样生长所致。本组无相关病例。钙化及出血在RMS中少见[9],本组均未出现。
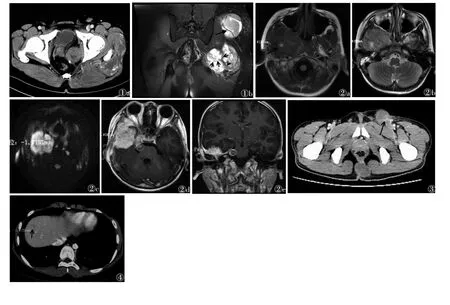
图1 男,45岁,横纹肌肉瘤(pRMS)图1aCT增强扫描示左臀部肌间隙及盆壁见多发结节性软组织肿块,内可见多发血管影显示(围血管现象)图1bT2FS序列见多结节融合混杂长T2信号,结节边缘可见短T2纤维间隔(短箭),结节内可见多发流空血管(围血管现象,长箭)图2男,10岁,头痛,胚胎型横纹肌肉瘤(eRMS),面部感觉异常2个月就诊图2aT1WI示等T1混杂信号,内可见斑片状高信号(黏液蛋白而非出血,长箭)图2bT2WI示右侧翼腭窝略长T2肿块,其内见斑片状更长T2信号(黏液)。病灶内可见流空血管征象(围血管现象,短箭)图2cDWI呈明显不均质高信号,左侧咽旁间隙可见肿大淋巴结,DWI亦呈高信号图2d,2eT1WI增强扫描示肿块呈明显均匀增强,右侧颞区脑膜异常增强,右侧桥小脑角池内见结节状增强病变图3男,34岁,臀部腺泡型横纹肌肉瘤(aRMS)术后淋巴结转移。CT增强扫描示左侧腹股沟区见肿大淋巴结,其内可见血管穿行(围血管现象,长箭)图4女,10岁,面部aRMS术后肝脏转移。CT增强扫描示肝右叶转移结节灶内可见点状异常血管影(围血管现象,短箭)
RMS侵袭性非常强,常见的转移方式为直接蔓延。其次为淋巴转移和血行转移。本组中骨质破坏和淋巴结转移比例相仿,可能和选取的样本类型有关,11例骨质破坏出现在eRMS亚型中,eRMS头颈部多见,与头颈部的解剖特点关系,所以骨质破坏的概率较高。淋巴结转移在eRMS中更多见,aRMS仅出现1例,pRMS未出现淋巴转移病例。部分转移淋巴结(图3)及转移病灶(图4)CT强化中亦有血管影穿行特点,笔者猜测可能与原发病变的病理基础相似,也同样有围血管现象,由于样本量过小,此征象在淋巴结转移中表现不足以定义为特征性表现。本研究5例脑膜转移、脑脊液播散,均发生在翼腭窝、眼眶区,与颅底解剖结构、肿瘤巨大及RMS的生物学特性有关。睾丸转移、肝转移、肺转移、胸膜转移各1例。
3.3 鉴别诊断RMS在头颈部需与NK/T淋巴瘤、内翻肉头状瘤、PNET、恶性黑色素瘤、上颌窦癌、嗅神经母细胞瘤鉴别,围血管现象、环形、线条状葡萄簇状增强以及少钙化、出血、坏死可作为鉴别要点。NK/T淋巴瘤可多位于筛窦级鼻腔顶壁,呈中度增强,强化多均匀,亦可出现浸润性骨质破坏,但NK/T淋巴瘤多可见面部、鼻部软组织弥漫性肿胀。四肢躯干区的需与尤文肉瘤、恶性纤维组织细胞瘤、骨肉瘤、滑膜肉瘤、PNET、神经母细胞瘤鉴别,尤文肉瘤和骨肉瘤骨质破坏为中心,坏死出血可见,骨膜反应常见;PNET、滑膜肉瘤、恶纤维组织细胞瘤,出血、坏死、囊变更多见。T2WI的高信号特点及围血管现象可作为鉴别的要点。
本研究存在的不足:样本量相对较少及采样的受限,未能完成RMS所有部位的影像学特点;所有病例未能统一检查标准,会出现部分征象的误读。
总之,RMS是极具侵袭性的恶性软组织肿瘤,生存率低、复发率高,青少年好发,头颈部多见。笔者认为围血管现象、多结节融合征象、葡萄簇状(环形、线样增强)、环形致密增强、DWI高信号、少钙化出血可作为RMS特征性影像学表现。
[1]Brown BJ,Oluwasola AO.Childhood Rhabdomyosarcoma in Ibadan,Nigeria:1984-2003[J].Ann Trop Paediatr,2006,26:349-355.
[2]诸静其,汤光宇,周国兴,等.横纹肌肉瘤的影像学诊断[J].临床放射学杂志,2014,33(8):1237-1242.
[3]Gopinathan A,Tan TY.Kimura′s disease:Imaging patterns on computed tomography[J].Clin Radiol,2009,64:994-999.
[4]Parham DM,Ellison DA.Rhabdomyosarcomas in adults and children:an update[J].Arch Pathol Lab Med,2006,130:1454-1465.
[5]Schurch W,Begin LR,Seemayer TA,et al.Pleomorphic soft tis-sue myogenie sarcomas of adulthood.A reappraisal in the mid-1990s[J].Am J Surg Pathol,1996,20:131-147.
[6]王玲,刘学文,李卉,等.胚胎型横纹肌肉瘤的影像学表现[J].中国医学影像技术,2013,29(5):791-795.
[7]潘恩源,陈丽英.儿科影像诊断学[M].北京:人民卫生出版社,2006:1099-1101.
[8]高峰,唐文伟,李小会.小儿横纹肌肉瘤的影像学诊断[J].中国临床医学,2013,6(12):1173-1175.
[9]Allen SD,Moskovic EC,Fisher C,et al.Adult rhabdomyosarcoma:cross-sectoonal imaging findings including histopathologic correlation[J].AJR Am J Roentgenol,2007,189:371-377.
[10]郑加贺,马洁韬.胆管横纹肌肉瘤影像诊断[J].中国医学影像技术,2008,24(8):1235-1235.
[11]潘恩源,陈丽英.儿科影像诊断学[M].北京:人民卫生出版社,2006:847-851.
2016-03-21)
10.3969/j.issn.1672-0512.2017.01.027
王维青,E-mail:doctorwangwq@163.com。

