抗蛇毒IgY对尖吻蝮(Deinagkistrodon acutus)蛇毒主要活性的中和作用研究
刘锦花,李 恒,2, 和七一,张迎锋,陈典成,罗 聪,余晓东
(1. 重庆师范大学生命科学学院,重庆市动物生物学重点实验室,重庆市生物活性物质工程研究中心,重庆 4000472.重庆市公安局物证鉴定中心,重庆 400021)
抗蛇毒IgY对尖吻蝮(Deinagkistrodon acutus)蛇毒主要活性的中和作用研究
刘锦花1,李 恒1,2, 和七一1,张迎锋1,陈典成1,罗 聪1,余晓东1
(1. 重庆师范大学生命科学学院,重庆市动物生物学重点实验室,重庆市生物活性物质工程研究中心,重庆 4000472.重庆市公安局物证鉴定中心,重庆 400021)
目的 评价抗尖吻蝮蛇(D.acutus)毒IgY对该蛇毒主要活性的中和能力。方法 通过不同浓度IgY与该蛇毒混合孵育后,再用生化方法检测该蛇毒的多种活性。结果 体外实验表明,IgY能明显地中和该蛇毒的PLA2、 5′-核苷酸酶、透明质酸酶、金属蛋白酶和丝氨酸蛋白酶(纤维蛋白酶)等酶活性;小鼠实验表明,IgY对小鼠的半有效保护剂量(ED50)为1 131.09 μg。结论 该抗尖吻蝮蛇毒IgY 具有很好的中和活性,且IgY无明显的毒性。
抗尖吻蝮蛇毒 IgY; PLA2; 5′-核苷酸酶; 透明质酸酶; 丝氨酸蛋白酶(纤维蛋白酶); 金属蛋白酶; ED50; 中和作用
尖吻蝮蛇(Deinagkistrodonacutus),又俗称五步蛇,是我国独有的蛇种,其每年咬伤率在我国十大毒蛇中是较高的。其毒液主要由功能多样化的各种多肽或蛋白质(包括磷脂酶A2、5′-核苷酸酶、透明质酸酶、金属蛋白水解酶、丝氨酸蛋白水解酶等) 构成,并主要作用于血液系统,致使患者发病,或因抢救不及时或不当而致残甚至死亡,故其毒液属于典型的血液毒素[1-3]。
目前,虽然抗蛇毒血清是治疗毒蛇咬伤的首选有效药物,但是,它存在诸多不足,包括临床使用中出现的副作用(过敏性休克、致热反应及血清病等),以及其生产周期长、纯化成本高与价格昂贵、不易保存等缺点[4]。为此,寻找价格便宜、方便使用、保存容易及安全性好的治疗蛇伤的药物是非常必要而迫切的。
已有研究表明,用各种抗原(如致病原)免疫鸡产生的卵黄抗体(即IgY)具有很高的效价,而且拥有毒副作用低、生产成本低、使用方便等优势[4-5]。近年来,国内外开展了用蛇毒(包括响尾蛇、圆斑蝰、眼镜蛇、眼镜王蛇、锯鳞蝰、银环蛇、珊瑚蛇)免疫鸡的实验研究,并从其蛋黄制备出效价高的IgY[6-8],但是,至今这些IgY还未在临床上使用。我们已经首次用我国特有的尖吻蝮蛇毒来免疫鸡,从其卵黄中制备和分离纯化得到了抗尖吻蝮蛇毒的抗体IgY。本研究就该IgY对尖吻蝮蛇毒中的主要活性成分的中和作用进行实验研究与评估,为下一步开发IgY成为抗蛇毒药物提供理论依据。
1 材料与方法
1.1 主要仪器与设备 Infinite ®200Pro多功能酶标仪(Tecan);恒温水浴锅(上海跃进医疗器械有限公司);TG16-W微量高速离心机(长沙湘仪离心机仪器有限公司);DHG-9023A型电热恒温鼓风干燥箱(上海精宏实验设备有限公司);冰箱(SIEMENS);电磁炉(SUPOR)。
1.2 主要材料与试剂 抗尖吻蝮蛇毒IgY(本实验室自备);尖吻蝮蛇毒(本实验室保存);18 g~20 g健康的昆明种♀鼠(第三军医大学动物实验中心);未免鸡蛋;5′-核苷酸酶活性测定试剂盒(南京建成生物工程研究所);透明质酸钠(上海伊卡生物);十六烷基三甲基溴化铵(CTAB,厦门市先端科技);牛血纤维蛋白原(瑞楚生物);琼脂糖(Invitrogen);三氯乙酸(成都科龙化工);盐酸(重庆川东化工);Folin试剂(北京鼎国昌盛技术责任有限公司);乙醚(扬州三和化工);醋酸(成都科龙化工);Tris(genview);酪蛋白(北京奥博星生物技术责任有限公司);NaOH(北京红星化工);醋酸钠、CaCl2(重庆博艺化学试剂)。
1.3 方法
1.3.1 IgY中和蛇毒PLA2活性实验 蛇毒PLA2活性测定按照Habermann等琼脂糖平板法进行[9]。在平板每孔中分别加入相同体积(10 μL)不同浓度的蛇毒(0.5、0.25、0.125、0.062 5、0.031 3、0.015 7 g·L-1),37 ℃孵育24 h后,测量透明圈直径。以生理盐水为阴性对照组。实验重复3次,选取直径11 cm的透明圈所作对应的蛇毒浓度作为IgY中和实验的蛇毒基础浓度。分别将不同浓度的抗尖吻蝮蛇毒 IgY (0、0.25、0.35、0.45、0.55、0.65、0.75、0.85、0.95 g·L-1)与以上所选蛇毒浓度混合(总体积10 μL)。37 ℃下水浴 45 min , 再离心5 min(1 737×g),取上清液加入平板孔中, 37 ℃孵育24 h后,测量透明圈直径。以生理盐水为阴性对照组。实验重复3次。
1.3.2 IgY中和蛇毒5′-核苷酸酶活性 按照厂家试剂盒说明书测定不同浓度(0、0.01 、0.05、0.1、0.15、0.2、0.3、0.4 g·L-1)的尖吻蝮蛇毒中的5′-核苷酸酶活性,选取其中酶活力最强的蛇毒浓度作为IgY中和能力测定的蛇毒基础浓度,再将其与不同浓度(0、0.05、0.1、0.2、0.4、0.6、0.8、1、1.5、3 g·L-1) 的IgY混和孵育(37 ℃)45 min,再离心5 min(1 737×g),取上清液进行5′-核苷酸酶活性测定。实验重复3次。
1.3.3 IgY中和蛇毒透明质酸酶活性 按照Singer等[10-11]方法进行。在平板每孔中分别加入等体积(10 μL)不同浓度(0、0.5、1、2、3、4、6、8、10 g·L-1)的蛇毒,37 ℃孵育12 h后,再加入0.75%的CTAB溶液,反应1 h后,倒掉CTAB溶液。再将平板孵育12 h(4 ℃),测透明圈直径。用生理盐水为阴性对照组。实验重复3次,选取直径11 cm的透明圈所对应的蛇毒浓度作为IgY中和实验的蛇毒基础浓度。分别将不同浓度的(0、5、10、15、30、45、60、75、90、105 g·L-1)IgY与所选浓度的蛇毒混合(总体积10 μL),37 ℃水浴45 min, 再离心5 min(1 737×g)。取上清液再进行透明质酸酶酶活性实验。以生理盐水为阴性对照组。实验重复3次。
1.3.4 IgY中和蛇毒蛋白水解酶活性实验 按照Molander 等[12]方法进行。将等体积(10 μL)不同浓度(0、0.1、0.5、1、2、4、6 g·L-1)的尖吻蝮蛇毒溶液分别与30 μL 1.0%的酪蛋白溶液混合, 37 ℃水浴40 min后,分别加入90 μL 0.44 mol·L-1三氯乙酸,终止反应,再离心5 min(1 737×g),取50 μL上清液至96孔板中。再加入50 μL以1 ∶4稀释的Folin试剂及250 μL 0.4 mol·L-1碳酸钠溶液,混匀。溶液变蓝,室温放置20 min后,双蒸水调零,于630 nm读取吸光值。选取较高吸光度所对应的尖吻蝮蛇毒剂量作为IgY中和实验的蛇毒基础用量。分别将不同量的IgY (0、37.5、75、150、225、250) g·L-1与该蛇毒混合, 37 ℃水浴45 min后, 再离心5 min(1 737×g),取30 μL上清液进行蛋白水解酶活性测定。实验重复3次。
1.3.5 IgY中和蛇毒纤维蛋白水解活性 按照Astrup等[13]纤维蛋白平板法进行 。在平板每孔中分别加入等体积(15 μL)不同浓度(1.33、2.66、4.00、5.33、6.66 g·L-1)的蛇毒,37 ℃孵育12 h后,测量透明圈环直径。以生理盐水为阴性对照组。选取能产生直径为11 cm的透明圈所对应的蛇毒量作为IgY中和实验的蛇毒基础用量。分别将15 μL不同浓度(0、60、80、100、120、140 g·L-1)的IgY与该蛇毒基础用量混合, 37 ℃水浴45 min后, 再离心5 min(1 737×g),取上清液进行纤维蛋白水解活性测定。以生理盐水为阴性对照组。实验重复3次。
1.3.6 IgY中和蛇毒保护性实验 按照Paul等[14]所述法,取健康的昆明♀鼠( 18~20 g),随机分成7组,每组10只。100 μL不同浓度的IgY(0、2、4、8、16、32、64 g·L-1)与一定剂量(3×LD50,LD50=0.00 293 mg·g-1)的尖吻蝮蛇毒混合, 37 ℃下水浴45 min后, 再离心5 min(1 737×g),取上清液进行腹腔注射,24 h后记录小鼠存活情况。
1.3.7 统计分析 实验结果(计量资料)均为3次重复实验的平均值,进行线性回归。
2 结果
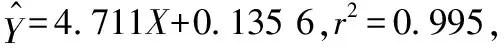
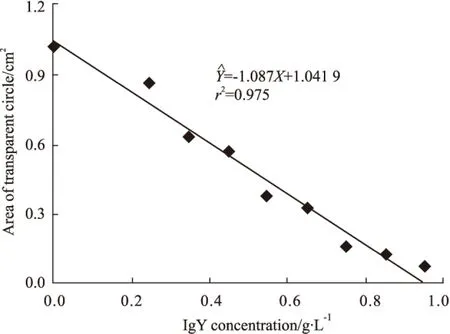
Fig 1 Neutralization of anti-D. acutus venom IgY against activity of PLA2 in snake venom
As demonstrated by the highr2value, IgY dose-dependently decreases the area of transparent circle cased by PLA2hydrolyzing the substrate
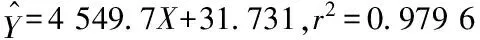
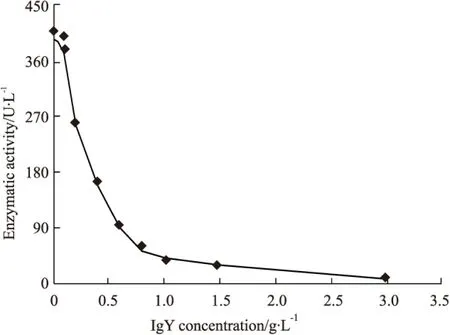
Fig 2 Neutralization of anti-D. acutus venom IgY against 5′-nucleotidase activity in snake venom
The activity of 5′ nucleotidase amongD. acutus vemon decreased with the increase of specific IgY dose . It almost completely neutralized the activity of 5′ nucleotidase when Specific IgY up to 300 μg.
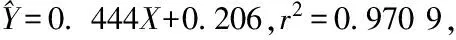
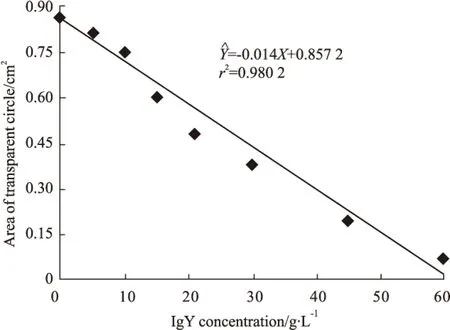
Fig 3 Neutralization of anti-D. acutus venom IgY against hyaluronidase in snake venom
IgY dose-dependently decreased the area of transparent circle caused by hyaluronidase hydrolyzing sodium hyaluronate, which had remarkable linear correlation.
2.4 IgY对蛇毒金属蛋白水解酶活性的中和作用 不同量的尖吻蝮蛇毒的蛋白水解酶活性与吸光度值呈量效关系,但无线性相关性。选取与阴性对照表现出明显的吸光度差异的蛇毒浓度(1 g·L-1)作为基础浓度。中和实验表明,IgY在0~250 g·L-1之间随着浓度增加,蛇毒蛋白水解酶活性降低,IgY浓度与蛇毒蛋白水解酶活力降低之间呈现量效关系。10 μg尖吻蝮蛇毒的蛋白水解酶活性几乎可被250 g·L-1IgY完全中和,而IgY自身无蛋白水解酶活性(Fig 4)。

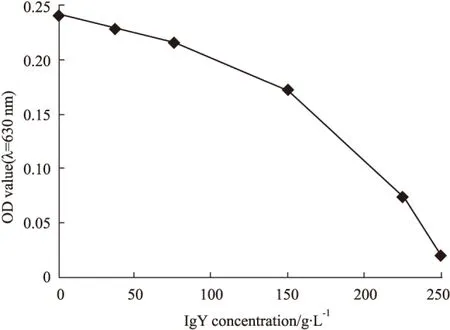
Fig 4 Neutralization of anti-D. acutus venom IgY against metalloprotease in snake venom
IgY dose-dependently decreased the absorbance value of the solution spectrophotometrically monitored at λ=630 nm. As demonstrated by the dose-effect relationship, it showed that the activity of protease of 10 μg venom was almost totally inhibited by 5 000 ug specific IgY.
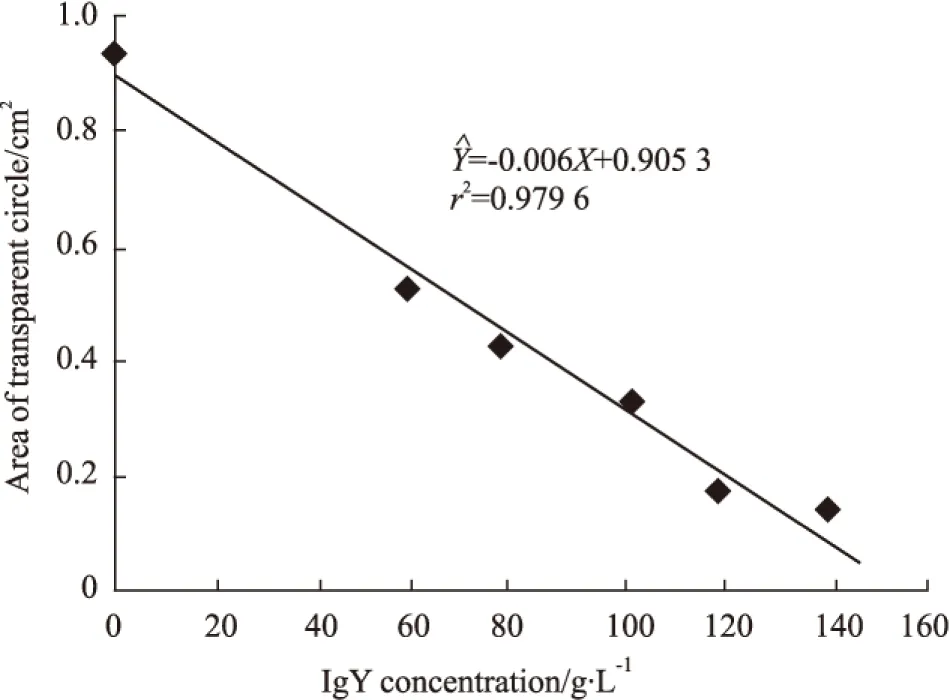
Fig 5 Neutralization of anti-D. acutus venom IgY against serine proteinase ( fibrinogenase) in snake venom
IgY dose-dependently decreases the relative area hydrolyzing fibrinogen from bovine plasma. It showed linearity in the area of transparent circle for the range of IgY. The ED50value was calculated as described in methods section.
2.6 保护性实验 采用蛇毒挑战剂量(3×LD50, LD50=2.93 mg·kg-1)进行IgY的保护性实验结果见Tab 1。 采用WHO推荐的方法[15],最后计算出IgY对小鼠的半有效保护剂量(ED50)为1 131.09 μg。
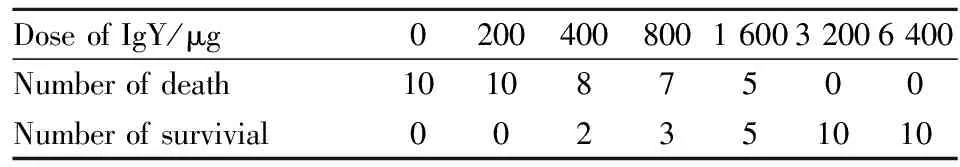
Tab 1 Records of mouse death in IgY’s protection experiments
3 讨论
采用现代转录组学与蛋白质组学技术和方法的匹配,人们对尖吻蝮蛇毒腺细胞的毒素基因转录表达谱和毒液蛋白质组进行了较多分析研究,目前基本搞清了尖吻蝮蛇毒中的蛋白质组分构成情况[16]。尖吻蝮蛇毒发挥致伤致毒的主要活性成分包括PLA2、5′-核苷酸酶、透明质酸酶、金属蛋白水解酶、丝氨酸蛋白水解酶等,它们在毒理上主要扮演血液毒素和肌肉毒素的作用,给毒蛇咬伤患者带来致伤甚或致死的效应[1-3 ]。
实验表明,抗尖吻蝮蛇毒IgY能显著地中和该蛇毒主要活性成分的活性。IgY中和PLA2活性呈现量效关系,其ED50为4.568 μg;IgY中和5′-核苷酸酶活性呈现量效关系,而且当IgY达到300 μg,蛇毒5′-核苷酸酶活力几乎完全被中和;IgY中和透明质酸酶活性呈现量效关系,其ED50为276.57 μg;IgY中和金属蛋白水解酶活性呈现量效关系(Fig 4);IgY中和丝氨酸蛋白水解酶(如纤维蛋白水解酶)活性呈现量效关系,其ED50为1 045 μg;这些结果表明IgY完全能中和尖吻蝮蛇毒中的血液毒素(5′-核苷酸酶、金属蛋白水解酶、透明质酸酶和丝氨酸蛋白水解酶)和肌肉毒素(PLA2)的活性,从而阻止这些毒素引起尖吻蝮蛇咬伤患者的血液系统和肌肉系统紊乱。采用小白鼠活体保护实验表明,IgY的保护效果非常好,自身没有毒性,其半有效保护剂量(ED50)为1 131.09 μg。
当前,我国治疗尖吻蝮蛇咬伤的主要药物仍是通过蛇毒免疫马而制备出的抗蛇毒血清。由于抗蛇毒血清自身存在较多不足,再加之制备成本高,使用价格昂贵,而我国的实际情况是被毒蛇咬伤的患者一般是边远山区的贫穷村民,他们很难承担使用该抗蛇毒血清的费用。因此,本研究首次采用尖吻蝮蛇毒免疫鸡来制备抗尖吻蝮蛇毒的抗体即IgY, 不仅大大降低了IgY制备成本,而且实验结果显示抗尖吻蝮蛇毒IgY对该蛇毒活性的中和能力非常理想,这些结果为开发抗尖吻蝮蛇毒IgY药物提供了前期基础。
[1] Ouyang C, Teng C M, Huang T F. Characterization of snake venom principles affecting blood coagulation and platelet aggregation[J].AdvExpMedBiol, 1990, 281:151-63.
[2] Tu A T. Overview of snake venom chemistry[J].AdvExpMedBiol, 1996, 391:37-62.
[3] Ouyang C, Teng C M, Huang T F. Characterization of the purified principles of Formosan snake venoms which affect blood coagulation and platelet aggregation[J].TaiwanYiXueHuiZaZhi, 1982, 81(7): 781-90.
[4] 王桂平, 余清声, 覃 媛, 黄 劭. 抗眼镜蛇王蛇毒鸡卵黄抗体的制备[J]. 中国药理学通报, 2004, 20(12): 1426-9.
[4] Wang G P, Yu Q S, Qin Y, Huang S. King cobra egg yolk antibody from the egg yolks of immunized hens [J].ChinPharmacolBull, 2004, 20(12):1426-9.
[5] Rǜdiger. Schade, 张小莺, 郑 礼. IgY技术及其医药应用: 理论基础[J]. 中国药理学通报, 2004, 20(5): 491-5.
[5] Rǜdiger. Schade, Zhang X Y, Zheng L. IgY -technology and its applications in medicine(Ⅰ): theoretical background[J].ChinPharmacolBull, 2004, 20(5): 491-5.
[6] Almeida C M, Kanashiro M M, Rangel Filho F B, et al. Development of snake antivenom antibodies in chickens and their purification from yolk[J].VetRec, 1998,143(21): 579-84.
[7] Meenatchisundaram S, Parameswari G, Michael A, Ramalingam S. Neutralization of the pharmacological effects of Cobra and Krait venoms by chicken egg yolk antibodies[J].Toxicon, 2008,52(2): 221-7.
[8] Araújo A S, Lobato Z I, Chávez-Olórtegui C, Velarde D T. Brazilian IgY-Bothrops antivenom: Studies on the development of a process in chicken egg yolk[J].Toxicon, 2010, 55(4): 739-44.
[9] Habermann E, Hardt K L. A sensitive and specific plate test for the quantitation of phospholipases[J].AnalBiochem, 1972, 50(1): 163-73.
[10]Singer R, Sagiv M, Allalouf D, et al. Estimation of hyaluronidase activity of human semen and its relationship with sperm density by means of a simplified method[J].IntJFertil, 1982, 27(3): 176-80.
[11]苏 昀,周性明. 正常人精子透明质酸酶活性测定[J]. 铁道医学,1998, 26(1): 31-2.
[11]Su Y,Zhou X M. Determination of hyalurondase activity in normal human sperm[J].RailwayMed, 1998, 26(1): 31-2.
[12]Molander M, Nielsen L, Søgaard S, et al. Hyaluronidase, phospholipase A2and protease inhibitory activity of plants used in traditional treatment of snakebite-induced tissue necrosis in Mali, DR Congo and South Africa[J].JEthnopharmacol, 2014, 157: 171-80.
[13]Astrup T, Müllertz S. The fibrin plate method for estimating fibrinolytic activity[J].ArchBiochemBiophys, 1952, 40(2): 346-51.
[14]Paul K, Manjula J, Deepa E P, et al. Anti-Echis carinatus venom antibodies from chicken egg yolk: isolation, purification and neutralization efficacy[J].Toxicon, 2007, 50(7): 893-900.
[15]Organization W H. Progress in the characterization of venoms and standardization of antivenoms[M].WHOOffsetPubl, 1981, (58):1-44.
[16]Zhang B, Liu Q, Yin W, et al. Transcriptome analysis of Deinagkistrodon acutus venomous gland focusing on cellular structure and functional aspects using expressed sequence tags[J].BMCGenomics, 2006, 7:152.
Neutralization of anti-venom IgY against main activities of Deinagkistrodon acutus venom
LIU Jin-hua1, LI Heng1,2, HE Qi-yi1, ZHANG Ying-feng1, CHEN Dian-cheng1, LUO Cong1, YU Xiao-dong1
(1.SchoolofBiologicalScience,ChongqingNormalUniversity,ChongqingKeyLaboratoryofAnimalBiology,ChongqingEngineeringCenterofBioactiveSubstance,Chongqing400047,China; 2.InstituteofForensicScience,CriminalPoliceCropsofChongqingPublicSecurityBureau,Chongqing400021,China)
Aim To evaluate the potency of anti-D.acutusvenom IgY neutralizing the main activities ofD.acutusvenom. Methods After mixing the different amounts of IgY with snake venom and incubating together, the main activities of snake venom were assayed by biochemical methods. Results Theinvitroassays indicated that anti-D.acutusvenom IgY obviously neutralized the activities of PLA2, 5′-nucleotidase, hyaluronidase, metalloprotease and serine proteinase (fibrinogenase) inD.acutusvenom. Mouse experiments showed that the ED50value of IgY for mouse was 1 131.09 μg. Conclusion Anti-D.acutusvenom IgY antibodies have good effects in neutralizingD.acutusvenom without the toxicities themselves.
anti-D.acutusvemon IgY; PLA2; 5′-nucleotidase; hyaluronidase; Serine proteinase (fibrinogenase); metalloprotease; ED50Neutralization
时间:2016-12-27 16:13
http://www.cnki.net/kcms/detail/34.1086.R.20161227.1613.022.html
2016-08-29,
2016-11-30
重庆市林业局渝林科研项目(No 2015-5);重庆市自然科学基金(No CSTC2016jacyjA0224、CSTC2015shmszx)
刘锦花(1992- ),女,硕士,研究方向:生物毒素与药物开发,E-mail:491449569@qq.cm; 余晓东(1964- ),男,博士,硕士生导师,研究方向:生物毒素与药物开发,通讯作者,Tel:023-65307142, E-mail: yxd@cqnu.edu.cn
10.3969/j.issn.1001-1978.2017.01.011
A
1001-1978(2017)01-0058-05
R-332;R392.11;R977.3;R996.3