六味五灵片对刀豆蛋白A诱导的小鼠急性免疫性肝损伤的保护作用研究
刘慧敏,韩延忠,郭玉明,牛 明,张雅铭,沈宏辉,王伽伯,柏兆方,肖小河
(1. 解放军第三〇二医院全军中医药研究所&中西医结合诊疗与研究中心,北京 100039;2. 承德医学院,河北 承德 067000)
◇复方药物药理学◇
六味五灵片对刀豆蛋白A诱导的小鼠急性免疫性肝损伤的保护作用研究
刘慧敏1,2,韩延忠1,2,郭玉明1,牛 明1,张雅铭1,沈宏辉1,王伽伯1,柏兆方1,肖小河1
(1. 解放军第三〇二医院全军中医药研究所&中西医结合诊疗与研究中心,北京 100039;2. 承德医学院,河北 承德 067000)
目的 研究六味五灵片(Liuweiwuling Tables,LWWL)对刀豆蛋白A(concanavalin A, ConA)诱导的小鼠急性免疫性肝损伤的保护作用及机制。方法 将小鼠随机分成正常组对照组、模型组、双环醇组(Bicyclol,39 mg·kg-1)、六味五灵片低剂量组(8 g·kg-1)、六味五灵片高剂量组(16 g·kg-1),各给药组每天给药1次,连续7 d,末次给药1 h后,除正常对照组外,其他各组尾静脉注射ConA(15 mg·kg-1)制备小鼠急性免疫性肝损伤模型。HE染色观察小鼠肝组织病理变化;比色法检测小鼠血清中丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)、总胆红素(TBIL);实时定量RT-qPCR测定法检测肝组织中白介素-12(IL-12)、干扰素-γ(IFN-γ)、肿瘤坏死因子-α(TNF-α)、白介素-4(IL-4)、白介素-10(IL-10)mRNA的表达;流式细胞术(FCM)观察脾脏Th1(IFN-γ)/Th2(IL-4)细胞的变化;免疫印迹(Western blot)法检测肝组织中Th1/Th2转录因子T-bet/GATA-3的表达。结果 与正常对照组相比,模型组小鼠血清中ALT、AST、TBIL明显升高,小鼠肝组织病理损伤严重,肝细胞大量坏死、凋亡,表明造模成功。与模型组比较,六味五灵片低、高剂量组小鼠血清中ALT、AST、TBIL的水平明显降低;脾脏中Th1细胞减少,Th2细胞增多。肝组织中IL-12、IFN-γ、TNF-α的mRNA表达下降, IL-4、IL-10的mRNA表达上升,GATA-3蛋白表达上调,T-bet蛋白表达无明显变化。结论 六味五灵片通过调节Th1/Th2的平衡,保护ConA诱导的急性免疫性肝损伤。
六味五灵片; ConA; 急性免疫性肝损伤; Th1/Th2免疫平衡; 保肝; T-bet/GATA-3
目前,肝脏疾病是危害全球人类健康的主要疾病之一,急性肝损伤是其重要临床表现形式之一。大量文献报道,多种免疫细胞及相关的细胞因子参与了急性肝损伤的病理生理过程[1-2]。尽管急性肝损伤的免疫学机制复杂多变,但T淋巴细胞,特别是CD4+T细胞亚群Th1/Th2及其相关的细胞因子作为急性肝损伤炎症发生发展的关键因素得到了国内外专家的广泛认可[3-5]。
六味五灵片(Liuweiwuling Tablets,LWWL)是在中医理论和现代医学理论共同指导下,根据君臣佐使的原理组方而成,有滋肾养肝,活血解毒之效,在治疗病毒性肝炎的临床应用中具有良好的保肝降酶等作用[6-7]。研究发现[8-9],六味五灵片可通过调节T细胞和自然杀伤细胞活化,抑制IL-2的升高,并且对LPS联合GaLN及对乙酰氨基酚导致的急性肝损伤均有较好的保护作用等[10-11]。然而其对Th1/Th2免疫细胞失衡导致的肝损伤的保护作用至今未见报道[12-13]。因此本研究采用 ConA诱导的急性免疫肝损伤模型,诱导Th1/Th2免疫失衡,研究六味五灵片的保肝作用及机制。
1 材料
1.1 药品与试剂 六味五灵片(由五味子、女贞子、连翘、莪术、苣荬菜、芝孢子粉组成,山东世博金都药业有限公司,批号 150705,);双环醇(Bicylcol,北京协和药厂,批号150303 );ConA(美国Sigma公司,C2010);生理盐水(石家庄四药有限公司);丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)、总胆红素(TBIL)检测试剂盒(均购自南京建成科技有限公司);TUNEL染色试剂盒(Roche,11684817910);RNA保存液(北京康为世纪生物科技有限公司),TRIzol(Life Technology),逆转录和PCR反应试剂盒(Thermo);TNF-α、IFN-γ、IL-4、IL-12、IL-10引物(上海捷瑞生物工程有限公司);小鼠淋巴细胞分离液(达科为生物工程有限公司),流式抗体CD8a、IFN-γ、IL-4(BD),CD3(达科为生物技术有限公司);Western blot抗体,GATA-3、T-bet(Abclonal Technology)。GAPDH(美国,CST)。
1.2 实验动物 Balb/c小鼠,♂[14],清洁级,体质量(20±2) g,购于军事医学科学院实验动物中心(合格证号SCXK-(军)2012-0004),饲养于解放军第三O二医院动物实验中心。
1.3 主要仪器 SynergyH2全功能微孔板检测仪(美国BioTek);UV-2550紫外分光光度计(日本岛津);爱华KPJ-1A生物组织摊片烤片机(天津天利航空有限公司);Leica 2016石蜡切片机(上海莱卡仪器有限公司);Nikon E200光学显微镜;7500型荧光定量PCR仪(Applied Biosystems);Cantoll流式细胞检测仪(BD)。
2 方法
2.1 分组与给药 将50只Balb/c小鼠随机分为正常对照组、模型组、六味五灵片低、高剂量组、双环醇组,每组10只。适应性饲养3 d后,各组分别灌胃给予药物干预:六味五灵片低剂量组8 g·kg-1、六味五灵片高剂量组16 g·kg-1、双环醇组39 mg·kg-1,正常对照组、模型组以生理盐水0.2 mL/10 g灌胃,每天1次,连续7 d。
2.2 模型制备 参照tiegsd等[15]的造模方法,末次给药1 h后,除正常对照组小鼠给予相同剂量的射生理盐水外,其余各组小鼠一次性尾静脉注射ConA 15 mg·kg-1[16],禁食不禁水,8 h后取材检测。
2.3 血清ALT、AST、TBIL水平测定 造模后8h小鼠摘眼球采血,4℃,离心15 min(3000 r·min-1),分离血清,按照试剂盒说明检测血清中ALT、AST、TBIL水平。
2.4 肝脏病理学观察 取相同部位的肝组织,苏木精-伊红(HE)染色,光学显微镜下观察肝组织病理学变化。
2.5 脾脏淋巴细胞的分离及FACS分析 按照说明书操作步骤分离脾脏淋巴细胞,用佛波酯和离子霉素刺激[17]6 h后,分别加入CD3/CD8/IFN-γ/IL-4抗体标记,室温避光30 min后,加入1%的多聚甲醛固定,流式细胞仪检测。
2.6 RT-qPCR检测肝组织中TNF-α、IFN-γ、IL-4、IL-6、IL-10 mRNA表达水平 取小鼠相同部位肝组织,加TRIzol提取RNA,逆转录合成cDNA,以GAPDH作为内参进行扩增,检测肝组织中IFN-γ、TNF-α、IL-4 、IL-12、IL-10mRNA的表达水平。试验操作步骤按试剂盒说明书进行。所有引物序列见Tab 1。

Tab 1 Primer sequences of RT-qPCR
2.7 Western blot 检测肝组织中GATA-3、T-bet的表达 取50mg左右的肝组织,加入0.5 mL含有cocktail的RIPA裂解液,震荡匀浆,直至看不到明显的悬浮物为止,超声破碎2 s,间隔10 s,共5次,整个过程在冰上操作,静置20 min,4℃,10 000×g,离心30min,取上清,BCA蛋白定量后用于Western blot检测。SS-PAGE电泳后,将蛋白转移至PVDF膜,室温封闭2 h,一抗4℃过夜,TBST洗3遍,每次5 min,二抗室温孵育2 h,TBST洗3遍,化学发光法(ECL)显影,使用Image J进行结果定量分析。

3 结果
3.1 六味五灵片对小鼠血清中ALT、AST、TBIL水平的影响 与正常对照组相比,模型组血清中ALT、AST、TBIL值明显升高,差异均有统计学意义(P<0.01);与模型组相比,六味五灵片低、高剂量组小鼠血清中 ALT、AST值均降低,差异有显著性(P<0.01);六味五灵片低剂量组小鼠血清中TBIL水平降低,但差异无统计学意义。六味五灵片高剂量组血清中TBIL值下降,差异有统计学意义(P<0.01)。见Fig 1。
3.2 六味五灵片对免疫性肝损伤小鼠肝脏病理的影响 与正常组对照组相比,模型组小鼠肝组织突出表现为肝细胞胞质肿胀、疏松,肝窦内红细胞淤积,细胞排列紊乱,肝细胞呈点状、灶状坏死,坏死细胞处炎性细胞浸润,肝组织损伤严重。双环醇和六味五灵片低、高剂量组肝细胞肿胀减轻,肝窦内红细胞减少,细胞呈放射状排列,仅可见散在的少量细胞坏死,炎性细胞浸润减少,肝细胞损伤程度明显减轻。见Fig 2。

Fig 1 Effect of LWWL on serum ALT, AST and TBIL concentration
**P<0.01vsnormal;#P<0.05,##P<0.01vsmodel
3.3 六味五灵片对免疫性肝损伤小鼠脾脏Th1/Th2活化的影响 流式细胞术检测CD4+T淋巴细胞IFN-γ、IL-4的分泌,可分别反映Th1、Th2细胞的数量。与正常对照组相比,模型组小鼠脾脏中Th1细胞增多,差异有统计学意义(P<0.01);模型组Th2细胞增多,但差异无统计学意义。与模型组相比,六味五灵片低、高剂量组脾脏Th1细胞均减少,差异有统计学意义(P<0.01);六味五灵片低、高剂量组Th2细胞增多,差异有统计学意义(P<0.05),其中高剂量组增加更为明显。见Fig 3。
3.4 六味五灵片对免疫性肝损伤小鼠肝组织Th1/Th2细胞因子mRNA水平的影响 IFN-γ、IL-12、TNF-α是Th1的主要细胞因子,IL-4、IL-10是Th2的主要细胞因子。与正常对照组比较,模型组小鼠肝组织IFN-γ、IL-12、TNF-α表达均明显升高(P<0.01);IL-4、IL-10表达降低,但差异无统计学意义。与模型组比较,六味五灵片低、高剂量组TNF-α、IFN-γ、IL-12表达明显下降,差异有统计学意义(P<0.01);六味五灵片低剂量组IL-4表达升高,但差异无统计学意义;六味五灵片高剂量组IL-4表达明显升高,差异有统计学意义(P<0.01);六味五灵片低、高剂量组IL-10表达均升高,差异有统计学意义(P<0.05)。结果提示,六味五灵片低、高剂量组能明显降低ConA引起的小鼠肝组织中Th1细胞因子表达,提高Th2细胞因子表达。见Fig 4。
3.5 六味五灵片对免疫性肝损伤小鼠肝组织Th1/Th2转录因子T-bet/GATA-3活化的影响 Western blot结果显示,与正常对照组相比,模型组GATA-3蛋白表达明显降低,差异有统计学意义(P<0.01),T-bet表达升高,但差异无统计学意义;与模型组比较,六味五灵片能够上调GATA-3蛋白表达,差异有统计学意义(P<0.01),其中高剂量组升高尤著, T-bet蛋白表达升高,但差异无统计学意义。见Fig 5。
4 讨论
肝脏是ConA体内诱导毒性的主要靶器官[18],本研究采用ConA诱导急性肝损伤模型来探讨六味五灵片的保肝作用及其机制。结果显示:ConA自小鼠尾静脉注射8 h后血清ALT、AST 和TBIL明显升高,肝组织HE染色结果显示肝内大量淋巴细胞浸润,肝窦内红细胞淤积,肝细胞凋亡坏死区明显。六味五灵片各剂量组能明显降低小鼠血清ALT、AST 和TBIL水平,明显改善肝脏的病理损伤及肝细胞凋亡状况,初步表明六味五灵片对Con A 诱导的小鼠免疫性肝损伤具有保护作用。
早期研究表明ConA激活CD4+T细胞向肝组织浸润[19],辅助性T细胞( Th)和巨噬细胞是该模型的主要效应细胞[20]。正常情况下,辅助性T淋巴细胞亚群Th1/Th2细胞处于平衡状态,但机体功能异常时,Th1/Th2平衡失调向Th1或Th2状态转化。Th1及其细胞因子占优势的状态称Th1状态,Th2及其细胞因子占优势的状态称为Th2状态[21-22]。在ConA 诱导的肝损伤模型中,Th1型细胞因子和促炎细胞因子起主要损伤作用[23]。研究发现[20],Th1/Th2细胞因子的活性是相互拮抗的,其平衡和调控对免疫反应至关重要。本研究结果显示,ConA造模后,Th1细胞数量及其分泌的关键性细胞因子IFN-γ、IL-12、TNF-α明显增加,Th2细胞数量及其分泌的关键细胞因子IL-4和L-10未发生明显变化。说明ConA诱导了小鼠肝脏中Th1/Th2细胞平衡失调,此时处于Th1状态,引起了肝脏损伤,这与文献中报道的结果一致。六味五灵片预处理后,Th1细胞及其所分泌的细胞因子明显减少,Th2细胞及其所分泌的细胞因子明显增加,说明六味五灵片可通过抑制ConA引起的小鼠Th1细胞比例的升高,促进Th2细胞比例的增加,从而恢复Th1/Th2细胞平衡,减轻肝脏损伤。

Fig 2 Effect of LWWL on liver pathology in mice with immunological liver injury(×100)
A:Control group;B:Model group;C:39mg·kg-1Bicyclol group;D:8 g·kg-1LWWL group;E:16 g·kg-1LWWL group

Fig 3 Effect of LWWL on activation of Th1/Th2 in spleen of mice with immunological liver injury(n=4)
**P<0.01vsnormal;#P<0.05,##P<0.01vsmodel
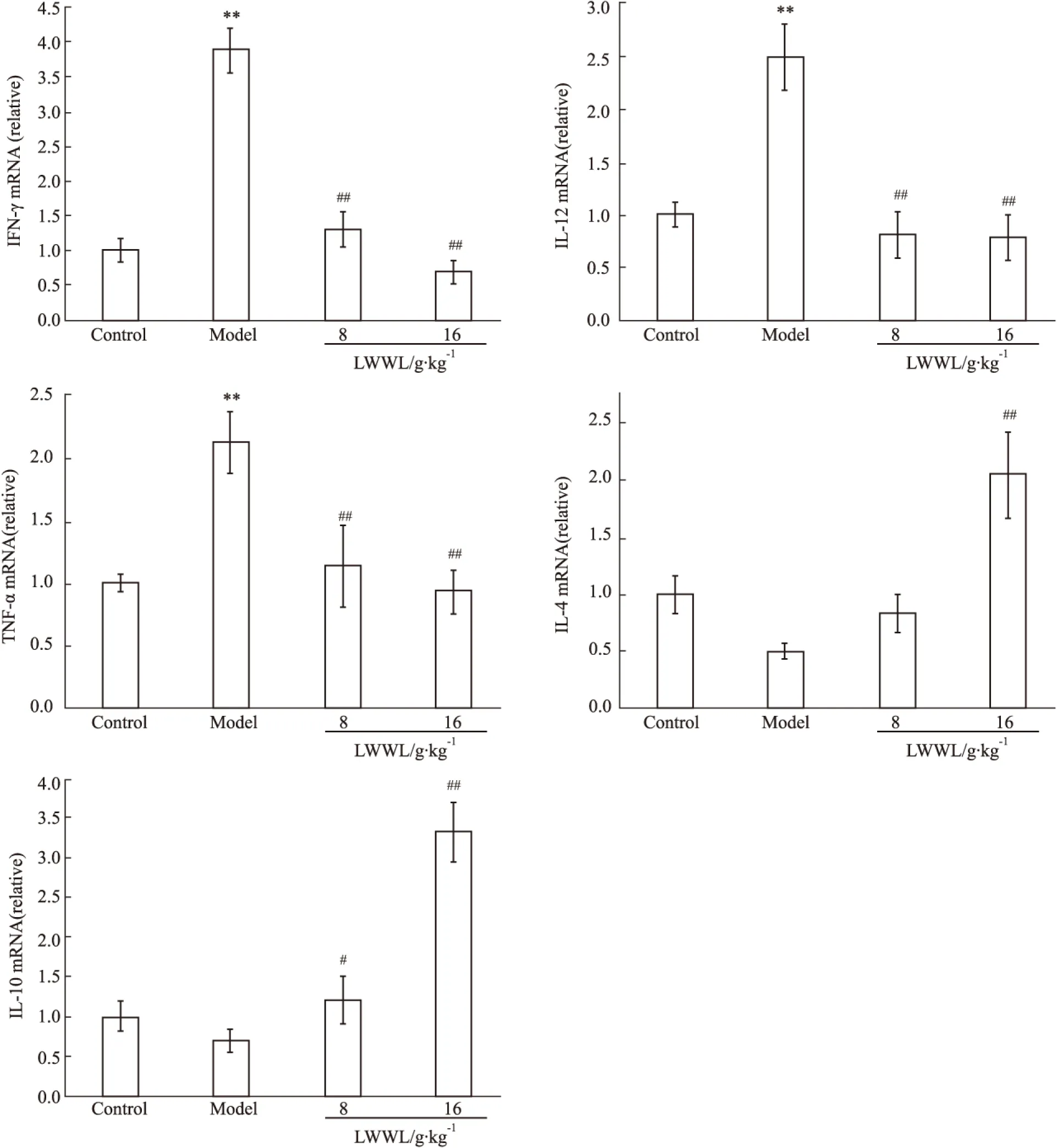
Fig 4 Effect of LWWL on the level of Th1/Th2 cytokines mRNA in liver tissue of mice with immunological liver injury
**P<0.01vsnormal;##P<0.01vsmodel
T-bet选择性表达于Th1细胞,是Th1细胞特异性转录因子,在Th1 细胞的分化过程中起决定性作用[24],可反式激活IFN-γ的启动子[25];GATA-3则是Th2细胞的特异性转录因子[26],可通过IL-4依赖的机制抑制Th1的活化[27]。T-bet/ GATA-3是从Th1/Th2细胞分化的上游控制Th1/ Th2分化的重要蛋白,T-bet/ GATA-3的平衡对Th1/ Th2平衡调节起到关键性的作用[28]。本研究结果显示,模型组中GATA-3蛋白表达降低,而T-bet未发生明显的改变,相对于T-bet而言,GATA-3蛋白相对降低,此时肝脏环境处于Th1状态,肝细胞损伤严重。给予六味五灵片干预后,GATA-3蛋白的表达上升,T-bet虽有所增加,但差异无统计学意义,此时GATA/T-bet比例上升,平衡向Th2状态发生了转化,因此肝脏损伤程度减轻。综上所述,Th1及其细胞因子占优势,是ConA 诱导的肝损伤重要因素, 是肝损伤的机制之一,六味五灵片可通过作用于GATA-3蛋白,调节ConA诱导的Th1/Th2细胞失衡,使机体免疫趋向于平衡协调,减轻肝脏损伤,达到保肝作用。
( 致谢:本实验在解放军第三〇二医院全军中医药研究所&中西医结合诊疗与研究中心分子生物学实验室完成。特别感谢导师肖小河老师、柏兆方老师在实验设计之初给予指导,感谢韩延忠师兄在后续的实验操作、论文撰写方面给予的帮助,感谢王伽伯老师、郭玉明老师、牛明老师、张雅铭老师、沈宏辉老师在实验过程中给予的意见和建议,以及实验室同学们的支持,在此致以诚挚的谢意。)

Fig 5 Effect of LWWL on the activation of Th1/Th2 transcription factor T-bet/GATA-3 in liver tissues of mice with immunological liver injury
A:Control group;B:Model group;C:8 g·kg-1LWWL group;D:16 g·kg-1LWWL group.**P<0.01vsnormal;##P<0.01vsmodel
[1] Malik R, Mookerjee R P, Jalan R. Infection and inflammation in liver failure: Two sides of the same coin[J].JHepatol, 2009, 51(3):426-9.
[2] Antoniades C G, Berry P A, Wendon J A, et al.The importance of immune dysfunction in determining outcome in acute liver failure[J].JHepatol, 2008, 49(5):845-61.
[3] Lähr H F, Schlaak J F, Gerken G, et al. Phenotypical analysis and cytokine release of liver-infiltrating and peripheral blood T lymphocytes from patients with chronic hepatitis of different etiology[J].Liver, 1994, 14(3):161-6.
[4] Mcfarlane I G. Pathogenesis of autoimmune hepatitis[J].BiomedPharmacother, 1999, 53(5-6):255-63.
[5] Rehermann B. Intrahepatic T cells in hepatitis B: viral control versus liver cell injury[J].JExpMed, 2000, 191(8):1263-8.
[6] 辛绍杰, 韩 晋, 丁晋彪,等. 六味五灵片治疗慢性乙型肝炎多中心随机对照研究[J]. 中西医结合肝病杂志, 2009, 19(1):7-9.
[6] Xi S J, Han J, Ding J B, et al. The clinical study of Liuweiwuling Tablet on patients with chronic hepatitis B[J].ChinJIntegratedTraditandWestMedonLiverDis, 2009, 19(1):7-9.
[7] 吴贻琛, 朱 冰, 游绍莉,等. 六味五灵片治疗慢性乙型肝炎近期疗效分析[J]. 传染病信息, 2007, 20(2):116-7.
[7] Wu Y C, Zhu B, You S L, et al. Short curative effect analysis of Liuweiwuling Tablets in the treatment of chronic hepatitis B[J].InfectDisInforma, 2007, 20(2):116-7.
[8] 蔺鹏珍, 张文斐, 马丽萍,等. 拉米夫定阿德福韦联合六味五灵片治疗HBeAg阴性的慢性乙型肝炎及肝硬化患者37例临床分析[J]. 山西医药杂志, 2014, 43(13):1560-2.
[8] Lin P Z, Zhang W F, Ma L P, et al. Lamivudine and ADV combined with Liuweiwuling Tablets treatment clinical analysis of 37 cases of HBeAg negative chronic hepatitis B and liver cirrhosis[J].ShanxiMedJ, 2014, 43(13):1560-2.
[9] 程荣贵. 六味五灵片治疗肝炎后肝硬化疗效分析[J]. 中华临床医学研究杂志, 2008,14(10): 1498-9.
[9] Cheng G R. Analysis of the curative effect of six kinds of Liuweiwuling Tablets in the treatment of liver cirrhosis after hepatitis[J].ChinJClinPractMed, 2008,14(10): 1498-9.
[10] 刘 添, 周建平, 李绍旦. 六味五灵片对LPS联合GalN所致肝损伤的防护作用机制研究[J]. 北京中医药, 2014, 33(3):226-8.
[10] Liu T, Zhou J P, Li S D. Protective effect mechanism of Liuweiwuling Tablet on hepatic injury induced by lipopolysaccharide and GaIN[J].BeijingJTraditChinMed, 2014, 33(3):226-8.
[11] Lei Y C, Wen L, Pan L. Liuweiwuling tablets attenuate acetaminophen-induced acute liver injury and promote liver regeneration in mice[J].WorldJGastroenterol, 2015, 21(26):8089-95.
[12] Xiao Z Y, Chen S H, Zhou W X, et al. H1521, a novel derivative of 4-hydroxyquinoline-3-carboxamide, suppresses the development of lupus in mice by inducing Th1 cytokine profile in T cells[J].IntImmunopharmacol, 2011, 11(4):435-43.
[13] Sharma R, Tiku A B. Emodin inhibits splenocyte proliferation and inflammation by modulating cytokine responses in a mouse model system[J].JImmunotoxicol, 2016, 13(1):20-6.
[14] Heymann F, Hamesch K, Weiskirchen R, et al. The concanavalin A model of acute hepatitis in mice[J].LabAnim, 2015, 49(1 Suppl):12-20.
[15] Tiegs G, Hentschel J, Wendel A. A T cell-dependent experimental liver injury in mice inducible by concanavalin A[J].JClinInvest, 1992, 90(1):196-203.
[16] Jung K, Kang M, Park C, et al. Protective role of V-set and immunoglobulin domain-containing 4 expressed on kupffer cells during immune-mediated liver injury by inducing tolerance of liver T- and natural killer T-cells[J].Hepatology, 2012, 56(5):1838-48.
[17] 吴 炜, 陈 智. 佛波脂和离子霉素对大鼠CD3/CD4/CD8分子表达的影响[J]. 浙江预防医学, 2007, 19(9):4-5.
[17] Wu W, Cheng Z. Effect of phorbol myfismte acetate and ionomycin on CD3/ CD4/ CD8 expression[J].ZhejiangJPreventiveMed, 2007, 19(9):4-5.
[18] Gantner F, Leist M, Lohse A W, et al. Concanavalin A-induced T-cell-mediated hepatic injury in mice: The role of tumor necrosis factor[J].Hepatology, 1995, 21(1):190-8.
[19] Trautwein C, Rakemann T, Brenner D A, et al. Concanavalin A-induced liver cell damage: Activation of intracellular pathways triggered by tumor necrosis factor in mice[J].Gastroenterology, 1998, 114(5):1035-45.
[20] Zhang X L, Quan Q Z, Sun Z Q, et al. Protective effects of cyclosporine A on T-cell dependent ConA-induced liver injury in Kunming mice[J].WorldJGastroenterol, 2001, 7(4):569-71.
[21] 姚金晶, 陈宜涛. Th1/Th2平衡调节与疾病发生的研究进展[J]. 现代生物医学进展, 2009, 9(13):2597-600.
[21] Yao J J, Cheng Y T. Advances of Regulation Th1/Th2 type cytokines balance in human diseases[J].ProgModernBiomed, 2009, 9(13):2597-600.
[22] 邓雪红,刑小燕,李 光,等.Th1/Th2失衡与缺血/再灌注损伤及中药多靶点调节的应用前景分析[J]. 中国药理学通报,2015,31(9):1185-9.
[22] Deng X H,Xing X Y,Li G,et al. Th1/Th2 imbalance in ischemia-reperfusion injury and the application prospects of traditional Chinese medicine with multi-target effect[J].ChinPharmacolBull,2015,31(9):1185-9.
[23] Kremer M, Hines I N, Milton R J, et al. Favored T helper 1 response in a mouse model of hepatosteatosis is associated with enhanced T cell–mediated hepatitis[J].Hepatology, 2006, 44(1):216-27.
[24] Bowen H, Kelly A, Lee T, et al. Control of cytokine gene transcription in Th1 and Th2 cells[J].ClinExpAllergy, 2008, 38(9):1422-31.
[25] Szabo S J, Kim S T, Costa G L, et al. A novel transcription factor, T-bet, directs Th1 lineage commitment[J].Cell, 2000, 100(6):655-69.
[26] Jenner R G, Townsend M J, Jackson I, et al. The transcription factors T-bet and GATA-3 control alternative pathways of T-cell differentiation through a shared set of target genes[J].ProcNatlAcadSciUSA, 2009, 106(42):17876-81.
[27] Ouyang W, Ranganath S H, Weindel K, et al. Inhibition of Th1 Development Mediated by GATA-3 through an IL-4-Independent Mechanism[J].Immunity, 1998, 9(5):745-55.
[28] Zhu K, Ye J, Wu M, Cheng H. Expression of Th1 and Th2 cytokine-associated transcription factors, T-bet and GATA-3, in peripheral blood mononuclear cells and skin lesions of patients with psoriasis vulgaris[J].ArchDermatolRes, 2010, 302(7):517-23.
The protection effects of Liuweiwuling Tablets against concanavalin A-induced acute immunological liver injury in mice
LIU Hui-min1,2, HAN Yan-zhong1,2, GUO Yu-ming1, NIU Ming1, ZHANG Ya-ming1, SHEN Hon-hui1, WANG Jia-bo1, BAI Zhao-fang1, XIAO Xiao-he1
(1.ChinaMilitaryInstituteofChineseMateria&IntegrativeMedicalCenter, 302MilitaryHospital,Beijing100039,China; 2.ChengdeMedicalUniversity,Chengde,Hebei067000,China)
Aim To explore the protective effects and underlying mechanisms of Liu weiwuling Tablets (LWWL) in concanavalin A (ConA) induced acute immunological liver injury in mice. Methods Mice were randomly divided into control, model, Bicyclol, LWWL low dose (8 g·kg-1)and LWWL high dose (16 g·kg-1)group. The medicattion was performed once daily for seven consecutive days, then the model of immunological liver injury was prepared by intravenous injection of ConA (15mg·kg-1)in the tail of mice in each group except for the control group one hour after the last treatment. The pathological changes of liver tissues of mice were evaluated by HE staining with, and the levels of alanine amino transferase (ALT), aspartate aminotransferase (AST), and total bilirubin (TBIL) in serum were analyzed by colorimetric method; the level of interleukin 12 (IL-12), interferon-γ (IFN-γ), tumor necrosis factor-α (TNF-α), interleukin 4 (IL-4) and interleukin 10 (IL-10) in liver was measured by real-time quantitative polymerase chain reaction (RT-qPCR); the changes of Th1 (IFN-γ) and Th2 (IL-4) cells were observed by flow cytometric (FCM) analysis; the expression of Th1/Th2 transcription factor T-bet/GATA-3 in liver tissue was detected by Western blot. Results Compared with normal control group, the serum ALT, AST and TBIL were significantly increased in model group, the pathological damage of the liver tissue was severe, and the necrosis and apoptosis of hepatic cells were large, which showed that the model was successful. Compared with model group, both low and high dose of LWWL could significantly reduce ALT, AST, TBIL levels in serum induced by ConA; Th1 cells in the spleen decreased, while Th2 cells increased; the expressions of IL-12, IFN-γ and TNF-α mRNA were significantly inhibited with IL-4 and IL-10 mRNA expression elevated in mouse liver tissue; the expression of GATA-3 protein was up-regulated, T-bet protein expression showing no significant changes. Conclusion LWWL could regulate Th1/Th2 balance, thus inhibiting the acute immunity hepatic injury induced by ConA.
Liuweiwuling Tablets; concanavalin A; acute immunological liver injury; immunological balance of Th1/Th2; hepatoprotection; T-bet/GATA-3
时间:2016-12-27 16:13
http://www.cnki.net/kcms/detail/34.1086.R.20161227.1613.046.html
2016-09-14,
2016-11-13
国家自然科学基金资助项目( No 81274026 )
刘慧敏(1989- ) , 女, 硕士生, 研究方向:临床中药学,Tel:010-66933324, E-mail:sugg77@163.com; 肖小河(1963 - ) , 男, 博士, 研究员, 博士生导师, 研究方向:临床中药学, 通讯作者, E-mail:Pharmacy@126.com; 柏兆方(1982 - ), 男, 博士, 助理研究员, 研究方向:临床中药学, 通讯作者, E-mail: baizf2008@126.com
10.3969/j.issn.1001-1978.2017.01.023
A
1001-1978(2017)01-0133-08
R-332;R282.71;R322.47;R392.12;R575.053.1;R593.053.1