GLP-1对AGEs诱导H9C2心肌细胞凋亡的保护作用研究
张 军,谷 翔,黄问银,张普华,殷嫦嫦 ,于 欢,张义平,王丽丽,李卫东
(1. 九江学院附属医院心内科, 江西 九江 332000;2. 南昌大学研究生院医学部, 江西 南昌 330006;3. 九江学院基础医学院,江西 九江 332000)
GLP-1对AGEs诱导H9C2心肌细胞凋亡的保护作用研究
张 军1,2,谷 翔1,黄问银1,张普华1,殷嫦嫦3,于 欢3,张义平3,王丽丽3,李卫东3
(1. 九江学院附属医院心内科, 江西 九江 332000;2. 南昌大学研究生院医学部, 江西 南昌 330006;3. 九江学院基础医学院,江西 九江 332000)
目的 研究胰高血糖素样肽素-1(glucogon like pep tide-1,GLP-1)对晚期糖基化终产物(advanced glycation end products,AGEs)诱导H9C2心肌细胞凋亡的保护作用机制。方法 体外培养H9C2细胞,实验分为4组:正常对照组、100 mg·L-1AGEs试验组、AGEs(100 mg·L-1)+GLP-1(10 nmol·L-1)组、 AGEs(100 mg·L-1)+NAC(5 mmol·L-1)组,处理24 h。通过CCK-8比色法检测细胞存活率,相差显微镜观察细胞形态,双氯荧光素(DCFH-DA)染色荧光显微镜摄片观察细胞内活性氧(ROS)水平;RT-PCR法测定Bax、Bcl-2 mRNA基因的表达;运用Hoechst 33258检测试剂盒及流式细胞术检测心肌细胞的凋亡率,Western blot检测凋亡相关蛋白Bax、Bcl-2的表达量。结果 与正常组相比,100 mg·L-1AGEs组降低H9C2细胞生存率,活性氧(ROS)生成量增加;与 AGEs 组相比,AGEs+GLP-1组细胞生成率提高,活性氧(ROS)生成量减少。与正常组相比,AGEs组促凋亡蛋白Bax表达增加,抑制凋亡蛋白Bcl-2减少,细胞凋亡率升高;AGEs+GLP-1组较AGEs组下调促凋亡蛋白Bax,上调凋亡抑制蛋白Bcl-2,细胞凋亡率减少。结论 GLP-1对AGEs诱导的心肌细胞凋亡具有保护作用,其保护机制与减少活性氧(ROS)有关。
胰高血糖素样肽素-1; 糖基化终产物;活性氧; H9C2心肌细胞; 凋亡; 心肌保护;机制
大量研究表明晚期糖基化终产物(advanced glycation end proudct, AGEs)在糖尿病心肌病的发生发展过程中发挥关键的作用[1-2],AGEs是机体在长期高糖状态时蛋白质和还原糖之间经过非酶性糖基化反应生成的物质;AGEs诱导心肌氧化应激,活性氧形成,进而导致细胞损伤、甚至凋亡。因此,发现抑制AGEs诱导心肌氧化应激并对其损伤性小的药物尤为关键。
越来越多的研究证实,过多活性氧在心血管疾病发生发展中起到重要作用。如:动脉粥样硬化、心力衰竭[3-4]等。另外心力衰竭、心肌病等心血管疾病的发生、发展与心肌细胞凋亡现象有关。心肌细胞凋亡是心肌缺血损伤机制中的一个重要环节,是引发心力衰竭的重要诱因; 其中活性氧 ( ROS) 介导的氧化应激在心肌细胞凋亡的病理过程中发挥了重要的作用[5-6]。
胰高血糖素样肽-1(glucogen like peptide-1,GLP-1)是机体中一种具有“肠促胰素效应”的肠源性激素,在发挥综合降糖作用外,GLP-1对心血管系统也有保护作用;在血管内皮细胞中GLP-1能降低RAGE表达,阻断AGEs/RAGE轴造成的细胞损害[7-8];同时发现GLP-1也可减少急性冠脉综合征患者心肌梗死面积[9-10]。但 GLP-1对AGEs诱导的H9C2心肌细胞损伤的作用未见报道。本实验通过建立AGEs诱导H9C2心肌细胞损伤模型,探讨GLP-1对AGEs诱导H9C2心肌细胞损伤性保护作用及其可能机制。为GLP-1临床上有效治疗糖尿病心血管并发症提供理论研究基础。
1 材料与方法
1.1 细胞与主要试剂 H9C2大鼠心肌细胞株由南昌大学第二附属医院实验室细胞库惠赠。AGEs (121800,Calbiochem,美国),DMEM-F12培养基( Hyclone公司,美国), 胎牛血清(BI公司,以色列),GLP-1(Sigma公司,美国),Hoechst 33258试剂盒购自南京建成生物工程研究所,N-acety-L-cysteine( NAC)、活性氧检测试剂盒、细胞计数CCK-8试剂盒均购于碧云天生物技术研究所,细胞凋亡检测试剂盒AnnexinV-FITC/PIKit(北京庄盟),兔抗老鼠GAPDH(10494-1-AP,Peprotech公司产品,美国),Bax、Bcl-2(12789-1-AP) 多克隆抗体为Peprotech公司产品,CDI-165M 三气细胞培养箱、BIO-BEST200E凝胶成像系统(SIM公司),TS100-F倒置相差显微镜(Nikon公司,日本), 超净工作台(苏州净化设备有限公司),冷冻高速离心机( 珠海黑马医学仪器有限公司),水平电泳仪( 北京六一仪器厂),PCR仪(BIO-RAD公司),BDFACSCalibur流式细胞仪( BD公司,美国)
1.2 方法
1.2.1 细胞培养与处理 H9C2细胞培养于含体积分数为0.15胎牛血清的DMEM-F12培养液,37 ℃、CO2体积分数0.05、饱和湿度条件下培养。细胞贴壁80%以上时,0.25%胰酶消化、计数、传代,每3~4 d传代1次。取接种对数生长期细胞进行实验。
1.2.2 CCK-8法检测细胞成活率 取对数生长期细胞,以2×107·L-1细胞浓度接种96孔板,各实验组设4个复孔,另设无细胞培养液孔为空白对照。根据CCK-8试剂盒说明书,处理结束后每孔加入10μL CCK-8工作液。37 ℃培养2 h,酶标仪( El×800,BioTek,USA) 记录 450 nm波长处的吸光度。取4孔光密度( optical density,OD) 的平均值,按下列公式计算细胞存活率:生存率/% = (OD处理组-OD空白组)/(OD对照组-OD 空白组)×100%。实验重复3次。
1.2.3 细胞内ROS 水平的测定 根据实验需要给予相应的处理:(1) 实验对照组; (2)100 mg·L-1AGEs处理24 h; (3) 10 nmol·L-1GLP-1与100 mg·L-1AGEs处理24 h; (4) 抗氧化剂(NAC)与100 mg·L-1AGEs处理24 h。均包括3个复孔。处理完成后,用PBS漂洗6孔板2次,用10 μmol·L-1DCFH-DA 染液于37 ℃孵育20 min。在荧光显微镜下随机选取5个不重复区摄片,用 Image J 1.410 软件分析4个视野绿色荧光强度的平均值,再对每组的各样本进行统计分析。
1.2.4 Hoechst 33258核染色法检测心肌细胞凋亡 H9C2心肌细胞经不同因素处理后,小心弃去培养基,PBS洗1遍,4%多聚甲醛固定10 min,PBS 漂洗后,加入5 mg·L-1Hoechst 33258 试剂,室温轻摇30 min。在荧光显微镜 ( BX50-FLA,Olympus,Japan)下摄片,染色质均匀分布,核被染成均匀蓝色的细胞认为是正常细胞,核呈浓缩、碎裂的明亮蓝色细胞认为是凋亡细胞,随机选取视野在荧光显微镜下摄片。
1.2.5 RT-PCR检测凋亡相关基因 Bax、Bcl-2 mRNA的表达 将H9C2细胞按1×106/孔接种于6孔板中,实验分组同上,刺激细胞24h后,按RNA快速提取试剂盒说明书提取各组细胞总RNA,采用两步法RT-PCR:以Olig(dT)为引物,以M-MLV反转录合成cDNA,0.01琼脂糖凝胶电泳鉴定其完整性再行 PCR扩增,PCR反应体系: cDNA 0.5 μL,上下游引物各1 μL,Mix 12.5 μL,ddH2O 10 μL,总体积25 μL。扩增产物采用0.01琼脂糖凝胶电泳25~30 min,凝胶成像系统照相,Image J软件进行灰度分析。如 Table1所示
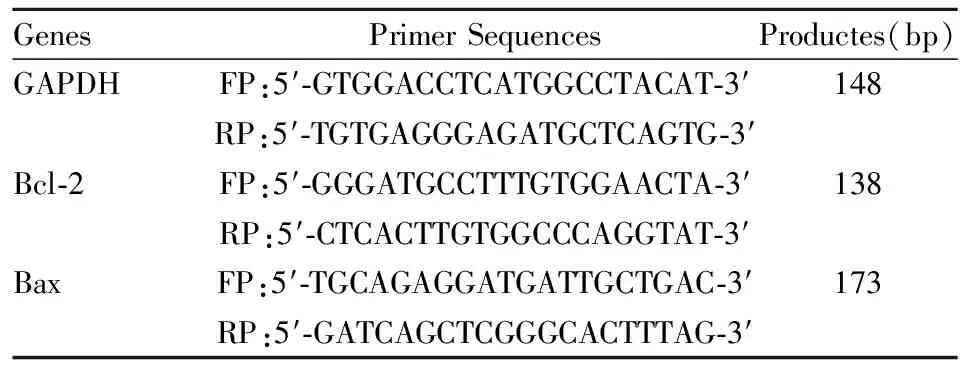
Tab 1 Primer sequences and products
1.2.6 Western blot 测定 Bax、Bcl-2 蛋白表达 收集H9C2 细胞,预冷的 PBS 洗涤3次,RIPA全细胞裂解液冰上裂解30 min,离心取上清,BCA 法进行蛋白定量。每孔蛋白上样量 30 μg,在0.1聚丙烯酰胺凝胶( SDS-PAGE)中进行电泳70V,电泳15-20 min,待指示剂到浓缩胶与分离胶交界处后,改为 120V 继续电泳,直至溴酚蓝完全到凝胶底部停止电泳。置于电转液中,在250 mA恒定电流下将蛋白转移至 PVDF 膜上。50 g·L-1脱脂奶粉封闭1 h,Bax、Bcl-2一抗( 1 ∶1000 稀释)4 ℃孵育过夜,TBST洗膜3次。二抗室温孵育1 h,漂洗3次,ECL显色。用ECL 检测液发光显影定影后,用Image J软件进行灰度分析。
1.2.7 流式细胞仪检测细胞凋亡 收集H9C2 细胞,预冷的PBS洗2次,每次均需300 g,4℃离心 5 min,加入100 μL 1× Binding buffer 重悬细胞。再加入5 μL Annexin V-FITC 和 PI Staining solution,轻轻混匀。避光,室温反应10 min。后再加入400 μL 1× Binding buffer 混匀,样品在1 h内用流式细胞仪检测
2 结果
2.1 细胞形态学观察 倒置相差显微镜观察发现: 正常 H9C2细胞呈梭形,排列规整,大小均一,胞核、胞质境界清楚。AGEs 损伤组细胞大小不规则,胞体变圆、皱缩。胞核增大,胞质有空泡出现。AGEs+GLP-1组细胞大小较为均一,形态趋向正常,细胞皱缩变形和胞质空泡化减少。

Fig 1 Cellular morphology observation(×100)
A:Control group; B: AGEs group; C:AGEs+GLP-1 (10 nmol·L-1) group;D:AGEs+NAC (5 mmol·L-1) group
2.2 GLP-1处理提高H9C2细胞生成率 用CCK-8法测定细胞生成率,如Tab 2示:根据不同浓度预实验结果并参考文献[11-12],以100 mg·L-1AGEs 处理24h建立H9C2损伤模型,正常对照组,100 mg·L-1AGEs,AGEs+GLP-1 (10 nmol·L-1), AGEs+NAC(5mmol·L-1)处理24 h。结果显示100 mg·L-1处理细胞生成率明显降低,而AGEs+GLP-1组的细胞生成率升高。
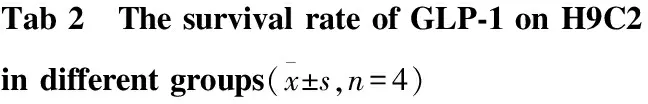
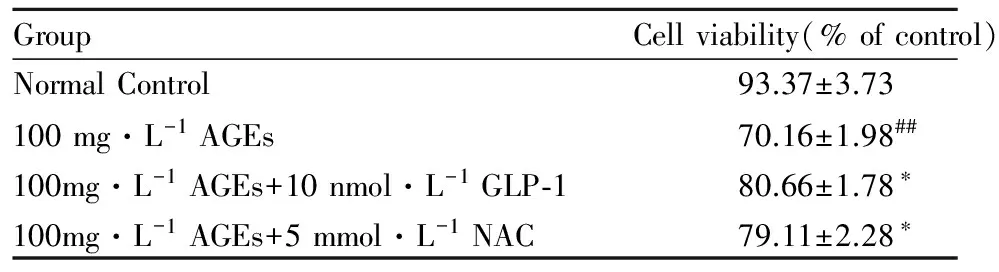
GroupCellviability(%ofcontrol)NormalControl93.37±3.73100mg·L-1AGEs70.16±1.98##100mg·L-1AGEs+10nmol·L-1GLP⁃180.66±1.78∗100mg·L-1AGEs+5mmol·L-1NAC79.11±2.28∗
##P<0.01vscontrol group ;*P<0.05vs100 mg·L-1AGEs group
2.3 GLP-1处理抑制AGEs诱导的ROS Fig 2显示, 正常心肌细胞内存在少量的ROS,100 mg·L-1AGEs处理H9C2心肌细胞24 h使胞内ROS水平明显增多,与对照组比较,差异具有统计学意义(P<0.01)。10 nmol·L-1GLP-1与100 mg·L-1AGEs共培养24 h能明显地抑制 AGEs 诱导的ROS,使胞内ROS 明显减少(P<0.05)。
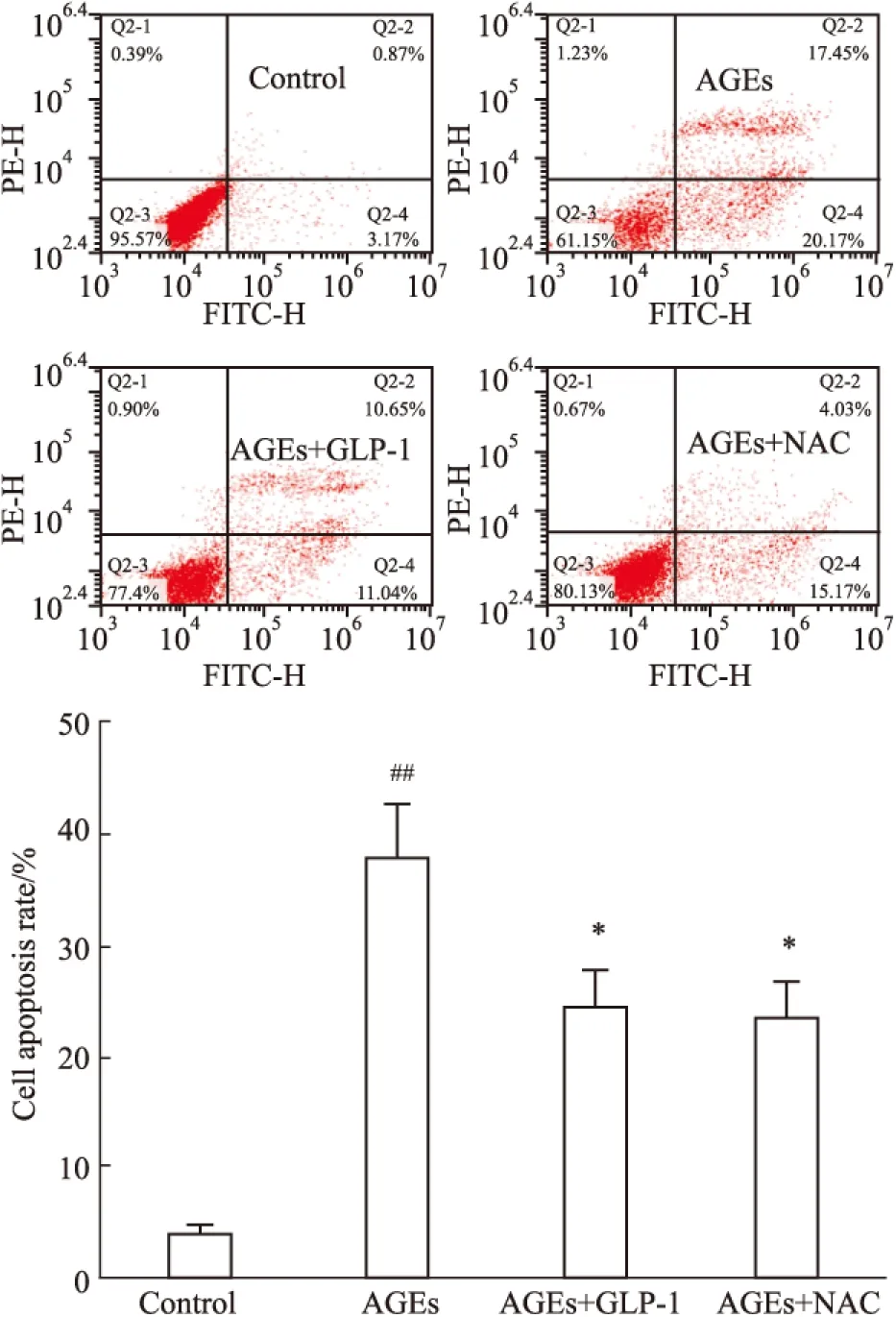
2.4 GLP-1抑制 AGEs 诱导的心肌细胞凋亡 Fig 3显示,与正常组比较,100 mg·L-1AGEs处理H9C2心肌细胞24h能使凋亡H9C2细胞数量明显增多;与100 mg·L-1AGEs组损伤相比,100 mg·L-1AGEs+10 nmol·L-1GLP-1、100 mg·L-1+5 mmol·L-1NAC mg·L-1组对细胞凋亡有抑制作用,差异具有统计学意义(P<0.05) 。
2.5 GLP-1抑制促凋亡Bax mRNA的表达,增加抑凋亡Bcl-2 mRNA的表达 Fig 4显示,与正常组相比较,100 mg·L-1AGEs处理24 h,促凋亡蛋Bax含量增加;抑凋亡蛋白Bcl-2含量则减少;GLP-1处理可以抑制上述改变。与AGEs损伤组比较,GLP-1+AGEs处理组使Bax mRNA减少,Bcl-2 mRNA 增加。2.6 运用流式细胞仪检测:GLP-1减少AGEs诱导的H9C2心肌细胞凋亡 Fig 5显示,正常组凋亡率为3.73%,100 mg·L-1AGEs处理细胞凋亡率明显增加,而100 mg·L-1AGEs+10 nmol·L-1GLP-1组、100 mg·L-1AGEs+5 mmol·L-1NAC组处理24 h可明显地减少凋亡细胞的数量;与AGEs组比较,差异具有统计学意义(P<0.05)。
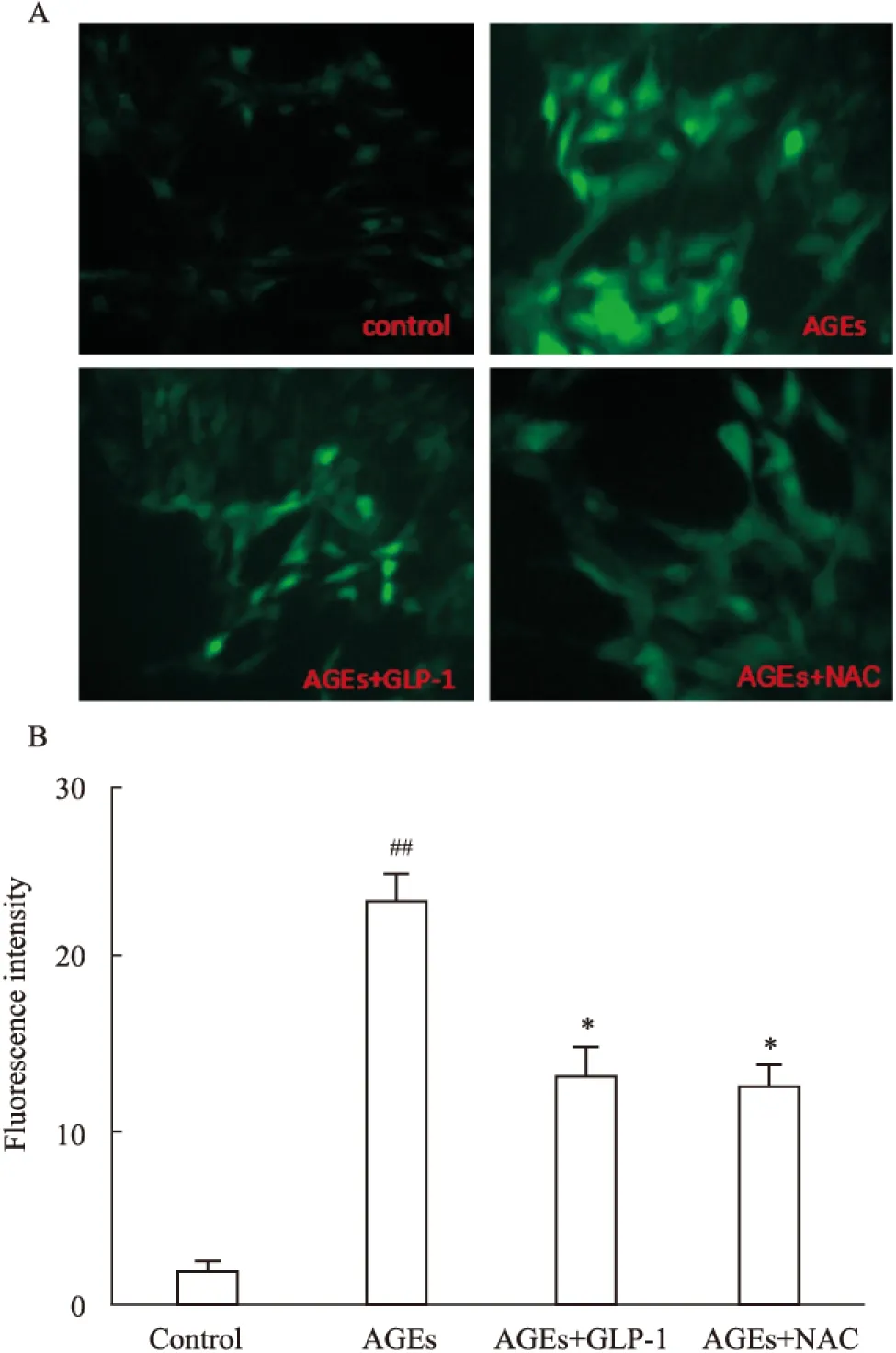
Fig 2 Effect of GLP-1 on AGEs-induced
A、B:Fluorescence intensity of ROS production in H9C2 cells in different groups under inverted fluorescence microscope.##P<0.01vscontrol;*P<0.05vsAGEs
2.7 Western blot检测各组凋亡相关蛋白Bax,Bcl-2表达 细胞发生凋亡时,促凋亡蛋白Bax增加,而抑制凋亡蛋白Bcl-2减少。Western blot检测结果如Fig 6,与对照组相比,AGEs组的Bax上调及Bcl-2下调。与AGEs组相比,AGEs+GLP-1组,AGEs+NAC组的Bax表达量均下调,而抑制凋亡Bcl-2均上调。与AGEs+GLP-1组相比,AGEs+NAC组差异无统计学意义(P>0.05)。
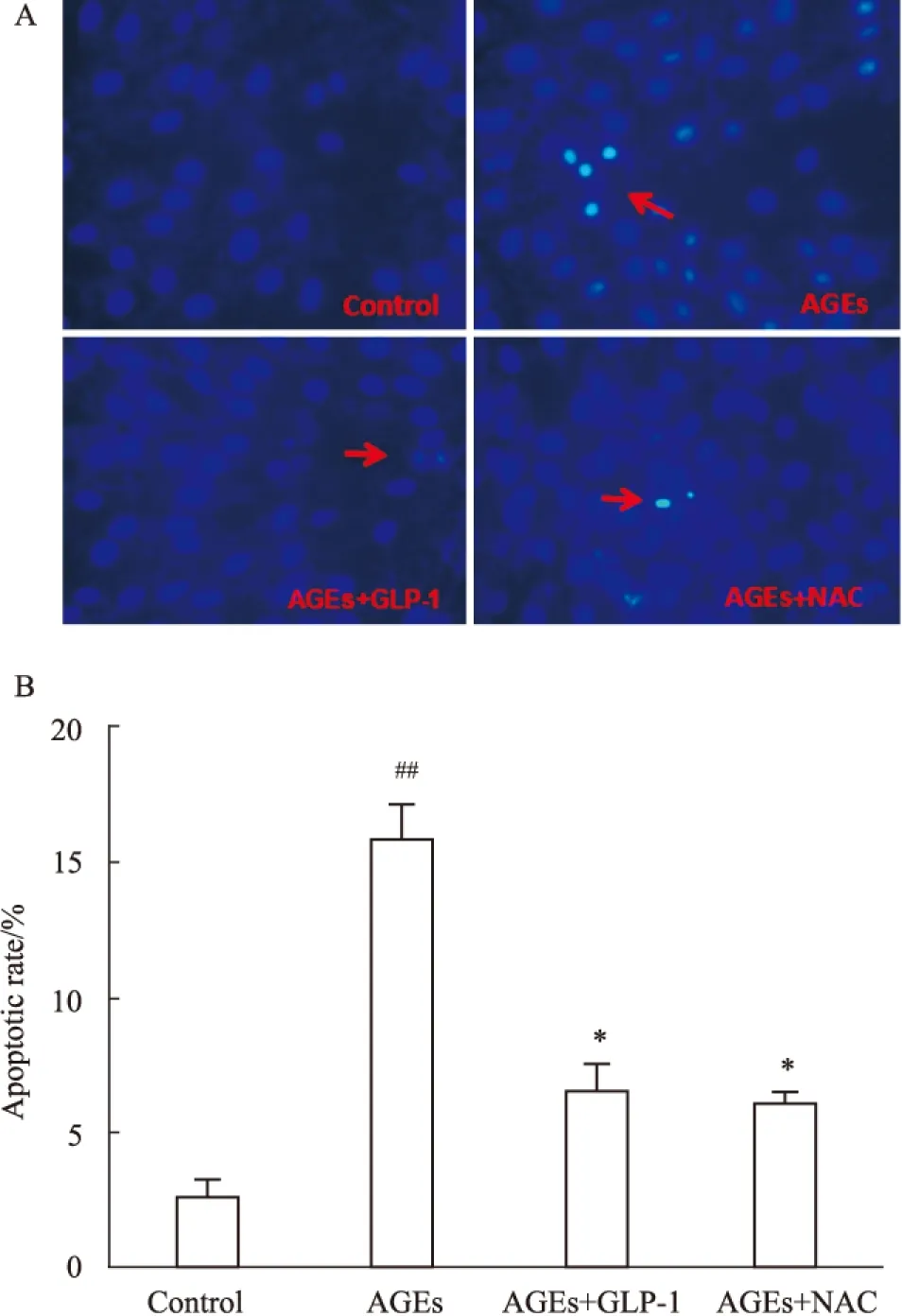
A、B:Show that the apoptotic rate of each group H9C2 was determined by fluorescence microscope.##P<0.01vscontrol;*P<0.05vsAGEs
3 讨论
越来越多的实验证实AGEs在糖尿病心肌病的发生发展过程中发挥关键的作用[2-3],AGEs在心肌细胞代谢过程中,产生大量内源性抗氧化物质,造成心肌细胞过氧化,引发一系列的病理生理变化;AGEs 激活细胞凋亡通路,从而导致细胞凋亡。研究发现:凋亡造成心肌细胞丢失,与AGEs引起的的心肌能量代谢和心功能衰竭关系密切[13-14]。通过CCK-8活力比较,选用100 mg·L-1AGEs建立体外H9C2心肌损伤模型。AGEs对心肌细胞的损伤具有浓度依赖性,Hoechst 33258及流式细胞仪检测其细胞凋亡率明显增加;以上结果证明,本研究成功复制了心肌细胞体外损伤模型。
GLP-1是由肠道L细胞分泌的一种重要的肠促胰岛素;具有一定的抗炎、抑制ROS产生、抗氧化、减少细胞凋亡、发挥对血管内皮细胞的保护作用[9-10,15-16]。在心肌细胞凋亡机制研究中, 目前有3条凋亡途径:死亡受体途径、内质网途径和线粒体凋亡途径[17]。其中线粒体凋亡通路是主要的途径[18],Bax是Bcl-2家族的促凋亡蛋白,细胞受到损伤时,大量的细胞内信号引起前凋亡蛋白Bax的活化,Bax转位到线粒体表面,增加线粒体通透性,导致细胞色素C外漏,从而激活线粒体细胞凋亡途径[19],形成凋亡小体。然而,此凋亡途径可被Bcl-2等蛋白凋亡抑制因子所调控[20-21],Bcl-2可与Bax形成异源二聚体,阻止Bax 向线粒体移位,减少线粒体通透性,抑制Bax 的促凋亡作用。因此,两者在线粒体凋亡途径中起到重要的调节作用[22]。
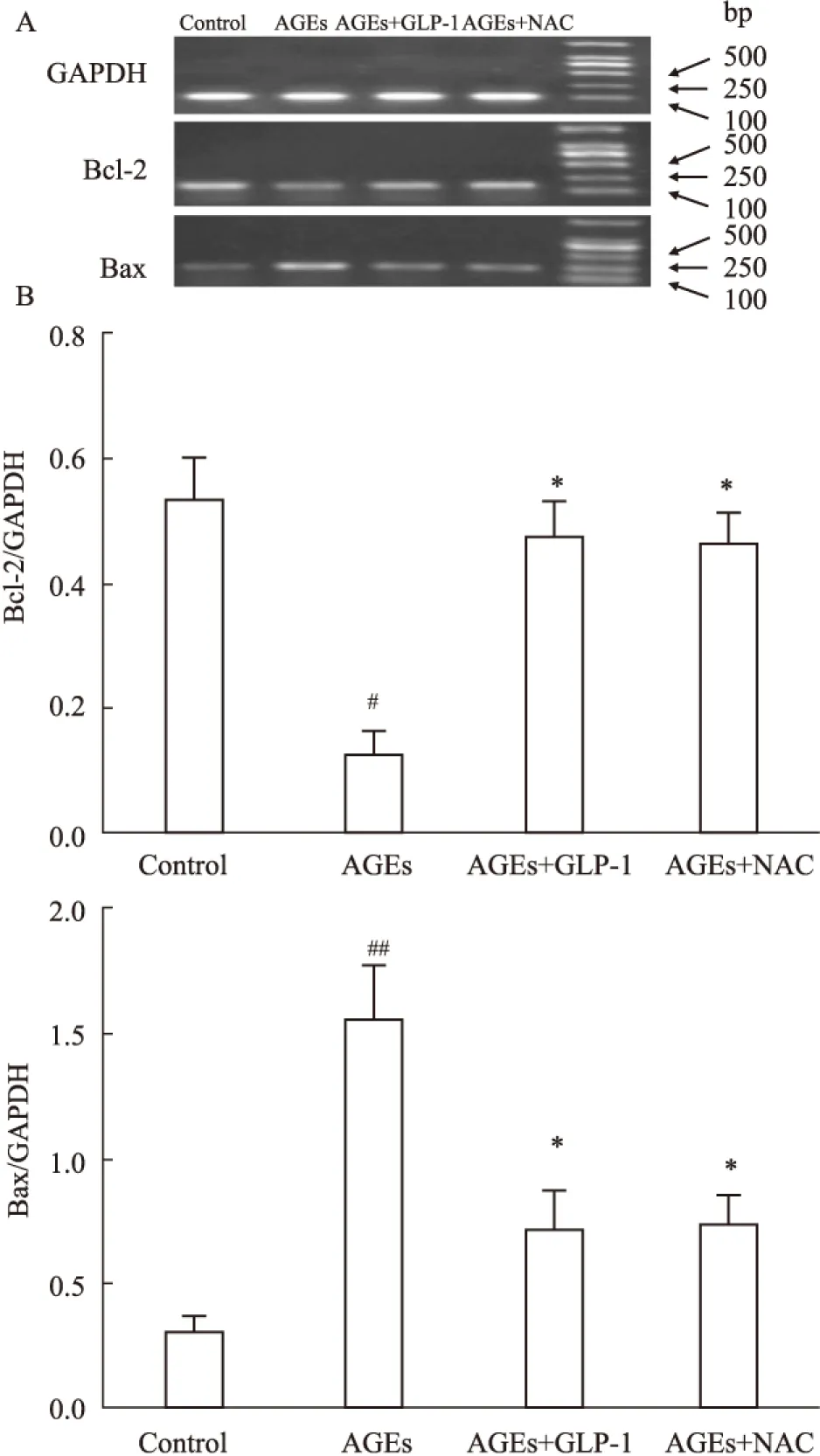
Fig 4 Effect of GLP-1 on anti-apoptotic Bcl-2 and
B、C:##P<0.01vscontrol;#P<0.05vscontrol;*P<0.05vsAGEsl
本研究首先检测了Bax和Bcl-2的表达变化,研究表明GLP-1 对细胞凋亡的抑制是否与Bcl-2 的上调和 Bax 的下调有关。Western blot 实验表明,与正常组相比,AGEs组的促凋亡蛋白Bax表达量明显增加,而抑制凋亡蛋白Bcl-2的表达量减少;而与AGEs组相比,AGEs+GLP-1组下调促凋亡蛋白Bax表达,上调抑制凋亡蛋白Bcl-2的表达。本研究结果说明, GLP-1可能通过调控 Bax 和 Bcl-2 蛋白的表达而缓解氧化损伤。
##P<0.01vscontrol;*P<0.05vsAGEs
流式细胞术检测结果显示, GLP-1作用后, AGEs所导致的 H9C2 细胞凋亡率减少;AGEs损伤组细胞 DCFH-DA 荧光强度水平升高,DCFH-DA 是活性氧的指示剂,细胞氧化应激时,ROS产生增加;GLP-1处理使 DCF-DA 荧光强度水平降低,说明GLP-1 可以清除活性氧,减轻心肌脂质过氧化,对抗 AGEs引起的氧化应激,减轻细胞损伤。结果说明 GLP-1可能通过调控细胞氧化还原系统, 减少 AGEs 引起的ROS 过量堆积, 进而保护心肌细胞。
综上所述, GLP-1拮抗AGEs诱导心肌细胞氧化损伤所导致的凋亡作用, 且能通过调控凋亡相关蛋白发挥对心肌细胞保护作用。上述实验结果对 GLP-1 抗氧化研究、防治糖尿病心血管并发症等疾病具有重要意义。
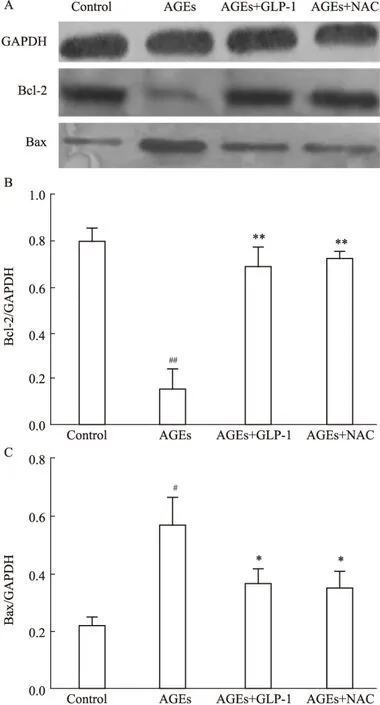
Fig 6 Effect of GLP-1 on anti-apoptotic
B、C:Show that the protein expression of each group H9C2 was determined by Western blot.#P<0.05,##P<0.01vscontrol;*P<0.05 ,**P<0.01vsAGEs group
[1] Prasad A,Bekker P, Tsimikas S. Advanced glycation end products and diabetic cardiovascar disease[J].CardiolRev, 2012,20(4):177-83.
[2] Ramasamy R, Yan S F, Schmidt A M. Receptor for AGE (RAGE): signaling mechanisms in the pathogenesis of diabetes and its complications[J].AnnNewYorkAcadSci, 2011, 1243:88-102.
[3] van den Oever IA,Raterman H G,Nurmohamed M T,et al .Endothelial dys-function,inflammation and apoptosis in diabetes mellitus[J].MediatorsInflamm,2010,2010:792393.
[4] Santos C X,Anilkumar N,Zhang M,et al. Redox signaling in cardiacmyocytes [J].FreeRadicBiolMed,2011,50(7):777-93.
[5] Kajstura J, Cheng W, Reiss K, et al. Apoptotic and necrotic myocyte cell deaths are independent contributing variables of infarct size in rats[J].LabInvest, 1996, 74(1): 86-107.
[6] Rodrigo R,Libuy M, Feliu F,et al.Molecular basis of cardioprotective effect of antioxidant vitamins in myocardial infarction[J].BiomedResInt,2013,2013: 437613.
[7] Ishibashi Y, Matsui T,Takeuchi M, Yamagishi S. Glucagon-like peptide-1 (GLP-1)inhibits advanced glycation end product (AGE)-induced up-regulation of VCAM-1 mRNA levels in endotheial cells by suppressing AGE receptor (RAGE) expression[J].BiochemBiophysicalResCommunications, 2010, 391(3):1405-8.
[8] Ishibashi Y, Matsui T,Takeuchi M, Yamagishi S.Sitagliptin augments protective effects of GLP-1 against advanced glycation end product receptor axis in endothelial cells[J].HormMetabRes,2011,43(10):731-4.
[9] Zhao X, Liu G, Shen H, Gao B,et al. Liraglutide inhibits autophagy and apoptosis induced by high glucose through GLP-1R in renal tubular epithelial cells[J].IntJMolMed, 2015,35(3):684-92.
[10] Lonborg J, Vejlstrup N, Kelbaek H, et al. Impact of acute hyperglycemia onmyocardial infarct size, area at risk, and salvage in patients with STEMI and the association with exenatide treatment:results from a randomized study[J].Diabetes, 2014,63(7) 2474-85.
[11] 胡 波,李德才. 糖基化终产物对心肌细胞 GLP-1 受体表达及凋亡影响的研究[J]. 四川医学,2013,34(6):746-8.
[11] Hu B, Li D C. Effects of advanced glycation end-products on the expression of GLP-1 receptor and apopotis in cultured cardiomyo-cytes[J].SichuanMedJ,,2013,34(6):746-8.
[12] 曾 平,许顶立,李 针,等. 晚期糖基化终产物对心肌细胞细胞周期和凋亡的影响[J]. 第一军医大学学报,2003,23(1):9-11.
[12] Zeng P, Xu D L, Li Z,et al. Eeffect of advanced glycation end-products on cell cycle distribution and apoptosis in neonatal rat cardiac myocytes[J].JFirstMilMedUniv, 2003,23(1):9-11.
[13] Hegab Z,Gibbons S,Neyses L,et al.Role of advanced glycation end products in cardiovascular disease[J].WorldJCardiol,2012,26(4):90-102.
[14] Diguet N,Mallat Y,Ladouce R,et al. Muscle creatine kinase deficien-cy triggers both actin depolymerization and desmindisorganization by advanced glycation end products in dilated cardiomyopathy[J].JBiologicalChem,2011,286(40):35007-19.
[16] Zhu T,Wu X L,Zhang W,Xiao M. Glucagon like peptide-1 (GLP-1) modulates OVA-induced airway inflammation and mucus secretion involving a protein kinase A (PKA)-dependent nuclear factor-κB (NF-κB) signaling pathway in mice[J].IntJMolSci, 2015,16(9):20195-211.
[17] Ueda Y, Hirai S I, Osada S I, et al. Protein kinase C delta activates the MEK-ERK pathway in a manner independent of Ras and dependent on Raf[J].JBiolChem, 1996, 271(38):23512-9.
[18] Zhang Q, Huang W D, Lü X Y, et al. Puerarin protects differentiated PC12 cells from H2O 2 -induced apoptosis through the PI3K/Akt signalling pathway[J].CellBiolInt, 2012, 36: 419-26.
[19] 牛子冉,徐晓娜,陈俞材,等. 丹酚酸 A 对异丙肾上腺素致小鼠心肌缺血的保护作用及其机制[J].中国药理学通报,2015,31(12):1667-74.
[19] Niu Z R ,Xu X N,Chen Y C, et al.Protective effect of Salvianolic acid A against isoproterenol-induced myocardial infarction in mice[J].ChinPharmacolBull, 2015,31(12):1667-74.
[20] Adams J M,Cory S.The Bcl-2 protein family: arbiters of cell survival[J]Sci,1998,281( 5381) : 1322-6.
[21] 谢荣辉, 殷明,殷嫦嫦,等. N-乙酰半胱氨酸对过氧化氢诱导的骨髓间充质干细胞凋亡的保护及作用机制研究[J]. 中国药理学通报, 2014,30(1):54-9.
[21] Xie R H, Yin M,Yin C C et al,Effect of N-Acetyl-L-cysteine on protection research in H2O2-Induced mesenchymal stem cells apoptosis[J].ChinPharmacolBull,2014,30(1):54-9.
[22] Cheng E H,Wei M C,Weiler S,et al. BCL-2,BCL-X(L)sequester BH3 domain-only molecules preventing BAX-and BAK-mediated mitochondrial apoptosis[J].MolCell,2001,8(3):705-711.
Protective effect of GLP-1 against AGEs-induced H9C2 myocardial cell apoptosis
ZHANG Jun1,2,GU Xiang1,HUANG Wen-yin1, ZHANG Pu-hua1,YING Chang-chang3, YU Huan3ZHANG Yi-ping3, WANG Li-li3, LI Wei-dong3
(1.DeptofCardiology,JiujiangUniversityHospital,JiujangJiangxi332000,China,2.DeptofMedicine,GraduateSchool,NanchangUniversity,Nanchang330006China, 3.BasicMedicalCollege,JiujiangUniversity,JiujiangJiangxi332000,China)
Aim To investigate the protective effect of Glucogon like pep tide-1(GLP-1 ) on H9C2 cardiomyocytes against AGEs-induced apoptosis and the potential molecular mechanisms. Methods H9C2 cardiomyocytes cells culturedinvitrowere divided into the following groups: normal control group,100 mg·L-1AGEs group,100 mg·L-1AGEs+10 nmol·L-1GLP-1 group,100 mg·L-1AGEs+5 mmol·L-1N-acetylcysteine (NAC) group. Cell viabillity rate was measured by CCK-8 assay,ROS production was measured by DCFH-DA fluorescent probe;Cells in different groups were stained with Annexin V-FITC/PI and then apoptotic rate was detected by flow cytometry;Nucleus morphology was observed under fluorescence microscope after being incubated with Honchest 33258;Bax, Bcl-2 mRNA gene expression was measured using RT-PCR;Western blot was applied to assess the apoptotic components expression including Bax and Bcl-2. Result Compared with control group,cell viability rate in AGEs group was decreased in a dose-dependent manner;cell apoptosis and ROS production in H9C2 cells were remarkably increased in AGEs group. However,compared with AGEs group,GLP-1 reduced ROS production and ameliorated cell apoptosis caused by AGEs;the expression of pro-apototic proteins Bax was decreased,the expression of anti-apoptotic proteins like Bcl-2 was increased. Conclusion GLP-1 protects H9C2 cardiomyocytes against AGEs-induced apoptosis,which may be related to the reduction of the active oxygen (ROS).
GLP-1; AGEs; ROS; H9C2 cardiomyocytes; apoptosis; myocardial preservation; mechanism
时间:2016-12-27 16:13
http://www.cnki.net/kcms/detail/34.1086.R.20161227.1613.042.html
2016-07-05,
2016-10-14
国家自然科学青年基金资助项目(No 81000075);江西省教育厅科技课题资助项目(No GJJ09350)
张 军(1989-),男,硕士生,医师,研究方向:糖尿病心肌病发病机制,E-mail:15079265586@163.com; 谷 翔(1967-),男,博士,主任医师,教授,硕士生导师,研究方向:糖尿病心肌病、心肌缺血/再灌注的发病机制,通讯作者,E-mail:eagle0094@163.com
10.3969/j.issn.1001-1978.2017.01.021
A
1001-1978(2017)01-0120-07
R-332;R322.11;R329.25;R587.2;R977.6