蛇毒组学与抗毒素组学:蛋白质组学技术在抗蛇毒血清效价评估中的应用
张皓冰,陈慧慧,文 琳,孙 妍,赵红燕,高建芳
(杭州师范大学生命与环境科学学院,浙江 杭州 311121)
蛇毒是由肽类与蛋白质构成的混合物,是有毒蛇类重要的捕食与防御敌害的生化武器[1-2].蛇毒的组成与含量存在较大的种内、种间差异,如眼镜蛇科物种的蛇毒主要含有三指结构毒素(3FTx)与磷脂酶A2(PLA2)等组分,蝰科物种的蛇毒主要含有金属蛋白酶(SVMP)、磷脂酶A2与丝氨酸蛋白酶(SVSP)等组分;同种不同年龄、性别、季节和地理等来源的蛇毒在组分的相对含量上也会存在不同程度的差异[2].得益于蛋白质组学技术的飞速发展,系统阐释蛇毒蛋白组构成特征的全貌,推进蛇毒的进化机制与功能解释深度、蛇伤的精准化诊疗以及天然活性药物的挖掘,成为当前蛇毒组学研究工作兴起的重要内容.蛇毒组学研究策略的构建以及大规模研究结果的报道为抗蛇毒血清制备策略的优化完善以及效价评估新方法的构建提供了基础.
1 蛇毒组学研究的兴起与研究策略的发展
自1994年澳大利亚学者Wilkins和Williams提出“蛋白质组学”概念[3]以来,人们开始不断尝试各种方法分离并鉴定复杂混合蛋白样品中的组分,进而表征整个蛋白样品的组成、相对含量以及结构特点等信息.随着蛋白组学技术的成熟,尤其是质谱鉴定方法,高通量表征复杂蛋白样品的研究变得日益广泛,全球范围有关蛇毒组成的研究也同样获得了一次新的发展.2004年,Calvete实验室开创性地提出了“蛇毒组学(snake venomics)”[4]研究思路与策略,并于2007年启动大范围蛇毒组学研究计划项目[5].至今,在全球科学家的共同努力下,已完成200多种蛇毒全蛋白组构成特征的解析.
蛇毒组学研究策略一般涉及蛇毒的分离与高通量鉴定方法的优化组合,当前主要遵循的是自下而上(bottom-up)的方法组合(图1).其中,分离方法主要涉及基于凝胶(gel-based)的电泳技术和无凝胶(gel-free)的层析技术两大类.一般来说,以分子量大小为分离基础的十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE,也即一维电泳)和以等电点结合分子量大小为分离基础的二维电泳(2-DE,也称双向电泳)是两种主要分离蛇毒蛋白的电泳方法.前者无论操作还是设备,均较为简单,作为主要或辅助手段在蛇毒蛋白分离中至今被广泛使用;后者在蛇毒蛋分离中的应用始于1998年,由Rioux首次从二维尺度上比较了蓝灰扁尾海蛇(Laticaudacolubrina)和陆栖圆斑蝰(Viperarusselli)蛇毒蛋白构成特征的差异[6].由于设备条件的限制,二维电泳在蛇毒蛋白分离研究中的应用远没有一维电泳来得广泛,且在过去的10年中正逐渐被研究者遗忘.此外,凝胶电泳不易表征等电点与分子量极端的蛇毒蛋白,且对低丰度组分的分辨能力也存在较大的局限性.层析技术被认为在一定程度上可弥补凝胶电泳的不足,且可实现不同规模的蛇毒组分分离要求.其中,凝胶排阻(GF)、离子交换(IEX)和亲和吸附(AF)为主的低压液相层析(FPLC)以及疏水分离为基础的反相高效液相层析(RP-HPLC)技术伴随着设备的迭代,自动化水平获得了极大提升,在蛇毒活性成分的分离纯化研究中已成为常规手段.不过,单纯依靠层析技术,在蛇毒分离中同样会存在不足.2004年,Li等以4种不同的组合方法(GF+2-DE、GF+酶解+RP-HPLC、酶解+RP-HPLC和SDS-PAGE+酶解+RP-HPLC)分离并鉴定短尾蝮蛇毒和舟山眼镜蛇毒发现,不同方法所解析的蛇毒蛋白组构成特征存在较大差异,方法间的相互组合可能有助于提高蛇毒蛋白的分离效果[7].事实上,在过去10余年中兴起的蛇毒组学研究工作正是大范围采用了RP-HPLC与SDS-PAGE技术组合以实现质谱前蛇毒蛋白的分离(图1B-C)[5,8],并辐射至其他生物毒素组学的研究工作[9-10].
一般认为,末端(N端)测序技术较早被用于蛇毒蛋白的鉴定,Rioux等正是采用Edman降解法与氨基酸分析明确了两种蛇毒的蛋白组构成差异[6].末端测序虽然精准,但测序的长度有限,且可能受N端封闭等因素的影响,目前在高通量解析蛇毒蛋白组特征中的应用较少.20个世纪80年代,以电离喷雾(ESI)和基质辅助激光解析(MALDI)为基础的质谱技术开始出现在生物大分子的检测研究中,相关技术的发展成熟为大规模解析蛇毒蛋白组构成特征提供了重要支撑.一般,高通量分离的蛇毒蛋白被酶解后形成的肽段由质谱扫描获取其一级和二级离子峰图,经解析和数据库比对后确定蛋白类型.早期蛇毒蛋白组鉴定时常以一级质谱(也称为肽质量指纹图谱)为主,并搭配末端测序补充测定前者无法鉴定的组分[4,11].随着各种形式的二级质谱(如傅里叶、四极杆、离子阱和静电轨道阱等)鉴定技术的发展,开始逐渐出现一级质谱搭配二级质谱鉴定蛇毒蛋白组[5,7,12-13],或者末端测序与二级质谱组合鉴定蛇毒蛋白组,而一级质谱仅用于测定各蛇毒组分的分子量[14-17].此外,共享数据库(如NCBI、UniProt)中蛇毒蛋白与相关编码基因(尤其是转录组和基因组)序列数据的大量释放,以及检索软件关于肽段de novo解析功能的强化,使得众多有关蛇毒组学的研究热衷于用二级质谱进行组分鉴定(图1D-E)[18-23].
蛇毒组学研究策略的最后环节是确定各组分的含量,所有鉴定组分一般依据其所在液相峰、电泳条带的相对含量以及特征性肽段的质谱峰强度等参数进行相对定量,这成为多数研究评估各毒素家族占全毒比重的主要方法(图1F),简洁直观的数据结果在进行不同蛇毒比较时也十分方便.此外,同位素标记的相对定量检测也同样被应用于蛇毒组学的比较研究,但相关工作迄今只有两例[24-25].尽管确定各组分的绝对含量对蛇毒组学研究更有意义,迄今只有Calderón-Celis等在2017年发表了一例相关工作,主要以同位素32S/34S信号强度比为标准参照,利用三重四极杆和电喷雾四极杆质谱对多种蛇毒中不同组分进行了绝对含量的测定[26].无论相对定量还是绝对定量,蛇毒组学研究大规模解析的各种蛇毒全蛋白组构成信息,为理解蛇毒功能、蛇伤临床症状以及抗蛇毒血清的制备完善以及临床应用提供了丰富的数据参考,同时也为毒素组学的发展奠定了基础.
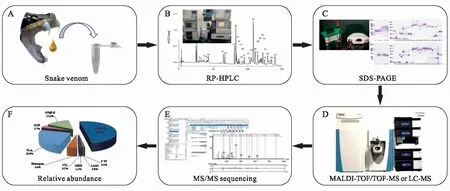
图1 蛇毒组学常规研究策略示意图Fig.1 Schematic representation of a routine strategy in snake venomic analysis
2 传统评估抗蛇毒血清效价的方法
毒蛇咬伤如救治不及时,容易引发较高的死亡率和致残率.动物源性抗蛇毒血清自发明以来,已被实践证实为临床治疗毒蛇咬伤的最佳药物.20世纪抗蛇毒血清的制备技术经过一系列改良完善后,形成一套可提炼临床用高效价的完整免疫球蛋白IgG或免疫球蛋白片段F(ab’)2/Fab的抗蛇毒药物精制品的工艺[27].然而,接受免疫的动物可能因生理状态以及个体差异等原因,对注入的外源性蛇毒会出现不同强度的免疫应答,进而导致同批蛇毒免疫制备的抗蛇毒血清呈现不同强度的效价.此外,蛇毒组分与含量还存在显著的种内种间差异,使得现行临床用抗蛇毒血清往往只对特定蛇种或特定区域的蛇种具有较好的治疗效果.因此,无论是免疫不同阶段抗蛇毒血清效价的动态监测还是最终精制品效价的评估,都应借助可靠的检测方式予以严格把关.
传统评估抗蛇毒血清效价是以体外与体内检测相结合的方式进行的.体外检测方式通常包括双向免疫扩散、蛋白印迹(western blot)和酶联免疫吸附测定(ELISA)等,可供动态监测动物在接受免疫不同阶段对蛇毒的免疫应答强度,也可用于评估精制抗蛇毒血清的效价.体内检测则以待测抗蛇毒血清中和蛇毒致死毒性(半数致死剂量LD50)的能力(半数有效剂量ED50)为主,中和肌肉毒性、出血毒性、促凝活性及疽死活性等为辅[28],因此需涉及实验动物(如小鼠)的使用,是精制抗蛇毒血清商业使用前的必检环节.事实上,传统体外评估抗蛇毒血清效价的方法往往只能提供一个笼统的定性(双向免疫扩散、蛋白印迹)或定量(ELISA)结果,无法同步实现精准的定性定量效果.此外,随着人们对实验动物3Rs使用原则[28]的日益重视,优化使用、少用实验动物或以其他方法替换实验动物的使用成为新的准则,这同样向传统体内评估抗蛇毒血清效价的方法提出了挑战.当然,毒蛇咬伤未必致死,但会导致患者组织损伤和一些永久性的后遗症,某些特定的症状也往往只与某一类或几类蛇毒组分相关.因此,寻求新的方法以供精准测定抗蛇毒血清对蛇毒不同组分的中和能力成为完善抗蛇毒血清效价临床前综合评估方法的迫切工作,这一要务更是被纳入了《世界卫生组织抗蛇毒血清生产与质控指南》[29].
3 抗毒素组学策略评估抗蛇毒血清效价
在过去的10多年中,基于质谱技术的蛇毒组学研究使人们对蛇毒成分的了解快速增长,与此关联的“抗毒素组学(antivenomics)[30]”应运而生,是抗蛇毒血清效价临床前评估方法的重要革新.抗毒素组学被认为是一种翻译性的蛇毒组学,是以大规模解析蛇毒蛋白组构成特征为前提结合免疫沉淀/亲和吸附技术发展起来的一项研究策略,旨在完善传统抗蛇毒血清效价的体内临床前评估策略的不足.其原理是将蛇毒与抗蛇毒血清按一定的含量比予以孵育,通过检测抗蛇毒血清中和/吸附蛇毒不同组分及含量来衡量抗蛇毒血清对蛇毒的免疫中和能力.尽管一些研究基于毒素组学的结果,直接应用ELISA或western blot等技术评估抗蛇毒血清对蛇毒不同液相分离峰的中和效果[31-35],但各类毒素组分可能因分子量等理化特性的差异影响其被固相材料(如96孔酶标板)吸附效果的均一性或转膜速度的一致性,不利于评估的精准性.目前,抗毒素组学策略已更新迭代至第三代,能够实现可视化评估抗蛇毒血清对蛇毒的定性定量识别吸附能力,可较为准确地计量抗蛇毒血清对蛇毒中各种毒素蛋白的最大结合能力.
基于抗原抗体免疫沉淀原理,第一代抗毒素组学是将蛇毒与抗蛇毒血清按一定的配比(眼镜蛇科蛇毒1∶8,蝰科蛇毒1∶20)进行孵育,随后用RP-HPLC表征上清液中尚未被抗体识别的蛇毒组分(包括部分被免疫沉淀和无法被免疫沉淀的组分)[30,35].液相分离峰与事先经液相分离-凝胶电泳-质谱表征的蛇毒组学结果进行比对,具有相同保留时间的分离峰被认为是相同组分,以峰面积量化各组分的相对含量,最终基于上清液中所留存的蛇毒组分的类型与含量来评估抗蛇毒血清对蛇毒的免疫识别能力[30].第一代抗毒素组学策略(图2)自2008年首次提出后一直被沿用至2012年,至少在10种商用或实验室制备的抗蛇毒血清的效价评估中成功获得了实践[30,35-36].然而,该方法涉及的抗蛇毒血清需一次性消耗使用,不利于结果的重复检验,且易造成抗蛇毒血清的浪费.
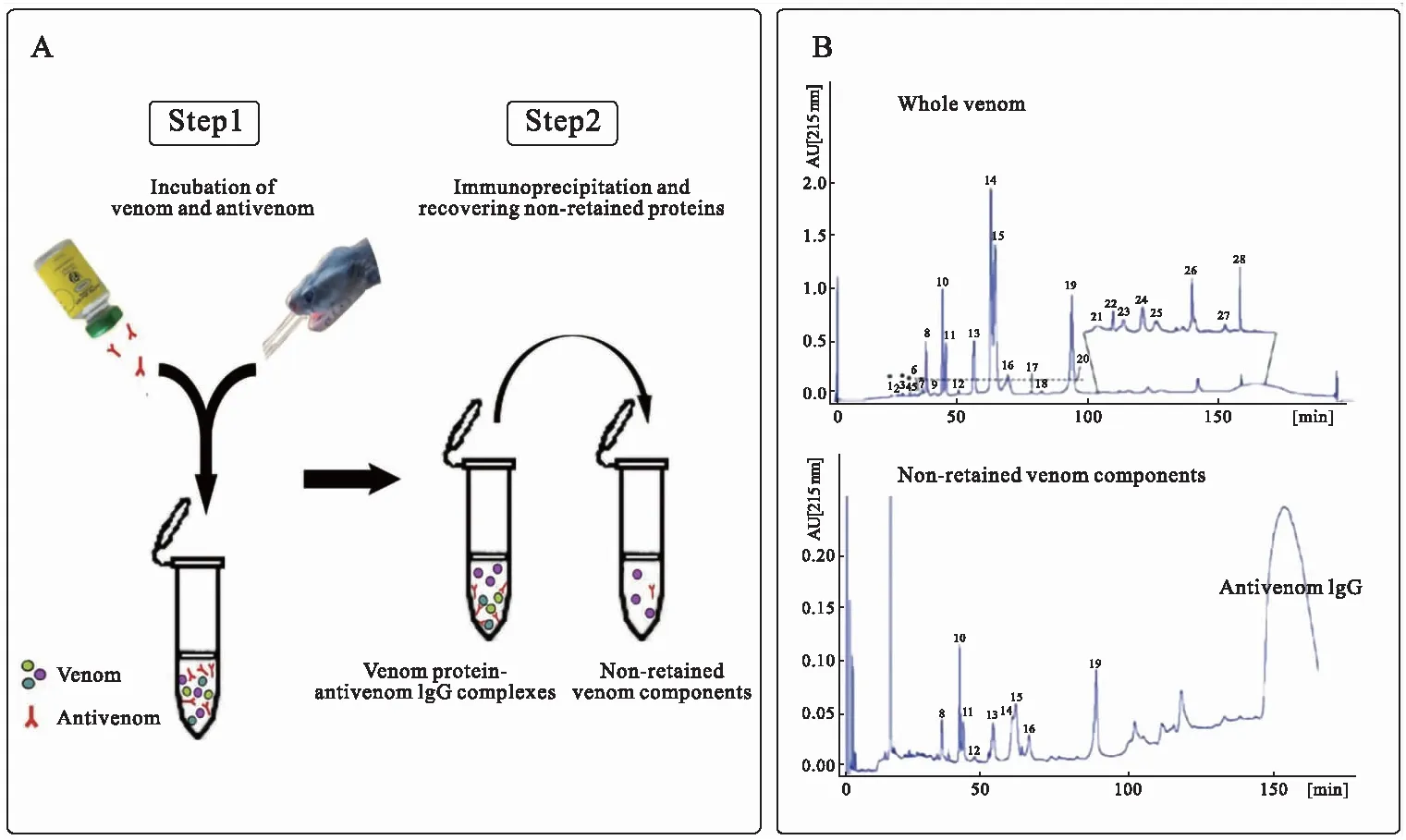
图2 第一代抗毒素组学策略流程图(改编自Petras等[35])Fig.2 Schematic representation of the first generation antivenomics (adapted from Petras et al.[35])
第二代抗毒素组学以抗蛇毒血清亲和吸附蛇毒组分为设计理念,将抗蛇毒血清分子固定在固相基质(如CNBr活化的琼脂糖4B或NHS活化的琼脂糖4FF)上,制成抗蛇毒血清亲和吸附柱(图3A).随后将蛇毒与亲和柱孵育(蛇毒与抗蛇毒血清孵育比例同第一代抗毒素组学),分别收集未被吸附和被吸附的蛇毒组分流穿液(图3A),两种组分的液相分离峰与全蛇毒进行定性定量比较后确定抗蛇毒血清对蛇毒的免疫识别能力(图3B).相比于第一代抗毒素组学,第二代抗毒素组学色谱痕迹更平滑,可获得更好的分辨率和更准确的定量结果,且挂载有抗蛇毒血清分子的亲和吸附柱经再生处理后可重复使用,极大地提高了抗毒素组学的易推广性、经济性和结果的可重复性,有效改良了第一代抗毒素组学的不足[28,37].第二代抗毒素组学策略的应用实例要比第一代抗毒素组学策略来得多[28],由于蛇毒与抗蛇毒血清仍沿用经验性孵育比,不同的蛇毒组分与抗蛇毒血清分子的结合效率可能因孵育比的不同而存在差异,因此无法深入探讨抗蛇毒血清对不同含量的蛇毒的中和识别能力.

图3 第二代抗毒素组学策略流程图(改编自Gao等[38])Fig.3 Schematic representation of the second generation antivenomics (adapted from Gao et al.[38])
2017年,Calvete实验室再次提出一项方案以优化第二代抗毒素组学策略,并将其定义为第三代抗毒素组学[39].迭代后的策略仍遵循免疫亲和吸附原理(图3A),相较于第二代抗毒素组学策略,在亲和吸附柱挂载抗蛇毒血清含量一定的前提下改变蛇毒孵育量,形成多个蛇毒与抗蛇毒血清孵育的梯度(图4A).通过比较全蛇毒、吸附组分以及未吸附组分的液相表征结果,并结合已有的蛇毒组数据来确定抗蛇毒血清对蛇毒不同组分的最大吸附能力以及动态吸附效果,最终构建可视化的量效关系(图4B).由于第三代抗毒素组学策略增加了孵育梯度的数量,明显改善了蛇毒与抗蛇毒血清中和反应量效关系的分辨率.迭代后的策略虽然优势明显,但工作量却增加不少,目前其应用仅涉及4种抗蛇毒血清对5种蛇毒中和效价的评估[39-42].
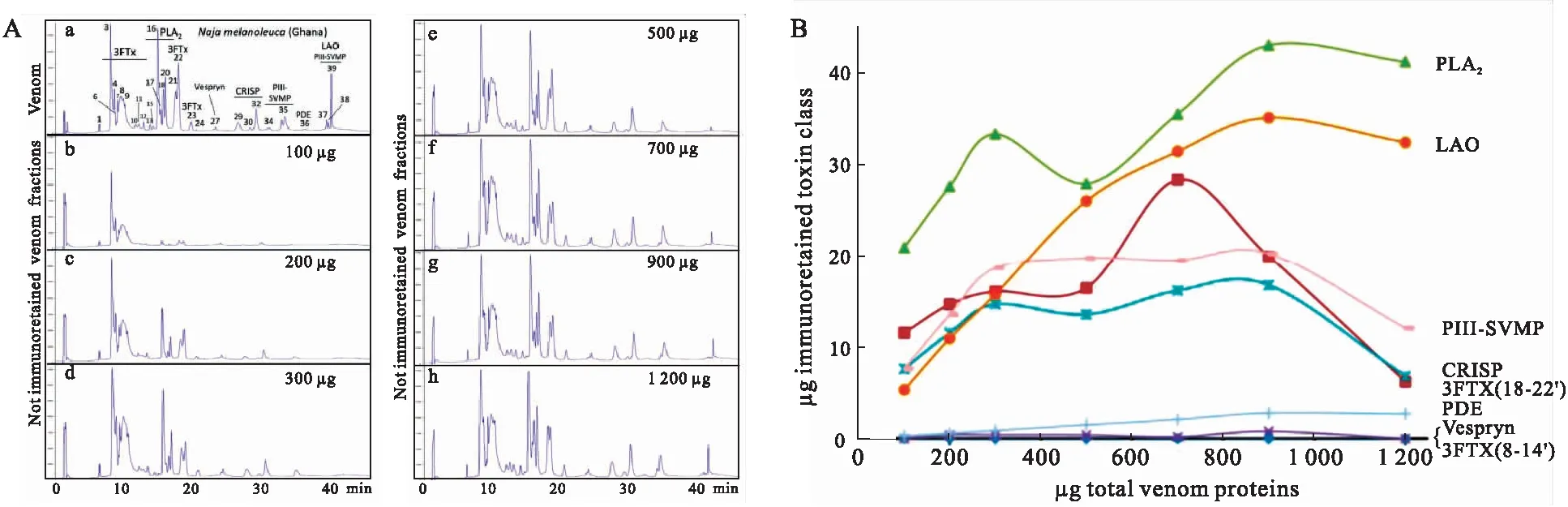
图4 第三代抗毒素组学策略流程图[39]Fig.4 Schematic representation of the third generation antivenomics[39]
4 展望
尽管相较于当前主流的自下而上的蛇毒组学研究策略,自上而下(top-down)的策略无论在体现肽段与目标蛋白的覆盖度还是解析相似度极高的蛋白质变体(proteoform)时,均具有明显的优势,能极大提高蛇毒组分鉴定的精准性和可靠性,但受限于技术设备、数据库等条件,在蛇毒组学研究中的应用实例较少[43-46].此外,抗体分子在固相基质上的吸附能力决定着毒素组学研究结果可靠性,蛇毒组分的复杂度和变异度也同样会增加抗蛇毒血清效价评估时的难度.但不可否认的是,蛇毒组学研究结果为系统阐释蛇毒功能与蛇伤症状的复杂性、优化完善抗蛇毒血清制备方案提供了丰富的依据,抗毒素组学将抗蛇毒血清对蛇毒组分的免疫识别的评估与蛇毒组学数据关联,为抗蛇毒血清的同源或准特异性功效推断提供了依据.此外,相较于传统的体内、体外实验评估抗蛇毒血清效价的方法,抗毒素组学策略具备更精准有效的结果,有望推动减少乃至彻底替代实验动物在抗蛇毒血清效价评估中的使用.随着技术与分析方法的发展,蛇毒组学与抗毒素组学面临的问题也将逐渐解决,它也将凭借着其优势在相关领域发挥重要作用.

