曙红催化的缩醛化反应研究
刘亮亮, 冯乙巳,2*, 徐卓玮, 许华建
(1. 合肥工业大学 a.化学与化工学院; b. 医学工程学院, 安徽 合肥 230009;2. 安徽省杂环实验室,安徽 合肥 230009)
·快递论文·
曙红催化的缩醛化反应研究
刘亮亮1a, 冯乙巳1a,2*, 徐卓玮1a, 许华建1b
(1. 合肥工业大学 a.化学与化工学院; b. 医学工程学院, 安徽 合肥 230009;2. 安徽省杂环实验室,安徽 合肥 230009)
以醇溶性曙红为催化剂,在温和条件下高效催化缩醛化反应,该催化体系适应于不同种类的脂肪醛或芳香醛与短链一元醇或二元醇的羰醇缩合反应,于室温反应24 h,缩醛化产物收率58%~99%,其结构经1H NMR,13C NMR和HR-MS确证。
醛; 缩醛化; 醛基保护; 醇溶性曙红; 催化; 合成
醛基是一类十分活泼的化学基团,极易发生氧化、加成、聚合及缩合等反应[1-2]。在多步合成中,为防止活泼醛基对反应的干扰,缩醛化处理是醛基保护的最常用策略[3-4]。此外,缩醛化合物又是重要的有机中间体[5]和极具经济价值的化工产品,广泛应用于医药、食品、化妆品、香料和表面活性剂等领域[6]。缩醛化反应通常在质子酸[7]催化下进行,如硫酸、盐酸、三氟乙酸和三氟化硼等。质子酸来源广泛,价格低廉,但存在催化剂用量大、催化效率低、后续处理过程复杂、腐蚀设备和污染环境等弊端。由于缩醛化反应是可逆反应,在理论研究和工业化生产实践中,缩醛化反应在多数情况下反应收率较低,反应时间长,工艺过程相对复杂。有报道指出使用固体酸[8]、金属盐[9]和离子溶液[10]等方法,也都能获得良好的催化效果。
近些年来,Connon等[11-12]使用含氮杂环有机盐作为催化剂,实现了温和条件下的缩醛化反应,收率41%~99%。研究发现一些有机小分子也能在缩醛化反应中表现出良好的催化效能。如Rangel等[13]报道四氯苯醌在醇溶液和光照条件下能有效催化缩醛化反应。推测其反应机理认为光激发产生的四氯对苯二酚起着质子化作用,缩醛收率为47%~98%。然而该类催化剂制备复杂、价格昂贵且毒性大。
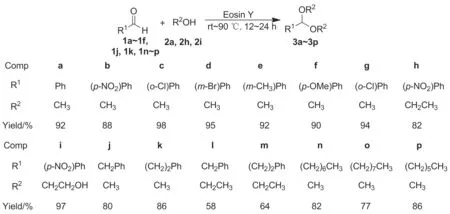
Scheme 1
醇溶性曙红具有类似四氯对苯二酚的结构,醌酚互变的分子结构(Chart 1)具有质子化作用,并表现出较强的酸性。缩醛化反应的实质是质子化过程。本文对曙红催化的缩醛化反应进行研究,发现该催化体系在不同种类的脂肪醛或芳香醛与短链一元醇或二元醇的羰醇缩合反应中具有良好的催化活性,于室温反应24 h,缩醛化产物收率58%~99%(Scheme 1),其结构经1H NMR,13C NMR和HR-MS确证。
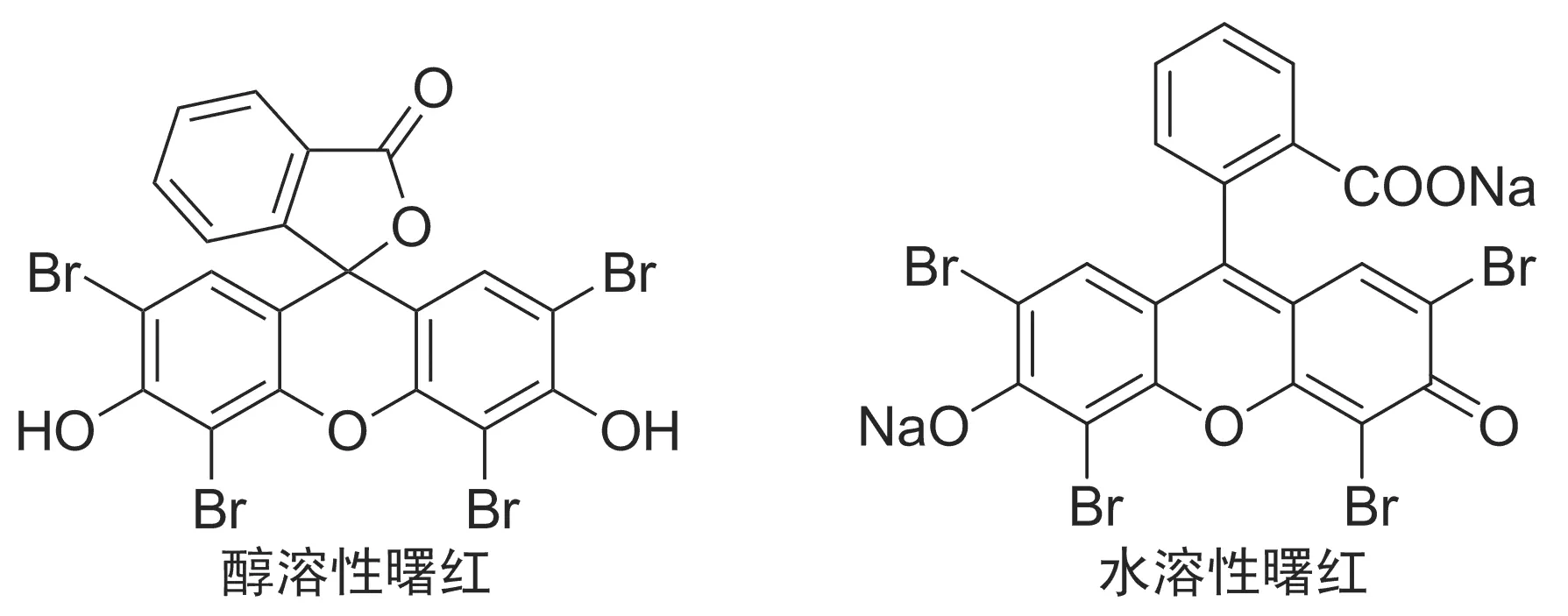
Chart 1
1 实验部分
1.1 仪器与试剂
安捷伦VNMRS600型超导核磁共振仪(CDCl3为溶剂,TMS为内标);Waters LCT Premier XE型高分辨质谱仪;Trace 1300型气相色谱仪。
HSGF254高效薄层层析硅胶板,烟台汇友开发有限公司;HSGF254型薄层板硅胶(300~400 目),青岛海洋化工分厂;其余所用试剂均为分析纯或化学纯。
1.2 缩醛化反应合成3a~3p(以3a为例)
在Schlenk反应管中依次加入苯甲醛(1a)53 mg(0.5 mmol), 1 mol%醇溶性曙红3.2 mg和甲醇(2a)2 mL,搅拌下于室温反应24 h(GC监测)。用饱和NaHSO3溶液(5 mL)洗涤除去残留苯甲醛,依次用饱和NaHCO3溶液(5 mL)和蒸馏水洗涤,无水Na2SO4干燥,旋蒸脱溶后经硅胶柱层析[洗脱剂:V(石油醚)∶V(乙酸乙酯)=20 ∶1]纯化得淡黄色液体苯甲醛二甲缩醛(3a)70 mg,收率92%。
用类似方法合成3b~3p,其中含强吸电子基的对硝基苯甲醛(1b)在微热条件反应,其余醛类于室温反应。
3a: 淡黄色液体,收率92%;1H NMRδ: 7.46~7.44(s, 2H, ArH), 7.36(d,J=7.1 Hz, 2H, ArH), 7.32(t,J=7.2 Hz, 1H, ArH), 5.39(s, 1H, CH), 3.33(s, 6H, CH3);13C NMRδ: 137.99, 128.41, 128.16, 126.64, 103.11, 52.67; HR-MSm/z: Calcd for C9H12O2[M+] 152.084 6, found 152.084 2。
对甲氧基苯甲醛二甲缩醛(3b): 淡黄色液体,收率88%;1H NMRδ: 7.37(d,J=8.5 Hz, 2H, ArH), 6.89(d,J=8.6 Hz, 2H, ArH), 5.35(s, 1H, CH), 3.81(s, 3H, OCH3), 3.31(s, 6H, CH3);13C NMRδ: 159.66, 130.37, 127.89, 113.51, 103.05, 55.18, 52.59; HR-MSm/z: Calcd for C10H14O3[M+]182.091 4, found 182.091 2。
对硝基苯甲醛二甲缩醛(3c): 淡黄色液体,收率98%;1H NMRδ: 8.22~8.24(s, 2H, ArH), 7.64~7.65(s, 2H, ArH), 5.48 (s, 1H, CH), 3.34 (s, 6H, CH3);13C NMRδ: 148.02, 145.06, 127.81, 123.42, 101.57, 52.71; HR-MSm/z: Calcd for C9H11NO4[M+]197.072 0, found 197.072 2。
对氯苯甲醛二甲缩醛(3d): 淡黄色液体,收率95%;1H NMR(DMSO-d6)δ: 7.44(d,J=8.5 Hz, 2H, ArH), 7.39(d,J=8.4 Hz, 2H, ArH), 5.39(s, 1H, CH), 3.23(s, 6H, CH3);13C NMR(DMSO-d6)δ: 137.19, 132.95, 128.44, 128.18, 101.85, 52.57; HR-MSm/z: Calcd for C9H11O2Cl[M+] 186.046 4, found 186.046 0。
间溴苯甲醛二甲缩醛(3e): 淡黄色液体,收率92%;1H NMR(DMSO-d6)δ: 7.55~7.53 (m, 1H, ArH), 7.39 (d,J=7.8 Hz, 1H, ArH), 7.36 (t,J=7.6 Hz, 1H, ArH), 5.39 (s, 1H, CH), 3.25(s, 6H, CH3);13C NMR(DMSO-d6)δ: 138.05, 131.22, 130.42, 129.21, 125.57, 122.39, 101.63, 52.70; HR-MSm/z: Calcd for C9H11O2Br[M+] 229.996 8, found 229.996 6。
间甲基苯甲醛二甲缩醛(3f): 淡黄色液体,收率90%;1H NMR(DMSO-d6)δ: 7.26(t,J=7.5 Hz, 1H, ArH), 7.20(s, 1H, ArH), 7.18~7.13(m, 2H, ArH), 5.33(s, 1H, CH), 3.23(s, 6H, CH3), 2.32(s, 3H, CH3);13C NMR(DMSO-d6)δ: 138.09, 137.18, 127.94, 127.01, 126.85, 123.56, 102.69, 52.46, 20.67; HR-MSm/z: Calcd for C10H14O2[M+]166.102, found 166.103 4。
邻氯苯甲醛二甲缩醛(3g): 淡黄色液体,收率94%;1H NMR(DMSO-d6)δ: 7.68(d,J=8.5 Hz, 1H, ArH), 7.39(d,J=8.4 Hz, 1H, ArH), 7.28(s, 1H, ArH), 7.21(s, 1H, ArH), 5.36(s, 1H, CH), 3.37(s, 6H, CH3);13C NMR(DMSO-d6)δ: 137.21, 132.85, 129.24, 128.34, 128.28, 126.52, 101.75, 52.52; HR-MSm/z: Calcd for C9H11O2Cl [M+]186.043 4, found 186.043 2。
对硝基苯甲醛二乙缩醛(3h): 淡黄色液体,收率82%;1H NMRδ: 8.22(d,J=8.6 Hz, 2H, ArH), 7.66(d,J=8.3 Hz, 2H, ArH), 5.58(s, 1H, CH), 3.59(dt,J=16.4 Hz, 9.3 Hz, 4H, CH2), 1.25(t,J=7.0 Hz, 6H, CH3);13C NMRδ: 147.90, 146.10, 127.71, 123.39, 100.12, 61.27, 15.13; HR-MSm/z: Calcd for C11H15NO4[M+]225.108 6, found 225.108 8。
2-(4-硝基苯基)-1,3-二氧戊环(3i): 淡黄色液体,收率97%;1H NMRδ: 8.25(s, 2H, ArH), 7.66(s, 2H, ArH), 5.90(s, 1H, CH), 4.15~4.07(m, 4H, CH2);13C NMRδ: 148.35, 144.88, 127.40, 123.57, 102.21, 65.46: HR-MSm/z: Calcd for C9H9NO4[M+]195.053 6, found 195.053 2。
苯乙醛二甲基缩醛(3j): 无色液体,收率80%;1H NMRδ: 7.30(d,J=7.6 Hz, 2H, ArH), 7.24(s, 2H, ArH), 7.21(d,J=7.2 Hz, 1H, ArH), 4.54(t,J=5.6 Hz, 1H, CH), 3.34(s, 6H, CH3), 2.91(s, 2H, CH2);13C NMRδ: 137.03, 129.40, 128.29, 126.34, 105.34, 53.31, 39.67; HR-MSm/z: Calcd for C10H14O2[M+]166.102 8, found 166.102 4。
苯丙醛二甲基缩醛(3k): 无色液体,收率86%;1H NMRδ: 7.28(t,J=7.5 Hz, 2H, ArH), 7.21~7.17(m, 3H, ArH), 4.37(t,J=5.7 Hz, 1H, CH), 3.33(s, 6H, CH3), 2.70~2.65(m, 2H, CH2), 1.93(dt,J=13.7 Hz, 5.9 Hz, 2H, CH2);13C NMRδ: 141.61, 128.37, 125.85, 103.76, 52.71, 34.08, 30.85; HR-MSm/z: Calcd for C11H16O2[M+]180.125 3, found 180.125 1。
苯乙醛二乙基缩醛(3l): 无色液体,收率58%;1H NMRδ: 7.24~7.20(m, 2H, ArH), 7.19(s, 2H, ArH), 7.17(d,J=7.7 Hz, 1H, ArH), 4.57(t,J=5.6 Hz, 1H, CH), 3.64~3.59(m, 2H, CH2), 3.42~3.35(m, 2H, CH2), 2.86(d,J=5.6 Hz, 2H, CH2), 1.10(t,J=7.0 Hz, 6H, CH3);13C NMRδ: 137.35, 129.59, 128.14, 126.24, 103.85, 61.86, 40.89, 15.25; HR-MSm/z: Calcd for C12H18O2[M+]194.136 6, found 194.136 4。
苯丙醛二乙基缩醛(3m): 无色液体,收率64%;1H NMRδ: 7.30~7.27(m, 2H, ArH), 7.22(d,J=7.6 Hz, 2H, ArH), 7.20(d,J=7.3 Hz, 1H, ArH), 4.51(t,J=5.7 Hz, 1H, CH), 3.68(dq,J=14.2 Hz, 7.1 Hz, 2H, CH2), 3.52(dq,J=14.3 Hz, 7.1 Hz, 2H, CH2), 2.74~2.68(m, 2H, CH2), 2.00~1.94(m, 2H, CH2), 1.24(t,J=7.1 Hz, 6H, CH3);13C NMRδ: 141.78, 128.39, 128.34, 125.78, 102.19, 61.02, 35.09, 31.01, 15.37; HR-MSm/z: Calcd for C13H20O2[M+]208.151 5, found 208.151 3。
1,1-二甲氧基辛烷(3n): 无色液体,收率82%;1H NMRδ: 4.35(t,J=5.7 Hz, 1H, CH), 3.30(s, 6H, CH3), 1.58(dd,J=14.6 Hz, 6.1 Hz, 2H, CH2), 1.36~1.21(m, 12H, CH2), 0.87(t,J=6.9 Hz, 3H, CH3);13C NMRδ: 104.60, 52.57(s), 32.50, 31.77, 29.44, 29.21, 24.60, 22.63, 14.06; HR-MSm/z: Calcd for C10H22O2[M+]174.163 4, found 174.163 6。
1,1-二甲氧基壬烷(3o): 无色液体,收率77%;1H NMRδ: 4.35(t,J=5.7 Hz, 1H, CH), 3.40(d,J=105.5 Hz, 6H, CH3), 1.60(ddd,J=14.6 Hz, 11.0 Hz, 6.4 Hz, 2H, CH), 1.26(dd,J=20.1 Hz, 9.2 Hz, 10H, CH), 0.87(t,J=6.9 Hz, 3H, CH3);13C NMRδ: 104.59, 52.56, 32.50, 31.85, 29.50(2C), 29.21, 24.60, 22.65, 14.08; HR-MSm/z: Calcd for C11H24O2[M+]188.183 5, found 188.183 3。
1,1-二甲氧基庚烷(3p): 无色液体,收率86%;1H NMRδ: 4.36(t,J=5.8 Hz, 1H, CH), 3.32(s, 6H, CH3), 1.62~1.56(m, 2H, CH2), 1.30(dd,J=12.2 Hz, 5.6 Hz, 6H, CH2), 1.28(s, 2H, CH2), 0.88(t,J=6.8 Hz, 3H, CH3);13C NMRδ: 104.50, 52.54, 32.45, 31.76, 29.14, 24.56, 22.57, 14.07; HR-MSm/z: Calcd for C9H20O2[M+]160.152 7, found 160.152 5。
2 结果与讨论
2.1 反应条件优化
以1a与2a的缩醛化反应为模型反应,研究催化剂及其用量和反应时间等因素对缩醛化反应的影响,对反应条件进行优化,结果见表1。
研究了水溶性曙红与醇溶性对1a与2a的缩醛化反应,选用类似于四溴苯醌和四溴对苯二酚结构的曙红催化剂。从表1实验结果可推测:具有类似四溴苯酚结构的醇溶性曙红,有明显的催化效果(No.3);醌结构的水溶性曙红没有表现出催化作用(No.2)。这与Rangel等[10]的实验结果相一致,他们选用四氯苯醌作为催化剂,在光照条件下四氯苯醌转化四氯对苯二酚,四氯苯醌没有催化活性,起催化作用的是四氯对苯二酚。醇溶性曙红本身具有类似四氯对苯二酚的结构,在无光条件下即可实现缩醛化的高效催化。本文进一步探究了催化剂用量和反应时间的影响,可以看出1 mol%(No.4)是最佳的催化剂量,减少催化剂量时,收率下降(No.5~6),增加催化剂量时,收率无显著提高(No.3);选择8~36 h进行模型反应时,分析实验结果发现:24 h是最优的反应时间(No.4),缩短反应时间收率下降(No.7~8),延长反应时间收率无进一步提升。通过对模型反应的各类影响因素的优化和筛选,确定苯甲醛与甲醇缩醛化反应的最佳条件为:1 mol%醇溶性曙红为催化剂,在无水甲醇(2 mL)中于室温反应24 h,收率94%。
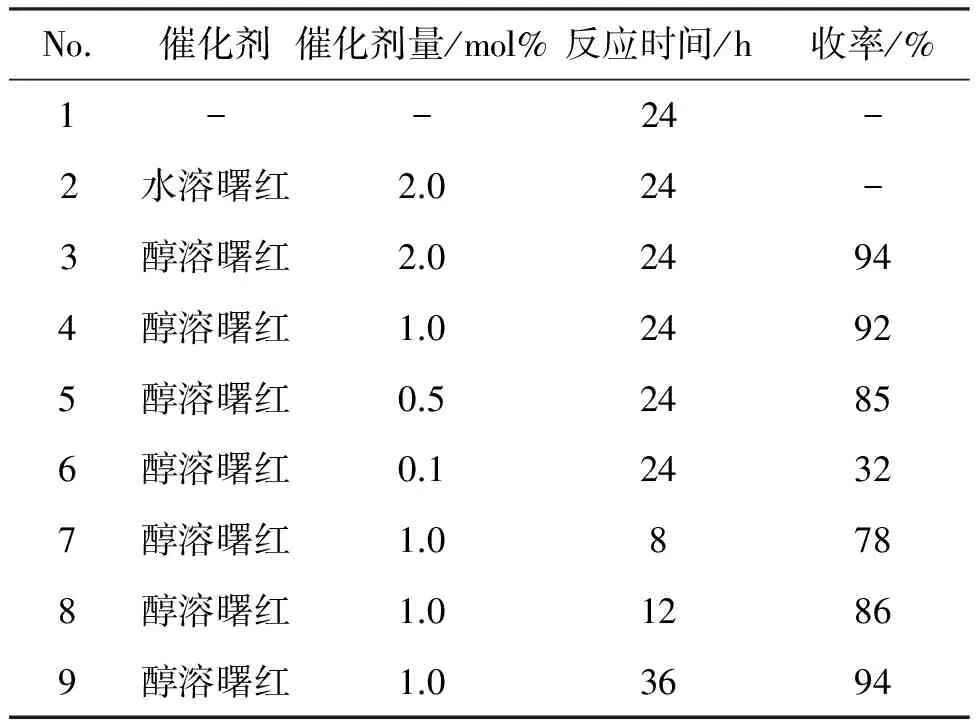
表1 模型反应条件优化*
*反应条件: 1a 0.5 mmol, 2a 2 mL,于室温反应。
2.2 底物适应性
由Scheme 1反应结果可知,醇溶性曙红作为催化剂具有良好的底物适应性。首先模型反应可以获得92%的收率(3a)。对于取代苯甲醛,无论是具有吸电子基Cl, Br和NO2,或是具有供电子基CH3和OCH3,缩醛化反应都获得较高的反应收率(3b~3g),并呈现出一定的反应规律。苯甲醛对位为吸电子基时,收率相对模型反应升高,几乎获得定量反应的收率(3c~3d);苯甲醛对位为供电子基时,收率相对模型反应下降(3b)。对于间位取代的苯甲醛,无论是供电子基还是吸电子基,其收率相比模型反应差别不大(3e~3f),主要是由于间位的空间位阻作用和电子效应影响不明显。当吸电子基位于醛基邻位时,缩醛化收率相比模型反应稍微增加(3g),主要是电子效应与空间效应共同作用的结果。对于不同的脂肪醛,醇溶性曙红也表现出良好的催化效能,但由于烷基是供电子基团,其反应收率相比于苯甲醛有所下降(3f~3l)。本文进一步研究使用不同短链一元醇(如甲醇和乙醇)或二元醇(如乙二醇)进行的缩醛化反应,其中醇类起到反应物和溶剂作用。乙醇由于碳骨架比甲醇长,其反应收率会出现明显的下降(如3c和3h)。乙二醇由于与醛形成是稳定的环状结构,其收率相比乙醇较高。
选用廉价易得的有机分子曙红作为催化剂,通过反应条件的优化和底物适应范围的探究,实现缩醛化合物的高效合成。实验结果表明:苯甲醛在室温条件下的甲醇溶液中反应24 h可达到92%的缩醛收率。该反应底物适用范围广泛,当选用不同类型的芳香醛和脂肪醛时,缩醛化反应都能获得很好的收率;对于不同种类的短链一元醇和二元醇的羰醇缩合反应,醇溶性曙红也表现出良好的兼容性。曙红催化剂具有优良的反应特性,缩醛合成在室温或微热条件下进行,催化剂用量少,反应温和且高效。该研究结果为缩醛香料的合成提供一种简单经济的新方法,温和高效且底物适应范围广,具有一定的工业应用前景。
[1] Climent M J, Velty A, Corma A. Design of a solid catalyst for the synthesis of a molecule with blossom orange scent[J].Green Chem,2002,4:565-569.
[2] Iwamoto M, Tanaka Y, Sawamura N,etal. Remarkable effect of pore size on the catalytic activity of mesoporous silica for the acetalization of cyclohexanone with methanol[J].J Am Chem Soc,2003,125:13032.
[3] Leonard N M, Oswald M C, Freiberg D A,etal. A simple and versatile method for the synthesis of acetals from aldehydes and ketones using bismuth triflate[J].J Org Chem,2002,67:5202-5207.
[4] Smitha G, Reddy C S. A facile and efficient ZrCl4catalyzed conversion of aldehydes to geminal-diacetates and dipivalates and their cleavage[J].Tetrahedron,2003,59:9571-9576.
[5] Jia L Q, Jiang H F, Li J H. Palladium(II)-catalyzed oxidation of acrylate esters to acetals in supercritical carbon dioxide[J].Chem Commun,1999,985-986.
[6] Nieendick Claus, Schmid Karl Heinz. Aqueous perlescent concentrate for cosmelics:EP 1060740[P].2000.
[7] Torok D S, Fifueroa J J, Scott W J. 1,3-Dioxolane formation via Lewis acid-catalyzed reaction of ketones with oxiranes[J].J Org Chem,1993,58:7274-7276.
[8] Kamble V T, Bandgar B P, Muley D B,etal. An expedient and efficient cemoselective protection of carbonyl compounds and transthioacetalization ofO,O- andS,O- acetals catalyzed by HBF4-SiO2[J].Journal of Molecular Catalysis A:Chemical,2007,268:70-75.
[9] Smith B M, Kubczyk T M, Graham A E. Indium(III) triflate catalysed transacetalisation reactions of diols and triols under solvent-free conditions[J].Tetrahedron,2012,68:7775-7781.
[10] Fang D, Gong K, Shi Q R,etal. A green procedure for the protection of carbonyls catalyzed by novel task-specific room-temperature ionic liquid[J].Catalysis Communications,2007,8:1463-1466.
[11] Procuranti B, Connon S J. Unexpected catalysis:Aprotic pyridinium ions as active and recyclable Brønsted acid catalysts in protic media[J].Org Lett,2008,21:4935-4938.
[12] Myles L, Gore R G, Gathergood N,etal. The catalytic versatility of low toxicity dialkyltriazolium salts:Insitumodification facilitates diametrically opposed catalysis modes in one pot[J].Chem Commun,2013,49:5316-5318.
[13] Lijser H J P D, Rangel N A. Photochemical acetalization of carbonyl compounds in protic media using an in situ generated photocatalyst[J].J Org Chem,2004,69:8315-8322.
Study on The Acetalization Reaction Catalyzed by Eosin Y
LIU Liang-liang1a, FENG Yi-si1a,2*, XU Zhuo-wei1a, XU Hua-jian1b
(a. School of Chemistry and Chemical Engineering; b. School of Medical Egineering; 1. Hefei University of Technology, Hefei 230009, China; 2. Anhui Provincial Laboratory of Heterocyclic Chemistry, Hefei 230009, China)
The acetalization reaction of different kinds of aliphatic aldehydes or aromatic aldehydes with short chain monohydric alcohols and diols was achieved under mild conditions catalyzed by the alcohol-soluble Eosin Y. The yield of acetal compounds were 58%~99% after reaction for 24 h at room temperature. The structures were confirmed by1H NMR,13C NMR and HR-MS.
aldehyde; acetalization; carbonyl protection; alcohol-soluble Eosin Y; catalysis; synthesis
2016-04-12;
2016-11-16
国家自然科学基金资助项目(21472033, 21371044)
刘亮亮(1989-),男,汉族,安徽界首人,硕士研究生,主要从事有机合成研究。 E-mail: d30914038@126.com
冯乙巳,教授, Tel. 0551-62904405, E-mail: fengyisi@hfut.edu.cn
O621.3; O623.54+1
A
10.15952/j.cnki.cjsc.1005-1511.2017.01.16100

