LKB1在糖尿病肿瘤患者服用二甲双胍获益中的作用
姜宏卫,彭慧芳,张颖裕,马瑜瑾
糖尿病是一种严重的慢性病,造成巨大的经济负担,我国成人糖尿病患病率高达10.9%,糖尿病前期在成人中的发生率为35.7%[1]。糖尿病患者糖代谢失调、激素紊乱、肥胖等症状以及某些器官的特异性机制与多种恶性肿瘤发生关联,显著增加糖尿病患者的肿瘤发生率和恶性肿瘤死亡率,对其治疗和预后也产生不利的影响[2-3]。LKB1(liver kinase B1)或称STK11(serine-threonie kinase 11)是一种丝氨酸/苏氨酸蛋白激酶,AMPK[denosine 5’-monophosphate(AMP)-activated protein kinase]激活的必要因子,参与多种细胞通路的调控,在细胞代谢、细胞周期、细胞增殖、细胞极性维持等过程中发挥重要作用,也是一种重要的抑癌基因,该基因缺失、突变与多种肿瘤的发生密切相关[4-5]。
二甲双胍是目前2型糖尿病患者的一线用药,主要通过LKB1/AMPK通路发挥降糖作用[6]。使用二甲双胍控制血糖可以减少糖尿病患者的肿瘤发生风险,对肿瘤化疗或放疗有一定的增敏作用,还对许多肿瘤有一定的抑制作用,包括胰腺癌、肺癌、结肠癌、卵巢癌、乳腺癌[7]、前列腺癌、黑素瘤、淋巴细胞瘤等[8]。本文结合近年来研究报道,探讨二甲双胍通过LKB1或独立于LKB1/AMPK的降糖作用机制,以及对肿瘤细胞的抑制途径,为提高糖尿病患者二甲双胍获益率提供参考,同时也为二甲双胍应用于肿瘤患者提供理论基础。
1 二甲双胍降血糖机制
二甲双胍可以引起细胞内AMP/ATP比值升高,这种能量平衡的变化是激活AMPK的信号之一,活化的AMPK引起一系列下游反应是二甲双胍降糖作用的主要机制。AMPK是一个αβγ异源三聚体,其激活作用需在LKB1的作用下,磷酸化α亚基172位苏氨酸(Thr)[9],如果LKB1缺失,则无法激活。激活后AMPK会打开分解代谢通路,关闭合成代谢途径和细胞循环,调节激素或细胞活素类(如瘦素、脂联素、抵抗素、饥饿激素、大麻醇)对机体能量平衡的调控[10]。
LKB1/AMPK调控糖异生通路的主要靶标分子之一是TORC2(target of rapamycin complex 2),活化的AMPK可以磷酸化转录激活因子TORC2,抑制mTOR信号通路,抑制糖异生相关基因的表达,降低血糖和胰岛素水平[11];二甲双胍可以通过抑制mTOR来抑制ISR-1(insulin receptor substrate-1)Ser636/639磷酸化和PI3K/Akt通路,减弱糖尿病患者的胰岛素抗性[12]。AMPK的激活还可以抑制ACC(aceacetyl coA carboxylase)和HMGCR(3-hydroxy-3-methyl-glutaryl-coenzyme A reductase),限制脂肪酸氧化和固醇类合成,激活PFK(phosphofructokinase-1),促进糖酵解作用[13]。同时活化的LKB1/AMPK可以通过SITR1(sirtuin 1)来形成对二甲双胍降糖作用的代谢记忆[14]。
AMPK激活引起一系列的下游反应是二甲双胍降糖作用的主要机制,但是AMPK的活化必须有磷酸化的LKB1存在,如果LKB1受到抑制或缺失等负调控,AMPK激活也会受到抑制。敲除小鼠肝脏中LKB1基因,会增加糖异生基因表达,引起肝脏葡萄糖输出和显著高血糖症状,二甲双胍的降血糖作用也会受到抑制[15]。多磷酸肌醇激酶(inositol polyphosphate multikinase,IPMK)在细胞能量代谢和葡萄糖相关的AMPK调控中发挥一定的作用,IPMK缺失或抑制IPMK与LKB1之间的显性负调控作用可以减弱二甲双胍对AMPK的激活,引入IPMK过表达载体则可以恢复二甲双胍作用的LKB1/AMPK激活,表明IPMK是二甲双胍引起LKB1/AMPK激活的上游调节因子[16]。二甲双胍处理脐静脉内皮细胞,激活AMPK的同时还可以激活蛋白激酶C-zeta(protein kinase C-zeta type,PKC-zeta),增加其转录,药理或基因抑制PKC-zeta可以减弱二甲双胍作用下LKB1/AMPK的激活,表明PKC-zeta可能是LKB1的上游激酶[17]。
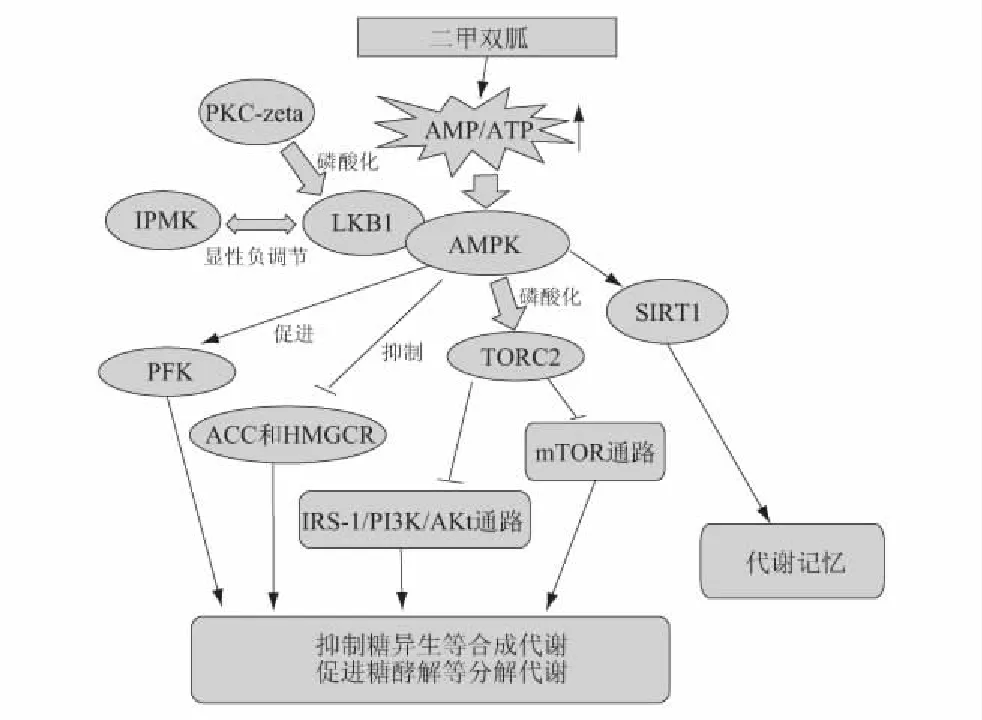
图1 二甲双胍降糖作用分子途径
二甲双胍降糖作用相关的分子激活通路如图1所示,LKB1/AMPK及其下游调控通路,胰岛素等激素调节,以及基因、蛋白等不同分子水平的作用是一个互相关联的作用网路[18],而LKB1是激活AMPK的必要因子,如果细胞中LKB1受到抑制或失活,则AMPK不能被激活,依赖AMPK的下游调控路径也会受到抑制。有报道指出,在LKB1或AMPK缺失的情况下,二甲双胍可以独立于LKB1/AMPK途径发挥一定的作用,例如在AMPK缺乏的小鼠中,二甲双胍对于其血糖仍有一定的调节作用,肝细胞中糖异生受到抑制,此时的降糖作用可能是通过调整糖异生相关基因PGC-1α(PPARγ coactivator-1α)过表达来实现[18]。在LKB1/AMPK失活的情况下,二甲双胍的降糖作用是否仍然与LKB1/AMPK正常情况下有同样的效果,尚无明确报道,对于其发挥作用的主要通路尚缺乏充足的数据支持。
2 二甲双胍对糖尿病患者肿瘤作用情况
二甲双胍对肿瘤有一定的治疗或辅助作用,使用二甲双胍作为降糖药可以减少糖尿病患肝癌的风险[19],糖尿病子宫内膜癌患者在服用抗癌药物贝伐单抗同时用二甲双胍来控制血糖时,会增加贝伐单抗的作用效果[20]。糖尿病合并实体肿瘤患者用二甲双胍比用胰岛素或磺脲类药物有更好的生存率[21-22]。临床上用二甲双胍作为糖尿病肿瘤患者的降糖药,对肿瘤发生的抑制以及肿瘤治疗都有一定的积极作用,其在体内外抑制肿瘤细胞的作用机制包括激活LKB1/AMPK通路,细胞周期阻断或引起细胞凋亡,抑制蛋白合成,减少循环胰岛素水平,抑制蛋白未折叠反应,激活免疫系统,除去肿瘤干细胞等[23-24]。
2.1二甲双胍对LKB1缺失肿瘤细胞的作用
LKB1/AMPK信号在保护细胞免受凋亡中发挥重要作用,尤其对增加细胞AMP/ATP比率的药物起作用。活化的AMPK信号通路可以为细胞争取到调整AMP和ATP浓度的安全时间和相关的反应信号而对细胞起到保护作用,如果细胞不能及时调整AMP/ATP,将会发生细胞死亡[24]。
作为肿瘤抑制因子之一,LKB1在许多肿瘤细胞中发生缺失或失活,这也是多种细胞癌变的诱发因素之一[25]。在这种情况下,AMPK则无法被激活,mTOR通路将不受抑制[26],二甲双胍作用于LKB1失活的肿瘤细胞时,可以调节STAT3通路,抑制肿瘤细胞血管内皮生长因子,该途径是独立于LKB1/AMPK的作用途径,同时通过对ROS的作用和IL-6自分泌的影响,产生与肿瘤细胞的转移和化疗药物耐药性相关的作用[27]。对肝癌细胞,二甲双胍的作用会对p21和p27上调,并下调cyclin D1,影响细胞周期[19]。二甲双胍还可以通过作用于与线粒体相关的生物合成活性,影响线粒体电子传递链复合体1,而对肿瘤细胞的增殖产生抑制作用,缺乏有功能的线粒体的肿瘤细胞在二甲双胍处理下表现为减弱对二甲双胍引起的抑制增殖作用的敏感性[28]。其相关的作用通路及作用效果总结如图2所示。
2.2二甲双胍通过LKB1对肿瘤细胞的作用
同时有报道二甲双胍对于一些癌变的细胞产生抑制作用必须依赖于LKB1/AMPK的作用,如果LKB1突变,则影响其作用效果[29]。用二甲双胍处理宫颈癌细胞,发现只有LKB1未受损,AMPK-mTOR信号通路完整的细胞系对二甲双胍的抑制作用敏感;在LKB1缺失的细胞中转入过表达LKB1载体,可以促进AMPK的激活和其对mTOR的抑制作用,进而增加细胞对二甲双胍的敏感性,而敲除LKB1基因则会减弱细胞对二甲双胍的敏感性[30]。对于卵巢癌细胞,二甲双胍的作用同样显著依赖于激活AMPK以及其下游调控,减弱mTOR-SS6RP磷酸化,抑制蛋白转录和脂质生物合成,及对细胞周期和增殖的乳腺癌肿瘤细胞MCF-7中,二甲双胍处理引起总蛋白表达量减少的作用是通过AMPK的作用实现的[31]。细胞极性的保持对保护细胞免受癌变有重要作用,而对细胞极性保持起作用的SAD激酶(single anomalous dispersion kinase)、Par-1(proteinase-activated receptor 1)以及GIV/Girdin的磷酸化依赖于AMPK的激活[32-33]。二甲双胍还可以通过LKB1/AMPK的作用在mRNA和蛋白水平上对PI3K/Akt/mTOR通路进行下调,同时减少胰岛素、胰岛素样生长因子、炎性因子、血管内皮生长因子的产生,起到抗细胞分裂、抗炎、抗血管生成作用[34]。
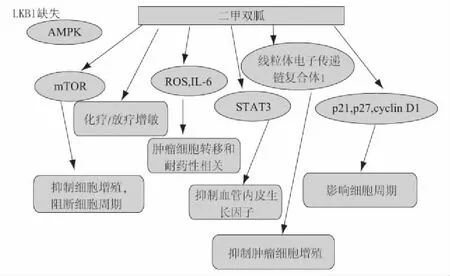
图2 二甲双胍对LKB1缺失的肿瘤细胞作用通路
二甲双胍对肿瘤细胞抑制必须通过LKB1/AMPK作用的情况在多种肿瘤细胞中均有验证,但对LKB1缺失肿瘤细胞的抑制作用也有报道[24]。因此猜测:①在不同种类的肿瘤细胞中二甲双胍作用途径有所不同,或者在LKB1/AMPK功能受到抑制时,二甲双胍通过替代通路发挥作用;②在细胞应对二甲双胍作用的过程中可能还有其他的上游关键分子发挥重要作用;③二甲双胍作用于肿瘤细胞不仅对相关核酸、蛋白进行调节,对激素等其他水平的调节发挥巨大的作用,尤其在LKB1/AMPK功能缺失的情况下,但具体的原因仍需要详细的数据支持。
3 结语与展望
无论是二甲双胍的降糖作用,还是其对肿瘤细胞的抑制作用,都经过多条信号通路互相协作,在转录和翻译水平上均进行相关调控。LKB1的突变与缺失又与肿瘤的发生发展有密切关系,同时与二甲双胍作用的主要激活通路密不可分。那么在糖尿病肿瘤患者获益于二甲双胍作用的分子机制中,LKB1的决定性作用值得深入研究。这种可能存在的作用是否与肿瘤类型有必然关系,这对于糖尿病、糖尿病肿瘤患者以及单独肿瘤患者二甲双胍用药的分子分型,以及对二甲双胍的用药指导及扩大适用症范围有重要意义。
[1] Wang LM,Gao P,Huang ZL,et al.Prevalence and ethnic pattern of diabetes and prediabetes in China in 2013[J].JAMA,2017,317(24):2515-2523.
[2] Makhoul I,Yacoub A,Siegel E.Type 2 diabetes mellitus is associated with increased risk of pancreatic cancer:a veteran administration registry study[J].SAGE Open Med,2016,14(4):1-7.
[3] Ma RC,Tsoi KY,Tam WH,et al.Developmental origins of type 2 diabetes: a perspective from China[J].Eur J Clin Nutr,2017,71(7):870-880.
[4] Zhang CS,Li M,Lin SC.Methods to study lysosomal AMPK activation[J].Methods Enzymol,2017,587(9):465-480.
[5] Zhang M,Yang D,Gong X,et al.Protective benefits of AMP-activated protein kinase in hepatic ischemia-reperfusion injury[J]. Am J Transl Res,2017,9(3):823-829.
[6] Tan MH,Alquraini H,Mizokami-Stout K,et al.Metformin: from research to clinical practice[J]. Endocrinol Metab Clin North Am, 2016,45(4):819-843.
[7] 李璞玉,冯笑山.降糖药二甲双胍治疗乳腺癌的研究进展[J].河南科技大学学报(医学版),2015,33(4):311-314.
[8]Vallianou NG,Evangelopoulos A,Kazazis C.Metformin and cancer[J].Rev Diabet Stud,2013,10(4):228-235.
[9] Russo GL,Russo M,Ungaro P.AMP-activated protein kinase:a target for old drugs against diabetes and cancer[J].Biochem pharmacol,2013,86(3):339-350.
[10]Hardie DG,Ross FA,Hawley SA.AMP-activated protein kinase: a target for drugs both ancient and modern[J].Chem Biol,2012,19(10):1222-1236.
[11]Shaw RJ,Lamia KA,Vasquez D,et al.The kinase LKB1 mediates glucose homeostasis in liver and therapeutic effects of metformin[J]. Science,2005,310(5754):1642-1646.
[12]Tzatsos A,Kandror KV. Nutrients suppress phosphatidylinositol 3-kinase/Akt signaling via raptor-dependent mTOR-mediated insulin receptor substrate 1 phosphorylation[J].Mol Cell Biol,2006,26(1):63-76.
[13]Barnea M,Haviv L,Gutman R,et al.Metformin affects the circadian clock and metabolic rhythms in a tissue-specific manner[J]. Biochim Biophys Acta,2012,1822(11):1796-1806.
[14]Zheng Z,Chen H,Li J,et al.Sirtuin 1-mediated cellular metabolic memory of high glucose via the LKB1/AMPK/ROS pathway and therapeutic effects of metformin[J].Diabetes,2012,61(1): 217-228.
[15]Carling D.LKB1:a sweet side to Peutz-Jeghers syndrome[J].Trends Mol Med,2006,12(4): 144-147.
[16]Bang S,Chen Y,Ahima RS,et al.Convergence of IPMK and LKB1-AMPK signaling pathways on metformin action[J].Mol Endocrinol,2014,28(7):1186-1193.
[17]Xie Z,Dong Y,Scholz R,et al.Phosphorylation of LKB1 at serine 428 by protein kinase C-zeta is required for metformin-enhanced activation of the AMP-activated protein kinase in endothelial cells[J].Circulation,2008,117(7):952-962.
[18]Foretz M,Hebrard S,Leclerc J,et al.Metformin inhibits hepatic gluconeogenesis in mice independently of the LKB1/AMPK pathway via a decrease in hepatic energy state[J].J Clin Invest,2010,120(7):2355-2369.
[19]Chen HP,Shieh JJ,Chang CC,et al.Metformin decreases hepatocellular carcinoma risk in a dose-dependent manner:population-based and in vitro studies[J].Gut,2013,62(4):606-615.
[20]Indraccolo S,Randon G,Zulato E,et al.Metformin:a modulator of bevacizumab activity in cancer: a case report[J].Cancer Biol Ther,2015,16(2):210-214.
[21]De Souza A,Khawaja KI,Masud F,et al.Metformin and pancreatic cancer: is there a role[J].Cancer Chemother Pharmacol,2016,77(2):235-242.
[22]Li D.Metformin as an antitumor agent in cancer prevention and treatment[J].J Diabetes,2011,3(4):320-327.
[23]Kourelis TV,Siegel RD.Metformin and cancer: new applications for an old drug[J].Med Oncol,2012,29(2):1314-1327.
[24]Micic D,Cvijovic G,Trajkovic V,et al.Metformin: its emerging role in oncology[J].Hormones (Athens),2011,10(1):5-15.
[25]Shaw RJ.Tumor suppression by LKB1: SIK-ness prevents metastasis[J].Sci Signal,2009,2(86):55-62.
[26]Green AS,Chapuis N,Lacombe C,et al.LKB1/AMPK/mTOR signaling pathway in hematological malignancies:from metabolism to cancer cell biology[J].Cell Cycle,2011,10(13):2115-2120.
[27]Lin CC,Yeh HH,Huang WL,et al.Metformin enhances cisplatin cytotoxicity by suppressing signal transducer and activator of transcription-3 activity independently of the liver kinase B1-AMP-activated protein kinase pathway[J].Am J Respir Cell Mol Biol,2013,49(2):241-250.
[28]Griss T,Vincent EE,Egnatchik R,et al.Metformin antagonizes cancer cell proliferation by suppressing mitochondrial-dependent biosynthesis[J].PLoS Biology,2015,13(12):1002309.
[29]KorsseSE,Peppelenbosch MP,van Veelen W.Targeting LKB1 signaling in cancer[J].Biochim Biophys Acta,2013,1835(2):194-210.
[30]Xiao X,He Q,Lu C,et al.Metformin impairs the growth of liver kinase B1-intact cervical cancer cells[J].Gynecol Oncol,2012,127(1):249-255.
[31]Dowling RJ,Zakikhani M,Fantus IG,et al.Metformin inhibits mammalian target of rapamycin-dependent translation initiation in breast cancer cells[J].Cancer Res,2007,67(22):10804-10812.
[32]Brenman JE,Temple BR.Opinion:alternative views of AMP-activated protein kinase[J].Cell Biochem Biophys,2007,47(3):321-331.
[33]Ghosh P.The stress polarity pathway:AMPK ′GIV′-es protection against metabolic insults[J].Aging,2017,9(2):303-314.
[34]Gadducci A,Biglia N,Tana R,et al.Metformin use and gynecological cancers:a novel treatment option emerging from drug repositioning[J].Crit Rev Oncol Hematol,2016,105(9):73-83.

