一氧化氮供体JS-K对H22荷瘤小鼠抑瘤作用的研究
刘 玲,王 静,刘沐辰,慎会娜,花昌林
一氧化氮(nitric oxide,NO)是一种普遍存在的水溶性自由基气体,在各种生理及病理过程中发挥着十分重要的作用[1-3]。研究表明,高浓度NO可通过抑制血管生成和转移、诱导细胞凋亡等机制抑制肿瘤细胞增殖[4-6]。NO供体是指在体内经酶或非酶作用释放NO的化合物,现已发现多种结构类型的NO供体,如机硝酸酯类、亚硝基硫醇、呋咱氮氧化合物和偶氮鎓二醇盐等,其中偶氮鎓二醇盐类在靶向性释放NO方面优势明显[7-9]。O2-(2,4-二硝基苯基)1-[(4-乙氧羰基)哌嗪-1-yl]偶氮-1-鎓-1,2-二醇(JS-K)是一种新型偶氮鎓二醇盐类衍生物,是在偶氮二醇盐O2端以硝基芳香取代基进行取代[10-11]。本组前期研究显示:JS-K对体外多种肝癌细胞(HepG2、SMMC-7721、Bel-7402)的增殖均有较强的抑制作用,可通过增加Ca2+水平,升高Bax/Bcl-2比值,激活caspase通路等机制诱导细胞凋亡[12]。本研究将以H22腹水瘤细胞和H22荷瘤小鼠为研究对象,分别从体外和体内实验,进一步观察JS-K对H22腹水瘤细胞和肿瘤生长的抑制作用,为该化合物的应用提供理论依据,现报道如下。
1 材料与方法
1.1动物、试剂和主要仪器健康雄性Balb/c小鼠40只,体质量(20±2) g,由河南科技大学医学院实验动物中心提供,动物许可证号:SCXK(鄂)2010-0007,将小鼠饲养在室温18~25 ℃,光照12 h,相对湿度45%~55%,通风良好的环境中,喂普通饲料自由饮水。JS-K(纯度≥97%,分子量384),美国Santa Cruz公司。氟尿嘧啶注射液(10 mL:0.25 g,批号100605,上海旭东海普药业有限公司)。丙氨酸氨基转移酶(alanine transaminase,ALT)、天门冬氨酸氨基转移酶(aspartate transaminase,AST)测试盒购自南京建成生物工程研究所。Bcl-2、Bax和cleaved-caspase-3兔多克隆抗体、辣根过氧化物酶(horseradish peroxidase,HRP)标记羊抗兔 IgG为武汉三鹰生物技术有限公司产品;其他化学试剂均为分析纯。ZS-板式酶标仪(美国Molecular Device公司)。
1.2动物及分组体外传代培养的H22细胞用无菌生理盐水配成1×107·mL-1的浓度。取0.2 mL接种于小鼠的腹腔,在小鼠腹腔内常规传代3次代以后,选择腹水饱满的小鼠抽取腹水,按照1∶3的比例用生理盐水稀释制成瘤细胞混悬液,调整细胞浓度为1×107·mL-1。每只0.2 mL接种在小鼠的右侧腋窝皮下。接种次日,称重,将小鼠随机分成5组,每组8只,分为空白对照组、模型组、5-Fu阳性药对照组(20 mg·kg-1)、JS-K 低剂量组(0.75 mg·kg-1)和JS-K高剂量组(1.50 mg·kg-1)。空白对照组和模型组尾静脉注射生理盐水,每3 d给药1次;5-FU组腹腔注射,每天给药1次;JS-K给药组尾静脉注射,每3 d给药1次,连续14 d。期间每天记录各组小鼠的体质量、进食量和生存状态。
1.3肿瘤抑制率计算腋窝接种后第15天以脱颈椎法处死小鼠,完整取出右侧腋窝皮下的瘤组织,准确称质量(g),计算肿瘤抑制率。抑瘤率(%)=(模型组平均瘤质量—给药组平均瘤质量)/ 模型组平均瘤质量×100%。
1.4血清ALT、AST检测第15天处死小鼠前,眼眶取血,离心取上清,按试剂盒说明书步骤进行操作,比色法检测并计算血清中ALT和AST的含量。
1.5Western蛋白印迹法检测凋亡相关蛋白水平将瘤组织剪碎,加裂解液裂解提取总蛋白,BCA法测定蛋白含量。用12% SDS-PAGE电泳分离总蛋白,将凝胶上的蛋白转印至PVDF膜上,5%脱脂奶粉常温封闭1 h,加入一抗(稀释倍数1∶1 000)于封闭袋中4 ℃孵育过夜;二抗室温孵育 2 h。ECL化学发光法显影,凝胶成像系统拍照并对蛋白条带进行半定量分析。以目的蛋白条带积分吸光度值与内参条带吸光度值的比值表示目的蛋白相对含量。
2 结果
2.1JS-K对H22荷瘤小鼠瘤质量的影响体内实验显示,肿瘤接种前各组小鼠活动正常,食欲良好。实验中后期,小鼠日进食量、活泼度均有所下降,荷瘤模型组最为明显,小鼠反应迟缓,体型瘦小,毛色有黏连,不光滑,有脱毛现象。荷瘤模型组平均瘤质量为(1.62±0.12) g,5-Fu 组移植瘤生长受抑制,5-FU组瘤质量为(0.65±0.11)g,抑瘤率60.02%。JS-K实验组平均瘤质量明显小于荷瘤模型组,JS-K治疗组低剂量组瘤质量为(1.23±0.15) g(P<0.05),抑瘤率23.93%;JS-K高剂量组移植瘤生长抑制更加明显,移植瘤生长较为局限,质地稍硬,包膜较为完整。高剂量组瘤质量为(0.81±0.16) g(P<0.05),抑瘤率50.26%。结果JS-K能显著抑制H22移植瘤小鼠体内肿瘤的生长,见图1。
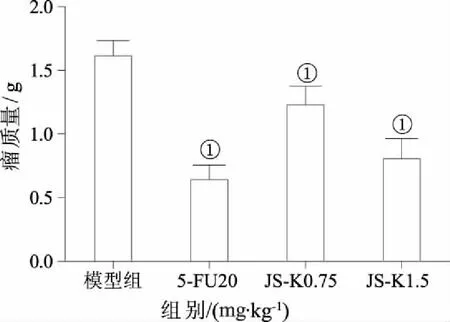
①与模型组比较,P<0.05。图1 JS-K对H22荷瘤小鼠移植瘤质量的影响
2.2JS-K对H22荷瘤小鼠ALT和AST的影响JS-K给药14 d后,与正常对照组相比,JS-K对H22荷瘤小鼠血清中ALT和AST水平没有显著影响,提示JS-K对小鼠肝脏没有损伤作用,见表1。
表1 JS-K对H22荷瘤小鼠ALT和AST的影响
注:ALT:丙氨酸氨基转移酶;AST:天门冬氨酸氨基转移酶。
2.3JS-K对H22荷瘤小鼠凋亡相关蛋白的影响与模型组比较,JS-K能降低肿瘤组织中抗凋亡蛋白Bcl-2表达,升高促凋亡蛋白Bax表达,同时使caspase-3剪切形式(活化)cleaved-casapse-3蛋白表达增加,提示JS-K可激活促进凋亡发生的相关通路,见图2和图3。
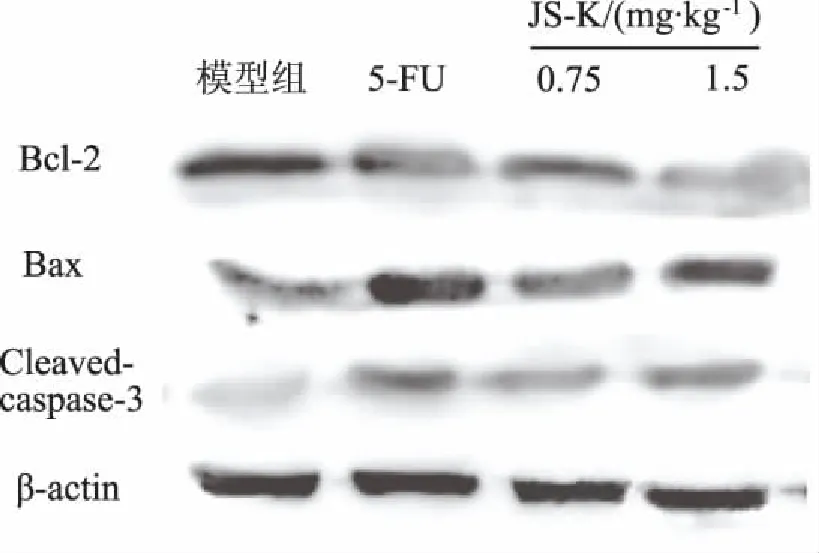
图2 JS-K对H22荷瘤小鼠瘤组织中凋亡相关蛋白表达的影响
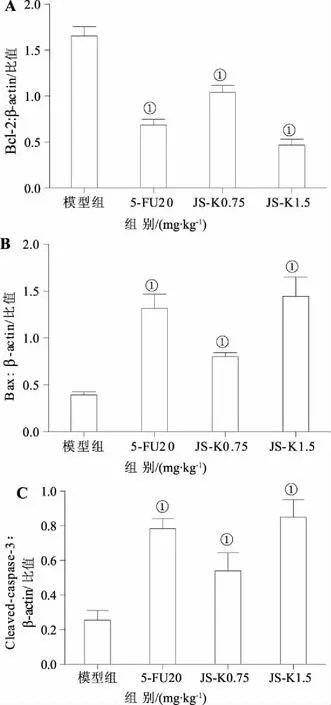
A:各组Bcl-2表达比较;B:各组Bax表达比较;C:各组cleaved-casapse-3表达比较。①与模型组比较,P<0.05。图3 H22荷瘤小鼠瘤组织中凋亡相关蛋白比较
3 讨论
由于NO的半衰期很短,为提高体内NO浓度,所以对其前体药的研究日益增多,其中NO供体药偶氮烯翁二醇盐类具有半衰期长的特点,可明显提高放疗疗效和诱导肿瘤细胞凋亡。为解决NO供体靶向作用这一难题,应该针对体内特定酶进行研究,以期该酶能识别或活化的NO供体,或者是开发对特定组织具有高度亲和力的NO供体[13-15]。JS-K作为偶氮翁二醇盐类衍生物显示了对多种肿瘤的抗肿瘤效应,可在谷胱甘肽S转移酶(glutathione-S-transfarase,GST)催化下,被谷胱甘肽的亲核性巯基攻击,生成偶氮鎓二醇盐离子,在生理条件下偶氮鎓二醇盐离子分解释放NO[16-18]。研究发现JS-K可选择性地在急性髓性白血病HL-60细胞内释放NO,杀灭癌细胞,而不伤害正常细胞,对免疫缺陷型小鼠体内植入的HL-60细胞及前列腺癌细胞PC-3,JS-K均能抑制其生长,且不导致小鼠血压下降等副作用[19-20]。
药物在体外敏感性试验是直接作用于细胞,但往往与体内实验效果并不一定完全相符。而且,药物的活性成分在体内受多种因素的影响,并且通过肝、肾器官可使药物疗效增强或减弱,因此体内抗肿瘤实验结果是评价抗肿瘤药物有效性的重要指标。H22荷瘤小鼠肝癌细胞皮下移植模型是用于研究抗肿瘤药物及筛选药物作用机制的肿瘤模型。本研究分别通过体外细胞实验和体内移植瘤实验观察了JS-K的抗肿瘤作用。Ren等[21]发现JS-K可抑制Hep3B肝癌细胞的增殖,这与ERK、JNK和p38及其下游效应c-Jun和AP-1的激活有关。NO清除剂可取消JS-K对MAPK的激活和肿瘤抑制作用。
本研究中,通过尾静脉注射给药的方式观察了JS-K对小鼠移植H22肿瘤生长的抑制作用。结果显示:与模型组相比,JS-K能显著抑制小鼠 H22实体瘤的生长,对移植瘤的重量都有较明显的抑制作用。其中荷瘤模型组小鼠平均瘤质量为(1.62±0.12) g ,超过1 g,表示造模成功,肿瘤生长良好。JS-K低、高给药组可在不同程度上抑制肿瘤的生长,而且对肝脏功能影响较小。
细胞凋亡是细胞为维持内环境稳定,由基因控制的自主的有序的死亡。凋亡是多基因严格控制的过程。这些基因在种属之间非常保守,如Bcl-2家族、caspase家族、癌基因如C-myc、抑癌基因P53等[22-23]。Bcl-2通过阻止线粒体细胞色素C的释放而发挥抗凋亡作用。此外, Bcl-2具有保护细胞的功能,Bcl-2的过度表达可引起细胞核谷胱苷肽的积聚,导致核内氧化还原平衡的改变,从而降低了Caspase的活性。Bax是Bcl-2家族中参与细胞凋亡的一个成员,当诱导凋亡时,它从胞液迁移到线粒体和核膜。细胞内的Bax与Bcl-2比值决定线粒体外膜孔道形成,细胞色素C从线粒体释放,在dATP存在的条件下能与凋亡相关因子1结合,使其形成多聚体,并促使caspase-9与其结合形成凋亡小体,caspase-9被激活,被激活的caspase-9能激活其他的caspase,如caspase-3等,从而诱导细胞凋亡[24]。caspase-3即半胱天冬蛋白酶-3是凋亡中的关键执行者。JS-K可增加Bax蛋白表达而降低Bcl-2蛋白表达,并促使caspase-3的活化形式即剪切的caspase-3表达增加。
因此,JS-K对H22荷瘤小鼠的抑瘤作用与其诱导肿瘤细胞凋亡有关。JS-K具有良好的抗肿瘤作用,可能成为一个理想的抗肿瘤候选药。
[1]El-Sehemy A,Postovit LM,Fu Y.Nitric oxide signaling in human ovarian cancer: a potential therapeutic target[J].Nitric Oxide,2016,15(54):30-37.
[2] Forstermann U,Sessa WC.Nitric oxide synthases: regulation and function[J].Eur Heart J,2012,33(7):829-837.
[3] Rabender CS,Alam A,Sundaresan G,et al.The role of nitric oxide synthase uncoupling in tumor progression [J].Mol Cancer Res,2015,13(6):1034-1043.
[4] Carradori S,Mollica A,De Monte C,et al.Nitric oxide donors and selective carbonic anhydrase inhibitors:a dual pharmacological approach for the treatment of glaucoma,cancer and osteoporosis[J].Molecules,2015,20(4):5667-5679.
[5]Huerta S,Chilka S,Bonavida B.Nitric oxide donors: novel cancer therapeutics (review) [J].Int J Oncol,2008,33(5):909-927.
[6] Hickok JR,Thomas DD.Nitric oxide and cancer therapy: the emperor has NO clothes [J].Curr Pharm Des,2010,16(4):381-391.
[7] Basudhar D,Cheng RC,Bharadwaj G,et al.Chemotherapeutic potential of diazeniumdiolate-based aspirin prodrugs in breast cancer[J].Free Radic Biol Med,2015,83:101-114.
[8] Kogias E,Osterberg N,Baumer B,et al.Growth-inhibitory and chemosensitizing effects of the glutathione-S-transferase-π-activated nitric oxide donor PABA/NO in malignant gliomas[J]. Int J Cancer,2012,130(5):1184-1194.
[9] Townsend DM,Findlay VJ,Fazilev FA.glutathione S-transferase pi-activated prodrug causes kinase activation concurrent with S-glutathionylation of proteins[J].Mol Pharmacol,2006,69(2):501-508.
[10]Qiu M,Chen L,Tan G,et al.A reactive oxygen species activation mechanism contributes to JS-K-induced apoptosis in human bladder cancer cells[J].Sci Rep,2015,5:151-156.
[11]Qiu M,Chen L,Tan G,et al.JS-K promotes apoptosis by inducing ROS production in human prostate cancer cells[J].Oncol Lett,2017,13(3):1137-1142.
[12]Liu L,Wang D,Wang J,et al.The nitric oxide prodrug JS-K induces Ca (2+)-mediated apoptosis in human hepatocellular carcinoma HepG2 Cells[J].J Biochem Mol Toxicol,2016,30(4):192-199.
[13]张奕华,彭司勋.一氧化氮供体型创新药物的研究进展[J].中国药科大学学报,2006,37(5):387-396.
[14]Huang Z,Fu J,Liu L,et al.Glycosylated diazeniumdiolate-based oleanolic acid derivatives:synthesis,in vitro and in vivo biological evaluation as anti-human hepatocellular carcinoma agents[J].Org Biomol Chem,2012,10(19):3882-3891.
[15]Fu J,Liu L,Huang Z,et al.Hybrid molecule from O2-(2,4-dinitrophenyl)diazeniumdiolate and oleanolic acid: a glutathione S-transferase π-activated nitric oxide prodrug with selective anti-human hepatocellular carcinoma activity and improved stability[J].J Med Chem,2013,56(11):4641-4655.
[16]Udupi V,Yu M,Malaviya S,et al.JS-K,a nitric oxide prodrug, induces cytochrome c release and caspase activation in HL-60 myeloid leukemia cells[J].Leuk Res,2006,30(10):1279-1283.
[17]Günzle J,Osterberg N,Saavedra JE,et al.Nitric oxide released from JS-K induces cell death by mitotic catastrophe as part of necrosis in glioblastoma multiforme[J].Cell Death Dis,2016,7(9):e2349.
[18]Kaczmarek MZ,Holland RJ,Lavanier SA, et al.Mechanism of action for the cytotoxic effects of the nitric oxide prodrug JS-K in murine erythroleukemia cells[J].Leuk Res,2014,38(3):377-382.
[19]Shami PJ,Saavedra JE,Bonifant CL,et al.Antitumor activity of JS-K [O2-(2,4-dinitrophenyl)1-[(4-ethoxycarbonyl)piperazin-1-yl]diazen-1-ium-1,2-diolate]and related O2-aryl diazeniumdiolates in vitro and in vivo[J].J Med Chem,2006,49(14):4356-4366.
[20]Shami PJ,Saavedra JE,Wang LY,et al.JS-K,a glutathione/glutathione S-transferase-activated nitric oxide donor of the diazeniumdiolate class with potent antineoplastic activity[J].Mol Cancer Ther,2003,2(4):409-417.
[21]Ren Z,Kar S,Wang Z,et al.JS-K,a novel non-ionic diazeniumdiolate derivative, inhibits Hep 3B hepatoma cell growth and induces c-Jun phosphorylation via multiple MAP kinase pathways[J].J Cell Physiol,2003,197(3):426-434.
[22]Cui Q,Wen S,Huang P.Targeting cancer cell mitochondria as a therapeutic approach: recent updates[J].Future Med Chem,2017,9(9):929-949.
[23]Dillon CP,Green DR.Molecular cell biology of apoptosis and necroptosis in cancer[J].Adv Exp Med Biol,2016,930:1-23.
[24]Luna-Vargas MP,Chipuk JE.Physiological and pharmacological control of BAK,BAX,and beyond[J]. Trends Cell Biol,2016,26(12):906-917.

