胎盘中转运蛋白表达水平对胆汁酸排泌的影响
曾慧
(四川成都崇州市人民医院,四川 成都 611230)
·论 著·
胎盘中转运蛋白表达水平对胆汁酸排泌的影响
曾慧
(四川成都崇州市人民医院,四川 成都 611230)
目的:探讨胎盘中转运蛋白基因FIC1、MDR3和BSEP表达量对妊娠期胆汁酸排泌功能及胎儿预后的影响。方法:采用RT- PCR、免疫印迹、免疫组化等检测手段检测我院妊娠期肝内胆汁淤积症(ICP)患者(ICP组,38例)及正常妊娠孕妇(对照组,38例)胎盘组织中FIC1、MDR3和BSEP mRNA水平及MDR3和BSEP蛋白表达情况,并对两组孕妇丙氨酸转移酶、总胆红素、甘氨胆酸表达量及新生儿围生期各指标进行比较。结果:FIC1、MDR3基因mRNA及MDR3蛋白在ICP组中均为弱表达,与对照组比较差异具有统计学意义(P<0.05),而BSEP mRNA及蛋白表达量在两组中差异无统计学意义(P>0.05);此外,ICP组丙氨酸转移酶、总胆红素、甘氨胆酸、羊水粪染率均高于对照组(P<0.05),而孕周、胎儿体重、Apgar评分均低于对照组,差异均具有统计学意义(P<0.05)。结论:FIC1、MDR3基因表达下调可对胎盘胆汁酸排泌起到负性调节作用,从而影响胎儿围生期预后情况。
胆汁淤积症; 妊娠; 转运蛋白; 胎儿; 胎盘
妊娠期肝内胆汁淤积症(intrahepatic cholestasis of pregnancy,ICP)是一种以瘙痒及黄疸为主要特征的妊娠期特有并发症,且多发于妊娠中、晚期[1]。目前研究显示,ICP虽不会对母体造成严重危害,但常可致胎儿窘迫、早产、畸胎、低体重儿或死胎等现象发生,从而显著增加围产儿患病率及死亡率[2]。因此,早期诊断及针对性治疗具有一定临床意义。而转运蛋白基因表达变异则是导致肝胆汁转运系统功能异常的重要因素之一。近年来研究发现,转运蛋白基因FIC1(ATP8B1)、MDR3(ABCB4)、BSEP(ABCB11)表达异常均与母体肝脏胆汁酸排泌及淤积具有一定相关性,但针对以上3个基因在胎盘组织中表达情况的报道较少[3- 4]。鉴于ICP的发生对胎儿危重程度明显高于母体,因此有必要就3个基因在胎盘中的表达情况进行深入研究,以便进一步揭示ICP的发病机制。本研究从胎盘组织及胎儿角度,通过实时定量PCR及免疫印迹等方法研究上述基因表达对胆汁排泌及胎儿预后的影响,现将结果呈报如下。
1 资料与方法
1.1 一般资料
收集2013年2月至2015年1月由我院产科收治且符合纳入标准的ICP患者共计38例作为ICP组,患者年龄24~35岁,平均(27.5±3.4)岁,平均孕周(36.1±2.32)周;此外,随机抽选38例同期正常妊娠女性作为对照组,年龄23~36岁,平均(27.4±3.5岁),平均孕周(38.3±2.73),在各项指标符合剖宫产手术情况下自愿采取择期剖宫产手术。ICP患者纳入标准:(1) ICP确诊参考文献[5]所述;(2) 单胎,择日剖宫产;(3) 既往无高血压、糖尿病及肝、肾相关疾病史;(4) 未合并其他妊娠相关疾病;(5) 胎儿无畸形;(6) 无感染性疾病。
1.2 实验材料
RNA提取试剂盒购自TAKARA公司,MDR3一抗、BSEP一抗及生物素标记二抗及内参β- actin购自abcam公司,福尔马林、TBST、石蜡等HE染色试剂购自杭州博日生物科技有限公司,丙氨酸转移酶及总胆红素试剂盒购自R&D公司,电泳仪购自Bio- RID公司,RT- PCR仪购自Aglient公司。
1.3 方法
1.3.1 标本采集 两组孕妇剖宫术毕10 min内从母体面取1 cm×1 cm×1 cm胎盘组织块,生理盐水漂洗后分成两份,1份放入10%福尔马林固定,另1份放于-80 ℃保存。胎儿则进行常规检查,记录其体重、身长、胎盘重量并进行新生儿Apgar评分。羊水粪染情况判断:0°羊水清,无污染;Ⅰ°呈淡黄色,为轻度污染;Ⅱ°黄绿色,中度污染;Ⅲ°棕黄色黏稠,重度污染。羊水粪染率(%)=(1-无污染例数/总例数)×100%。血样收集:(1) 母体外周血,两组患者均在实施剖宫术前空腹抽取静脉血2管,1管进行丙氨酸转移酶及总胆红素测定,另1管进行甘氨胆酸测定;(2) 脐带血,新生儿断脐后收集脐带血约2 ml,与母体外周血一并进行甘氨胆酸测定。
1.3.2 RT- PCR 采取两步法,采用Trizol抽提获得组织总RNA后进行RT- PCR,将其以10倍稀释度进行稀释后作为模板进行定量PCR,反应条件70 ℃ 5 min,42 ℃ 1 h,95 ℃ 4 min,4 ℃ 5 min,绘制标准曲线。设计FIC1(ATP8B1)、MDR3(ABCB4)、BSEP(ABCB11)及GAPDH引物序列(表1),逆转录成cDNA,PCR条件:95 ℃预变性3 min,94 ℃ 15 s,60 ℃ 20 s,72 ℃ 20 s,循环40次,依据标准曲线求出待测cDNA量模板中原始浓度。
表1 引物及内参设计

基因正义链(5'-3')反义链(5'-3')FIC1(ATP8B1)GATGTGGCTCGCCATAAAATGGAAGTGGAAAGAAATTCAAGTTGGMDR3(ABCB4)ATGCCAGTTCATTTGCTCCAGCTACGACCCCTTGGCGGBSEP(ABCB11)GAGAGGGTCGGACCTGCATGACACGACAGCAATGATATCTGAGTGAPDHCGGAGTCAACGGATTTGGTCGTATAGCCTTCTCCATGGTGGTGAAGAC
1.3.3 免疫印迹 按蛋白提取试剂盒步骤获取目的蛋白后,以β- actin为内参进行10% SDS- PAGE,上样量为40 μg蛋白垂直电泳,随后将蛋白转膜至硝酸纤维素膜上,并添加5%脱脂牛奶进行过夜封闭,TBST清洗3次后依据检测蛋白不同分别加入相应一抗MDR3(浓度1∶50,abcam公司,鼠抗人)、一抗FIC1(浓度1∶100,abcam公司,鼠抗人)、一抗BSEP(浓度1∶250,abcam公司,鼠抗人)进行4 ℃过夜孵育,次日用TBST清洗3次后加入生物素标记二抗(浓度分别为1∶1 000、1∶1 000、1∶1 500)(abcam公司,羊抗鼠),37 ℃孵育1 h后加入显影液。由Gel pro5.0软件分析成像灰度值,并参考内参β- actin灰度值比较目的蛋白水平。
1.3.4 免疫组化 将10%福尔马林固定24 h后的组织进行石蜡包埋、切片(4 μm)脱蜡处理,3%双氧水室温孵育30 min,PBS冲洗并浸泡5 min,并进行抗原修复。采用10%牛血清过夜封闭,去除血清后依据蛋白不同分别加入鼠抗人MDR3(浓度1∶50)或鼠抗人BSEP(浓度1∶250),过夜孵育,次日用TBST清洗3次后加入生物素标记的二抗,37 ℃孵育30 min。TBST清洗3次,加入辣根过氧化物酶标记的链霉卵白素,37 ℃ 20 min,TBST清洗3次,加入显色剂(DAB)。水洗,复染,中性树脂封片。
1.4 统计学处理

2 结 果
2.1 两组患者一般资料及胎儿情况比较
两组孕妇年龄、孕次差异无统计学意义(P>0.05),而孕周、丙氨酸转移酶、总胆红素、胎盘重量差异具有统计学意义(P<0.01或P<0.05);同时,两组胎儿体重、Apgar评分及羊水粪染率差异均有统计学意义(P<0.01),见表2。

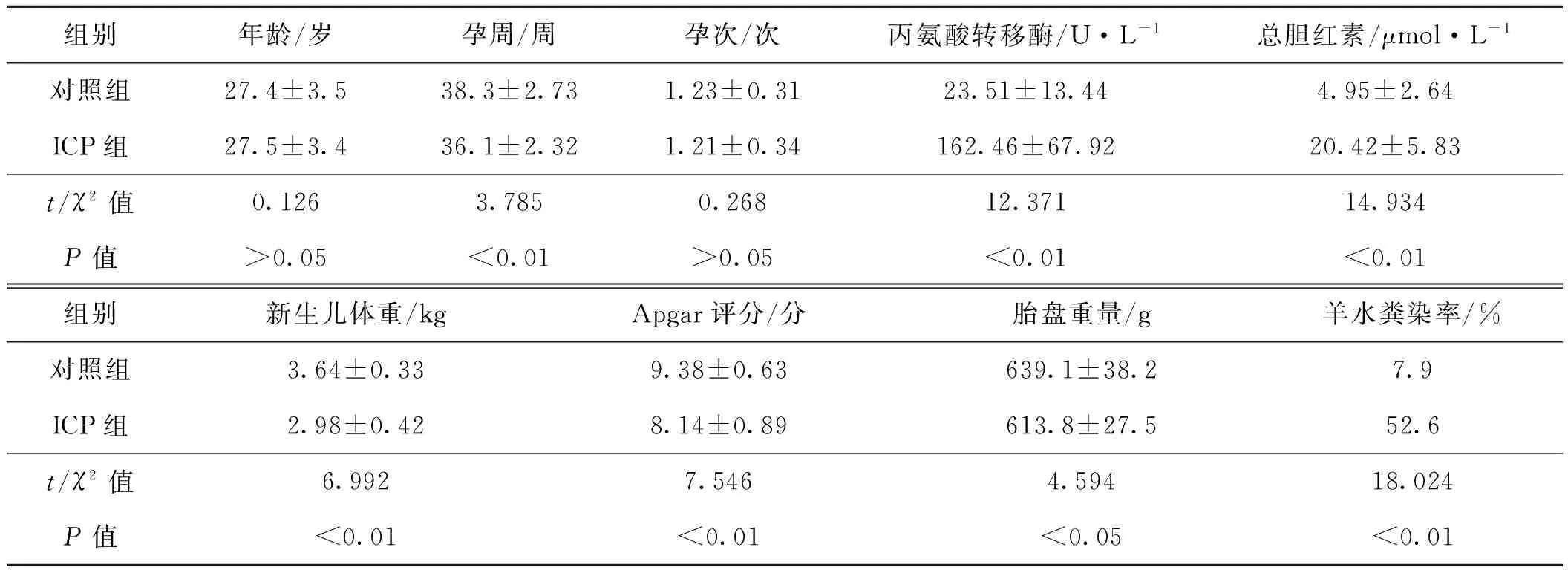
组别年龄/岁孕周/周孕次/次丙氨酸转移酶/U·L-1总胆红素/μmol·L-1对照组27.4±3.538.3±2.731.23±0.3123.51±13.444.95±2.64ICP组27.5±3.436.1±2.321.21±0.34162.46±67.9220.42±5.83t/χ2值0.1263.7850.26812.37114.934P值>0.05<0.01>0.05<0.01<0.01组别新生儿体重/kgApgar评分/分胎盘重量/g羊水粪染率/%对照组3.64±0.339.38±0.63639.1±38.27.9ICP组2.98±0.428.14±0.89613.8±27.552.6t/χ2值6.9927.5464.59418.024P值<0.01<0.01<0.05<0.01
2.2 两组外周血及脐带血甘氨胆酸分析
对照组孕妇外周血甘氨胆酸含量(2.81±1.23) mg·L-1,低于ICP组孕妇[(27.5±12.3) mg·L-1],差异具有统计学意义(t=4.343,P<0.01);对照组脐带血甘氨胆酸含量(5.54±1.73) mg·L-1,低于ICP组[(19.94±7.34) mg·L-1],差异具有统计学意义(t=5.324,P<0.01)。
2.3 两组FIC1、MDR3、BSEP基因mRNA表达水平
ICP组的FIC1、MDR3基因mRNA为弱表达,且表达水平低于对照组,差异具有统计学意义(P<0.01);两组BSEP基因mRNA表达水平差异无统计学意义(P>0.05),见图1。
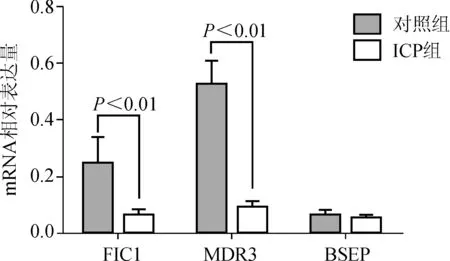
图1 两组间FIC1、MDR3、BSEP基因mRNA表达水平比较
2.4 免疫印迹
两组在140 kDa(MDR3)、160 kDa(BSEP)、34 kDa(FIC1)均可见明显条带,其中对照组在140 kDa及34 kDa条带处颜色明显深于ICP组,经灰度分析可知,两者差异存在统计学意义(P<0.05);此外,两组160 kDa条带颜色相近,灰度分析下两组差异无统计学意义(P>0.05),见图2。

1、2泳道为对照组,3、4泳道为ICP组
图2 蛋白质免疫印迹
2.5 免疫组化结果
MDR3蛋白和BESP蛋白在对照组与ICP组中定位及分布无明显差异,均匀分布于具有微绒毛的滋养层细胞膜上,但两组蛋白在对照组中呈现颜色较ICP组深,见图3。
3 讨 论
ICP是临床妊娠晚期较常见的一种肝脏功能损伤性疾病,其临床表现为黄疸、皮肤瘙痒等症状,且常伴随部分肝功能生化指标,如丙氨酸转移酶、总胆红素、甘氨胆酸等轻中度升高。目前,ICP全球发病率约0.8%~12%[6],而我国上海、四川等地是该病高发区域之一。由于ICP可对胎儿预后造成多种不良影响,因此,早期诊断及干预显得尤为重要,而母胎间胆汁酸转运异常及胆汁酸毒性作为该病的直接原因,或许可为进一步研究该病发病机制提供理论基础。
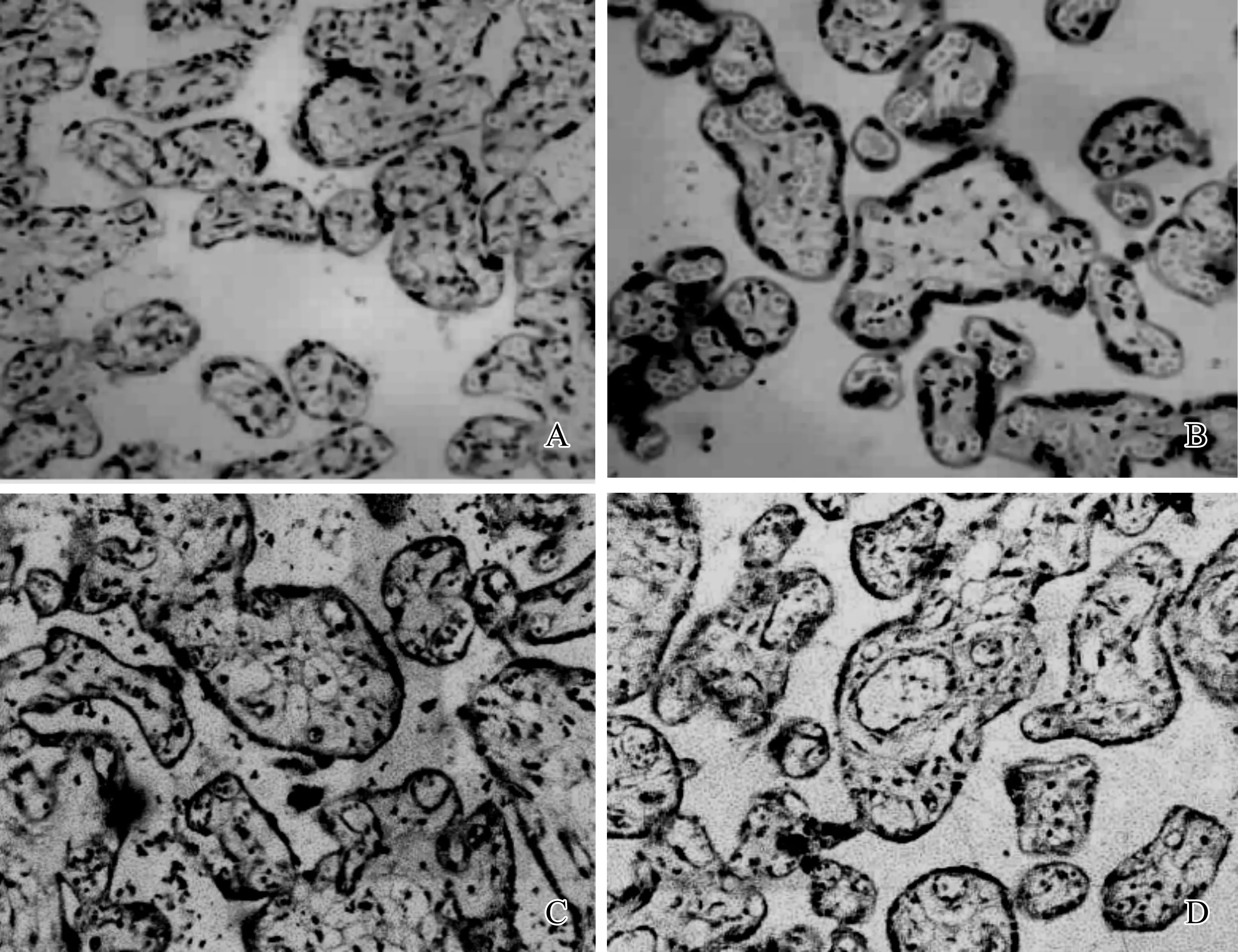
A.对照组胎盘组织中MDR3蛋白表达; B.ICP组胎盘中MDR3蛋白表达; C.对照组胎盘组织中BSEP蛋白表达; D.ICP组胎盘中BSEP蛋白表达
图3 不同蛋白在胎盘中表达情况 ×400
3.1 胆汁酸的作用机制及其对胎儿预后的影响
研究显示,妊娠中晚期时,由于胎儿及母体胆汁酸浓度差的存在,使得胎儿产生的胆汁酸可经胎盘ATP依赖的转运蛋白及ATP非依赖的胆汁酸排泌系统转运至母体,并最终排泄出体外[7]。然而,当ICP发生时,母体出现胆汁酸代谢异常及胆汁酸淤积,使得胎盘两侧胆汁酸浓度差消失,甚至逆转,进而造成胎儿体内胆汁酸淤积。而本研究证实,ICP患者其母体外周血及脐带血中甘氨胆酸含量均显著高于对照组,与之前报道[8]相符合。而从孕周、胎儿体重、Apgar评分、羊水粪染率可知,ICP组胎儿预后较对照组差。研究显示,妊娠晚期孕周差异对胎儿体重影响较大,而对于Apgar评分及胎儿预后的影响较小[9],本研究主要观察母体中3个转运蛋白对胆汁酸排泌的影响,因此孕周差异并未对本研究造成影响。胆汁酸作为胎粪的重要成分之一,其含量的增加必然会导致发生羊水粪染几率增加[10]。此外,高浓度胆汁酸还可引起线粒体膜的破坏,生成氧自由基,减少胎儿对氧的利用度,引发胎儿窘迫等症状发生。而胎儿窘迫发生时,机体血流将主要供应心、脑、肾等重要脏器,肠道等次要部位血流减少,肛门括约肌松弛并排出大量胎粪,加剧羊水污染,进而形成恶性循环[11]。由此可知,ICP患者胆汁酸淤积是造成胎儿预后不良的重要诱因。然而,鉴于胎盘存在多种胆汁酸转运途径,因此通过分子水平的研究将有助于我们进一步确认其致病机制,并探索更有效的治疗措施。
3.2 转运蛋白对胆汁酸排泌的影响
近年来,通过对转运蛋白的研究发现,FIC1、MDR3、BSEP可能与胆汁酸排泌具有一定相关性。这3类蛋白主要分布于毛细胆管膜中,其中FIC1是一种P型ATP酶,具有氨基磷脂或磷脂载体内向转移酶的作用,并有利于维持毛细胆管膜脂质不对称分布[12]。MDR3是磷脂载体,具有转运磷脂及排泌毒性药物作用[13]。BSEP蛋白是胆汁酸转运的主要载体。而本研究证实,ICP组MDR3、FIC1基因mRNA表达水平显著低于对照组,且MDR3蛋白表达水平低于对照组。以往研究[14]发现,MDR3基因突变会导致患者肝脏组织中蛋白量减少,从而引起胆汁中磷脂水平下降,游离胆汁酸增多,加重肝细胞损伤。而胎盘合体滋养层细胞与肝细胞具有相似结构,且具有相应的载体蛋白,因此低水平MDR3可能导致胎盘合体滋养层细胞同样受到胆汁酸损伤,从而无法起到有效传递物质及排毒作用。而对于FIC1蛋白,研究[15]发现,其蛋白含量减少将会引起胎盘合体滋养层细胞膜稳定性降低,进而影响ATP依赖胆汁酸载体含量。正如前人研究[16]所知:高胆汁酸环境中,胎盘合体滋养层细胞中可参与物质交换的微绒毛数量减少或功能减弱,甚至还可出现细胞膜破裂、溶解等现象,从而对各种载体蛋白功能产生影响。此外,作为肝脏中主要胆汁酸载体蛋白,BSEP蛋白在胎盘组织中的作用则并不显著,正如本研究所示,ICP组及对照组的BSEP mRNA水平及蛋白水平差异均无统计学意义。而当母儿血液中胆汁酸水平均增高情况下,BSEP仍处于低表达,其进一步提示,胎盘中胆汁酸可能未涉及BSEP蛋白,且胎盘中可能存在其他转运载体。因此,对于妊娠期肝内胆汁淤积症发生机制仍需进一步研究。
综上所述,研究3种可影响胆汁酸代谢的基因在ICP胎盘中的表达情况,将有助于我们进一步了解影响胆汁酸排泌的相关因素,也有利于提高ICP不良妊娠结局的诊断,为疾病治疗提供新的思路。
[1] 陈友英,陈宣伊,梁国强.茵陈加味汤联合熊去氧胆酸治疗妊娠肝内胆汁淤积症62例[J].东南大学学报:医学版,2014,33(2):159- 161.
[2] 贺晶,陈璐,梁琤.妊娠期肝内胆汁淤积症发生死胎的临床因素分析[J].中华妇产科杂志,2011,46(5):333- 337.
[3] DAVIT- SPRAUL A,GONZALES E,JACQUEMIN E.NR1H4 analysis in patients with progressive familial intrahepatic cholestasis,drug- induced cholestasis or intrahepatic cholestasis of pregnancy unrelated to ATP8B1,ABCB11 and ABCB4 mutations[J].Clin Res Hepatol Gastroenterol,2012,36(6):569- 573.
[4] ABU- HAYYEH S,PAPACLEOVOULOU G,LÖVGREN- SANDBLOM A,et al.Intrahepatic cholestasis of pregnancy levels of sulfated progesterone metabolites inhibit farnesoid X receptor resulting in a cholestatic phenotype[J].Hepatology,2013,57(2):716- 726.
[5] 贺晶,刘兴会,漆洪波.2011年中华医学会妇产科学分会妊娠期肝内胆汁淤积症诊疗指南[J].中国医学前沿杂志:电子版,2013,5(7):34- 40.
[6] ANZIVINO C,ODOARDI M R,MESCHIARI E,et al.ABCB4 and ABCB11 mutations in intrahepatic cholestasis of pregnancy in an Italian population[J].Dig Liver Dis,2013,45(3):226- 232.
[7] 李常晓,王朝霞.婴儿肝内胆汁淤积易感基因的研究进展[J].临床肝胆病杂志,2011,27(7):694- 699.
[8] 张雅琴,沈玲珑.餐后2小时血清甘胆酸测定对妊娠期肝内胆汁淤积症的早期诊断意义[J].中华全科医学,2015,13(4):636- 637.
[9] 傅江行,方海娅.妊娠合并甲状腺功能减低对妊娠结局及胎儿的影响研究[J].中国现代医学杂志,2014,24(8):98- 100.
[10] 张丽娟,张凤华,汤丽丽,等.妊娠期肝内胆汁淤积症与胎儿损伤[J].中南大学学报:医学版,2013,38(6):645- 652.
[11] 陈丽莎,陈萦晅.胆汁淤积的发病机制和诊治现状[J].胃肠病学,2012,17(7):385- 388.
[12] GEENES V,LÖVGREN- SANDBLOM A,BENTHIN L,et al.The reversed feto- maternal bile acid gradient in intrahepatic cholestasis of pregnancy is corrected by ursodeoxycholic acid[J].PloS One,2014,9(1):e83828.
[13] YANG X F,LIU G S,LI M X.Analysis of mutations of MDR3 exons 9 and 23 in infants with parenteral nutrition- associated cholestasis[J].Exp Ther Med,2015,10(6):2361- 2365.
[14] 陈新萍,张智,刘丝荪.胎盘ABCB4表达下调对胆汁酸排泌功能的负性调节作用及其对围生儿预后的影响[J].中国病理生理杂志,2011,27(5):1012- 1015.
[15] GEENES V,WILLIAMSON C.Liver disease in pregnancy[J].Best Pract Res Clin Obstet Gynaecol,2015,29(5):612- 624.
[16] 舒赛男,骆冉.进行性家族性肝内胆汁淤积症诊治及研究进展[J].中国实用儿科杂志,2013,28(4):300- 304.
2016- 03- 25
2016- 07- 19
曾慧(1979-),女,四川崇州人,主治医师。E- mail:2893648540@qq.com
曾慧.胎盘中转运蛋白表达水平对胆汁酸排泌的影响[J].东南大学学报:医学版,2016,35(6):913- 917.
R714.225
A
1671- 6264(2016)06- 0913- 05
10.3969/j.issn.1671- 6264.2016.06.017
——以咸阳市屯庄水库为例

