负载型磷钼钒杂多酸催化果糖一锅法制备2,5-二甲酰基呋喃
赵树伟,杨真真,齐崴,苏荣欣,何志敏
负载型磷钼钒杂多酸催化果糖一锅法制备2,5-二甲酰基呋喃
赵树伟1,杨真真1,齐崴1,2,3,苏荣欣1,2,3,何志敏1,2
(1天津大学化工学院化学工程研究所;2化学工程联合国家重点实验室(天津大学);3天津市膜科学与海水淡化技术重点实验室,天津300072)
首先制备了兼具酸性和催化醇氧化活性的Keggin型杂多酸H4PMo11VO40,为使其可以重复利用,又制备了孔道均匀、比表面积大的介孔二氧化硅作为载体,并将H4PMo11VO40固载在二氧化硅上作为催化剂,实现了在外加氧气条件下,一锅法催化果糖经脱水和氧化制备2,5-二甲酰基呋喃(2,5-DFF)。对杂多酸及载体进行了一系列表征,通过优化反应过程得到了最佳反应条件:在120℃下,DMSO作为溶剂,催化剂、果糖与DMSO质量比为1∶10∶100,反应时间4h,前1h通入N2,体系生成5-HMF并防止了果糖的直接氧化,后3h通入O2,催化氧化5-HMF生成2,5-DFF,所得2,5-DFF的最高收率为48.4%。催化剂的重复利用实验表明:使用5次后再次负载仍可保持较高的催化活性。
磷钼钒杂多酸;生物质;催化;果糖;2,5-二甲酰基呋喃
随着石油等化石能源的消耗,环境污染的日益严重,开发利用储量丰富、可再生的生物质资源已成为研究热点。在生物质资源中,所占比例最大的碳水化合物对于生产大宗化学品、能源替代品具有重要意义[1-4]。5-羟甲基糠醛(5-HMF)是生物质资源综合利用过程中的重要中间体[5-6],经氧化可得到高附加值产品2,5-二甲酰基呋喃(2,5-DFF)、可用于生产医药[7]、灭菌剂[8]、杂环配体[8]等多种化学品,并在有机合成工业中具有潜在用途[9]。因此由生物质资源合成2,5-DFF具有重要意义。
已报道的2,5-DFF合成方法大多从5-HMF氧化得到,一系列传统的氧化剂如氯铬酸吡啶(PCC)[10]、NaOCl[11]、四甲基哌啶氮氧化物(TEMPO)[12]等都可以氧化5-HMF得到中等收率的2,5-DFF。为了使工艺更加绿色,出现了以空气或者氧气作为氧化剂的催化剂,如VOPO4·2H2O[13]、V2O5[14]、Cu(NO3)/VOSO4[15]、含V聚合物[16]、金属/溴(Co/Mo/Br)催化剂[17]、金属Ru固载在水滑石/碳上的催化剂[18-19]、OMS-2分子筛[20-21]、TEMPO/Cu[22]、三金属氧化物RuCo(OH)2CeO2[23]、聚乙烯吡咯烷酮固载Pd的纳米粒子[24]等。然而,由于5-HMF在生产过程中分离和纯化成本高,导致由5-HMF氧化生产2,5-DFF的工艺路线不经济。因此,由储量丰富且廉价易得的果糖直接制备2,5-DDF成为发展的趋势。目前,已报道的催化果糖制备2,5-DFF的反应一般是两步法:首先采用酸性催化剂催化果糖脱水生成5-HMF,再由氧化催化剂氧化5-HMF得到2,5-DFF,例如,氢离子交换树脂和V2O5[14]、Amberlyst–15和水滑石固载的Ru催化剂[18]、Fe3O4-SBA-SO3H和K-OMS-2[20]等组合。在两步法中,酸催化剂和氧化催化剂分步加入体系中,催化剂分离操作复杂,降低了果糖制备2,5-DEF的实际应用价值[18,20]。
针对上述问题,本文合成了Keggin结构的磷钼钒杂多酸(H4PMo11VO40)双功能催化剂,H4PMo11VO40既具有强Bronsted酸性,电离出的H+可催化果糖脱水生成5-HMF,同时又具有V的催化活性,在有氧条件下可催化5-HMF生成2,5-DFF。进一步,为达到催化剂回用的目的,将杂多酸负载在介孔二氧化硅上,制得H4PMo11VO40/SiO2。基于催化剂的酸性和催化氧化性质,可用于一锅法由果糖制备2,5-DFF(图1)。
1 实验部分
1.1 试剂与仪器
试剂:钼酸钠(纯度>99.0%),十六烷基三甲基溴化铵(纯度>95.0%),偏钒酸钠(纯度>99%),购于天津希恩思生化科技有限公司;乙醚(纯度>95.0%),购于天津市元立化工有限公司;十二水和磷酸氢二钠(纯度>99.0%),购于天津市化学试剂一厂;正硅酸乙酯(纯度>98.0%),氨水(NH3含量25%~28%),购于天津市科密欧化学试剂有限公司;二甲基亚砜(纯度>99.8%),购于天津市康科德科技有限公司;D-果糖(纯度>99%),购于阿拉丁科技有限公司。
仪器:电子天平(精度为0.1mg),Sartotius BT125D型,瑞士;离心机,TGL–16C型,上海安亭科学仪器厂;恒温磁力搅拌器,90–1型,上海泸西分析仪器厂;马弗炉,FURNACE 13000,天津市中环实验电炉有限公司;真空干燥箱,上海一恒科学仪器有限公司;Synthware反应器,北京欣维尔有限公司;超声波清洗器,KQ-250E型,昆山市超声仪器有限公司;通气玻璃反应器,天津大学玻璃仪器中心。
1.2 磷钼钒杂多酸H4PMo11VO40的制备
13.32g(0.055mol)钼酸钠和1.76g(0.005mol)十二水合磷酸氢二钠溶于50mL去离子水中,加热至沸腾,反应30min,作为溶液A。0.732g(0.006mol)偏钒酸钠(过量)溶于6mL去离子水中,配成溶液B。将溶液B缓缓加入溶液A,90℃条件下反应30min后冷却至室温,得到溶液C。在搅拌条件下向溶液C中滴加65%的硫酸溶液,调节其pH至1.90~2.00,溶液C由无色变为红色油状,继续搅拌待溶液冷却至室温后将其加入30mL乙醚中,充分振荡,使杂多酸完全形成醚化物,此时溶液分为两层,再继续加入65%硫酸溶液少许,振荡静置后溶液分为三层。上层为溶解有少量杂多酸的乙醚,将其分离回收乙醚;中间层是含有少量杂多酸的盐溶液层;下层鲜红色油状物为杂多酸醚化物,取下层油状物,用氮气吹除乙醚,加入少量去离子水,置于冰箱(0~5℃)结晶,干燥可得红色杂多酸 粉末。
1.3 介孔二氧化硅的制备
将0.56g(0.00154mol)十六烷基三甲基溴化铵(CTAB)溶解于200mL去离子水中,超声10min使其充分溶解,向该溶液中加入6mL氨水,磁力搅拌0.5h,待体系稳定后,在40℃水浴并且剧烈搅拌的条件下逐滴加入3mL正硅酸乙酯,继续在该温度下搅拌反应4h,待反应结束,离心收集所得样品(离心8000r/min,5min),分别用无水乙醇和水洗涤2遍,所得样品在90℃真空干燥箱中干燥过夜。最后将干燥的样品放入马弗炉中,以5℃/min的升温速率升至600℃,煅烧6h,烧去表面活性剂CTAB,得到介孔二氧化硅纳米材料。
1.4 催化剂的固载及活化
采用等体积浸渍法,1.5g H4PMo11VO40溶解在去离子水中,浸渍在5g介孔二氧化硅中,室温下浸渍24h,干燥温度为80℃,8h。催化剂使用前在马弗炉中200℃条件下活化6h。
1.5 催化剂及载体的表征
使用日本RIGAKU公司的D/MAX-RB型X射线衍射仪进行分析,条件为Cu靶 Kα辐射,波长=0.15406nm,100mA,40kV扫描速率5°/min,扫描范围(2)5°~50°;使用Varian公司的电感耦合等离子体原子发射光谱法(ICP-AES)进行元素分析;使用美国Nicolet公司560E.S.P型傅里叶变换红外光谱仪(FTIR)测定红外光谱,扫描分辨率4cm–1,扫描次数20,扫描范围4000~400cm–1;使用日本日立公司S-4800扫描电镜(SEM)表征形貌,加速电压为3.0kV,样品用E1045镀膜机(15mA,60s)镀金属铂;使用日本电子株式会社JEOL 1200EX透射电子显微镜(TEM)表征形貌,加速电压为80kV;使用美国Quantachrome公司的Nova 2200e比表面分析仪测试氮气物理吸附/脱附曲线;使用美国Micromeritics 公司的AutoChem 2920型全自动化学吸附仪进行NH3-TPD分析。
1.6 果糖氧化反应及样品分析
向30mL的synthware玻璃反应器中加入DMSO、果糖、H4PMo11VO40/SiO2催化剂、磁力转子,一定温度下反应。反应结束后,将反应产物用水稀释至50mL,取液体样品待测,收集催化剂,水洗3次,干燥后重复使用多次。反应需要通入气体时,采用可通气的玻璃反应器,不带压操作,流速均为10mL/min。
果糖(Fructose)、5-羟甲基糠醛(5-HMF)、2,5-二甲酰基呋喃(DFF)、呋喃-2,5-二羧酸(FDCA)的浓度采用Agilent公司的1200Series高效液相色谱仪测定;HPX-87H(300mm×7.8mm)色谱柱,美国Bio-Rad公司,柱温箱温度为65℃;示差折光检测器,日本SHODEX公司。流动相:0.005mol/L H2SO4,流速:0.6mL/min,进样量:20μL。进样前样品需用0.45μm微滤膜过滤。
反应物转化率(摩尔分数)和产品收率(摩尔分数)的计算公式为式(1)、式(2)。

(2)
2 实验结果与讨论
2.1 磷钼钒杂多酸H4PMo11VO40的结构分析
2.1.1 磷钼钒杂多酸H4PMo11VO40的FTIR表征
图2所示为磷钼钒杂多酸的红外光谱图。由图2可见,磷钼钒杂多酸在1100~700cm–1出现了4个Keggin结构的特征峰。其中1062.60cm–1为P—O键的伸缩振动频率;962.32cm–1为Mo—O键的伸缩振动频率;867.82cm–1为Mo—O—Mo键桥键的伸缩振动频率(不同组MoO6八面体的氧桥);781.04cm–1为Mo—O—Mo键桥键的伸缩振动频率(同组MoO6八面体的氧桥);1623.80cm–1为附近水分子中H—O—H的弯曲振动频率[25]。
2.1.2 磷钼钒杂多酸H4PMo11VO40的XRD表征
图3所示为磷钼钒杂多酸的X射线衍射图。X粉末射线衍射可以表征杂多酸的二级结构或三级结构,衍射线出现的位置决定于晶体的点阵结构,而衍射强度决定于晶胞中原子的位置。图3中2为7°~10°,16°~22°,25°~30°的位置出现了Keggin结构的特征吸收峰[25]。
2.1.3 磷钼钒杂多酸H4PMo11VO40的ICP表征
对P、Mo、V三种元素进行了ICP分析,为了得到相对准确的结果,配制P、Mo、V三种元素标样的浓度分别为4mg/L、130mg/L、6mg/L,测试重复3次。由表1可知,磷钼钒杂多酸中P、Mo、V的摩尔比约为1∶11∶1,符合分子式H4PMo11VO40。
2.1.4 磷钼钒杂多酸H4PMo11VO40的NH3-TPD 表征
酸性条件利于果糖到5-HMF的转化,由图4可以看出,H4PMo11VO40具有一个160℃时的弱酸峰和一个480℃时的强酸峰,计算得到催化剂的酸量为7.297mmol/g,催化剂的Bronsted酸性保证了5-HMF的顺利生成。
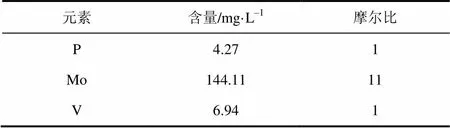
表1 ICP元素含量分析结果
注:数据测量3次取平均。
2.2 介孔二氧化硅及负载后催化剂的结构分析
2.2.1 介孔二氧化硅及负载后催化剂的形貌分析
图5为负载前后介孔二氧化硅的透射电镜图,从图5(a)、(b)中可以清晰看到二氧化硅中规则的介孔结构,为其成为优良的载体提供了必要条件。对比图5(c)、(d)和(a)、(b)可知,杂多酸成功地负载在二氧化硅的孔道里。图6为TEM能谱的元素分布图,可以看出主要元素分布均匀,说明负载情况良好。
a,b —未负载催化剂的介孔二氧化硅;c,d—负载催化剂的介孔二氧化硅
2.2.2 介孔二氧化硅及负载后催化剂的BET分析
氮气吸脱附等温线的实验温度为77K,在测试前,每份样品均在真空干燥箱中573K条件下脱气4h。比表面积由Brunauer-Emmett-Teller(BET)法计算;总孔容积(p)由相对压力为0.99左右时的氮气吸附量计算;孔径分布通过氮气脱附曲线采用Barrett-Joyner-Halenda(BJH)法估算。表2为BET及BJH测试结果。由结果可知,介孔二氧化硅比表面积很大,具有良好的负载条件;负载后比表面积明显减小,说明催化剂成功负载在介孔二氧化硅上。

表2 介孔二氧化硅负载杂多酸前后比表面积、孔容和孔径
2.3 反应条件的优化
图7为不同通气条件下固液比(果糖与DMSO溶剂的质量比)对2,5-DFF收率的影响图,反应体系为:4mL DMSO,果糖质量分别为DMSO质量的5%、10%、20%、30%,催化剂质量为果糖质量的10%,反应温度120℃,时间4h。由图7可知,随着固液比的增加,2,5-DFF收率越来越低,并且,通气条件a情况下2,5-DFF的收率相对于b情况优势越来越明显,反应结束后,b通气条件下的体系中有少量黑色腐殖质生成。分析原因:反应初期,反应物果糖在双功能催化剂以及氧气的同时存在下,一部分脱水生成5-HMF,一部分被氧化为副产物;而在通气条件a时,果糖先在氮气保护下完全生成5-HMF,后通入氧气进行5-HMF到2,5-DFF的氧化反应。
a—先通1h氮气,再通3h氧气;b—通4h氧气
图8的反应体系为:10mLDMSO,10%质量分数的果糖,催化剂质量为果糖质量的10%,反应时间4h。通气条件:1h氮气,3h氧气。反应第一步果糖脱水生成5-HMF为吸热反应,随着反应温度的增加,反应物分子有效碰撞次数增加,有利于反应进行,但是温度高于130℃后,2,5-DFF收率下降,推断可能的原因是高温下反应剧烈,不可避免地生成了少量腐殖质,覆盖在催化剂表面,使催化剂活性降低,不利于2,5-DFF的生成,所以其收率随温度呈先上升后下降的趋势,该体系下最佳反应温度为120℃。
图9的反应体系,通气条件均同图8,由图9可知:在第1h氮气的保护下,体系生成了大量的5-HMF,随着体系内通入氧气,5-HMF被氧化为2,5-DFF,第4h,5-HMF已经完全反应,2,5-DFF的收率也达到最大值48.4%。在酸性体系中2,5-DFF不易被氧化为下一步的氧化产物FDCA,随着反应时间进行,2,5-DFF有少量损失。该体系下最佳反应时间为4h。
表3为H4PMo11VO40与文献中同一反应的催化剂活性对比,由表中可知,在一锅法由果糖生成2,5-DFF的反应中,H4PMo11VO40具有收率更高的优势,虽然在分步法的反应中,文献收率可以达到71.1%,但其需要两种催化剂,且反应不连续,操作相对复杂,生产成本较高,相比而言,本文制备的催化剂在实际生产中具有特色和优势。

表3 一锅法由果糖生成2,5-DFF收率与文献对比
2.4 催化剂的重复利用性
在2,5-DFF达到48.4%最高收率时所对应的最适反应条件下,对H4PMo11VO40/SiO2的重复利用性进行测试,结果如图10。催化剂活性随重复利用次数增加而降低,在第五次反应时,2,5-DFF收率降至40%以下,这是由于浸渍在介孔二氧化硅中的H4PMo11VO40流失所致,再次使用浸渍法使催化剂再生,可将收率恢复至48%左右。
3 结论
(1)FTIR图谱、XRD图谱和ICP元素分析均证明:成功制备了杂多酸H4PMo11VO40;TEM图和BET、BJH分析结果表明:合成了比表面积大,孔道均匀的介孔二氧化硅。
(2)杂多酸负载在二氧化硅上的TEM图和元素分布图证明:H4PMo11VO40均匀地负载在介孔二氧化硅上。
(3)H4PMo11VO40/SiO2催化剂既具有强Bronsted酸性,可催化果糖脱水生成5-HMF,又具有V的催化活性,催化5-HMF氧化生成2,5-DFF。因此可以一锅法催化果糖得到2,5-DFF,在最佳反应条件下,2,5-DFF的最高收率为48.4%,比传统的两步法简便,且用氧气作为氧化剂更为经济。
[1] GALLEZOT P. Conversion of biomass to selected chemical products[J].Chemical Society Reviews,2012,41(4):1538-1558.
[2] CORMA A,IBORRA S,VELTY A.Chemical routes for the transformation of biomass into chemicals[J].Chemical Reviews,2007,107(6):2411-2502.
[3] HUBER G W,IBORRA S,CORMA A.Synthesis of transportation fuels from biomass: chemistry,catalysts,and engineering[J].Chemical Reviews,2006,106(9):4044-4098.
[4] CHENG Y,WANG Z,GILBERT C J,et al.Production of-xylene from biomass by catalytic fast pyrolysis using ZSM-5 catalysts with reduced pore openings[J].Angewandte Chemie,2012,124(44):11259-11262.
[5] 姜楠,齐崴,黄仁亮,等.生物质制备5-羟甲基糠醛的研究进展[J].化工进展,2011,30(9):1937-1945.
JIANG N,QI W,HUANG R L,et al. Research progress of synthesis of 5-hydroxy methylfurfural from biomass[J]. Chemical Industry and Engineering Progress,2011,30(9):1937-1945.
[6] ROSATELLA A A,SIMEONOV S P,FRADE R F M,et al.5-Hydroxymethylfurfural (HMF) as a building block platform: biological properties,synthesis and synthetic applications[J].Green Chemistry,2011,13(4):754-793.
[7] HOPKINS K T,WILSON W D,BENDER B C,et al.Extended aromatic furan amidino derivatives as anti-pneumocystis carinii agents[J].Journal of Medicinal Chemistry,1998,41(20):3872-3878.
[8] DEL P M,SCHELL W A,Dykstra C C,et al.Structureactivity relationships of pentamidine analogues and dication-substituted bis-benzimidazoles as new antifungal agents[J].Antimicrobial Agents and Chemotherapy,1998,42(10):2495-2502.
[9] AMARASEKARA A S,GREEN D,WILLIAMS L D.Renewable resources based polymers: synthesis and characterization of 2,5-Diformylfuran-urea resin[J].European Polymer Journal,2009,45(2):595-598.
[10] COTTIER L,DESCOTES G,LEWKOWSKI J,et al.Oxidation of 5-Hyderoxymethylfural under sonochemical conditions[J].Polish Journal of Chemistry,1994,68(4):693-698.
[11] AMARASEKARA A S,GREEN D,MCMILLAN E.Efficient oxidation of 5-hydroxymethylfurfural to 2,5-diformylfuran using Mn(Ⅲ)-salen catalysts[J].Catalysis Communications,2008,9(2):286-288.
[12] COTTIER L,DESCOTES G,LEWKOWSKI J,et al.Oxidational of 5-hyderoxymethylfural and derivatives to furanaldehydes with 2,2,6,6-tetramethylpeperidine oxide radical cooxidant paris[J].Journal of Heterocyclic Chemistry,1995,32(3):927-930.
[13] CARLINI C,PATRONO P,GALLETTI A M R,et al.Selective oxidation of 5-hydroxymethyl-2-furaldehyde to furan-2,5-dicarboxaldehyde by catalytic systems based on vanadyl phosphate[J].Applied Catalysis A:General,2005,289(2):197-204.
[14] HALLIDAY G A,YOUNG R J,GRUSHIN V V.One-pot,two-step,practical catalytic synthesis of 2,5-diformylfuran from fructose[J].Organic Letters,2003,5(11):2003-2005.
[15] MA J P,DU Z T,XU J,et al.Efficient aerobic oxidation of 5-hydroxymethylfurfural to 2,5-diformylfuran,and synthesis of a fluorescent material[J].ChemSusChem,2011,4(1):51-54.
[16] NAVARRO O C,CANOS A C,CHORNET S I.Chemicals from biomass: aerobic oxidation of 5-hydroxymethyl-2-furaldehyde into diformylfurane catalyzed by immobilized vanadyl-pyridine complexes on polymeric and organofunctionalized mesoporous supports[J].Topics in Catalysis,2009,52(3):304-314.
[17] PARTENHEIMER W,GRUSHIN VLADIMIR V.Synthesis of 2,5-diformylfuran and furan-2,5-dicarboxylic acid by catalytic air-oxidation of 5-hydroxymethylfurfural. Unexpectedly selective aerobic oxidation of benzyl alcohol to benzaldehyde with metal=bromide catalysts[J].Advanced Synthesis & Catalysis,2001,343(1):102-111.
[18] TAKAGAKI A,TAKAHASHI M,NISHIMURA S,et al.One-pot synthesis of 2,5-diformylfuran from carbohydrate derivatives by sulfonated resin and hydrotalcite-supported ruthenium catalysts[J].ACS Catalysis,2011,1(11):1562-1565.
[19] NIE J F,XIE J H,LIU H C.Efficient aerobic oxidation of 5-hydroxymethylfurfural to 2,5-diformylfuran on supported Ru catalysts[J].Journal of Catalysis,2013,301:83-91.
[20] YANG Z Z,DENG J,PAN T,et al.A one-pot approach for conversion of fructose to 2,5-diformylfuran by combination of Fe3O4-SBA-SO3H and K-OMS-2[J].Green Chemistry,2012,14(11):2986-2989.
[21] YADAV G D,SHARMA R V.Biomass derived chemicals:environmentally benign process for oxidation of 5-hydroxymethylfurfural to 2,5-diformylfuran by using nano-fibrous Ag-OMS-2-catalyst[J].Applied Catalysis B-Environmental,2014,147:293-301.
[22] HANSEN T S,SADABA I,GARCIA-SUAREZ E J,et al.Cu catalyzed oxidation of 5-hydroxymethylfurfural to 2,5-diformylfuran and 2,5-furandicarboxylic acid under benign reaction conditions[J].Applied Catalysis A:General,2013,456:44-50.
[23] WANG Y M,LIU B,HUANG K C,et al.Aerobic oxidation of biomass-derived 5-(hydroxymethyl)furfural into 2,5-diformylfuran catalyzed by the trimetallic mixed oxide (Co-Ce-Ru)[J].Industrial & Engineering Chemistry Research,2014,53(4):1313–1319.
[24] SIYO B,SCHNEIDER M,POHL M M,et al.Synthesis,characterization,and application of PVP-Pd NP in the aerobic oxidation of 5-hydroxymethylfurfural (HMF)[J].Catalysis Letters,2014,144(3):498-506.
[25] 王大全. 固体酸与精细化工[M]. 北京:化学工业出版社,2006:210-223.
WANG D Q. Solid acid and fine chemical industry[M]. Bejing:Chemical Industry Press,2006:210-223.
[26] GHEZALI W,DE OLIVEIRA ViGIER K,KESSAS R,et al.A choline chloride/DMSO solvent for the direct synthesis of diformylfuran from carbohydrates in the presence of heteropolyacids[J].Green Chemistry.,2015,17(8):4459-4464.
One-pot synthesis of 2,5-diformylfuran from fructose by PMoV-HPAs catalyst supported on silica
ZHAO Shuwei1,YANG Zhenzhen1,QI Wei1,2,3,SU Rongxin1,2,3,HE Zhimin1,2
(1Chemical Engineering Research Center,School of Chemical Engineering and Technology,Tianijn University;2State Key Laboratory of Chemical Engineering,Tianjin University;3Tianjin Key Laboratory of Membrane Science and Desalination Technology,Tianjin 300072,China)
A Kegin structure molybdovanadophosphoric heteropolyacids(PMoV-HPAs)was developed and used as the catalyst for one-pot synthesis of 2,5-diformyfuran(2,5-DFF)from fructose with oxygen as the oxidant under environmentally benign conditions. Mesoporous silica was prepared to be the carrier. The TEM mapping and other characterizations showed that the PMoV-HPAs was successfully supported on mesoporous silica. With DMSO as the solvent,the optimal reaction temperature was 120℃ and the best mass ratio of catalyst/fructose/DMSO was 1∶10∶100. In order to prevent the oxidation of fructose in the initial stage,the first one hour of the reaction was protected by nitrogen under atmospheric pressure,and the acidic site(H)offered by the PMoV-HPAs promoted the dehydration of fructose to 5-hydroxymethylfurfural(5-HMF). During the next three hours,the metallic site(V)catalyzed the aerobic oxidation of 5-HMF to 2,5-DFF under atmospheric pressure of oxygen and finally a maximum yield of 48.4% for 2,5-DFF was achieved. In addition,H4PMo11VO/SiO2could be reusable after 5 cycles without significant loss of activity,and it can achieve the best activity after impregnated again.
molybdovanadophosphoric heteropolyacids;biomass;catalysis;fructose;2,5-diformyfuran
TQ032.4
A
1000–6613(2017)01–0189–07
10.16085/j.issn.1000-6613.2017.01.024
2016-04-08;修改稿日期:2016-05-27。
天津市自然科学基金(16JCYBJC19600)及北洋青年学者计划(2012)项目。
赵树伟(1989—)男,硕士研究生。E-mail:2013207116@tju.edu.cn。联系人:齐崴,教授,从事生物基化学品领域的研究。E-mail:qiwei@tju.edu.cn。

