不同丙氨酸氮比率对中肋骨条藻生理生化的影响
黄仲文,曾德智,刘文华,李平
(1.汕头大学理学院海洋生物研究所,广东汕头,515063;2.中国科学院城市环境研究所,福建厦门,361021)
不同丙氨酸氮比率对中肋骨条藻生理生化的影响
黄仲文1,2,曾德智1,刘文华1,李平1
(1.汕头大学理学院海洋生物研究所,广东汕头,515063;2.中国科学院城市环境研究所,福建厦门,361021)
本文以不同丙氨酸氮比率(0%,25%,50%,75%和100%)人工海水培养基(ESAW)一次性培养中肋骨条藻(Skeletonema costatum),研究丙氨酸氮对其生理生化指标的影响.结果表明中肋骨条藻不能利用丙氨酸作为氮源进行生长.与对照组相比,高浓度丙氨酸(0.549 mmol/L)对中肋骨条藻有“刺激作用”,促使叶绿素a和最大光合效率均处于较高状态,胞内ROS含量上升,第9天中性脂肪增加了94%,藻细胞不能正常进入休眠状态.基于本实验结果推测,赤潮硅藻中肋骨条藻不能利用游离氨基酸作为氮源进行生长,而且藻细胞胞内代谢受到特定氨基酸(如丙氨酸)的影响,在无机氮耗竭的情况下不能进入休眠状态.本研究有助于了解游离氨基酸对赤潮硅藻生长及浮游植物群落演替的潜在影响,为赤潮防治提供理论依据.
中肋骨条藻;游离氨基酸;丙氨酸;刺激作用
0 引言
随着工业废水和生活污水的排放增加,以及农业化肥和农药的大量使用,近岸水体的有机氮污染不断加剧.早期观点认为溶解态无机氮是海洋浮游植物的主要氮源,但近期越来越多的研究表明浮游植物能够利用溶解态有机氮,并且尿素和游离氨基酸(DFAA)在沿海浮游植物总氮吸收的贡献度高达80%[1].游离氨基酸在海水中的浓度较低,其含量范围是0.001~0.70 μmol/L[2],但因其在海水中停留时间非常短[3],使它成为浮游植物的一种重要有机氮源.
海洋中不同的藻类利用氨基酸的能力各不相同.例如许多甲藻细胞表面含有氨基酸氧化酶,使其可以高效地利用游离氨基酸[4-7];硅藻利用氨基酸的能力则与地域及时间密切相关.Berg et al[8]研究波罗的海的里加海湾显示,春季硅藻的生物量与硝氮的吸收利用呈正相关,夏季硅藻与游离氨基酸的吸收利用呈负相关.但Wawrik et al[9]利用15N示踪技术研究了24种硅藻对无机氮和有机氮的利用情况,也没有发现其对标记氨基酸进行吸收利用的证据.对一些典型赤潮硅藻(包括中肋骨条藻)研究也表明其不能利用游离氨基酸进行生长[9-11],但也有研究显示某些典型硅藻在一定程度上能够利用甘氨酸[10,12]和丙氨酸、缬氨酸、丝氨酸、天冬氨酸、谷氨酸等多种氨基酸[13].
游离氨基酸除了作为浮游植物的氮源,可能还可以作为化学信号物质,对浮游植物产生影响.Amsler and Iken[14]汇总了对一些游离氨基酸有趋化效应的各种浮游植物.另外,海水游离氨基酸(DFAA)的一个重要来源是浮游植物的排泄(胞外分泌物),其组成和比例因浮游植物种类而有所差异[15],与生长状态也相关[16-18].释放至胞外的某些氨基酸不但可以反映浮游植物的生理状态,还可能作为一种胞外细菌的选择因子[19],甚至是使桡足类产生化学感应的信号分子[20-21]或原生生物摄食行为的抑制因子[22].另外,研究显示海水中最常见的游离氨基酸似乎是丝氨酸、甘氨酸和丙氨酸[19].夏清艳[23]对中国近海海域(南海、黄海、渤海和东海)的调查结果显示谷氨酸、甘氨酸、丝氨酸、丙氨酸和天门冬氨酸在游离氨基酸中占有较高比例.Amsler and Iken[14]总结的浮游植物的游离氨基酸趋化因子中,丙氨酸重现次数最多并在四个门类都出现.由此可见,丙氨酸对于大部分浮游植物是比较常见的趋化因子,并可能会影响藻细胞的生长状态和生理状态.
中肋骨条藻(Skeletonema costatum)是一种常见的浮游植物种类,广泛分布于世界各大洋,尤其是我国沿岸地区,既是引发赤潮的主要藻类,同时又是水产上的饵料生物,在海洋生态系统中起到极其重要的作用.随着各种人类活动的增加,排放到近岸的各种有机氮源(如氨基酸等)越来越多.这些氨基酸对海洋藻类的影响还有待深入研究.因此,本研究选用丙氨酸作为有机氮氮源,以ESAW人工海水培养基为基础,添加不同比例的丙氨酸和硝氮来培养中肋骨条藻,探讨中肋骨条藻是否能利用丙氨酸作为氮源进行生长,并研究其对高浓度丙氨酸氮的生理生化响应.
1 实验方法
1.1 藻种和培养方法
本实验所用藻种中肋骨条藻(Skeletonema costatum)由厦门大学近海海洋环境科学国家重点实验室提供.培养期间的温度为(20±1)℃,光照强度为140 photons·m-2·s-1,光照周期为12 h:12 h.培养液以ESAW人工海水培养基为基础,丙氨酸氮占总添加氮源的比率分别为0%,25%,50%,75%和100%(另添加相应的100%,75%,50%,25%和0%硝氮氮源),另设一个对照组(不添加氮源的处理组).为了抑制培养液中细菌的生长繁殖,添加了青霉素和链霉素终浓度为10 U mL-1和10 μg mL-1(碧云天,此使用浓度是Chung et al[24]文章的1/10).中肋骨条藻的接种浓度为5×104cells/mL,光照期间每隔2~3 h晃动并移动位置,使其光照均匀.
1.2 细胞密度
中肋骨条藻的细胞密度使用血球计数板或100 μL藻类计数框在显微镜下计数.比生长速率μ由以下公式计算[25]:
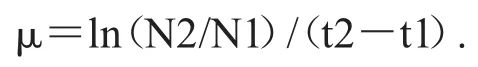
式中N1和N2分别是t1和t2时间对应的细胞密度.
1.3 叶绿素a
负压抽虑一定体积的藻液于Whatman GF/C(直径25 mm,孔径0.9 μm)玻璃纤维素滤膜,转移至离心管后加入90%丙酮并置于4℃冰箱过夜提取色素.提取液室温离心(5000 g,5 min)后取上清于DNA/蛋白分析仪(DU530,Beckman,USA)测定630 nm和664 nm的吸光度.叶绿素a浓度根据Jeffrey and Humphrey[26]公式:Chl a(μg mL-1)=11.47A664-0.40A630计算.
1.4 叶绿素荧光参数Fv/Fm
叶绿素荧光参数利用可调制式荧光仪Water-PAM(PAM-WATER-ED,Walz,Germany)进行测定.样品经过15 min暗适应后,检测初始荧光(F0)和最大荧光(Fm),并根据Kitajima和Butler(1975)的公式计算:
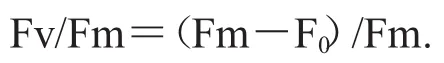
Fm:最大荧光,是在暗适应状态下,当PSII的所有反应中心处于完全关闭状态并且所有的非光化学过程处于最小时的荧光值;
F0:初始荧光,是在暗适应状态下,当PSII的所有反应中心处于完全开放状态并且所有的非光化学过程处于最小时的荧光值;
Fv:暗适应状态下,当所有的非光化学过程处于最小时的最大可变荧光,Fv=Fm-F0.
1.5 胞内ROS
使用2',7'-Dichlorofluorescein diacetate(DCFH-DA,Sigma,USA)荧光探针测定细胞内的ROS相对含量.DCFH-DA通过细胞质膜后和胞内的酯酶反应生成无荧光的DCFH,DCFH不能透过细胞膜并被细胞内的ROS氧化,生成能发出荧光的DCF.参考Eruslanov and Kusmartsev[27]的方法,将3 mL藻液离心(20℃,3000 g,10 min)去上清后加入3 mL培养液重悬,加入DCFH-DA探针,终浓度为5 μmol/L,37℃黑暗水浴30 min,离心(20℃,3000 g,10 min)后加入3 mL培养液重悬,使用荧光分光光度计(RF-5301)检测DCF的荧光强度(ex=504 nm,em=525 nm).
1.6 中性脂肪
尼罗红染液(Nile Red)被广泛应用于测定微藻的中性脂肪[28-29].本实验使用尼罗红(Sigma,USA)荧光探针测定胞内中性脂肪的相对含量.参考Liu et al[30]的方法,取4 mL混合均匀的藻液离心(20℃,3000 g,10 min)后加入培养基重悬,重悬后和尼罗红染液(0.10 mg/mL丙酮)按100/1的体积比混合,充分摇匀,于37℃黑暗水浴10 min后使用荧光分光光度计(RF-5301)检测Nile Red的荧光强度(ex=530 nm,em=575 nm).
1.7 统计分析
所有数据由三次实验重复得出,数值表示为平均值±SD(n=3).实验数据采用excel2010、Origin7.5统计软件进行数据处理及统计分析.采用单因素方差分析(One-Way ANOVA)检验差异的显著水平,设置显著水平α=0.05.
2 实验结果
2.1 不同丙氨酸氮比率对中肋骨条藻细胞生长的影响
丙氨酸氮比率对中肋骨条藻的生长密度具有显著性影响.随着丙氨酸氮比率的升高,细胞密度呈下降趋势,并在第7天达到最大细胞密度(图1).另外,100%丙氨酸氮比率藻细胞在第5天前的细胞密度都低于对照组;而对照组的藻细胞密度在第3天到达稳定期,并持续至第6天才出现明显下降,说明100%丙氨酸氮比率藻细胞在5天前生长受到抑制,整体生长速率小于没有添加氮源的对照组,推测藻细胞可能受到高浓度丙氨酸的抑制.100%丙氨酸氮比率和对照组的藻细胞从接种浓度5×104cells/mL分别生长至53、47×104cells/mL,说明接种的藻细胞内或接种的藻液中含有一定量的本底氮源供藻细胞生长.所有处理组的最大比生长速率平均值在1.31~1.56之间,且相互间无统计学意义上的显著差异(p<0.05)(图2A),说明藻细胞的最大比生长速率没有受到可利用氮源浓度的影响.实验处理组的最大细胞密度随着丙氨酸氮比率的升高而显著下降(p>0.05),依次为228、164、135、112和53×104cells/mL,100%丙氨酸氮比率与对照组的最大细胞密度无显著性差异(p<0.05)(图2B).由此说明最大细胞密度与丙氨酸氮源无关,藻细胞不能利用丙氨酸氮进行生长.
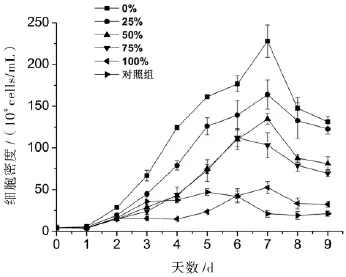
图1 丙氨酸氮比率对中肋骨条藻生长的影响.
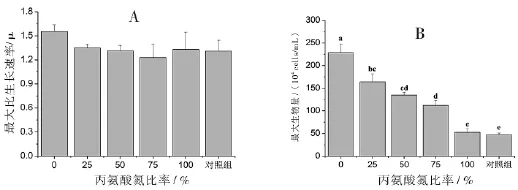
图2 丙氨酸氮比率对中肋骨条藻最大比生长速率(A)和最大细胞密度(B)的影响
2.2 不同丙氨酸氮比率对中肋骨条藻叶绿素a的影响
对照组的叶绿素a含量均显著低于其它处理组,并随着培养时间而递减.各丙氨酸氮比率的叶绿素a含量在第3天无明显规律,75%的丙氨酸氮比率叶绿素a显著升高;第6天和第9天,叶绿素a含量的总体趋势是随着丙氨酸氮比率升高而下降,推测是培养液中可利用于合成叶绿素a的氮源浓度随着丙氨酸氮比率升高而下降(图3).
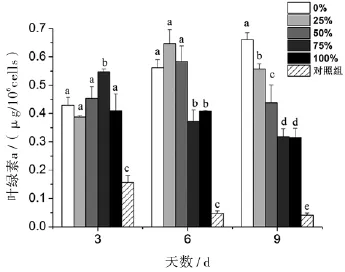
图3 丙氨酸氮比率对中肋骨条藻叶绿素a的影响.
2.3 不同丙氨酸氮比率对中肋骨条藻PSⅡ最大光合效率Fv/Fm的影响
丙氨酸氮比率对藻细胞的PSⅡ最大光合效率Fv/Fm影响不是特别显著.与0%丙氨酸氮比率(100%硝氮氮源)相比,第6天25%和50%丙氨酸氮比率的Fv/Fm略高,而75%和100%丙氨酸氮比率的Fv/Fm分别显著下降了3%和4%.而第9天(衰亡期),各丙氨酸氮比率的Fv/Fm与第3、6天相比整体下降,并随着丙氨酸氮比率升高而大幅度显著下降.第9天25%、50%、75%、100%丙氨酸氮比率的Fv/Fm与0%丙氨酸氮比率相比,分别被抑制了7%、22%、23%和17%.另外,对照组的Fv/Fm随着培养时间而显著下降(图4).
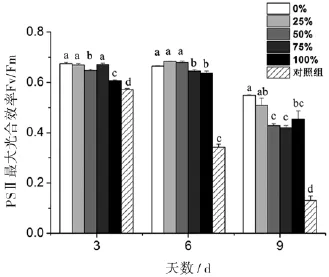
图4 丙氨酸氮比率对中肋骨条藻光系统Ⅱ最大光合效率Fv/Fm的影响.所有数据由三次实验重复得出,数值表示为平均值±SD(n=3),各处理组数据之间进行显著性分析(p<0.05).
2.4 不同丙氨酸氮比率对中肋骨条藻胞内ROS的影响
丙氨酸氮比率在第3天对中肋骨条藻的胞内ROS有显著性影响,50%、75%和100%丙氨酸氮比率的胞内ROS荧光强度与0%丙氨酸氮比率相比,分别增加了1.42、1.44和2.79倍.但是,在第6天和第9天,只有100%丙氨酸氮比率的胞内ROS荧光强度与0%丙氨酸氮比率相比有显著升高,而其它丙氨酸氮比率与之间无显著性差异.另外,对照组的ROS荧光强度一直维持在70~101(图5).
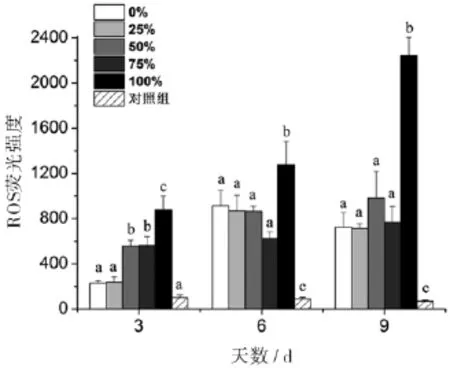
图5 丙氨酸氮比率对中肋骨条藻胞内ROS含量的影响.所有数据由三次实验重复得出,数值表示为平均值±SD(n=3),各处理组数据之间进行显著性分析(p<0.05).
2.5 不同丙氨酸氮比率对中肋骨条藻胞内中性脂肪的影响
不同丙氨酸氮比率的胞内中性脂肪在第3天无显著性差异(图6),Nile Red荧光强度在564~763之间,对照组则显著增加了1.12倍.第6天和第9天,中肋骨条藻的胞内中性脂肪随着丙氨酸氮比率的增加呈上升趋势,并且都在100%丙氨酸氮比率达到最高值.另外,对照组的胞内中性脂肪在第3、6、9天基本保持不变,维持在1336~1430.
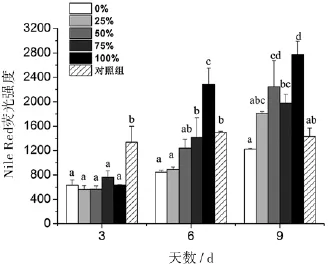
图6 丙氨酸氮比率对中肋骨条藻胞内中性脂肪的影响.所有数据由三次实验重复得出,数值表示为平均值±SD(n=3),各处理组数据之间进行显著性分析(p<0.05).
3 讨论
胡晗华等人报道中肋骨条藻在0.0882、0.882和2.646 mmol/L硝氮浓度条件下比生长速率差异不大[31],而苟彬等人报道中肋骨条藻在硝氮浓度高于80 μmol/L时,初始硝氮浓度对比生长速率影响很小[32].本实验结果与之类似,各处理组的最大比生长速率无显著性差异(图2A).75%丙氨酸氮比率对应的硝氮浓度为137.25 μmol/L(>80 μmol/L),0%、25%、50%和75%丙氨酸氮比率的生长状态基本相同.而100%丙氨酸氮比率和对照组除了最大比生长速率和其它处理组无显著差异外,其它时间段的比生长速率都处于较低水平.各丙氨酸氮比率(0%、25%、50%和75%)的生长状态基本一致,从第1天开始进入对数生长期,在第7天达到最高细胞密度(75%是第6天),然后进入衰亡期.各丙氨酸氮比率的叶绿素a和Fv/Fm都没有明显变化规律,只在第9天随着丙氨酸氮比率升高而下降(与可利用的硝氮比率呈正相关).同时,胞内ROS含量无明显变化规律(图5).各丙氨酸氮比率中性脂肪均随着培养时间延长而增加.
然而,无可利用氮源的两个处理组(100%丙氨酸氮比率和对照组)的最大细胞密度均约为接种细胞密度的10倍,可能原因是接种藻液含有的氮营养或接种藻细胞含有氮储备.两者的最大细胞密度无显著性差异,但叶绿素a,Fv/Fm,ROS和中性脂肪含量相差很大.
许多研究表明氮限制是诱导硅藻形成休眠孢子的最重要因素,也是孢子形成的必需条件[33].孙琳等人的研究表明培养液中硝氮的初始浓度对赤潮藻扁面角毛藻(Chaetoceros compressus)休眠孢子的形成时间有显著影响[34].氮的初始浓度越低,休眠孢子出现的时间越早;反之,休眠孢子出现的时间越晚.对照组的藻细胞胞内ROS一直维持在较低水平(胞内代谢活动缓慢),胞内较高含量的中性脂肪以及不断降解的叶绿素是维持藻细胞缓慢代谢的主要能源,Fv/Fm也随着叶绿素含量的下降而下降,并显著低于其它处理组.由此可推测对照组藻细胞在第3天达到稳定期后进入了休眠状态(休眠细胞).然而,无可利用氮源的100%丙氨酸氮比率藻细胞却没有进入休眠状态,胞内ROS从第3天的875(相对荧光量)上升至第9天的2242(相对荧光量),中性脂肪从第3天的633(相对荧光量)上升至第9天的2772(相对荧光量);同样无可利用氮源的对照组的胞内ROS和中性脂肪含量一直维持恒定.两者的中性脂肪和ROS有较好的正相关关系,推测100%丙氨酸氮比率藻细胞由于受到较高浓度丙氨酸(0.549 mmol/L)的“刺激作用”,光合作用(叶绿素a含量、Fv/Fm)等胞内代谢活跃,但由于胞内缺乏氮源而产生絮乱,胞内ROS含量不断升高,导致中性脂肪的大量累积.丙氨酸的“刺激作用”还表现在第3天的胞内ROS含量,50%、75%和100%丙氨酸氮比率的ROS显著高于0%和25%.
植物和动物在各种胁迫条件下累积丙氨酸是一种普遍现象,丙氨酸可能是一种细胞表达的普遍第一应力信号[35].体内和体外实验都表明甘氨酸和丙氨酸可以刺激肾细胞应激蛋白基因(HSP70)的表达,保护细胞免受应激损伤[36];L-丙氨酸还可以诱导植物悬浮培养细胞V.labrusca发生程序性死亡[37].另外,大量研究也表明硅藻细胞氨基酸含量与胞外氨基酸含量,生长周期等密切相关[16,18,38].本研究中,100%丙氨酸氮培养的藻细胞处于氮缺乏或氮饥饿状态,理论上应该与对照组一样进入休眠状态.但由于添加了高浓度的丙氨酸(0.549 mmol/L),可能会促使藻细胞累积大量的丙氨酸而使藻细胞ROS升高,中性脂肪累积等应激反应(图5,6),从而使藻细胞无法与对照组的藻细胞一样进入休眠状态.另外,丙氨酸的刺激作用可能也是50%、75%和100%丙氨酸氮比率的胞内ROS在第3天比0%和25%高的原因.
总之,中肋骨条藻不能利用丙氨酸作为氮源进行生长,而较高浓度的丙氨酸氮(0.549 mmol/L)可能对中肋骨条藻产生“刺激作用”,使其在无可利用氮源情况下不能进入休眠状态.丙氨酸对中肋骨条藻的具体作用机理需要进一步研究,但近岸海域有机氮污染加剧使某些游离氨基酸升高,将可能会对中肋骨条藻等浮游植物的胞内代谢产生干扰,影响其正常生理活动.
[1]BRONK D,SEE J,BRADLEY P,et al.DON as a source of bioavailable nitrogen for phytoplankton[J]. Biogeosciences,2007,4(3):283-296.
[2]BRONK D A.Dynamics of DON[M]//HANSELL D A,CA C.Biogeochemistry of Marine Dissolved Organic Matter.London:Academic press.2002:153-247.
[3]FUHRMAN J A.Close coupling between release and uptake of dissolved free amino-acids in seawater studied by an isotope-dilution approach[J].Marine Ecology Progress Series,1987,37(1):45-52.
[4]PALENIK B,MOREL F M.Comparison of cell-surface L-amino acid oxidases from several marine phytoplankton[J].Marine Ecology Progress Series,1990,59:195-201.
[5]GLIBERT P,LEGRAND C.The diverse nutrient strategies of harmful algae:focus on osmotrophy[M]// Granéli E,Turner J T.Ecology ofHarmful Algae.Springer Berlin Heidelberg.2006:163-175.
[6]STOECKER D K,GUSTAFSON D E.Cell-surface proteolytic activity of photosynthetic dinoflagellates[J]. Aquatic Microbial Ecology,2003,30(2):175-183.
[7]张清春.东海大规模甲藻赤潮种吞噬特性及其在赤潮形成中的作用初探[D].青岛:中国科学院海洋研究所,2011.
[8]BERG G,BALODE M,PURINA I,et al.Plankton community composition in relation to availability and uptake ofoxidized and reduced nitrogen[J].Aquatic Microbial Ecology,2003,30(3):263-274.
[9]WAWRIK B,CALLAGHAN V,BRONK D A.Use of inorganic and organic nitrogen by Synechococcus spp.and diatoms on the West Florida Shelf as measured using stable isotope probing[J].Applied and Environmental Microbiology,2009,75(21):6662-6670.
[10]WHEELER P A,NORTH B B,STEPHENS G C.Amino acid uptake by marine phytoplankters[J]. Limnology and Oceanography,1974,19(2):249-259.
[11]徐宁,刘静雅,赖海燕,等.海洋微藻对游离氨基酸的利用特性研究[J].环境科学学报,2013,33(4):1058-1065.
[12]BERLAND B,BONIN D,GUERIN-ANCEY O,et al.Concentration requirement ofglycine as nitrogen source for supporting effective growth ofcertain marine microplanktonic algae[J].Marine Biology,1979,55(2):83-92.
[13]FISHER N,COWDELL R.Growth of marine planktonic diatoms on inorganic and organic nitrogen[J]. Marine Biology,1982,72(2):147-155.
[14]AMSLER C D,IKEN K B.Chemokinesisand chemotaxisin marine bacteria and algae[M]//MCCLINTOCK J B,BAKER B J.Marine Chemical Ecology.Boca Raton,Florida:CRC Press,2001:413-430.
[15]HELLEBUST J A.Excretion of some organic compounds by marine phytoplankton[J].Limnology and Oceanography,1965,10(2):192-206.
[16]GRANUM E,KIRKVOLD S,MYKLESTAD S M.Cellular and extracellular production ofcarbohydrates and amino acids by the marine diatom Skeletonema costatum:diel variations and effects of N depletion[J]. Marine Ecology Progress Series,2002,242(1):83-94.
[17]POULET S A,MARTINJEZEQUEL V.Relationships between dissolved free amino-acids,chemicalcomposition and growth of the marine diatom Chaetoceros debile[J].Marine Biology,1983,77(1):93-100.
[18]VIDOUDEZ C,POHNERT G.Comparative metabolomics ofthe diatom Skeletonema marinoi in different growth phases[J].Metabolomics,2012,8(4):654-669.
[19]SARMENTO H,ROMERA-CASTILLO C,LINDH M,et al.Phytoplankton species-specific release of dissolved free amino acids and their selective consumption by bacteria[J].Limnology and Oceanography,2013,58(3):1123-1135.
[20]POULET S A,OUELLET G.The role ofaminoacids in the chemosensoryswarmingand feeding of marine copepods[J].Journal of Plankton Research,1982,4(2):341-361.
[21]GILL C W,POULET S A.Responses of copepods to dissolved free amino acids[J].Marine Ecology Progress Series,1988,43(3):269-276.
[22]STROM S L,WOLFE G V,BRIGHT K J.Responses of marine planktonic protists to amino acids:feeding inhibition and swimming behavior in the ciliate Favella sp[J].Aquatic Microbial Ecology,2007,47(2):107-121.
[23]夏清艳.中国近海海水中溶解氨基酸的分布与组成研究[D].青岛:中国海洋大学,2011.
[24]CHUNG C C,HWANG S P,CHANG J.Nitric oxide as a signalingfactor toupregulate the death-specific protein in a marine diatom,Skeletonema costatum,during blockage of electron flow in photosynthesis [J].Applied and Environmental Microbiology,2008,74(21):6521-6527.
[25]GUILLARD R R.Division rates[M]//STEIN J R.Handbook of Phycological Methods:Culture Methods and Growth Measurements.Cambridge:Cambridge University Press,1973:289-312.
[26]JEFFREY S W,HUMPHREY G F.New spectrophotometric equations for determining chlorophylls a,b,c1 and c2 in higher plants,algae and natural phytoplankton[J].Biochemie und Physiologie der Pflanzen,1975,167:191-194.
[27]ERUSLANOV E,KUSMARTSEV S.Identification of ROS using oxidized DCFDA and flow-cytometry [M]//ARMSTRONG D.Advanced Protocols in Oxidative Stress II.New York:Humana Press,2010:57-72.
[28]ELSEY D,JAMESON D,RALEIGH B,et al.Fluorescent measurement of microalgal neutral lipids[J]. Journal of Microbiological Methods,2007,68(3):639-642.
[29]CHEN W,ZHANG C,SONG L,et al.A high throughput Nile red method for quantitative measurement of neutral lipids in microalgae[J].Journal of Microbiological Methods,2009,77(1):41-47.
[30]LIU Z,WANG G,ZHOU B.Effect of iron on growth and lipid accumulation in Chlorella vulgaris[J]. Bioresource Technology,2008,99(11):4717-4722.
[31]胡晗华,石岩峻,丛威,等.不同氮磷水平下中肋骨条藻对营养盐的吸收及光合特性术[J].应用与环境生物学报,2004,10(6):735-739.
[32]苟彬,高永利,殷克东,等.不同无机氮浓度下中肋骨条藻和三角褐指藻生长对生长环境pH的影响[J].热带海洋学报,2011,30(3):82-87.
[33]谢文玲,康燕玉,高亚辉.硅藻休眠孢子生活史的研究进展[J].海洋科学,2006,30(9):75-78.
[34]孙琳,高亚辉,陈长平,等.氮、硅限制对赤潮藻扁面角毛藻休眠孢子形成的影响[J].植物学报,2009,44(5):601-607.
[35]BEN-IZHAK MONSELISE E,PAROLA AH,KOST D.Low-frequency electromagnetic fields induce a stress effect upon higher plants,as evident by the universal stress signal,alanine[J].Biochemical and Biophysical Research Communications,2003,302(2):427-434.
[36]NISSIM I,HARDY M,PLEASURE J,et al.A mechanism of glycine and alanine cytoprotective action:stimulation ofstress-induced HSP70 mRNA[J].Kidney International,1992,42(3):775-782.
[37]CHEN J,HALL D E,MURATA J,et al.L-Alanine induces programmed cell death in V.labrusca cell suspension cultures[J].Plant Science,2006,171(6):734-744.
[38]ADMIRAAL W,PELETIER H,LAANE R W P M.Nitrogen metabolism of marine planktonic diatoms;excretion,assimilation and cellular pools of free amino acids in seven species with different cell size[J]. Journal of Experimental Marine Biology and Ecology,1986,98(3):241-263.
Effect of Different Alanine Nitrogen Ratio on the Physiological Response of Skeletonema Costatum
HUANG Zhongwen,ZENG Dezhi,LIU Wenhua,LI Ping
(Marine BiologyInstitute,College of Science,Shantou University,Shantou 515063,Guangdong,China)
Skeletonema costatumwerebatchculturedinartificialseawater(ESAW)with different alanine nitrogen ratio(0%,25%,50%,75%,and 100%),tostudythe effects ofalanine on its physiological and biochemical responses.The results indicate that Skeletonema costatum can't grow with alanine as nitrogen source.Compared with the control group,high alanine concentration(0.549 mmol/L)“stimulate”Skeletonema costatum,induces higher chlorophyll a, maximum photosynthetic efficiency and intracellular ROS,and neutral fat content increased by 94%in day 9,resulting in abnormal dormant state.Based on our experimental results,it is speculated the HAB diatoms Skeletonema costatum can't growth with free amino acids. Furthermore,Skeletonema costatum cellular metabolism might be affected by specific amino acids(such as alanine),and could not access to dormant state in the case of inorganic nitrogen depletion.This results give a better understanding of the effect of free amino acids on the growth of HAB diatoms and phytoplankton community succession,and provides a theoretical basis for the basis for the prevention and control of HAB.
Skeletonema costatum;free amino acids;alanine;stimulation
Q94
A
1001-4217(2016)04-0064-10
2014-11-06
黄仲文(1985—),男,博士研究生.
李平(1981—),男,副教授,博士.E-mail:liping@stu.edu.cn
广东省科技计划项目(2011B050300026);广东省自然科学基金资助项目(S2011030005257,2016A030313065)

