mTOR在乳腺癌患者中的表达及意义
李金鸽,米 阳,徐叶红,王艳霞,李兰兰
(西北妇女儿童医院产二科,陕西 西安,710061)
mTOR在乳腺癌患者中的表达及意义
李金鸽,米 阳,徐叶红,王艳霞,李兰兰
(西北妇女儿童医院产二科,陕西 西安,710061)
目的 探讨mTOR、p-mTOR在乳腺癌中的表达及临床意义,为乳腺癌的临床治疗提供理论依据。方法 应用免疫组织化学SP方法及Western 印迹方法研究90例乳腺组织中mTOR、p-mTOR的表达,其中乳腺癌组织50例(乳腺导管原位癌5例、浸润性特殊乳腺癌10例,浸润性小叶癌14例,浸润性导管癌21例);乳腺良性病变40例。结果 mTOR在乳腺癌的阳性表达率为64.00%(32/50), 与乳腺良性病变组织相比无统计学差异(χ2=0.128,P>0.05),但与乳腺癌旁组织比较差异显著(χ2=7.758,P<0.05);p-mTOR在乳腺癌的阳性表达率为72.00%(36/50),与癌旁组织和乳腺良性病变相比均有显著性差异(χ2值分别为11.055、3.927,均P<0.05)。此外,mTOR、p-mTOR的表达与乳腺癌淋巴结转移有关(χ2值分别为4.271、6.913,P<0.05),与患者年龄、肿瘤大小、临床分期、组织学类型无关(χ2值分别为0.298、0.613、0.539、0.094,0.010、0.105、2.797、0.206,均P>0.05)。结论 mTOR、p-mTOR在乳腺癌中表达增加可能与乳腺癌发生及乳腺癌淋巴结转移有关,提示其可能在乳腺癌发生、发展中起促进作用。
mTOR;p-mTOR;乳腺肿瘤;表达
乳腺癌是妇女最常见的恶性肿瘤之一,近年研究发现,mTOR信号传导通路在细胞生存、生长,与增殖中起中心调控作用,在许多人类肿瘤均呈高表达。多种恶性肿瘤的发生与它所介导的信号传导通路的异常有关,已成为肿瘤治疗的新靶点[1]。但有关mTOR、p-mTOR在乳腺组织中的表达情况的研究较少。本实验拟对50例乳腺癌病人石蜡包埋切片中mTOR和 p-mTOR的表达进行联合检测,探讨mTOR和p-mTOR在乳腺癌中的表达及临床意义,并成为乳腺癌治疗的理论依据。
1材料与方法
1.1材料
乳腺组织来自西北妇女儿童医院乳腺科手术切除标本共90例。所有标本均行苏木精-伊红染色法(hematoxylin-eosin staining,HE)及免疫组化检测。患者均为女性,年龄为16~78岁,中位年龄47岁,要求术前未行放疗、化疗及免疫治疗,依据最新世界卫生组织 (World Health Organization,WHO)乳腺癌分类标准进行组织学分类:5例乳腺导管原位癌,10例浸润性特殊乳腺癌(髓样癌),14例浸润性小叶癌,21例浸润性导管癌,50例乳腺癌中有淋巴转移的29例。依据国际抗癌协会肿瘤淋巴结转移(tumor node metastasis,TNM)分期方案将乳腺癌分为:14例Ⅲ期,19例Ⅱ期,17例0期Ⅰ期,再取30例乳腺良性病变,10例癌旁乳腺组织。另取手术切除乳腺癌旁组织、 乳腺良性病变和乳腺癌组织标本30例,以备蛋白质印迹法(western blot,WB)分析。
1.2主要试剂与方法
兔抗人mTOR单克隆抗体 兔抗人磷酸化mTOR单克隆抗体(Cell Signaling 公司)免疫组化染色试剂盒(北京中杉生物技术有限公司) 生物素化二抗、DAB浓缩显色液、DAB稀释液 (武汉博士德生物试剂公司)采用免疫组化SP法。对照设置以同等稀释度的正常家兔血清及PBS代替一抗作阴性及空白对照,阳性对照采用试剂盒自带阳性切片免疫组化染色结果。Western Blot分别取手术切除乳腺良性病变和乳腺癌组织标本30例放入液氮中冻存再放入负80度冰箱。严格按照Western Blot试验步骤。
1.3结果判断标准
免疫组化结果判定:mTOR定位于细胞浆,p-mTOR定位于细胞浆和细胞核,棕黄色颗粒出现在细胞浆和细胞核为阳性细胞。连续观察10个高倍视野(×400)后,选用半定量计分法判定结果,以染色百分比计分×染色强度计分,4分以上定为阳性,将0~4分定为阴性。 Western Blot结果判定:由灰度值测定来分析各组蛋白的相对含量。
1.4统计学方法
采用SPSS13.0统计软件进行所有统计分析。临床病理参数间的关系与mTOR和p-mTOR表达采用χ2检验;Western Blot结果采用方差分析。P<0.05具有统计学意义。
2结果
2.1 mTOR、p-mTOR在乳腺癌、乳腺良性病变及乳腺癌旁组织中的组织表达及定位
mTOR主要定位于细胞浆,呈棕黄色颗粒,p-mTOR定位于细胞浆和细胞核,呈棕黄色颗粒(见图1)。50例乳腺癌组织中有32例mTOR呈阳性表达,其阳性率高达64.00%,乳腺良性病变的阳性率为60.00%,而对照的10例癌旁组织仅1例(10.00%)呈阳性表达。乳腺癌中mTOR的阳性表达率高于乳腺良性病变组织,但统计学处理无显著性差异(P>0.05)。乳腺癌与乳腺癌旁组织比较有显著性差异(P<0.05)。p-mTOR在乳腺癌、乳腺良性病变组织、乳腺癌旁组织、中的阳性表达率分别为72.00%、50.00%、10.00%,乳腺癌分别与乳腺癌旁组织、乳腺良性病变组织比较均有显著性差异(P<0.05),见表1。
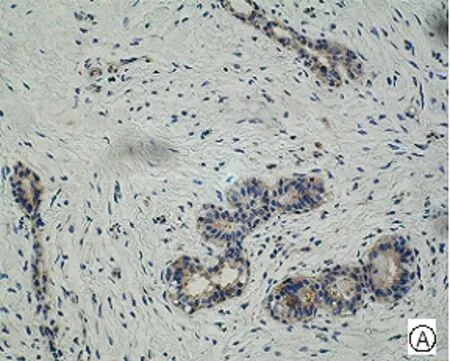
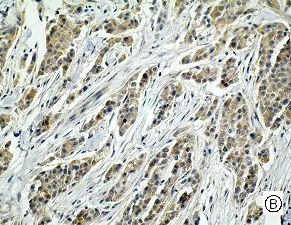

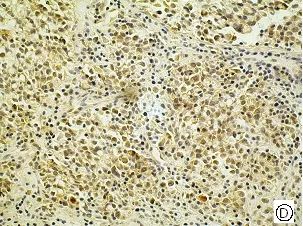
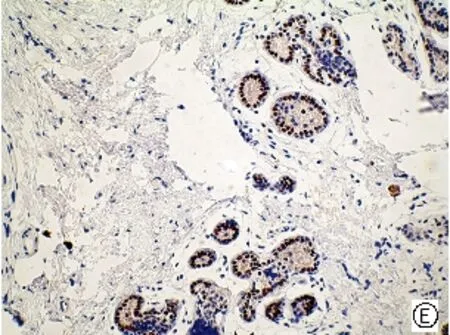

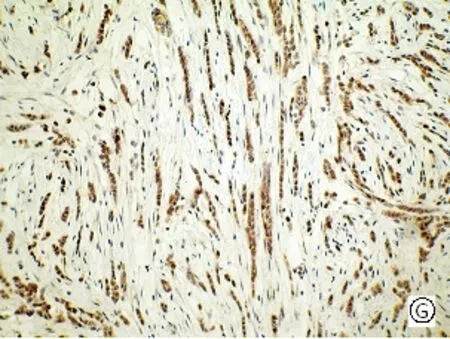

图1 mTOR、p- mTOR在乳腺癌不同组织学类型中的阳性表达[A、E乳腺良性病变(SP,×200); B、F 乳腺导管癌(SP,×200); C、G乳腺小叶癌(SP,×200) ;D、H乳腺髓样癌(SP,×200)]
Fig .1 Positive expressions of mTOR and p-mTOR in different histological types of breast cancer [A、E benign breast lesions (SP,×200); B、F ductal breast cancer (SP,×200); C、G breast lobular cancer (SP,×200); D、H medullary breast cancer (SP,×200) ]

表1 mTOR、p-mTOR在乳腺癌、乳腺良性病变及乳腺癌旁组织中的表达(n)
注:进行组间比较用χ2分割法。★乳腺良性病变与癌旁组织组间比较;■乳腺癌与乳腺良性病变组间比较;▲乳腺癌与乳腺癌旁组织组间比较。

表2 mTOR 、p-mTOR在乳腺不同组织学类型中Western blot灰度值分析
注:mTOR:癌旁组织分别与乳腺良性病变、乳腺癌比较,P<0.05;乳腺良性病变与乳腺癌比较,P>0.05。p-mTOR:癌旁组织分别与 乳腺良性病变、乳腺癌比较,P<0.05;乳腺良性病变与乳腺癌比较,P<0.05。
2.2 mTOR和p-mTOR在乳腺癌、乳腺良性病变及乳腺癌旁组织中的蛋白表达检测
在乳腺癌旁组织、乳腺良性病变组织、乳腺癌中均有mTOR 和p-mTOR的蛋白条带(289KD)出现(见图2);经吸光度测定灰度值(见表2),从乳腺癌旁组织、乳腺良性病变组织、乳腺癌呈逐渐升高趋势与免疫组化结果比较总体趋势一致。
2.3mTOR和p-mTOR在乳腺癌中的表达与临床病理因素的关系
淋巴结转移组的mTOR、p-mTOR的阳性表达率分别为22例(75.86%)、25例(86.21%),无淋巴结转移组的mTOR、p-mTOR的阳性表达率分别为10例(47.61%)、11例(52.38%),两组间相比具有显著性差异(P<0.05),但mTOR、p-mTOR的表达与乳腺癌病人的临床分期、组织学类型、年龄及肿瘤大小无关(均P>0.05),见表3。
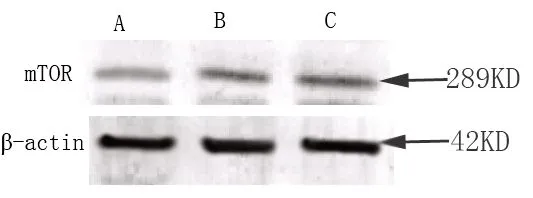

注:A为乳腺癌旁组织,B为乳腺良性病变组织,C为乳腺癌组织,β-actin为内参
图2 mTOR、p-mTOR在乳腺癌不同组织学类型中的蛋白表达
Fig. 2 Protein expressions of mTOR and p-mTOR in different histological types of breast cancer (A: adjacent tissue of breast cancer,B: benign breast lesions,C: breast cancer tissue,β-actin for reference)

表3 mTOR、p- mTOR在乳腺癌中的表达与临床病理因素的关系[n(%)]
3讨论
3.1 mTOR在乳腺癌中的表达
乳腺癌是一种严重威胁人类生命安全的肿瘤,是妇女最常见的恶性肿瘤之一。自主的和不受控制的生长是恶性肿瘤的特征之一,人类大部分恶性肿瘤存在增值信号传导途径的过度表达。有研究发现mTOR所介导的信号传导通路与细胞增殖和细胞凋亡有密切关系,已经发现多种常见肿瘤(乳腺癌、肝癌、肺癌、结直肠癌、前列腺癌等)的发生与该通道密切相关[2-3]。Zhou等研究发现,mTOR的磷酸化水平从正常乳腺上皮组织、不典型增生到恶性转化再到肿瘤浸润渐次增加。我们采用免疫组化SP法研究mTOR、p-mTOR在乳腺癌中的表达,结果显示;乳腺癌旁组织、乳腺良性病变、乳腺癌中mTOR、p-mTOR的阳性率分别为10.00%、60.00%、64.00%和10.00%、50.00%、72.00%,呈逐渐升高趋势,Western blot检测结果与免疫组化结果比较总体趋势一致,提示mTOR、p-mTOR的高表达在乳腺正常细胞向癌细胞转化和癌细胞增值中起重要调控作用。同时我们发现乳腺癌中mTOR的阳性表达率虽然高于乳腺良性病变组织,但无统计学意义(P>0.05),而p-mTOR的表达在乳腺良性病变组织与乳腺癌两组间比较有显著性差异(P<0.05)。p-mTOR作为mTOR的活性形式在乳腺癌中阳性表达率明显高于mTOR的阳性表达率,这一结提示在促进乳腺细胞异常增殖和恶性转化中mTOR磷酸化激活起着重要作用,可能为乳腺癌治疗提供新靶点。有文献报道,激活后的mTOR进一步磷酸化它的下游分子,核糖体蛋p70S6k和翻译抑制分子eIF24E结合蛋白1,从而启动蛋白质的翻译[4]。是蛋白质合成的正调控信号,随着肿瘤恶性度提高,mTOR和p-mTOR的表达量提高。本实验的结果也证明了这一点。免疫组化结果表明,mTOR主要表达在肿瘤细胞胞浆,p-mTOR主要表达在细胞浆及细胞核。推测mTOR被上游信号因子激活发生磷酸化后生成p-mTOR,p-mTOR进入细胞核后在调节下游在翻译过程中起重要作用,从而在翻译水平上而促进乳腺细胞异常增殖和恶性转化,与文献报道一致。有研究证实,mTOR在转录水平也有一定的影响,磷酸化mTOR可激活信号转导与激活因子3(signal transducer and activator of transcription 3,STAT3)等转录激活因子。mTOR信号传导通路激活后可以抑制多种刺激诱发的细胞凋亡,促使细胞周期进展,进而促进细胞的生存和增殖,同时在肿瘤的形成中扮演重要角色,参与血管形成,也参与肿瘤的侵袭和转移。已证实乳腺癌中存在PI3K/Akt/mTOR途径异常,Akt磷酸化mTOR的Ser2448位点,从而激活mTOR和它的下游途径,控制细胞增殖与转化所需特殊蛋白质的翻译[5-6]。Laughner等在乳腺癌中研究发现,mTOR信号能调控低氧诱导因子的表达,促使其下游血管内皮生长因子的转录,从而使内皮细胞迁移形成新生血管,提供肿瘤细胞血供。本实验结果表明,mTOR、p-mTOR的表达与恶性肿瘤的转移有关,提示mTOR信号传导途径激活可能进一步参与乳腺癌的侵袭和转移过程。Tuck等在乳腺癌及肝癌细胞中的研究均发现骨桥蛋白(osteopontin,OPN)为肿瘤转移相关基因,它的异常表达依赖mTOR的调控。另外实验结果发现mTOR、p-mTOR的阳性表达率随着乳腺癌的临床分期呈上升趋势,但无统计学意义,这一结果尚需扩大样本量进一步研究。
3.2 mTOR与肿瘤的关系
目前mTOR与肿瘤关系的直接模式尚未确立,研究发现mTOR信号传导通路的异常与细胞的恶性转化、多种肿瘤的形成有关。mTOR信号传导上游的蛋白如PI3K、Akt等都具有细胞转化、促进肿瘤形成的潜能蛋白。参与多种肿瘤的形成并起重要作用。生长因子可通过跨膜信号转导激活PI3K,生成Ptdln(3,4)P2、Ptdln(3,4,5)P3,正常情况下上述两种产物受人第10号染色体缺失的磷酸酶及张力蛋白同源的基因(phosphatase and tensin homologue deleted on chromosome 10,PTEN)的负性调控。PTFN是3-磷酯酞肌醇磷酸酶,是肿瘤抑制基因Pten的产物。可使Ptdln (3,4)P2、Ptdln(3,4,5)P3去磷酸化后失活。当PTEN的发生突变可使PI3K及产物增加、Akt活性增强,促使细胞发生转化。PTFN也是mTOR的负性调节因子,他发生功能缺失性突变出现在多种恶性肿瘤中,如乳腺癌、子宫内膜癌、前列腺癌等肿瘤中[7]。在这些肿瘤的PI3K及产物浓度、Akt活性明显升高。利用mTOR的选择性抑制剂rapamycin可以逆转Akt转化的细胞表型。因此,mTOR信号通路的与恶性肿瘤关系的进一步研究为恶性肿瘤的治疗提供了新的思路。特别是mTOR抑制剂雷帕霉素及其衍生物加来曲唑(temsirolimus,CCI-779)、依维莫司(everolimus,RAD001)已用于治疗局部晚期或转移性乳腺癌的II期临床实验。
综上所述,mTOR p-mTOR在乳腺癌中表达增加可能是介导乳腺癌发生的主要机制之一;mTOR p-mTOR的表达与乳腺癌淋巴结转移相关,提示其可能在乳腺癌发生、发展中起重要促进作用,mTOR、p-mTOR的阳性表达率随着乳腺癌的临床分期呈上升趋势,但无统计学意义,这一结果尚需扩大样本量进一步研究,mTOR、p-mTOR在浸润性小叶癌和浸润性导管癌中的表达差异无显著性。
[1]Ghayad S E,Cohen P A. Inhibitors of the PI3K/Akt/mTOR pathway:new hope for breast cancer patients[J].Recent Pat Anticancer Drug Discov,2010,5(1):29-57.
[2]Inglis D J,Lavranos T C,Beaumont D M,etal. The vascular disrupting agent BNC105 potentiates the efficacy of VEGF and mTOR inhibitors in renal and breast cancer[J]. Cancer Biol Ther,2014,15(11):1552-1560.
[3]McAuliffe P F,Meric-Bernstam F,Mills G B,etal. Deciphering the role of PI3K/ Akt/ mTOR pathway in breast cancer biology and pathogenesis[J].Clin Breast Cancer,2010,10(Suppl 3):S59-S65.
[4]Margariti N,Fox S B,Bottini A,etal.“Overcoming breast cancer drug resistance with mTOR inhibitors”. Could it be a myth or a real possibility in the short-term future?[J].Breast Cancer Res Treat,2011,128(3):599-606.
[5]Sabine V S,Crozier C,Brookes C L,etal. Mutational analysis of PI3K/ AKT signaling pathway in tamoxifen exemestane adjuvant multinational pathology study[J].J Clin Oncol,2014,32(27):2951-2958.
[6]Ciruelos Gil E M.Targeting the PI3K/AKT/mTOR pathway in estrogen receptor-positive breast cancer[J]. Cancer Treat Rev,2014,40(7):862-871.
[7]De Amicis F,Guido C,Santoro M,etal. A novel functional interplay between Progesterone Receptor-B and PTEN,via AKT,modulates autophagy in breast cancer cell [J].J Cell Mol Med,2014,18(11):2252-2265.
[专业责任编辑:任 予]
Expression and clinical significance of mTOR in breast cancer
LI Jin-ge, MI Yang, XU Ye-hong, WANG Yan-xia, LI Lan-lan
(Second Department of Obstetrics, Northwest Women and Children’s Hospital, Shaanxi Xi’an 710061, China)
Objective To study the expression and significance of mTOR and p-mTOR in primary breast carcer so as to provide theoretical basis for clinical treatment of breast cancer. Methods The expressions of mTOR and p-mTOR were studied in breast carcer samples by immunohistochemical (IHC) analysis and Western blot. Results The positive expression rate of mTOR was 64.00% (32/50) in breast cancer tissues, which was not different from that in breast benign lesions (χ2=0.128,P>0.05) but significantly different from that in breast cancer adjacent tissues (χ2=7.758,P<0.05). The positive expression rate of p-mTOR was 72.00% (36/50) in breast cancer tissues, and there was significant difference from that in breast benign lesions and adjacent cancer tissues (χ2value was 11.055 and 3.927, respectively, bothP<0.05). The expressions of mTOR and p-mTOR were correlated with the metastasis of lymph node (χ2value was 4.271 and 6.913, respectively, bothP<0.05) but not correlated with patients' age, tumor size, different clinical type and histological type (χ2value was 0.298, 0.613, 0.539, 0.094, 0.010, 0.105, 2.797 and 0.206,respectively, allP>0.05).Conclusion Higher expressions of mTOR and p-mTOR may be correlated with breast cancer and metastasis of lymph node, indicating their role in pathogenesis and development of breast cancer.
mTOR; p-mTOR; breast tumor; expression
2016-06-06
李金鸽(1980-),女,主治医师,硕士研究生,主要从事产科临床工作。
米 阳,主任医师。
10.3969/j.issn.1673-5293.2016.11.015
R655.8
A
1673-5293(2016)11-1335-04

