阿昔洛韦口服治疗晚期妊娠生殖器疱疹的血药浓度和疗效评价
邓红梅,刘 敏
(上海市公共卫生临床中心,上海 201500)
阿昔洛韦口服治疗晚期妊娠生殖器疱疹的血药浓度和疗效评价
邓红梅,刘 敏
(上海市公共卫生临床中心,上海 201500)
目的 评价妊娠晚期孕妇口服阿昔洛韦治疗生殖器疱疹的临床疗效和分娩期血药浓度。方法 选择2010年3月至2015年12月上海市公共卫生临床中心就诊的复发性生殖器疱疹23例,从孕期32~36w起口服阿昔洛韦片0.4g/次,3次/d,疗程至分娩结束,胎儿娩出后抽取脐静脉血、脐动脉血和母体静脉血检测阿昔洛韦血药浓度。结果 20例患者阴道顺产,1例胎位不正和2例胎儿宫内窘迫改为剖宫产,无1例患者分娩期出现疱疹活动,也无1例新生儿发生HSV感染。脐静脉血阿昔洛韦血药浓度浓度为251.38ng/mL,脐动脉血为231.57ng/mL,母体静脉血药浓度为430.64ng/mL;有60.87%(14/23)的脐静脉血,47.83%(11/23)脐动脉血和17.39%(4/23)母体静脉血样本低于阿昔洛韦稳态血药浓度180ng/mL;母体体重与脐静脉血、脐动脉血和母体静脉血血药浓度均无明显相关(r值分别为-0.207、0.130、0.164,P值分别为0.381、0.876、0.773,均P>0.05);分娩时程与脐静脉血、脐动脉血和母体静脉血血药浓度也无相关性(r值分别为-0.382、0.264、0.139,P值分别为0.076、0.533、0.413,均P>0.05);末次服药间隔时间与脐静脉血、脐动脉血和母体静脉血血药浓度均呈负相关(r值分别为-0.584、-0.624、-0.613,P值分别为0.003、0.001、0.002,均P<0.05)。结论 口服阿昔洛韦无法保证分娩期有效的血药浓度,而合适的给药方法和剂量仍需要大量研究。
阿昔洛韦;单纯疱疹病毒;妊娠期;血药浓度
新生儿单纯疱疹病毒(herpes simplex virus, HSV)感染是母体生殖器疱疹(Genital Herpes)最严重的并发症之一,由HSV血行散播和上行感染引起,在很多国家都属于突出的公共健康问题[1]。 阿昔洛韦、伐昔洛韦和泛昔洛韦等是目前治疗非妊娠期复发性生殖器疱疹最有效的手段,而对于妊娠期生殖器疱疹目前推荐在孕36周时开始口服阿昔洛韦或伐昔洛韦直至分娩结束,国内外研究对该治疗方案疗效和安全性进行评价,结果表明孕妇临床症状复发率和病毒脱落率明显改善[2]。阿昔洛韦的预防效果与血药浓度相关,而目前只有晚期妊娠患者的药代动力学数据[3],分娩时母体和胎儿阿昔洛韦血药浓度目前尚未不明确。由于分娩时阿昔洛韦的口服疗程通常会暂停,而一旦药物的疗程中断将会为HSV在分娩期复制提供可能,因此分娩期血药浓度对评估阿昔洛韦的实际预防效果有重要意义。为明确口服阿昔洛韦在分娩期血药浓度,本研究纳入我院部分患者进行血样分析,为临床决策提供更充分的依据。
1资料和方法
1.1一般资料
选择2010年3月至2015年12月在上海市公共卫生临床中心就诊分娩的复发性生殖器疱疹孕妇,入选标准:①年龄18~35岁,孕期32~36w;②临床症状和实验室检查符合复发性生殖器疱疹诊断,病史>1年;③孕期产检正常,无妊娠期高血压、妊娠期糖尿病等严重合并症;④不合并其他性传播性疾病(如淋病、梅毒、艾滋病等);⑤无阿昔洛韦过敏史或过敏体质;⑥了解研究内容并签署知情同意书。符合选择标准的孕妇23例,年龄21~33岁,平均27.5±3.6岁,孕期33.8±2.8w,生殖器疱疹病史14~27个月,平均20.8±5.3个月。
1.2治疗方法
所有孕妇从入组开始给予阿昔洛韦片(0.1g/片,国药准字H44021631),0.4g/次,3次/d,疗程至分娩结束,但分娩开始后不再强制要求服药。
1.3检测方法
分娩结束后即刻从脐带中抽取脐静脉和脐动脉血,从孕妇肘静脉中抽取静脉血各4mL,血标本置于肝素化试管中,3 500r/min。离心10min,分离血浆-70℃保存至测定。阿昔洛韦血药浓度采用全自动毛细管电泳系统(型号FSv2-CE,由美国AATI生产),定量极限为20ng/mL。紫外分析采用紫外检测器(EMC-UVCE10,北京艾美林科技有限公司生产),检测波长254nm,标准曲线外标法定量阿昔洛韦血药浓度。
1.4统计学处理
以SPSS 19.0统计学软件进行数据分析,计量资料以均值±标准差描述,组间比较采用独立样本t检验,计数资料以百分率描述,组间比较采用χ2检验;不同因素与阿昔洛韦血药浓度相关性分析采用Pearson相关分析,均以P<0.05为差异有统计学意义。
2结果
2.1一般情况
共23例生殖器疱疹孕妇纳入研究,所有患者均能按照给药方案进行治疗,只有5例患者在第一产程服用最后一次药物,其余均在第一产程开始前停止服药。20例患者阴道顺产,3例患者因胎位不正(1例)和胎儿宫内窘迫(2例)改为剖宫产。无1例患者分娩期出现疱疹活动,也无1例新生儿发生HSV感染。
2.2阿昔洛韦血药浓度
脐静脉血阿昔洛韦血药浓度浓度为251.38±103.41ng/mL,脐动脉血为231.57±89.24ng/mL,母体静脉血药浓度为430.64±135.37 ng/mL;有60.87%(14/23)的脐静脉血,47.83%(11/23)脐动脉血和17.39%(4/23)母体静脉血样本低于已知的阿昔洛韦稳态血药浓度180ng/mL。
2.3阿昔洛韦血药浓度影响因素分析
母体体重与脐静脉血、脐动脉血和母体静脉血血药浓度均无明显相关(r值分别为-0.207、0.130、0.164,P值分别为0.381、0.876、0.773,);分娩时程与脐静脉血、脐动脉血和母体静脉血血药浓度也无相关性(r值分别为-0.382、0.264、0.139,P值分别为0.076、0.533、0.413,均P>0.05);末次服药间隔时间与脐静脉血、脐动脉血和母体静脉血血药浓度均相关(r值分别为-0.584、-0.624、-0.613,P值分别为0.003、0.001、0.002,均P<0.05),见图1、图2、图3。

图1 末次服药间隔与脐静脉血血药浓度相关性
Fig. 1 The correlation between last dose interval and plasma concentration in umbilical venous blood
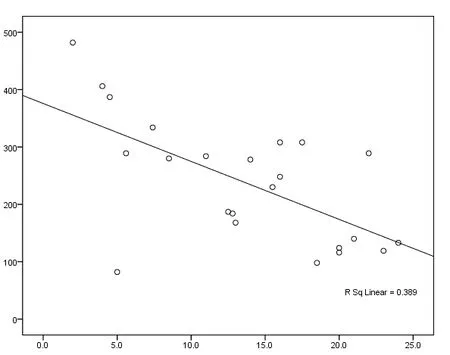
图2 末次服药间隔与脐静脉血血药浓度相关性
Fig. 2 The correlation between last dose interval and plasma concentration in umbilical artey blood

图3 末次服药间隔与脐静脉血血药浓度相关性
Fig. 3 The correlation between last dose interval and plasma concentration in maternal venous blood
3讨论
3.1 单纯疱疹病毒感染的流行病学和防治现况
HSV可通过胎盘及产道感染新生儿,患儿感染后可表现为皮肤、黏膜、眼和口腔损伤,也可以引起脑炎、肝炎、肺炎及血液系统病变,其中脑炎的死亡率达到15%,6w以内新生儿更高达65%,幸存患儿也可能出现智力低下、发育受限,只有不足10%能正常成长发育[4]。各国新生儿HSV感染率报道不一,欧洲约为1/20 000~60 000,美国约为1/3 200,而我国则高达2.79%[5]。85%的患儿经阴道分娩时被母体产道感染[1],为了减少围产期HSV的垂直传播,美国妇产科医师学会(ACOG)推荐分娩前出现生殖器疱疹复发的孕妇进行剖宫产[2],我国学者建议临产时有活动生殖器疱疹者、未破膜或破膜在4h内者均应行剖宫产结束分娩[6],但由此带来的并发症和死亡率上升也使该项措施受到质疑。近年来ACOG提出了孕期32~36w开始抗病毒治疗的策略,预防效果与剖宫产相似[7]。 国内北京佑安医院对180例妊娠合并生殖器疱疹孕妇分别给予阿昔洛韦口服和单纯观察,结果两组HSV抗体阳性率分别为2.26%和17.02%[8],抗病毒口服治疗越来越受到临床认可。
3.2 口服阿昔洛韦在分娩期无法有效抑制单纯疱疹病毒复制
阿昔洛韦通过干扰其DNA 聚合酶抑制单纯疱疹病毒DNA合成,是目前最有效也是最常用的抗病毒药物[8]。妊娠期生殖器疱疹的主要治疗目标是控制临床症状和病毒复制从而避免剖宫产,同时达到减少新生儿病毒暴露的风险,临床疗效最主要的决定因素是血药浓度折点和病毒脱落率[9]。分娩期孕妇由于体力透支和精神高度紧张,维持阿昔洛韦口服疗程有一定困难,而且阿昔洛韦的半衰期较短(2~3h),停止服药10~15h后血药浓度已经降至无法检测水平[10]。本研究结果进一步表明,分娩时停止口服阿昔洛韦的孕妇血药浓度未能达到最佳水平,参考1991年Frenkel等[11]的研究口服阿昔洛韦400mg后稳态血药浓度是180ng/mL, 60.87%脐静脉血和17.39%母体血均低于此标准。正如本资料立项初期的估计,母体血、脐带血药物浓度与末次服药间隔成负相关,阿昔洛韦在体内代谢迅速。虽然分娩时程与血药浓度未见相关性,笔者认为可能与不同孕妇分娩时程的长短变异极大有关。值得注意的是目前对HSV传播所需的最小感染滴度目前尚不明确,国外有个案报道即使极低的病毒水平也可以导致垂直传播[11],而本研究中处于亚临床浓度的新生儿无感染病例,目前理论也无法解释。因此180ng/mL水平对病毒的抑制能力仍值得商榷,是否给予口服或静脉滴注更大剂量需要学界关注。
根据临床经验,孕妇在分娩期未强制要求维持阿昔洛韦口服疗程时,有相当一部分孕妇和新生儿处于亚治疗量的血药浓度,导致治疗最关键的时期重新出现HSV病毒复制,因此寻找更合适的阿昔洛韦给药方法具有肯定的临床意义。另一方面,本研究无法确认较低的药物浓度是由于依从性下降还是分娩期生理环境的变化所致。孕期生理条件(如肾清除率)改变可以导致药代动力学变化,但既往的研究尝试就血药浓度和药物清除率的关系与非孕期女性进行比较,即使增加药物剂量和给药频率也无明显差异[12],同时,呕吐和胃排空延迟的因素也可能使分娩期生物利用度的分析变得复杂,难以真实评价药代动力学的实际情形,因此建议高危和吸收功能下降的患者分娩期阿昔洛韦改为静脉注射,以降低胎儿病毒暴露风险。
综上所述,本研究对阿昔洛韦分娩期血药浓度进行了小样本分析,发现现阶段的口服疗法无法保证分娩期有效的血药浓度,但新生儿在较低血药浓度的暴露风险尚不明确,而合适的分娩期给药方法仍需要大量研究。
[1]刘安, 陈舒, 孙丽君, 等. 不同孕期治疗孕妇生殖器疱疹对阻断新生儿感染的影响[J].中国皮肤性病学杂志, 2011,25(1):42-43.
[2]Money D,Steben M,Infectious Diseases Committee,etal.Guidelines for the management of herpes simplex virus in pregnancy[J].J Obstet Gynaecol Can, 2008, 30(6):514-519.
[3]Roxby A C, Atkinson C, Asbjörnsdóttir K,etal. Maternal valacyclovir and infant cytomegalovirus acquisition: a randomized controlled trial among HIV-infected women[J].PLoS One, 2014, 9(2):e87855.
[4]James S H, Sheffield J S, Kimberlin D W.Mother-to-child transmission of herpes simplex virus[J]. J Pediatric Infect Dis Soc, 2014,3( Suppl 1):S19-S23.
[5]袁静, 钱芳, 岳玉函, 等. 单纯疱疹病毒感染在妇产科疾病的研究现况[J].疾病监测与控制杂志,2013,7(11):676-677.
[6]包琳, 张建平. 妊娠合并感染性疾病患者的分娩安全[J].实用妇产科杂志,2012,28(3):168-170.
[7]ACOG Committee on Practice Bulletins. ACOG Practice Bulletin. Clinical management guidelines for obstetrician-gynecologists. No. 82 June 2007. Management of herpes in pregnancy[J]. Obstet Gynecol, 2007,109(6):1489-1498.
[8]苏文雁. 妊娠合并生殖器疱疹的相关因素分析及多元化干预对策[J]. 中国性科学,2013,22(6): 54-57.
[9]Purewal R, Costello L, Garlapati S,etal. Congenital herpes simplex virus in the newborn: a diagnostic dilemma[J]. J Pediatric Infect Dis Soc. 2016,5(3):e21-e23.
[10]Downing C, Moayyad J, Tamirisa A,etal. Acyclovir Lauriad(?): a muco-adhesive buccal tablet for the treatment of recurrent herpes labialis[J]. Expert Rev Anti Infect Ther, 2014,12(3):283-287.
[11]Capretti M G, Marsico C, Lazzarotto T,etal. Herpes Simplex Virus 1 infection: misleading findings in an infant with disseminated disease[J]. New Microbiol,2013, 36(3):307-313.
[12]Cies J J, Moore W S 2nd, Miller K,etal. Therapeutic drug monitoring of continuous-infusion acylovir for disseminated herpes simplex virus infection in a neonate receiving concurrent extracorporeal life support and continuous renal replacement therapy[J]. Pharmacotherapy,2015,35(2):229-233.
[专业责任编辑: 杨文方]
Plasma concentration and efficacy evaluation of oral acyclovir for genital herpes in late pregnancy
DENG Hong-mei, LIU Min
(Shanghai Public Health Clinical Center, Shanghai 201500, China)
Objective To evaluate the clinical efficacy of oral acyclovir for genital herpes in third trimester pregnant women and plasma concentration in delivery. Methods Altogether 23 patients of recurrent genital herpes were selected from March 2010 to December 2015. They orally administered acyclovir tablets 0.4g (tid) from gestation 32 to 36 week to the end of delivery. Acyclovir plasma concentration was detected in umbilical venous blood, umbilical artery blood and maternal venous blood sampled after delivery. Results Twenty patients underwent vaginal delivery. One case of malposition and 2 cases of fetal distress were changed to cesarean section. None of pregnant women complained of herpes activity during delivery, and no neonate appeared HSV infection. Plasma concentration of acyclovir in umbilical venous blood, umbilical artery blood and maternal venous blood was 251.38ng/mL, 231.57ng/mL and 430.64ng/mL, respectively. Acyclovir plasma concentration in 60.87% (14/23) of umbilical venous blood, 47.83% (11/23) of umbilical artery blood and 17.39% (4/23) of maternal venous blood samples was less than acyclovir steady-state plasma concentration (180ng/mL). There were no significant correlation between maternal weight and plasma concentration in umbilical venous blood, umbilical artery blood and maternal venous blood (rvalue was -0.207, 0.130 and 0.164, respectively,Pvalue was 0.381, 0.876 and 0.773, respectively, allP>0.05). There was no correlation between childbirth process and plasma concentration in umbilical venous blood, umbilical artery blood and maternal venous blood (rvalue was -0.382, 0.264 and 0.139, respectively,Pvalue was 0.076, 0.533 and 0.413, respectively, allP>0.05). Last dose interval was negatively associated with plasma concentration in umbilical venous blood, umbilical artery blood and maternal venous blood (rvalue was -0.584, -0.624 and -0.613, respectively,Pvalue was 0.003, 0.001 and 0.002, respectively, allP<0.05). Conclusion Oral acyclovir is unable to guarantee effective blood concentration in delivery. More researches are needed for appropriate dosage and administration method.
acyclovir; herpes simplex virus; pregnancy; plasma concentration
2016-05-01
邓红梅(1973-),副主任医师,主要从事妊娠合并感染性疾病的研究。
刘 敏,副主任医师/博士。
10.3969/j.issn.1673-5293.2016.11.038
R714.1
A
1673-5293(2016)11-1409-03

