兰州百合鳞茎不定芽诱导和植株再生
胡友军,贾双双,周玉丽
(安徽科技学院 生命科学学院,安徽 凤阳 233100)
兰州百合鳞茎不定芽诱导和植株再生
胡友军,贾双双,周玉丽
(安徽科技学院 生命科学学院,安徽 凤阳 233100)
目的:研究6-苄氨基腺嘌呤(6-BA)和α-萘2酸(NAA)对兰州百合鳞茎的诱导、增殖、生根及试管苗移栽的影响,筛选出不同培养阶段的最佳培养基。方法:选取生长健壮的兰州百合鳞茎,采用MS为基本培养基,添加不同浓度6-BA和NAA,进行不定芽的诱导。以鳞茎诱导的幼苗为外植体,MS添加不同浓度6-BA和NAA进行试管苗增殖培养。将试管苗转入以1/2 MS、MS为基本培养基,添加不同浓度6-BA和NAA组合的生根培养基中进行试管苗的生根培养,当幼根长2~3 cm时,炼苗1~2 d,再移入蛭石和珍珠岩配比为1 ∶1的营养钵中管理。结果:丛生芽诱导时,6-BA的最适浓度为1.0 mg/L,过高则芽的生长受到抑制;增殖试验中,NAA与6-BA配合使用,可提高芽的增殖率,而且新芽产生时间早,增殖倍数高;1/2 MS和MS培养基中NAA可以提高百合幼苗生根率,6-BA则明显抑制生根量。结论:兰州百合鳞茎片不同部位诱导丛生芽的诱导率顺序为下部>中部>上部;经炼苗移栽,再生株成活率可达100%。
百合鳞茎;不定芽诱导;植株再生
兰州百合(Liliumdavidiivar.willmottiae)为百合科百合属川百合的变种,多年生草本植物,为兰州地区名优特产蔬菜之一,其地下鲜鳞茎茎瓣大,阔卵状球形或扁球形,外无皮膜。兰州百合鳞片富含碳水化合物、蛋白质、多种维生素以及人体所必需的多种微量元素,为我国食用百合最佳品种,不仅有极高的营养价值,而且具有滋阴润肺、清心安神、清热利尿、消暑[1]等功效。
兰州百合主要依靠小鳞茎分株繁殖,单鳞片扦插[2]。小鳞茎分株繁殖方式在生产上应用较广,优点在于能保持其后代遗传基础的一致性,较少发生变异。百合长期的无性繁殖会使植株逐渐积累大量病毒,发生病毒病并导致种性退化。种子繁殖虽能获得大量无病毒健康的幼苗,但百合结实率极低,且种子发芽缓慢,栽培周期长,在生产中不适宜大规模采用,难以满足市场需求。为克服传统繁殖方法的不足,加快繁殖速度组织培养方法在国内外都做了不少研究,繁殖的效果也比较好[3-7]。近年来,兰州百合组织培养技术的研究也有报道[8-12],多以鳞片为外植体,繁殖率高,但鳞片不同部位的繁殖效果存在差异。本试验以兰州百合鳞片为材料,研究不同生长调节剂配比浓度对组织培养的影响,并筛选出最佳培养基配方,为兰州百合组培苗大量生产,提高种球繁殖率、抗病性,实现百合优质种球繁育产业化提供一定的理论参考。
1 材料与方法
1.1 材料
1.1.1 试验材料 以兰州百合(农家地方品种)鳞茎为试验材料。主要仪器为电子分析天平(JA2003N型)、移液枪(德国Eppendorf);药品和试剂为琼脂粉、蔗糖(分析纯)、酒精(分析纯);α-萘乙酸(NAA,化学纯)、6-苄氨基腺嘌呤(6-BA,化学纯)。
1.1.2 培养基及培养条件 本试验主要采用MS培养基为基本培养基,生根时使用MS、1/2 MS(大量元素减半),附加各种激素,每升培养基中加入蔗糖30 g(生根时20 g),琼脂6 g,调节pH值5.8~6.0,培养温度(25±1)℃,光照1600~2000 lx,14 h/d,相对湿度80%左右[13]。
1.2 方法
1.2.1 外植体的消毒 选取生长健壮的兰州百合鳞茎,剥除外层泥渍较多的老鳞茎片,剪取嫩白肥厚的鳞茎片作为外植体,先用洗涤液或洗衣粉液充分洗涤,再用流动自来水冲洗30 min,置于超净台上用75%酒精消毒30 s,最后用0.1%的升汞溶液消毒15 min,中间更换一次升汞溶液,消毒及冲洗过程中要不断摇动,使药剂充分接触,取出后用无菌水冲洗5~8次,用无菌滤纸吸干表面水分,在无菌的条件下进行接种[14]。
1.2.2 试管苗不定芽的诱导 以MS为基本培养基,6-BA设置0.5、1.0、1.5 mg/L三个浓度梯度,NAA浓度设置为0.1、0.2 mg/L,各组合见表1。每个组合接种9瓶,每瓶接种5片鳞茎片段,且分上、中、基部三个部分接于培养瓶内。
1.2.3 试管苗增殖培养 兰州百合的增殖培养过程中,用鳞茎诱导的幼苗为外植体,以MS为基本培养基,6-BA设置0.2、0.5、0.8 mg/L三个浓度梯度,NAA设置为0.1、0.2、0.3 mg/L三个梯度,各组合见表2。每个组合接种11瓶,每瓶接种4株幼苗。
1.2.4 试管苗的生根培养 试管苗增殖后,选取2~3 cm高,生长健壮的试管苗转入生根培养基中。以1/2 MS(C1~C8)、MS为基本培养基,设置6-BA、NAA两个因素,并且将1/2 MS培养基NAA浓度设置为0.1,0.2,0.3,0.4 mg/L四个浓度梯度,MS培养基NAA浓度设置为0.1,0.2,0.3,0.4 mg/L四个浓度梯度,1/2 MS培养基NAA浓度设置为0.3、0.6、0.9、1.2 mg/L,6-BA浓度设置为0.05、0.1 mg/L两个梯度,各组合见表3。每个组合接种8瓶,每瓶接种4株无菌苗,并定期观察统计生根情况。
1.2.5 试管苗移栽 当幼根在生根培养基上长到2~3 cm左右时,选取生长健壮且生根良好的兰州百合试管苗,去掉培养瓶瓶盖,炼苗1~2 d后将其取出,用自来水洗去其根部的培养基,然后移入以蛭石和珍珠岩配比为1 ∶1的营养钵中。前7 d覆盖无色透明地膜,防止水分蒸发过快,保持温度20~25 ℃左右,湿度80~90%,每1~2 d浇一次清水,中间适当补充1~2次培养液(1/20 MS大量元素),7 d后逐渐揭去塑料袋,转入常规管理。
另外,分别扦插了一批用100 mg/L的IBA和NAA浸泡5 min的无根苗于以上基质中,浇透水,置于室内散射光下,隔日浇水,并保持一定的湿度,逐渐增加光照量。大约30 d后出苗,放置于室外生长。
1.2.6 数据处理
平均芽数=统计时诱导芽总数/外植体数
诱导率(%)=(统计时萌芽总数/接种芽数)× 100
增殖倍数=统计时芽总数/接种芽数
生根率(%)=(统计时生根的植株数/接种植株数)× 100
平均根数=统计时的总根数/接种植株总数
平均根长=统计时的总根长/接种植株数
2 结果与分析
2.1 不同浓度激素对兰州百合丛生芽的诱导
根据表1的配方,将兰州百合鳞茎消毒的鳞茎片接入MS培养基中,7 d左右鳞茎片开始由白色变成淡黄色,14 d左右鳞茎片转为淡绿色,并有芽形成,3~4周后鳞茎片转为绿色,并随NAA浓度的增高,鳞茎片逐渐转为棕褐色。对40 d的诱导情况进行统计,结果如表1所示。观察发现,虽然A1培养基对鳞茎诱导丛生芽的诱导率不是最高,但其长势情况最好。
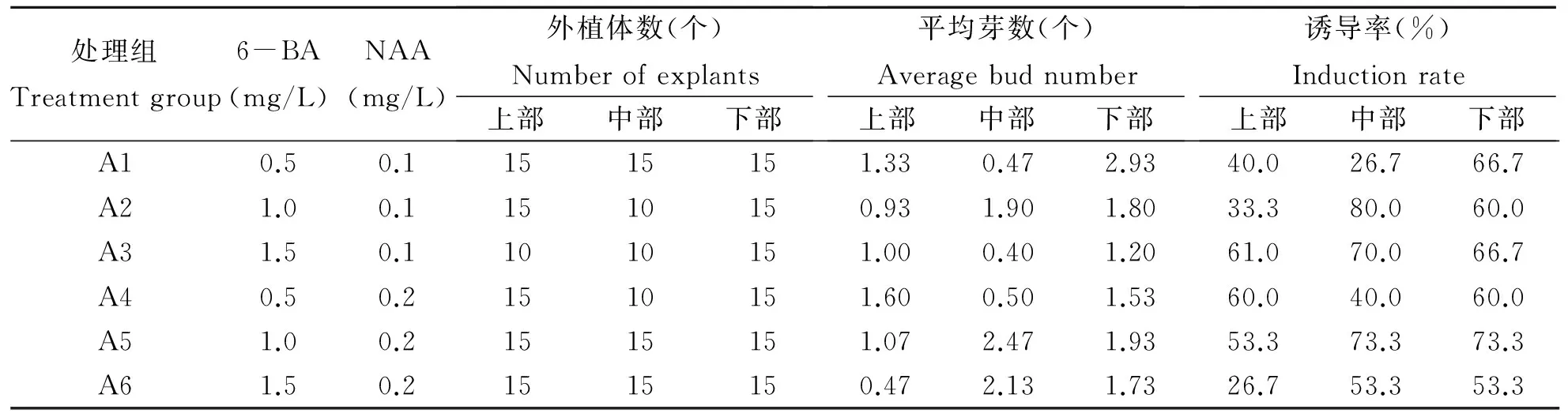
表1 不同激素配比对不定芽诱导的影响(40 d)
从表1可以看出,兰州百合上部鳞茎片诱导芽的最适培养基为:MS + 蔗糖30 g/L+琼脂6 g/L + 6-BA 1.5 mg/L + NAA 0.1 mg/L,中部鳞茎片诱导芽的最适培养基为:MS + 蔗糖30 g/L+琼脂6 g/L + 6-BA 1.0 mg/L+NAA 0.1 mg/L,下部鳞茎片诱导芽的最适培养基为:MS + 蔗糖30 g/L + 琼脂6 g/L + 6-BA 1.0 mg/L+NAA 0.2 mg/L。其中鳞茎片不同部位诱导丛生芽的诱导率顺序为下部>中部>上部。图1(A、B)是培养诱导出丛生芽的生长状况。
2.2 不同浓度激素配比对兰州百合增殖的影响
将兰州百合无菌丛生芽接入A1培养基内进行继代培养一段时间后,转接入不同浓度激素的MS培养基中,培养25 d后对增殖情况进行统计,结果如表2所示。在6-BA浓度为0.2 mg/L,NAA 0.1 mg/L的组合下诱导了大量的丛生芽,增殖倍数达到4.9,可在短期内获得较大的增殖群体,其他处理组出现的丛生芽增值倍数相对较低。
从表2可以看出,不同浓度激素配比对兰州百合增殖效果有着明显的差异,其中B1培养基处理的增殖倍数最大,其次为B4处理。极差分析结果表明,对兰州百合增殖影响最大的因素为6-BA,其次为NAA,其中6-BA以0.2 mg/L效果最好,NAA以0.1 mg/L效果最好,即最优的培养基为:MS + 蔗糖30 g + 琼脂6 g/L+6-BA 0.2 mg/L+NAA 0.1 mg/L。培养增殖芽的生长状况见图1(C、D)。

表2 不同浓度激素配比对增殖的影响(25 d)
注:K1、K2、K3和R为极差分析结果。其中K1、K2、K3分别代表各因素(6-BA和NAA)在水平1、2、3下的增殖倍数之和,R代表各因素处理后增殖倍数最大值与最小值之差。

图1 百合鳞茎不定芽诱导和植株再生各阶段生长状况
A:百合鳞茎诱导14 d左右芽的生长状况;B:百合鳞茎诱导丛生芽40 d的生长状况;C、D:百合试管苗增殖培养25 d的长势;E:百合试管苗生根培养25 d的生长状况;F:试管苗生根移栽30 d的生长状况
A: The growth status of 14 days and so on bulb of lily bulb; B: The growth status of 40 days of induction of cluster buds in lily bulb; C and D: The growth of the test tube plantlets of Lily in 25 days; E: The growth status of the test tube rooting culture of lily bulb for 25 days; F: The growth status of Lily test tube seedlings after rooting for 30 days.
2.3 不同浓度激素对兰州百合生根的影响
6-BA和NAA两种植物激素的不种组合加入1/2 MS(C1~C8)和MS生根培养基中,培养25 d的结果见表3。兰州百合在生根培养基中培养两周后植株开始生根,接种25 d的生根苗见图1(E)。
从表3可以看出,1/2 MS和MS培养基中NAA可以使生根率提高,而6-BA对百合幼苗生根具有明显的抑制作用。由此可见,就根数和根长方面而言C9组合生根培养基中NAA 0.1 mg/L时对生根效果最佳,其中C1~C8培养基内幼苗出现黑根现象,且长势较弱,C5~C8培养基内幼苗生根量较少,C9~C10培养基内幼苗根较为粗壮。综上所述,在本试验中,兰州百合幼苗生根的最佳培养基为:MS + 蔗糖30 g/L + 琼脂6 g/L+NAA 0.1 mg/L。
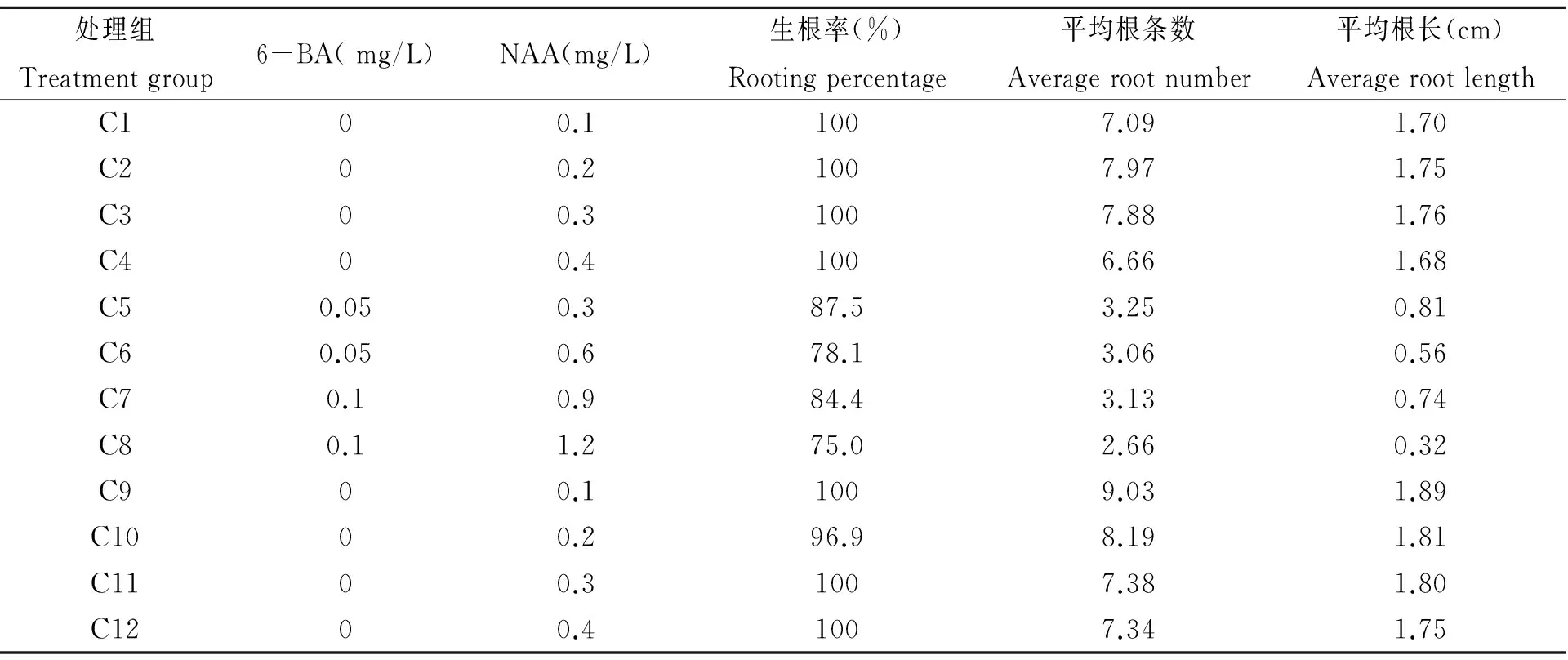
表3 不同激素浓度对生根的影响(25 d)
2.4 试管苗移栽与扦插
移栽前两周保持较高的空气湿度,移栽后的兰州百合植株能够成活,且长势较好,生根苗在两周左右长出新叶。30 d成活率的统计结果见表4,生根苗移栽见图1(F)。
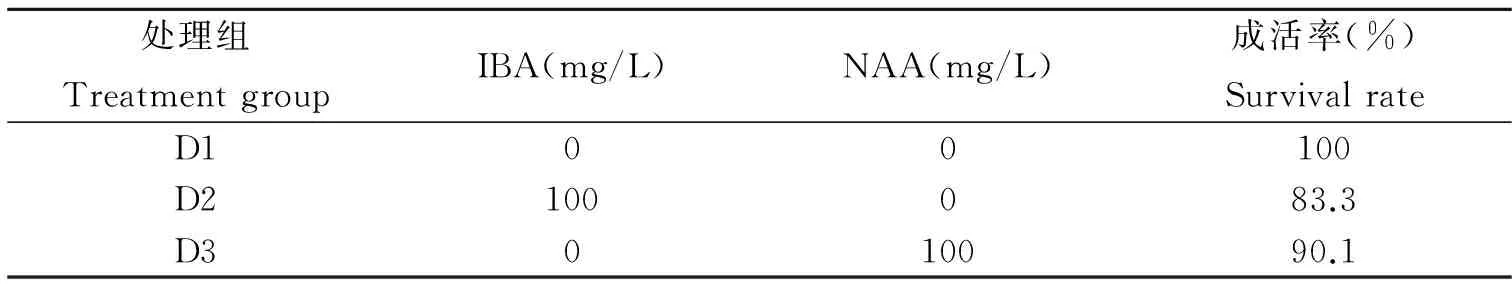
表4 移栽成活率统计(30 d)
注:D1号处理为生根苗移栽,D2、D3号为无根苗的扦插。
Note: D1 signal processing for rooting plantlets, D2, D3 for cutting seedlings.
由表4可以看出,移栽的生根苗成活率最高为100%,用NAA浸泡的扦插苗比用IBA浸泡的扦插苗成活率高。
3 结论与讨论
3.1 激素种类和浓度对兰州百合鳞茎离体诱导培养的影响
植物组织培养中,应用最多的细胞分裂素为6-BA,6-BA能促进细胞分裂,诱导芽的分化,用量一般在1.0~2.0 mg/L。当组织内细胞分裂素与生长素比例过高时,细胞分裂素起着主导作用,诱导芽的分化,促进侧芽萌发。本次试验选用了添加不同浓度6-BA和NAA的MS和1/2 MS培养基,诱导试验的结果表明,6-BA的最适浓度为1.0 mg/L。随着6-BA的浓度增加,芽的生长反而会受到抑制,甚至导致变态芽的发生,这与宛淑艳等研究结果相接近[15]。故最适培养基为:MS + 蔗糖30 g/L + 琼脂6 g/L + 6-BA1.0 mg/L+NAA 0.2 mg/L。
3.2 激素种类和浓度对兰州百合幼苗离体增殖培养的影响
不同浓度激素的作用机理不同,在兰州百合丛生芽的增殖试验中使用了6-BA和NAA两类植物激素。NAA与6-BA配合使用,不仅提高芽的增殖率,而且新芽产生时间早、增殖倍数高、种性变异小、成苗率高。
从增殖结果可以看出,幼苗发生的不定芽增殖率与培养基中添加的NAA浓度密切相关,随着NAA浓度的升高,不定芽的增殖倍数增大,NAA浓度为 0.1 mg/L时,增殖倍数达到最大值为4.9,形成丛生芽体,芽苗健壮,长势良好。当NAA浓度高于0.1 mg/L 时,形成丛生芽数量减少。
不同浓度的6-BA 对兰州百合的增殖也有较大影响,浓度较低或较高,增殖效果都不太理想,芽苗较小,长势较弱。当6-BA 浓度为0.5 mg/L时,芽苗增殖倍数最高,且芽苗健壮,叶片颜色鲜绿,长势最好。张卫芳[16]香石竹组织培养的研究也表明在MS + 蔗糖30 g/L + 琼脂6 g/L + 6-BA 0.5 mg/L + NAA 0.1 mg/L培养基上,能够保证有一定的增殖倍数。
综上所述,培养基:MS + 蔗糖30 g/L + 琼脂6 g/L + 6-BA 0.2 mg/L + NAA 0.1 mg/L 最适于兰州百合的增殖培养。
3.3 激素种类和浓度对兰州百合组培苗生根的影响
组织培养中,生长调节剂的种类和浓度的不同组合对器官的形成有着重要作用。本次试验选用了1/2 MS和MS 附加不同浓度的激素对兰州百合鳞茎片组培苗进行生根的培养。从生根结果可以看出,加入适量的NAA可以使生根率明显提高,浓度在0.1 mg/L时最佳,根条数多且长,苗长势较好。所以在兰州百合组培苗生根培养中最佳的培养基为:MS + 蔗糖30 g/L + 琼脂6 g/L + NAA 0.1 mg/L。
3.4 结论
本次试验经过多次重复对比,筛选出不同培养阶段的最佳培养基。在丛生芽诱导培养中,兰州百合上部鳞茎片诱导芽的最适培养基为:MS + 蔗糖30 g/L + 琼脂6 g/L + 6-BA 1.5 mg/L + NAA 0.1 mg/L;中部鳞茎片诱导芽的最适培养基为:MS + 蔗糖30 g/L + 琼脂6 g/L + 6-BA 1.0 mg/L + NAA 0.1 mg/L;下部鳞茎片诱导芽的最适培养基为:MS + 蔗糖30 g/L + 琼脂6 g/L + 6-BA 1.0 mg/L + NAA 0.2 mg/L。其中鳞茎片不同部位诱导丛生芽的诱导率顺序为:下部>中部>上部。在增殖培养中,最佳培养基为:MS + 蔗糖30 g/L + 琼脂6 g/L + 6-BA 0.2 mg/L + NAA 0.1 mg/L。在生根培养中,最佳培养基为:MS + 蔗糖30 g/L + 琼脂6 g/L+NAA 0.1 mg/L。生根苗移栽能够成活且长势良好。30 d的成活率统计显示:生根苗移栽成活率最高达100%。
[1]刘建常,魏国兴.兰州百合鳞茎增重规律的探讨[J].中国蔬菜,1994(5):27-30.
[2]兰州市七里河办.兰州百合系列研究[J].甘肃农业,1994(3):24-25.
[3]杨乃博,迟静芬.用组织培养的方法繁殖十种植物的实验[J].植物生理学报,1979(4):370-377.
[4]陈为民,宋为民.卷丹和青岛百合的组织培养及植株的分化[J].植物生理学通讯,1982(2):35-42.
[5]黄济民.几种花卉的组织培养[J].植物生理学报,1983(3):367-372.
[6]陈为民.百合离体培养再生植株[J].植物生理学报,1983(3):387-392.
[7]ROBB S M. The culture of excised tissue from bulb scales of Lilium Speciosum Thun[J]. Journal of Experimental Botany, 1975(8): 348-352.
[8]林贵美,李小泉,李朝生,等.兰州百合组织培养和高频繁殖[J].中国农业科技导报,2008,10(2):110-113.
[9]韩华丽,郭成金.兰州百合的组织培养[J].天津师范大学学报:自然科学版,2009,29(3):62-65.
[10]王刚,杜杰,李桂英,等.兰州百合和野百合资质培养及快速繁殖研究[J].西北师范大学学报:自然科学版,2002,38(1):69-71.
[11]罗丽萍,杨柏云,章敏华,等.百合的组织培养[J].中草药,2001,32(7):640-642.
[12]赵庆芳,曾小英,丁兰,等.东方百合组织培养和快速繁殖研究[J].西北师范大学学报:自然科学版,2003,39(1):66-68.
[13]丁兰,刘国安,田卫东,等.新铁炮百合组织培养和快速繁殖研究[J].西北师范大学学报:自然科学版,2001,37(1):80-82.
[14]王家福,陈振光.百合快速繁殖条件的优化[J].福建农业大学学报,1999,28(2):152-156.
[15]宛淑艳,包秀凤.香石竹快速繁殖技术研究[J].北方园艺,2012(6):114-117.
[16]张卫芳,段新玲.香石竹组织培养快速繁殖技术初探[J].塔里木农垦大学学报,2000,12(2):28-30.
(责任编辑:马世堂)
Adventitious Shoots Induction and Plant Regeneration from Bulb Explant ofLiliumdavidiivar.willmottiae
HU You-jun, JIA Shuang-shuang, ZHOU Yu-li
(College of Life Science, Anhui Science and Technology University, Fengyang 233100, China)
Objective:To investigate the effects of 6-BA and NAA on the induction, proliferation, rooting and transplanting of test tube seedlings ofLiliumdavidiivar.willmottiae, and to select the best culture medium in different stages. Methods: Select theLiliumdavidiivar.willmottiaebulb of robust growth, using MS as the basic medium supplemented with different concentrations of 6-BA and NAA for adventitious bud induction. The seedlings were used as explants, MS was added with different concentrations of 6-BA and NAA to test the pro-liferation and culture of test tube seedlings.The plantlets transferred to 1/2 MS and MS as the basic medium supplemented with different concentrations of 6-BA and NAA combination of rooting medium for rooting of plantlets, at the root length of 2~3 cm, 1~2 d seedling, and then into the vermiculite and perlite ratio for the management of nutrition pot in 1 ∶1. Results: Bud induction, the optimum concentration of 6-BA for 1 mg/L, high bud growth was inhibited; proliferation test, with the use of NAA and 6-BA, can enhance the bud proliferation rate and sprout time early, high proliferation rate and MS medium; 1/2 MS in NAA can improve the rooting rate of lily seedlings, 6-BA inhibited the rooting capacity. Conclusion: In different parts ofLiliumdavidiivar.willmottiaebulb slices induced multiple induction rate order lower > middle > upper buds; After transplanting, the survival rate of the regenerated plants was 100%.
Lily bulb; Adventitious bud induction; Plant regeneration
2016-06-01
安徽科技学院校级重点学科(AKZDXK2015C05)。
胡友军(1964-),男,安徽省定远县人,学士,副教授,主要从事园艺植物栽培生理及组织培养研究。
Q813.1+2
A
1673-8772(2016)06-0026-06

