酚酸酶法改性壳聚糖及其产物抗菌性能的研究
肖丽静,杨佳丽,赵希荣
(淮阴工学院生命科学与食品工程学院,江苏 淮安 223003)
酚酸酶法改性壳聚糖及其产物抗菌性能的研究
肖丽静,杨佳丽,赵希荣
(淮阴工学院生命科学与食品工程学院,江苏 淮安 223003)
通过酚类物质与壳聚糖酶法接枝以提高壳聚糖的抗菌性质。利用酪氨酸酶催化氧化酚类接枝至壳聚糖得到壳聚糖-酚类衍生物,通过红外光谱分析确定衍生物结构,采用抑菌圈法对其抗菌性能进行测定。IR表明壳聚糖-酚类衍生物在3400 cm-1、1384 cm-1、1654 cm-1处的吸收均有一定程度的减弱,在1637 cm-1出现C=N的伸缩振动峰。表明酚酸已接枝至壳聚糖分子上;壳聚糖-酚类衍生物的抑菌性能较壳聚糖有明显的提高。
壳聚糖,酚酸,酪氨酸酶,抑菌
壳聚糖其学名是β-(1→4)-2-氨基-2脱氧-D-葡聚糖,是甲壳素脱乙酰基后的产物,是自然界中存在的唯一的天然碱性线性多糖。壳聚糖不溶于水和碱溶液,但能够溶于稀盐酸、硝酸等以及大多数的有机酸中[1]。壳聚糖对人体无毒害作用,且在自然界中易被降解,也有良好的生物相容性。壳聚糖在医学、农业、食品、食品包装等诸多领域中都有着广泛应用[2-3]。
由于壳聚糖大分子链上分布着众多氨基和羟基,易形成分子间氢键,因而壳聚糖的结晶性较高、水溶性及力学性能差,生物活性如抗菌活性和抗氧化活性也完全不能令人满意,一定程度上限制了其应用。
为了改善壳聚糖的化学特性和生物活性,扩大其应用范围,对壳聚糖进行修饰,制备不同性能的壳聚糖衍生物势在必行。目前,壳聚糖的改性方法主要分为化学改性和生物改性[4-6]。壳聚搪化学改性时常用醛、酰氯、酸酐、环氧化物等活性高、危害性大的试剂,这会造成严重的环境污染,同时化学法还存在着反应步骤多,得率低、专一性差等缺点[7]。酶法改性壳聚糖具有催化活性高、专一性强且环境友好等优点,是一前景广阔的改性方法。目前,壳聚糖酶法改性所用的酶主要有酪氨酸酶(tyrosinase,tyr)[8]、过氧化物酶[9]等。
Kumar等[10]研究了利用酪氨酸酶催化氧化酚类物质接枝到壳聚糖上,酚类物质在酪氨酸酶的作用下生成醌类,醌类与壳聚糖上氨基通过席夫碱或者迈克尔加成反应进行接枝,接枝得到的壳聚糖衍生物其表面性质和流变性得到了不同程度的改善。已有诸如没食子酸、咖啡酸和阿魏酸等酚酸接枝到壳聚糖上从而赋予壳聚糖抗菌性和抗氧化活性的相关报道。这些改性物质有希望开发多功能包装材料和新型抗氧化剂。本文通过酪氨酸酶将酚酸(对香豆酸、香草酸、丁香酚、香芹酚)酶法催化接枝到壳聚糖分子上,以期改善壳聚糖的抗菌活性。
1 实 验
1.1 材料
酪氨酸酶(酶活≥1000 U·mL-1)、壳聚糖(Chitosan,CS,分子量20万,脱乙酰度90%)、对香豆酸(p-Coumaric acid,PCA)、香草酸(Vanillic acid,VA)、丁香酚(Eugenol,EU)、香芹酚(Carvacrol,CA);甲醇、乙醇、氢氧化钠、醋酸、氯化钠均为市售分析纯;琼脂,酵母浸膏为生物试剂。
1.2 仪器与设备
红外光谱分析仪、冷冻干燥机、恒温摇床。
1.3 壳聚糖酶法改性
将壳聚糖粉末分散于50 mL磷酸盐缓冲溶液(pH 6.6)中,依次加入6 mL 0.1 mol·L-1酚类物质和20 U·mL-1酪氨酸酶,置于25 ℃恒温摇床上振荡12 h。反应结束后,分别用乙醇和去离子水对产物进行漂洗,冷冻干燥。
1.4 壳聚糖-酚酸衍生物的IR表征
将壳聚糖及其衍生物分别进行溴化钾压片,用傅立叶红外光谱仪进行结构分析,扫描范围:4000~500 cm-1,分辨率为:4 cm-1,扫描16次。
1.5 壳聚糖-酚酸衍生物的抗菌活性测定
利用灭菌接种针将原始菌种(金黄色葡萄球菌、大肠杆菌、沙门氏菌、枯草芽孢杆菌)接种在预先准备好的LB液体培养基中,将接种后的液体培养基置于37 ℃的生化箱中培养24 h,得到第二代细菌,再将第二代细菌接种、培养获得第三代细菌,备用。
采用牛津杯法检测壳聚糖的抑菌能力。先取出指示菌培养物0.2 mL滴加到LB琼脂培养基平板上,之后在其表面均匀的涂上菌培养物,等待其自然干燥,再在每个平板上均匀放上4个消过毒的牛津杯,并滴入通过1%醋酸溶解的改性后的壳聚糖0.2 mL(待测样品浓度分别为0.2、0.5、0.8、1、2、5、10 mg·mL-1),将培养皿置于37 ℃生化培养箱中,24 h后取出测定抑菌圈的直径。每个样品做3次平行实验,结果取平均值。
2 结果与讨论
2.1 壳聚糖与壳聚糖-酚酸衍生物的IR分析
图1为改性前后壳聚糖及其衍生物的IR光谱图。
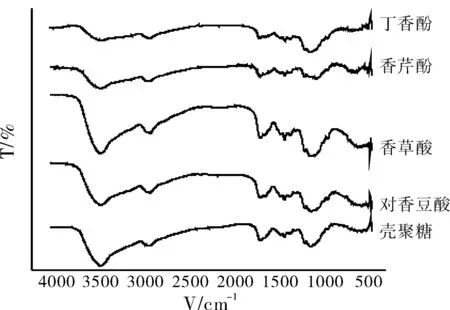
图1 壳聚糖及其衍生物红外光谱对照图
从图1中可以看出,壳聚糖改性前在3440 cm-1附近为-OH和-NH的伸缩振动的吸收带,在2875 cm-1是C-H的伸缩振动的吸收峰,1654 cm-1是氨基N-H的变形振动峰;1350 cm-1左右是氨基葡萄糖单元上NH-的弯曲振动,1261 cm-1是C-O和C-C的伸缩振动峰;1155 cm-1是C-O-C的反对称伸缩振动峰,1083 cm-1是C-O结构的伸缩振动峰;改性后,壳聚糖-酚类衍生物在3400 cm-1,1384 cm-1左右,1654 cm-1处的吸收均有一定程度的减弱,在1637 cm-1出现一个新的吸收峰,这是C=N的伸缩振动峰。这些吸收峰的变化说明壳聚糖上的氨基有所减少,与酪氨酸酶催化氧化酚类物质和壳聚糖氨基基团之间的发生共价反应相符,说明酚酸接枝到了壳聚糖分子上。
2.2 壳聚糖-酚酸衍生物抗菌性能的评价
表1~表4为改性前后壳聚糖及其衍生物的抑菌活性。

表1 壳聚糖及其衍生物对金黄色葡萄球菌抑菌效果

表2 壳聚糖及其衍生物对大肠肝菌抑菌效果

表3 壳聚糖及其衍生物对沙门氏菌抑菌效果
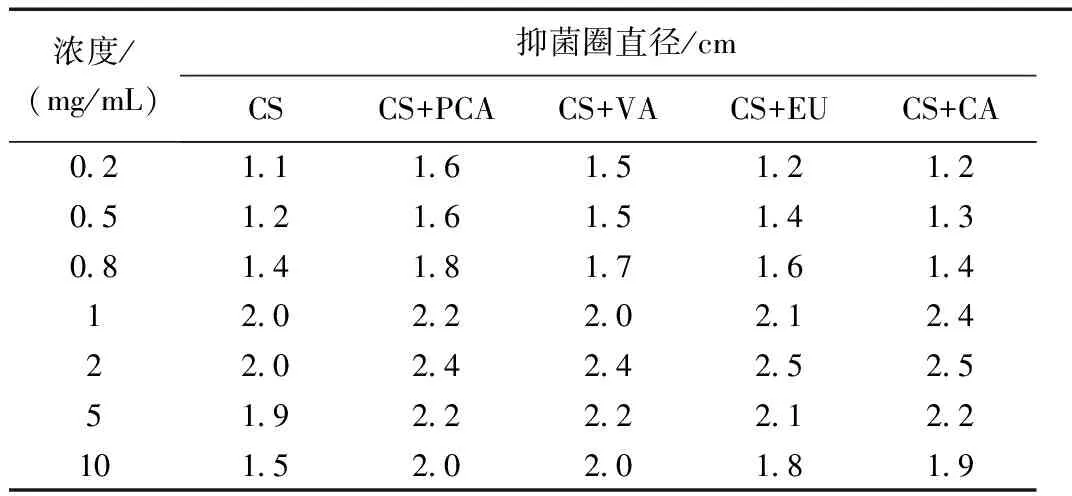
表4 壳聚糖及其衍生物对枯草芽孢杆菌抑菌效果
改性前壳聚糖对金黄色葡萄球菌、大肠杆菌、沙门氏菌和枯草芽孢杆菌都有一定的抑制作用,但是抑制作用并不强。改性后,壳聚糖-酚酸衍生物对上述四种菌的抑制能力明显提高。在较低的浓度范围内,随着壳聚糖-酚酸衍生物浓度的提高,其抑菌能力也有所提高;其中,壳聚糖-对香豆酸的抑菌能力最强。当浓度上升到一定范围后,壳聚糖-酚酸衍生物的抑菌能力有所下降。这可能是因为在较低浓度时,壳聚糖的正电荷较易与微生物细胞膜表面的负电荷之间的相互作用,从而改变了微生物细胞膜的通透性,引起微生物细胞的死亡[11];而高浓度的壳聚糖其粘度也会增大,进而会出现“再稳”现象[12];还可能是因为当浓度较高时,壳聚糖细胞壁表面所带有的致密包裹层会使得细胞质无法大量漏出。
3 结 论
本文利用酪氨酸酶催化氧化酚酸改性壳聚糖得到壳聚糖-酚酸衍生物,并进一步考察了它们对常见菌的抑制能力。结果发现,改性后的壳聚糖-酚酸衍生物的抑菌性较改性前有明显地提高。较低浓度时,壳聚糖-对香豆酸的抑菌性能最强。
[1] 蒋挺大.壳聚糖.2版[M].北京:化学工业出版社, 2001.
[2] Arvanitoyannis I S, Kassaveti A. Fish industry waste: Treaments, environment impacts, current and potential uses [J]. International Journal of Food Science and Technology, 2008,34(4):726-745.
[3] 余成华.漆酶催化氧化促进壳聚糖勘类物质接枝的研究[D].天津:天津科技大学, 2014.
[4] 马宁,汪琴,孙胜玲,等.甲壳素和壳聚糖化学改性研究进展[J].化学进展,2004,16(4):643-653.
[5] Ma N, Wang Q, Sun S L, ei al. Progress in chemical modification of chitin and chitosan [J].Progress in Chemistry, 2004,16(4):643-653
[6] 张美云,郭惠萍.季铵盐壳聚糖的制备及其在抗菌纸中的应用[J].中国造纸,2008,27(2):14.
[7] Ilyina A V, Tikhonov V E, Albulov A I, et al. Enzymic preparation of acid-free-water-soluble chitosan [J]. Process Biochemistry, 2000, 35(6):563-568
[8] 薛丽群,马秀玲,罗志敏,等.壳聚糖-对羟基苯甲酸酶法接枝及表征[J].化学通报,2007,70(9):703-706.
[9] Vachoud L, Chen T, Payne G F, et al. Peroxide catalyzed grafting of gallate esters onto the polysaccharide chitosan [J]. Enzyme and Microbial Technology,2001,9:380-385.
[10]Kumar G, Bristow J F, Smith P J, et al. Enzymatic gelation of the natural polymer chitosan [J]. Polymer,2000,41:2157-2168.
[11]Helander I M, Nurmiaho-Lassila E L, Ahvenainen R, et al. Chitosan disrupts the barrier properties of the outer membrane of gram-negative bacteria [J]. International Journal of Food Microbiology, 2001,71: 235-244.
[12]Sudharshan N R, Hoover D G, Knorr D. Antibacterial action of chitosan [J]. Food Biotechnol, 1992, 6: 257-272.
Study on Chitosan Enzymatic Modified by Phenolic Acids and Antimicrobial Activity of Products
XIAOLi-jing,YANGJia-li,ZHAOXi-rong
(College of Life Science and Food Engineering, Huaiyin Institute of Technology, Jiangsu Huaian 223003, China)
To improve the antimicrobial activities of chitosan, phenolic acid was grafted onto chitosan by enzymatic method. Phenolic acid was grafted onto chitosan by tyrosinase-catalyzed oxidation. The FTIR spectroscopy was used to character the structural changes of chitosan-phenolic acids derivatives, and the antimicrobial activities of the derivatives were analyzed. The FTIR spectroscopy presented an absorption decreased at 3400 cm-1, 1384 cm-1, 1654 cm-1, and a new band appeared at 1637 cm-1corresponding to C=N vibrations. Phenolic acids were grafted onto chitosan molecule successfully. Compared with that of nature chitosan, the antimicrobial activities of chitosan-phenolic acids derivatives were improved.
chitosan; phenolic acid; tyrosinase; antibacterial activities
肖丽静(1991-),女,研究生,专业方向:化学工程领域应用化学,壳聚糖改性与应用。
O636 1
A
1001-9677(2016)024-0063-03

