酸式盐知识整合及相关问题浅析
◇ 山东 宋志刚
酸式盐知识整合及相关问题浅析
◇ 山东 宋志刚
酸式盐是一类重要的化合物,涉及的知识分散在高中化学学习的各阶段,但各版本的教材中均没有该部分知识的系统介绍或总结.高考中有关酸式盐的题目却屡屡出现,但学生的得分率并不高.为了便于学生能全面系统地掌握酸式盐的性质和规律,笔者根据自己的教学和实践,结合其他教师的一些研究成果,对该部分内容作了如下几个方面的归纳梳理,以期把分散的知识集中,构建完整的知识体系.
1 酸式盐的概念、形成和分类
从微粒观看酸式盐概念:电离时生成的阳离子除金属离子(或NH+4)外还有氢离子,阴离子为酸根离子的盐.概念中突出盐电离时阳离子的多样性,但必须得满足有氢离子.通过化合价理论分析,我们知道,只有多元酸才能生成酸式盐,如果是n(n≥2)元酸,则它的酸式盐就有(n-1)种,这对无氧酸和含氧酸都是适用的,值得注意的是多元酸的判断并不是简单地看分子中氢原子的数目,而是由分子的结构特点来决定的,如2014年新课标全国卷Ⅰ中给出的次磷酸(H3PO2)是一元中强酸.高中阶段涉及的多元酸一般有硫酸、亚硫酸、氢硫酸、碳酸、草酸、磷酸等.
从变化观看酸式盐的形成:1)过量的酸性氧化物(如CO2、SO2等)或多元酸与少量可溶性碱溶液反应.例如,2CO2+Ca(OH)2=2Ca(HCO3)2.2)过量的酸性氧化物与少量相应酸(或称“同名酸”)的正盐反应.例如,CO2+H2O+Na2CO3=2NaHCO3.3)过量的酸性氧化物与可溶性弱酸盐(Na2SiO3)反应.例如,CO2+H2O+Na2SiO3=H2SiO3↓+2NaHCO3.4)难挥发性酸(浓H2SO4、H3PO4)与固态挥发性酸的盐(如NaCl、NaBr、NaI)微热条件下反应.例如,NaCl(固)+H2SO4(浓)=NaHSO4+HCl↑.5)多元弱酸盐的水解反应.例如,Na2CO3+H2O=NaHCO3+NaOH.
从分类观来看酸式盐的类别:一般情况下,我们依据酸式盐的电离程度不同,将酸式盐分为强酸酸式盐(如NaHSO4等)、较强酸酸式盐(如NaHSO3、NaHC2O4等)及较弱酸酸式盐(NaHCO3、NaHS等).
2 酸式盐的考查形式及应对策略
2.1 酸式盐的溶解性问题
在中学阶段,认为所有酸式盐都可溶于水,如要出现沉淀,就必须超过溶解度,并非一定要不溶于水才会出沉淀,例如向Na2CO3饱和溶液中通入CO2,就会析出NaHCO3沉淀,方程式为CO2+H2O+Na2CO3=2NaHCO3↓.高中阶段教材中没有讲过可沉淀的酸式盐,但是习题中出现过,例如磷酸一氢钙(CaHPO4),不溶于水,所以农业上用的磷肥是溶解度更大的Ca(H2PO4)2,这样才便于农作物的吸收,而且磷酸盐的肥料一般不与碱性肥料共用.
对于酸式盐与正盐的溶解度大小比较实际上并没有统一的结论.一般来讲,第ⅡA族(如钙)金属元素形成的盐,其酸式盐溶解性大于正盐,而第ⅠA族(如钠)金属元素形成的盐,其酸式盐溶解性则小于正盐(表1).
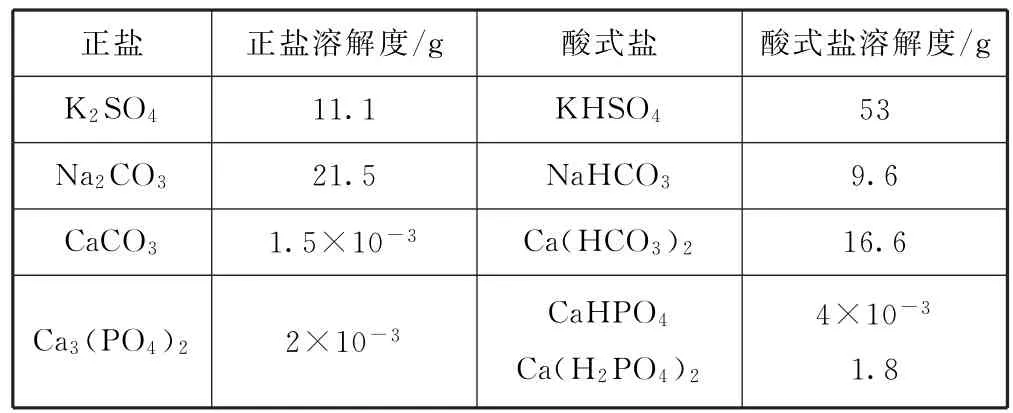
表1 几种盐的溶解度(298K)
2.2 酸式盐的热稳定性问题
热稳定性由大到小顺序为:可溶性正盐、不可溶性正盐、酸式盐、多元酸(对同一类酸而言).如大家熟知的套管实验中,直接受热的盛有Na2CO3的试管中,澄清石灰水没有变浑浊,而在间接受热的盛有NaHCO3的试管中却出现了浑浊,此对比实验能得到的结论是:NaHCO3的热稳定性小于Na2CO3的.同样的,高温煅烧石灰石可以分解得到生石灰,而碳酸氢钙只能存在于溶液中,稍有温度或压强变化就会分解成碳酸钙,因此可以得出CaCO3的热稳定性大于Ca(HCO3)2的,即正盐的热稳定性大于酸式盐,所以可以通过此种方法鉴别正盐和酸式盐,加热分解酸式盐可以得到正盐.在农田里施用碳酸氢铵这种化肥时要及时浇水溶解或深埋覆土,否则会由于NH4HCO3分解为气体而大大降低其肥效.一般说来,多元弱酸(如H2CO3、H2SO3)易分解,其对应酸式盐受热也易分解,如2NaHSO3=Na2SO3+SO2↑+H2O;多元酸较稳定,其酸式盐也较稳定,如H2SO4比H2CO3稳定,则NaHSO4比NaHCO3稳定.
2.3 酸式盐的电离和水解问题
1)强酸酸式盐在熔融状态或在水溶液中都能电离,但电离方程式不相同.如:
熔融状态:NaHSO4(熔融)=Na++HSO-4;
水溶液中:NaHSO4=Na++H++.
但需要注意的是,对于水溶液中的NaHSO4,在高考要求下,一般认为硫酸酸式盐能够完全电离,但是竞赛中的硫酸氢根看成是部分电离,而硫酸根离子也可以发生水解.硫酸的第1步电离可视为完全,而第2步电离是可逆的,二级电离常数Ka2=1.2×10-2,高中阶段认为第2步也全电离了.因此,高考中如没有特殊说明,NaHSO4溶液只考虑完全电离,不考虑水解平衡问题,溶液显酸性.
2)弱酸酸式盐一般在熔融状态易分解(见稳定性),所以不考虑熔融状态,只考虑其在水溶液中的电离问题.当然,弱酸的酸式酸根除了弱电离以外,还可以发生水解,弱酸的酸式盐在水溶液中既有电离平衡,又存在水解平衡,所以溶液的酸碱性与上述2个反应程度的相对大小有关系.电离程度大于水解程度且水溶液呈酸性的酸式盐有NaHSO3、NaH2PO4、NaHC2O4.电离程度小于水解程度且水溶液呈碱性的酸式盐有NaHCO3、Na2HPO4、NaHS.我们可以借用平衡常数的大小来比较2种平衡的相对强弱,参照表2中的数据,以NaHSO3和NaHCO3为例比较其电离和水解程度的大小.
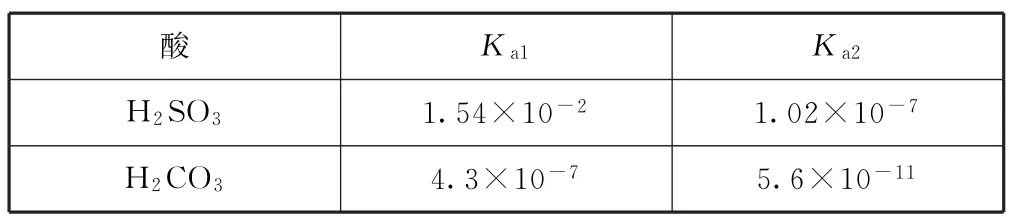
表2
2.4 酸式盐发生离子反应时的过量问题
强酸的酸式盐(如NaHSO4)一般只能和碱反应,而弱酸的酸式盐(如NaHCO3)既能与强酸反应又能与强碱反应,在和碱反应时有一些情况比较复杂,也是高考中经常出现的热点,涉及“因用量不同导致反应不同”的问题.书写方程式时,要掌握酸式盐与碱反应的本质是先发生中和反应(即OH-+H+=H2O或酸式弱酸根离子+OH-=弱酸根离子+H2O),然后再发生其他反应.通常采用“量少定量多”的原则确定参加反应的物质的量,把量少的物质设为1mol,再确定量多的物质的量从而正确写出方程式.例如向NH4HSO4溶液中滴加少量Ba(OH)2溶液的离子反应方程式的书写:因Ba(OH)2量少,设其为1mol,电离出1molBa2+和2molOH-,NH4HSO4足量,能电离出足够多的、H+和,OH-与、H+均反应,但是反应顺序是与H+先中和然后才会和反应,所以离子反应为Ba2++2OH-++2H+=BaSO4↓+2H2O;反之向Ba(OH)2溶液中滴入少量NH4HSO4溶液的离子反应方程式为+H+++Ba2++2OH-=BaSO4↓+H2O+NH3·H2O.如2008年上海卷第20题向Ba(OH)2溶液中加入少量的NaHSO3溶液的反应,2011年新课标卷第12题NH4HCO3溶于过量NaOH溶液中,2008年天津卷第11题NH4HSO3溶液与足量NaOH溶液混合加热等题型的离子方程式书写等,均可以用这种方法书写.
2.5 酸式盐在水溶液中离子浓度大小比较问题
从化学原理角度分析电解质溶液中微粒浓度关系的判定所涉及的化学知识点有:1)强电解质的电离;2)弱电解质的电离平衡;3)水的电离平衡;4)盐类的水解规律;5)物料守恒、电量守恒、质子守恒3大守恒原理.实际的考试题目,一般分为单一溶质溶液和混合溶质溶液2大类,涉及酸式盐溶液中离子浓度的考查,难度更高.
解决此类问题的关键是要抓住酸式盐溶液中的2个平衡“电离平衡、水解平衡”,先找出2个守恒式“电荷守恒、物料守恒”,再用电荷守恒和物料守恒2个等式联立,消掉不变的离子,即可得到第3个守恒式——质子守恒,然后再尝试比较其微粒浓度的大小顺序,这对分析电解质溶液的相关问题具有很强的指导作用,以0.1mol·L-1的NaHCO3溶液为例说明.先列出2个平衡⇌H++(程度小),+H2O⇌H2CO3+OH-(程度大).从比较和分析2个平衡入手,找到3个守恒式和1个不等式:
电荷守恒式(最重要):c(H+)+c(Na+)=c(OH-)+c()+2c().
物料(原子)守恒式:
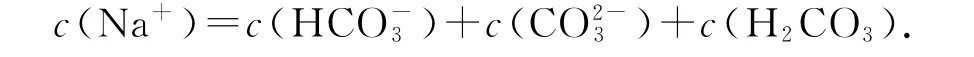
相减可以得到质子守恒:
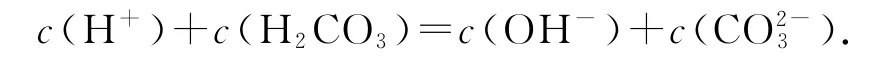
微粒浓度大小关系:
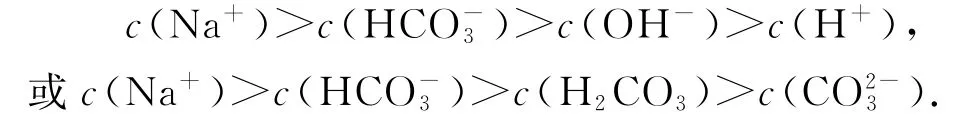
之所以不把所有微粒浓度大小的比较列在一起,是因为它们的大小需要经过系列运算才能得到,经过简单计算得出了如下结论:1)当水解大于电离,溶液呈碱性时,如、HS-、,粒子浓度大小关系为c(Na+)>c(HA-)>c(H2A)>c(A2-)>c(OH-)>c(H+),H2A代表二元弱酸,HA-代表二元弱酸的酸式酸根阴离子,下同;2)当电离大于水解,溶液呈酸性时,如、,粒子浓度大小关系为c(Na+)>c(HA-)>c(A2-)>c(H2A)>c(OH-)>c(H+).当然,对于以上的结论,如果考虑到溶液本身浓度的影响,精密计算表明Na HA溶液中质子守恒关系式:


3 酸式盐的考查中存在的一些常见问题
以实验为基础的化学学科的新课程教学,对激发学生探究新知识的欲望和学习兴趣起到了重要的作用,但在备课和实验教学实践中,笔者注意到其中尚存在一些不足甚至错误,为防止一些概念的错误在学生身上再现,我们除了要十分注重培养学生创新能力外,还必须善于发现科学性错误.
酸式盐的溶解度一般比正盐要大,但是20℃时NaHCO3溶解度为9.6g,有些题目甚至教材中却出现了配制2mol·L-1NaHCO3的科学性错误,有些题目中也出现了熔融的NaHCO3这种科学性错误,这都是知识的不熟练和教条主义使然.弱酸的酸式酸根因为同时存在着电离平衡和水解平衡,所以不能在强酸或强碱体系中大量存在,但是并不是不能大量存在于弱酸或弱碱体系中,比如2014年山东省高考题目中,HCO-3本身水解大于电离而呈弱碱性,所以可以在弱碱性溶液中存在.溶液中粒子浓度的关系是高中化学的重要考点,围绕粒子浓度关系编写的习题综合性强,能很好地考查考生对电离平衡及盐类水解知识的理解.2014年全国新课标卷Ⅱ中,等浓度的CH3COONa与NaHCO3溶液pH比较,不能想当然认为HCO-3水解能力大于CH3COO-的水解能力,通过分析可以得出CH3COONa溶液的pH小于NaHCO3溶液的pH的结论.有些教师通过绘制不同浓度下2种溶液的pH并进行分析,结果发现当溶液浓度等于7.3×10-3mol·L-1时,二者pH相等,当溶液浓度大于7.3×10-3mol·L-1时,CH3COONa溶液的pH大于NaHCO3溶液的pH,而当溶液浓度小于7.3×10-3mol·L-1时,CH3COONa溶液的pH小于NaHCO3溶液的pH.因此笔者以为,在比较二者的pH大小时,基于科学严谨的态度,必须指明溶液浓度,当然在常用浓度范围内,CH3COONa溶液的pH理应大于NaHCO3溶液的pH.通过前面的分析,我们知道,对于一般浓度的弱酸或中强酸的酸式盐,如NaHCO3、NaHSO3、NaHC2O4等,离子浓度大小受到电离、水解及初始浓度等多方面的影响,因此在编制或讲解这类习题时,最好回避这些溶液中所有离子浓度的排序,以免超出高中所学范围,犯教条主义和科学性错误.
(作者单位:山东师范大学附属中学)

