化学杀雄剂SQ-1和阿拉伯葡聚糖蛋白对小麦品种间杂交及远缘杂交成胚率的影响
王坤杨,张 伟,张双喜,刘宏伟,王 轲,杜丽璞,林志珊,叶兴国
(1中国农业科学院作物科学研究所/农作物基因资源与基因改良国家重大科学工程,北京 100081;2宁夏农林科学院农作物研究所,银川 750105)
化学杀雄剂SQ-1和阿拉伯葡聚糖蛋白对小麦品种间杂交及远缘杂交成胚率的影响
王坤杨1,张 伟1,张双喜2,刘宏伟1,王 轲1,杜丽璞1,林志珊1,叶兴国1
(1中国农业科学院作物科学研究所/农作物基因资源与基因改良国家重大科学工程,北京 100081;2宁夏农林科学院农作物研究所,银川 750105)
【目的】探究化学杀雄剂SQ-1对小麦品种间、小麦与近缘植物间、小麦与远缘植物间杂交成胚率的影响,以及阿拉伯葡聚糖蛋白对小麦与玉米杂交成胚率和得苗率的影响。研究结果对于合理选用小麦杂交方式,提高小麦杂交结实率和利用玉米诱导小麦单倍体植株的效率具有重要意义。【方法】通过在小麦拔节期喷施化学杀雄剂SQ-1,开花期分别授以小麦花粉和远缘植物(黑麦、玉米)花粉,并在小麦授玉米花粉后的处理液中加入不同浓度的阿拉伯葡聚糖蛋白(arabinogalactan proteins,AGP),对小麦与玉米杂交后产生的幼胚进行离体拯救培养,统计授粉小花数、接种幼胚数、膨大颖果数、结实粒数、萌发单倍体幼胚数和单倍体植株数,计算结实率、颖果膨大率、成胚率、萌发率和成苗率并对所得数据进行差异显著性分析,结合细胞学观察结果,研究SQ-1对小麦品种间杂交及远缘杂交结实性的影响,以及AGP对小麦单倍体胚诱导率的影响。【结果】在不同小麦品种间杂交中SQ-1处理结实率19.8%—83.3%,人工去雄的结实率为69.4%—93.0%,SQ-1对不同品种的影响不同,Fielder对SQ-1的反应比较敏感;在中国春与兰州黑麦杂交中,SQ-1处理的结实率为65.5%,人工去雄处理的结实率为78.8%,两种处理方式产生的F1杂种的染色体数均为28条;在不同小麦品种与玉米品种郑单 58杂交中,SQ-1处理小麦单倍体胚的成胚率为 1.11%—1.41%,人工去雄小麦单倍体胚的成胚率为2.38%—14.29%;在小麦与玉米杂交后的处理液中添加 0.5—2.0 g·L-1AGP一定程度地提高了小麦单倍体胚获得率和成苗率。另外,在玉米花粉诱导的单倍体胚离体培养过程中,发现13.07%的胚发育出了2—6株苗;显微镜观察发现,玉米花粉诱导后18 d左右小麦单倍体胚上出现了多个突起,这些突起在离体培养条件下进一步发育为形态健全的小植株,其染色体数目均为21条。【结论】化学杀雄剂SQ-1减低了小麦品种间杂交及小麦与黑麦、玉米间杂交的成胚率,AGP提高了小麦与玉米间杂交单倍体成胚率和成苗率。
普通小麦;化学杀雄剂SQ-1;阿拉伯葡聚糖蛋白;小麦品种间杂交;远缘杂交;单倍体胚
0 引言
【研究意义】小麦(Tritium aestivum L.)是世界上分布范围较广、种植面积较大、单产和总产量较高的粮食作物之一,作为重要的人类食品、动物饲料和加工原料,其产量和品质对国民经济的发展和人民生活水平的改善至关重要[1]。其中,培育优良品种是提高小麦产量、改进小麦品质的主要措施[2]。在众多小麦育种方法中,常规杂交育种是最为有效的途径。利用玉米花粉诱导小麦单倍体的加倍单倍体途径是正在兴起的育种技术[3-5],并利用该技术培育了小麦新品种[5-6],具有潜在发展空间。【前人研究进展】去雄是小麦杂交育种、远缘杂交育种和基于染色体消除加倍单倍体育种中一项繁琐的工作,常常需要花费较长时间和较多人力,化学杀雄剂(chemical hybridization agent,CHA)可以有效解决这一问题[7]。在长期的育种实践中,人们尝试了多种化学杀雄剂[8-10],但效果都不尽理想,存在药效不稳定、杀雄不彻底、环境不友好等缺点[11],没有充分发挥化学杀雄在育种中的作用。化学杀雄剂 SQ-1很好地克服了上述缺点,效果持续时间长、杀雄彻底、无环境污染,在适宜条件下杀雄率达95%—100%,异交结实率超过85%,在中国很多小麦育种单位得到了普遍应用[10-12]。在杀雄机理方面,SQ-1可抑制花药中的糖酵解、三羧酸循环及电子传递链过程,使不育株花药的有氧代谢过程受阻,能量供应不足,导致花粉细胞大量败育。因此,在不育花药中花药细胞内积累了过量活性氧,为消除过量的活性氧,抗氧胁迫相关基因大量表达。另外,化学杀雄剂 SQ-1诱导小麦败育花粉细胞的异常变化与RAFTIN1的表达相对应[13]。但有关化学杀雄剂 SQ-1对小麦品种间杂交及小麦与玉米杂交结实性的影响还缺乏研究。在玉米花粉诱导小麦单倍体方面,杂交后的成胚率较低[14],限制了该技术在育种实践中的有效应用,需要提高小麦与玉米杂交的成胚率。研究表明,阿拉伯半乳聚糖蛋白(arabinogalactan proteins,AGP)作为高等植物细胞组成的主要糖蛋白[15],在植物胚胎发生过程中起重要作用[16-17]。从云杉(Piceaabies)种子中提取的 AGP能够促进其悬浮细胞体细胞胚的发育[18],从胡萝卜种子中提取得到的AGP可以促进其胚性细胞的增加。培养基中添加 AGP结合剂β-Glc Yariv,再生性能较好的菊苣品系其叶片再生性能完全受到抑制,β-Glc Yariv移除后,菊苣叶片又恢复再生能力,且AGP在胚性细胞形成过程中的表达上调[19]。培养基中添加10 mg·L-1AGP对油菜[20]、大白菜[21]小孢子胚胎发生及胚性细胞分化过程有促进作用,降低了胚状体褐化和死亡现象,显著提高了成苗率。培养基中添加10 mg·L-1AGP对小麦小孢子胚状体发生同样具有促进作用,降低了小孢子死亡率和白化苗发生率[22]。培养基中添加50—100 mg·L-1AGP显著促进了不同小麦品种幼胚培养胚状体的发生,提高了植株再生率[23]。【本研究切入点】目前,有关SQ-1对小麦品种间杂交及小麦远缘杂交结实性的影响还缺乏研究,AGP是否可以提高玉米花粉诱导后的小麦单倍体成胚率还未见报道。【拟解决的关键问题】本研究在小麦拔节期喷施SQ-1,开花期分别授以小麦花粉和玉米花粉,研究 SQ-1对小麦品种间杂交以及小麦与黑麦、玉米杂交成胚率的影响。同时,通过在小麦与玉米杂交后的处理液中加入不同浓度 AGP,研究AGP对小麦单倍体胚诱导率的影响。另外,在离体培养条件下发现玉米花粉诱导小麦单倍体胚多苗现象,并进行组织细胞学观察,对于在小麦杂交育种和单倍体育种合理利用SQ-1及AGP,提高玉米花粉诱导小麦单倍体成胚率等,具有一定参考价值。
1 材料与方法
1.1 植物材料
冬小麦品种济麦22、扬麦16和科农199,春小麦品系Fielder、CB037和中国春(CS)由中国农业科学院作物科学研究所小麦分子遗传课题组收集、保存,兰州黑麦由北方民族大学生物科学与工程学院任贤教授提供。抗白粉病高代春小麦品系JW38由中国农业科学院作物科学研究所小麦分子遗传课题组利用宁春4号与CB037杂交,然后用宁春4号回交5次,自交4次,分子标记辅助选择结合白粉病抗性鉴定选育而成。2014—2016年,用于试验的冬小麦材料秋播于中国农业科学院作物科学研究所试验农场,春小麦材料和兰州黑麦分别冬播或春播于中国农业科学院作物科学研究所温室和试验农场。玉米杂交品种郑单58花粉取自中国农业科学院作物科学研究所温室。
1.2 化学杀雄和人工去雄及授粉
化学杀雄方法:小麦拔节末期(旗叶一半露出倒二叶叶鞘,雄蕊发育处于药隔期)用小型压力喷壶喷施化学杀雄剂SQ-1(全国小麦杂种优势利用攻关协作组提供,中国农业科学院作物科学研究所矮败小麦课题组保存),浓度为原药液的12%(添加1% Tween),喷洒时间为下午17:00,抽穗2 d及时整穗(去除上、下部小穗和每个小穗中间小花)、套袋,整穗3 d(颖壳已蓬松、柱头羽毛状已张开)授小麦花粉或远缘植物(黑麦、玉米)花粉。人工去雄:小麦抽穗1—2 d及时整穗(花粉尚未成熟,去除上、下部小穗和每个小穗中间小花)、去除花药和套袋,去雄3 d授小麦花粉或远缘植物(黑麦、玉米)花粉。收集玉米新鲜花粉的方法为上午8:00抖去雄穗上的旧花粉,上午10:00用A4打印纸收集花药中的新鲜花粉。每个杂交组合至少设置3次重复。品种间杂交每个重复2穗以上,远缘杂交每个重复10穗以上,每穗22—26朵小花。化学杀雄剂 SQ-1处理后小麦发育时期比对照推迟2—3 d,授粉时期相应比人工去雄推迟2—3 d。
1.3 玉米花粉诱导后的处理和阿拉伯葡聚糖蛋白浓度设置
化学杀雄和人工去雄的小麦穗授玉米花粉后,分别于第 2天和第 3天用小型压力喷壶喷施含 2,4-D(Sigma公司产品,货号为D7299)100 mg·L-1的处理液。为了研究阿拉伯葡聚糖蛋白对玉米花粉诱导后小麦单倍体成胚率的影响,在处理液中添加了0、0.5、1.0和2.0 g·L-1阿拉伯葡聚糖蛋白(Sigma公司产品,货号为G9752)。
1.4 小麦远缘杂交幼胚离体拯救培养
小麦与黑麦、玉米杂交后18—20 d,从田间或温室中采集授以玉米花粉的全部小麦杂交穗和授以黑麦花粉的部分小麦杂交穗,剥取杂交籽粒(授玉米花粉的小麦颖果空瘪、膨大,没有胚乳;授黑麦花粉的颖果发育正常,包括胚和胚乳),依次用70%酒精表面消毒1 min,15 %次氯酸钠灭菌20 min,无菌水冲洗5次,在解剖镜下取出杂交幼胚,胚轴朝上接种至1/2MS培养基(1/2MS大量元素、1/2MS微量元素、1/2MS铁盐、VB1 1.0 mg·L-1、谷氨酰胺150 mg·L-1、蔗糖20 g·L-1和植物凝胶2.4 g·L-1,pH6.0)上,每个培养管接种3—4个杂交胚,25℃黑暗条件下培养3 d,然后在25℃、光照条件下培养20—25 d。
1.5 组织学和细胞学观察
小麦与玉米杂交诱导的小麦单倍体胚接种后2 d,在体式显微镜下观察单倍体胚的组织结构。小麦与黑麦杂交产生的二倍体胚和小麦与玉米杂交产生的小麦单倍体胚培养15—20 d时,从试管中培养的小麦植株上取1—2 cm长度的根尖,冰水处理24 h,浸泡在3∶1的酒精与乙酸溶液中固定24 h,然后放入95%酒精中保存。将经固定液处理的根尖用1N HCl在60℃下水解14 min,然后用醋酸洋红进行染色,在相差显微镜下观察染色体数目。
1.6 数据统计和分析
小麦与玉米杂交后20 d统计授粉小花数和发育籽粒数,接种后统计接种胚数,培养7 d后统计萌发胚数,培养15—20 d统计单倍体苗数,计算籽粒发育率(幼嫩籽粒数/授粉小花数×100%)、得胚率(接种胚数/授粉小花数×100%)、萌发率(萌发胚数/授粉小花数×100%)和成苗率(单倍体苗数/授粉小花数×100%)。小麦品种间及小麦与黑麦杂交后30—35 d直接收获成熟杂交穗,统计授粉小花数和结实粒数,计算杂交结实率(结实粒数/授粉小花数×100%)。用t测验分析人工去雄和化学杀雄间主要指标的差异显著性。
2 结果
2.1 化学杀雄剂 SQ-1对小麦品种间杂交结实率的影响
对3个小麦品种Fielder、科农199和济麦22先后在拔节末期和抽穗期进行化学杀雄和人工去雄,分别授以CB037或Fielder花粉,统计授粉小花数和结实粒数,计算杂交结实率(表1)。结果显示,Fielder、科农199和济麦22人工去雄的结实率分别为69.4%、82.8%和 93.0%,化学杀雄的结实率分别为 19.8%、73.3%和83.3%,人工去雄比化学杀雄的结实率高9.5%—49.6%。不同小麦品种内 2个处理间的差异均达到极显著水平。结果表明,相比人工去雄,化学杀雄剂SQ-1处理显著降低了小麦品种间杂交结实率,对不同品种的影响不同,对Fielder的影响最大,对科农199和济麦22的影响相似。
2.2 化学杀雄剂 SQ-1对小麦与黑麦杂交结实率的影响
利用小麦品种CS作为母本,兰州黑麦作为父本,研究了化学杀雄和人工去雄对小麦与黑麦远缘杂交结实率的影响。结果显示,人工去雄方式中CS与兰州黑麦的结实率为78.8%,SQ-1杀雄方式中CS与兰州黑麦的结实率为64.5%(表2)。与人工去雄方式相比,使用化学杀雄剂SQ-1降低了小麦与黑麦间杂交的结实率,差异达到显著水平(表 2)。CS与兰州黑麦 F1杂种根尖细胞有丝分裂中期染色体观察发现,人工去雄方式和化学杀雄剂SQ-1处理方式产生的F1杂种染色体数目均为28条(图1),表明SQ-1处理对小麦与黑麦远缘杂交后的染色体构成没有影响。

表1 人工去雄与化学杀雄对小麦品种间杂交效果的影响Table 1 Effect of artificial emasculation and chemical hybridization agent on seed setting between wheat varieties

表2 人工去雄与化学杀雄对中国春与兰州黑麦杂交效果的影响Table 2 Effect of artificial emasculation and chemical hybridization agent on seed setting in a wild cross between a wheat line Chinese Spring and a rye line Lanzhou Heimai

图1 不同去雄方式获得中国春与兰州黑麦F1杂种的染色体构成鉴定Fig. 1 Identification of chromosome constitution of the F1hybrid between a wheat line Chinese Spring and a rye line Lanzhou Heimai by different emasculation treatment methods
2.3 化学杀雄剂 SQ-1对小麦与玉米杂交成胚率的影响
冬小麦品种科农199、春小麦高代小麦品系JW38在拔节末期进行化学杀雄和人工去雄处理,分别授以玉米杂交品种郑单58花粉,统计授粉小花数、膨大籽粒数和形成幼胚数,计算籽粒膨大率和得胚率(表3)。对科农199而言,人工去雄情况下籽粒膨大率和成胚率分别为66.45%和14.29%,SQ-1化学杀雄情况下籽粒膨大率和成胚率分别为66.53%和1.41%;对JW38来说,人工去雄情况下籽粒膨大率和成胚率分别为54.69%和2.38%,化学杀雄情况下籽粒膨大率和成胚率分别为59.28%和1.11%。对科农199、JW38化学杀雄和人工去雄处理的颖果率和得胚率进行的t测验结果表明,SQ-1处理对颖果率没有影响,但对成胚率有显著影响,与人工去雄处理的差异达到了显著或极显著水平(表3)。认为化学杀雄剂SQ-1在阻碍了小麦雄配子发育的同时,也一定程度影响了小麦雌配子的发育,但对小麦种皮的发育没有影响。

表3 人工去雄与化学杀雄对小麦与玉米物种间杂交效果的影响Table 3 Effect of artificial emasculation and chemical hybridization agent on haploid wheat embryo induction between wheat and maize
2.4 阿拉伯葡聚糖蛋白对小麦与玉米杂交成胚率和得苗率的影响
小麦品种扬麦16用玉米品种郑单58授粉后,分别用含阿拉伯葡聚糖蛋白0.5、1.0和2.0 g·L-1的2,4-D(100 mg·L-1)处理液处理,以不含AGP的2,4-D处理液作为对照。结果发现,随着2,4-D处理液中AGP浓度的增加,小麦单倍体胚的得胚率从 11.5%逐渐提高到17.0%、萌发率从8.0%提高到12.0%、成苗率则从9.3%提高到14.5%(图2),表明2,4-D处理液中加入0.5—2.0 g·L-1AGP一定程度提高了小麦与玉米杂交后小麦单倍体胚的获得率,相应提高了小麦单倍体成苗率(图2),认为AGP一定程度促进了小麦与玉米杂交后小麦单倍体胚的生长和发育。
2.5 玉米花粉诱导小麦单倍体胚的多苗现象
对小麦品种扬麦16与玉米品种郑单58杂交后产生的部分小麦单倍体胚在离体培养条件下进行了组织学观察,发现一些单倍体胚表面有 2—6个突起(图3-A)。培养15—20 d,每个突起发育为独立的幼苗,即出现了一胚多苗现象(图 3-B),部分单倍体胚出现了4—6棵苗,在13.07%的单倍体胚上观察到了一胚多苗现象。这些一胚多苗植株只有 1个根系(图3-B),染色体检查结果表明,其染色体数目为21条(图3-C),为没有加倍的单倍体植株。
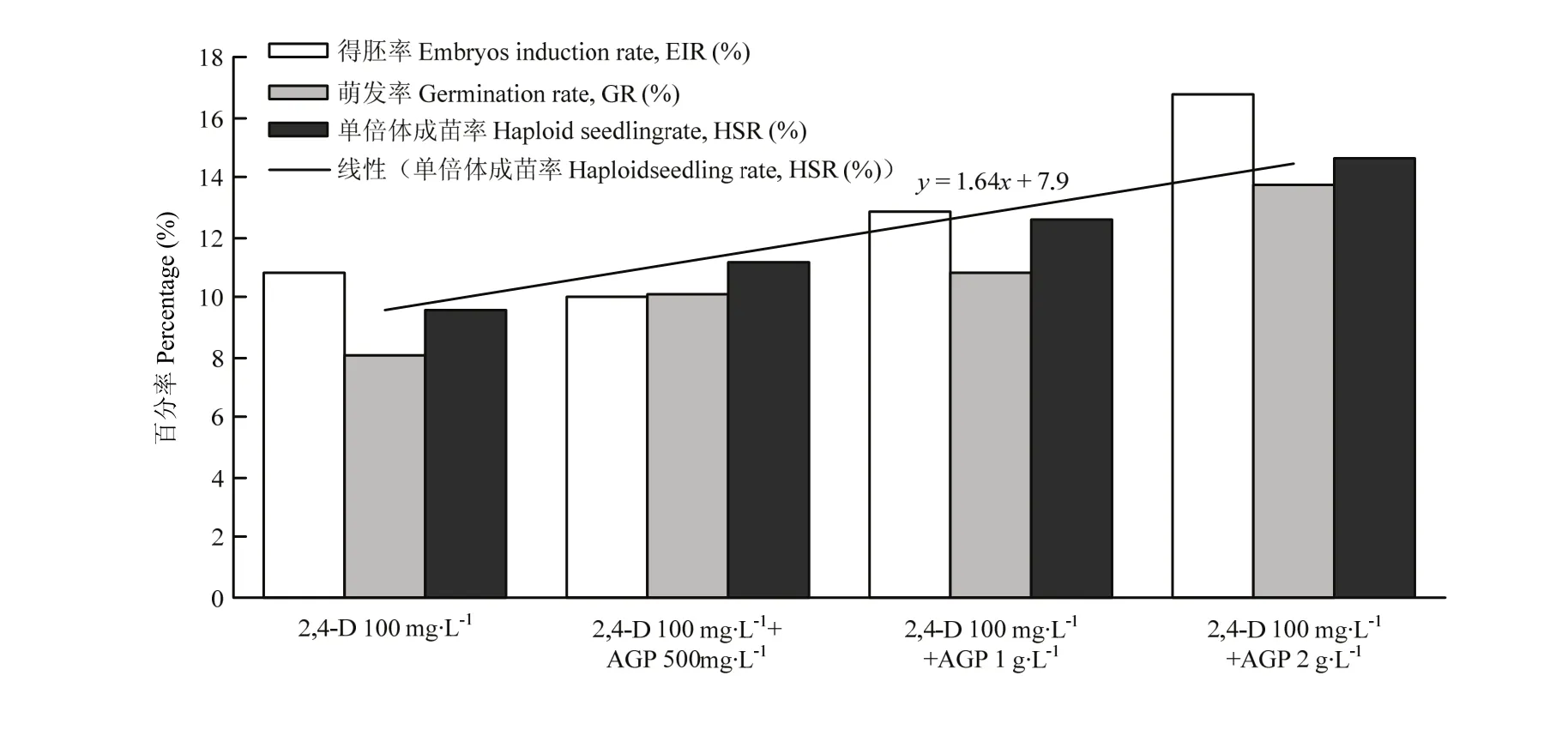
图2 不同浓度AGP对小麦与玉米杂交产生小麦单倍体的影响Fig. 2 Impact of different AGPs concentrations on haploid wheat embryos and plants induction in the wild cross between wheat and maize

图3 玉米花粉诱导小麦单倍体胚的组织学和染色体观察Fig. 3 Histological and cytological observation of haploid wheat embryos and plants derived from the wild cross between wheat and maize
3 讨论
目前,在小麦杂交育种和单倍体育种中,配制杂交组合主要采用人工去雄、化学杀雄和雄性不育系利用等方式,这3种配制方式各有优劣。人工去雄授粉的配组自由度比较大,灵活性较好,其缺陷是耗费较多人工和时间,而且易受不良天气条件的影响。化学杀雄简便快速,成本较低,可以配制大量杂交组合,但很多化学杀雄剂的杀雄效果不够稳定,一经喷药就不能收获自交种子,对环境有一定影响。雄性不育系尤其是矮败小麦的利用[24-25],不但极大节约了人力和时间,可以大规模配制杂交组合并进行轮回选择[26-27],而且不受天气和环境条件的影响,不育系种子和可育系种子同时获得[25],但配制杂交之前需要把常用小麦亲本转育为矮败小麦,前期准备工作耗时较长。近几年,利用矮败小麦与玉米杂交,成功获得了2种类型的小麦单倍体植株,证明了矮败小麦用于小麦单倍体育种的可行性[28],另外发现,不同杂交技术对小麦与玉米种间杂交产生单倍体有一定影响,利用改良垂直剪颖剪药杂交技术不仅操作方便,而且功效高速度快[29]。育种工作中根据选用的杂交亲本和人员等具体情况,灵活运用各种杂交组合配制方式。
迄今为止,化学杀雄剂SQ-1在小麦[9-11]、糜子[30]、谷子[31]等作物杂交育种中得到了较为广泛的应用,同时,对化学杀雄剂的作用机制也进行了一定研究。SONG等[32]的研究结果表明,化学杀雄剂SQ-1处理小麦植株后,小麦旗叶发生了氧化胁迫,叶片中的氧自由基、H2O2和丙二醛水平显著增加,相反,超氧化物歧化酶、过氧化物酶和愈创木酚过氧物酶等主要抗氧化酶的活性显著降低。BA等[33]利用cDNA扩增片段长度多态性(cDNA-AFLP)和甲基化敏感扩增多态性(MSAP)对1 376株化学杀雄剂诱导的雄性不育株DNA甲基化水平进行了研究,发现6.66%的DNA序列在基因表达上发生了变化,3.42%的DNA序列出现了甲基化现象,喷施 SQ-1后小麦植株中基因表达水平和DNA甲基化水平显著变化。ZHU等[34]运用转录组测序技术比较分析了 SQ-1处理的小麦植株和对照植株花药部位的基因表达差异,发现1 088个基因在SQ-1处理和未处理的小麦花药中的表达水平有明显差异,其中的643个基因上调表达,445个基因下调表达,这些基因主要涉及到光合作用、呼吸作用、嘌呤和嘧啶代谢、氨基酸代谢、谷胱甘肽代谢、RNA转运和信号转导等生理过程。WANG等[35]运用光学显微镜镜检、末端标记法和蓝色荧光染色等方法观察了SQ-1处理后小麦花药的显微结构,发现绒毡层细胞大量程序性死亡,进而导致花药败育。李莉等[36]通过利用 2-DE凝胶电泳技术和生物信息学技术比较了小麦遗传性雄性不育系和SQ-1诱导的生理型雄性不育系,发现6个差异蛋白可能与雄性不育相关。
但是,化学杀雄剂 SQ-1对小麦品种间杂交,以及小麦与玉米杂交后诱导小麦单倍体等的影响还鲜有报道。本研究探讨了 SQ-1对小麦品种间杂交结实率的影响,以及小麦与玉米杂交后诱导小麦单倍体植株等的影响,结果表明,SQ-1处理后小麦品种间杂交的结实率以及小麦与玉米杂交后小麦单倍体胚和单倍体植株诱导率均有降低,认为 SQ-1处理不但致使小麦小孢子败育,也一定程度影响了小麦大孢子的育性,具体原因有待进一步研究。
以往有关 AGP促进植物胚胎发生的作用多侧重于培养基添加[21-23],AGP直接处理植株的研究则不多。研究发现,在适宜浓度 2-吗啉基乙磺酸(3 mmol·L-1)和pH(6.4)条件下,喷施10 mg·L-1的AGP能够显著提高甘蓝花药培养胚胎发生率[37]。另外,LETARTE等[22]对2个春小麦品种喷施阿拉伯半乳聚糖(arabinogalactan,AG)和AGP,发现小麦花药培养的胚胎发生率和植株再生率显著增加。然而,有关AGP在小麦与玉米杂交中诱导小麦单倍体植株的影响还未曾研究。本研究发现,在小麦与玉米杂交后的2,4-D处理液中添加0.5—2.0 mg·L-1AGP一定程度提高了小麦单倍体胚获得率、萌发率和成苗率,并且经AGP处理产生的单倍体胚出现了频率较高的一胚多苗的现象。陈新民等[38]用 3个小麦品种与玉米杂交后,发现7.8%的胚表现为多苗现象(一个胚萌发出2—3个苗),认为这种现象可能是由胚的多极化造成的。本研究中观察到玉米花粉诱导的部分单倍体胚表面有4—6个突起结构,进一步发育出4—6个苗,认为这些突起可能是发育形成多苗的胚性组织,一胚多苗现象可能在小麦与玉米杂交中广泛存在,有关其产生机制有待进一步探究。
4 结论
化学杀雄剂 SQ-1处理情况下,不同小麦品种间杂交结实率为19.8%—83.3%,中国春与兰州黑麦杂交结实率为65.5%,不同小麦品种与玉米杂交诱导小麦单倍体胚成胚率为1.11%—1.41%;而在人工去雄情况下,不同小麦品种间杂交结实率为 69.4%—93.0%,中国春与兰州黑麦杂交结实率为78.8%,不同小麦品种与玉米杂交诱导小麦单倍体胚成胚率为 2.38%—14.29%;2种处理方式的差异达到显著或极显著水平,表明SQ-1显著降低了小麦品种间杂交及小麦与黑麦、玉米间杂交的结实性。在小麦与玉米杂交后的处理液中添加0.5—2.0 g·L-1AGP一定程度上提高了小麦单倍体胚获得率和成苗率,13.07%的胚发育出了2—6株苗,这种一胚多苗现象出现在单倍体胚离体培养之前。
[1] SHEWRY P R. Wheat. Journal of Experimental Botany, 2009, 60: 1537-1553.
[2] 何中虎, 夏先春, 陈新民, 庄巧生. 中国小麦育种进展与展望. 作物学报, 2011, 37(2): 202-215.
HE Z H, XIA X C, CHEN X M, ZHUANG Q S. Progress of wheatbreeding in China and the future perspective. Acta Agronomica Sinica, 2011, 37(2): 202-215. (in Chinese)
[3] LAURIE A D, BENNETT M D. Wheat × maize hybridization. Canadian Journal of Genetics Cytology, 1986, 28: 313-316.
[4] 陈新民, 王凤菊, 李思敏, 张文祥. 小麦与玉米杂交产生小麦单倍体与双单倍体的稳定性. 作物学报, 2013, 39(12): 2247-2252.
CHEN X M, WANG F J, LI S M, ZHANG W X. Stable production of wheat haploid and doubled haploid by wheat × maize cross. Acta Agronomica Sinica, 2013, 39(12): 2247-2252. (in Chinese )
[5] DEPAUW R M, KNOX R E, HUMPHREYS D G. New breeding tools impact Canadian commercial famer fields. Czech Journal of Genetics and Plant Breeding, 2011, 47: 528-534.
[6] 陈新民, 何中虎, 刘春来, 王德森, 张勇, 贾继增, 张运宏. 利用小麦×玉米诱导单倍体技术育成小麦新品种中麦533. 麦类作物学报, 2011, 31(3): 427-429.
CHEN X M, HE Z H, LIU C L, WANG D S, ZHANG Y, JIA J Z, ZHANG Y H. New wheat variety Zhongmai533 developed by wheat × maize cross. Journal of Triticeae Crops, 2011, 31(3): 427-429. (in Chinese)
[7] 李海林, 徐庆国. 化学杀雄在小麦杂种优势利用中的进展和展望.作物研究, 2003, 17(4): 208-212.
LI H L, XU Q G. Advances and prospects of utilization in wheat heterosis by chemically induced male sterility. Crop Research, 2003, 17(4): 208-212. (in Chinese)
[8] ROWELL P L, MILLER D G. Induction of male sterility in wheat with 2-chloroethylphosphonic acid (Ethrel). Crop Science, 1971, 11: 629-631.
[9] 黄铁城, 王明理, 张爱民, 张仲琦. 新型化学杀雄剂—WL84811诱导普通小麦(Triticum aestivum)雄性不育的研究. 作物学报, 1988(14): 155-162.
HUANG T C, WANG M L, ZHANG A M, ZHANG Z Q. Studies on the male sterility in wheat (Triticum aestivum) induced by new gametocide—WL84811. Acta Agronomica Sinica, 1988(14): 155-162. (in Chinese)
[10] 刘宏伟, 张改生, 王军卫, 王小利, 方振武. SQ-1对不同小麦品种杀雄效果的影响. 西北农林科技大学学报(自然科学版), 2003, 31(4): 15-18.
LIU H W, ZHANG G S, WANG J W, WANG X L, FANG Z W. Effect of male sterility on different wheat genotype induced by SQ-1. Journal of Northwest A&F University(Natural Science Edition), 2003, 31(4): 15-18. (in Chinese)
[11] WANG S P, ZHANG G S, SONG Q L, ZHANG Y X, LI Y, GUO J L, CHEN Z, NIU N, MA S C, WANG J W. Programmed cell death, antioxidant response and oxidative stress in wheat flag leaves induced by chemical hybridization agent SQ-1. Journal of Integrative Agriculture, 2015, 15: 76-86.
[12] 刘宏伟, 张改生, 王军卫, 王小利. 新型化学杀雄剂诱导小麦雄性不育的初步研究. 西北植物学报, 1998, 18(2): 218-222.
LIU H W, ZHANG G S, WANG J W, WANG X L. Preliminary study on the male sterile induced by new CHA genesis of wheat. Acta Botanica Boreali-occidentalia Sinica, 1998, 18(2): 218-222. (in Chinese)
[13] 盛英, 张改生, 李亚鑫, 张龙雨, 王书平, 赵新亮, 王亮明, 宋瑜龙. 小麦生理型雄性不育花药绒毡层和孢粉素变化与RAFTIN1表达的关系. 中国农业科学, 2011, 44(19): 3937-3944.
SHENG Y, ZHANG G S, LI Y X, ZHANG L Y, WANG S P, ZHAO X L, WANG L M, SONG Y L. The relationship on anther tapetum, sporopollenin and expression of RAFTIN1 in physiological male sterile wheat. Acta Agricultura Sinica, 2011, 44(19): 3937-3944. (in Chinese)
[14] 陈新民, 徐惠君, 周俊芳, 刘俊秀, 张宏哲. 提高小麦×玉米胚培养植株产生频率的研究. 中国农业科学, 1996, 29(4): 29-32.
CHEN X M, XU H J, ZHOU J F, LIU J X, ZHANG H Z. A study on the increasing frequencies of plant production during embryo culture in crosses between wheat and maize. Scientia Agricultura Sinica, 1996, 29(4): 29-32. (in Chinese)
[15] 林苏娥, 黄鹏, 曹家树. 阿拉伯半乳糖蛋白在被子植物中的功能.中国细胞生物学学报, 2011, 33(3): 306-312.
LIN S E, HUANG P, CAO J S. The functions of arabinogalactanproteins in angiosperms. Chinese Journal of Cell Biology, 2011, 33(3): 306-312. (in Chinese)
[16] JACQUELINE C T, GABRIELA T T, MARIO R M, GABRIELA S J. Arabinogalactan proteins are involved in cell aggregation of cell suspension cultures of Beta vulgaris L.. Plant Cell, Tissue and Organ Culture, 2011, 106: 169-177.
[17] DU H, CLARKE A E, BACIC A. Arabinogalactan-proteins: A class of extracellular matrix proteoglycans involved in plant growth and development. Trends in Cell Biology, 1996, 6(11): 411-414.
[18] ULRIKA E. Somatic embryogenesis in Picea suspension cultures. Methods in Molecular Biology, 1999, 111: 51-60.
[19] ANCA L D, LAURENT L, SYLVAIN L, LUDOVIC H, DAVID H, YVES L, JEAN L H, SIMON H, MARIE C Q, THEO H, ANNE S B. Identification of novel genes potentially involved in somatic embryogenesis in chicory (Cichorium intybus L.). BMC Plant Biology, 2010, 10: 122.
[20] TANG X C, HE Y Q, WANG Y, SUN M X. The role of arabinogalactan proteins binding to Yariv reagents in the initiation, cell developmentalfate, and maintenance of microspore embryogenesis in Brassica napus L. cv. Topas. Journal of Experimental Botany, 2006, 57(11): 2639-2650.
[21] 王爱杰, 章云, 刘洋, 冯辉. AG 和AGP对大白菜和普通白菜(小白菜)小孢子胚状体诱导及成苗的影响. 中国蔬菜, 2012, 4: 62-66.
WANG A J, ZHANG Y, LIU Y, FENG H. Effect of AG and AGPs on microspore embryogenesis and plant regeneration of Chinese cabbage and pakchoi. China Vegetables, 2012, 4: 62-66. (in Chinese)
[22] LETARTE J, SIMION E, MINER M, KASHA K J. Arabinogalactans and arabinogalactan-proteins induce embryogenesis in wheat (Tritium aestivum L.) mictospore culture. Plant Cell Reports, 2006, 24: 691-698.
[23] ZHANG W, WANG X M, FAN R, YIN G X, WANG K, DU L P, XIAO L L, YE X G. Effects of inter-culture, arabinogalactan proteins, and hydrogen peroxide on the plant regeneration of wheat immature embryos. Journal of Integrative Agriculture, 2015, 14: 11-19.
[24] LIU B H, DENG J Y. A dominant gene for male sterility in wheat. Plant Breeding, 1986, 97: 204-209.
[25] 刘秉华, 杨丽. “矮败”小麦的选育及利用前景. 科学通报, 1991, 36(4): 306-308.
LIU B H, YANG L. Breeding of dwarfing-sterile wheat and its potential values in wheat breeding. Chinese Science Bulletin, 1991, 36(4): 306-308. (in Chinese)
[26] 刘秉华, 杨丽, 王山荭, 孟凡华. 矮败小麦群体改良的方法与技术.作物学报, 2002, 28(1): 69-71.
LIU B H, YANG L, WANG S H, MENG F H. The method and technique of population improvement using dwarf male-sterile wheat. Acta Agronomica Sinica, 2002, 28(1): 69-71. (in Chinese)
[27] 翟虎渠, 刘秉华. 矮败小麦创制与应用. 中国农业科学, 2009, 42(12): 4127-4131.
ZHAI H Q, LIU B H. The innovation of dwarf male sterile wheat and its application in wheat breeding. Scientia Agricultura Sinica, 2009, 42(12): 4127-4131. (in Chinese)
[28] ZHANG W, WANG K, LIN Z S, DU L P, MA H L, XIAO L L, YE X G. Production and identification of haploid dwarf male sterile wheat plants induced by corn inducer. Botanical Studies, 2014, 55: 26.
[29] 陈新民, 李学渊, 陈孝, 孟繁华, 崔淑兰. 不同杂交技术对小麦×玉米产生单倍体的影响. 作物学报, 1998, 24(6): 743-746.
CHEN X M, LI X Y, CHEN X, MENG F H, CUI S L. Effect of different crossing techniques on haploid production in wheat × maize crosses. Acta Agronomica Sinica, 1998, 24(6): 743-746. (in Chinese)
[30] 崔秀辉. 化学杂交剂SQ-1诱导糜子雄性不育效果研究. 作物学报, 2008, 34(1): 106-110
CUI X H. Male sterility induced by chemical hybridizing agent SQ-1 in common millet. Acta Agronomica Sinica, 2008, 34(1): 106-110. (in Chinese)
[31] 宋瑜龙, 王亮明, 张改生, 盛英, 李亚鑫, 牛娜, 赵卓军. 杀雄剂SQ-1诱导谷子雄性不育研究. 作物学报, 2011, 37(9): 1695-1700.
SONG Y L, WANG L M, ZHANG G S, SHENG Y, LI Y X, NIU N, ZHAO Z J. Male sterility induced by chemical hybridizing agent SQ-1 in Setariaitalic Beauv. Acta Agronomica Sinica, 2011, 37(9): 1695-1700. (in Chinese)
[32] SONG Q L, WANG S P, ZHANG G S, LI Y, LI Z, GUO J L, NIU N, WANG J W, MA S C. Comparative proteomic analysis of a membrane-enriched fraction from flag leaves reveals responses to chemical hybridization agent SQ-1 in wheat. Frontier in Plant Science, 2015, 6: 669.
[33] BA Q S, ZHANG G S, WANG JS, NIU N, MA S C, WANG J W. Gene expression and DNA methylation alterations in chemically induced male sterility anthers in wheat (Triticum aestivum L.). Acta Physiologiae Plantarum, 2014, 36: 503-512.
[34] ZHU Q D, SONG Y L, ZHANG G S, JU L, ZHANG J, YUY G, NIU N, WANG J W, MA S C. De novo assembly and transcriptome analysis of wheat with male sterility induced by the chemical hybridizing agent SQ-1. PLoS ONE, 2015, 10(4): e0123556.
[35] WANG S P, ZHANG G S, SONG Q L, ZHANG Y X, LI Z, GUO J L, NIU N, MA S C, WANG J W. Abnormal development of tapetum and microspores induced by chemical hybridization agent SQ-1 in wheat. PLoS ONE, 2015, 10(3): e0119557.
[36] 李莉, 王书平, 张改生, 王亮明, 宋瑜龙, 张龙雨, 牛娜, 马守才.小麦生理型和遗传型雄性不育系及其保持系小花完整叶绿体蛋白质组分比较研究. 作物学报, 2011, 37(7): 1134-1143.
LI L, WANG S P, ZHANG G S, WANG L M, SONG Y L, ZHANG L Y, NIU N, MA S C. Comparison of floret intact chloroplast proteome in male sterile line induced by CHA-SQ-1, cytoplasmic-nuclear sterile and its normal fertile lines in wheat. Acta Agronomica Sinica, 2011, 37(7): 1134-1143. (in Chinese)
[37] YUAN S X, SU Y B, LIU Y M, FANG Z Y, YANG L M, ZHUANG M, ZHANG Y Y, SUN P T. Effects of pH, MES, arabinogalactanproteins on microspore cultures in white cabbage, Plant Cell, Tissue Organ Culture, 2012, 110: 69-76.
[38] 陈新民, 赖桂贤, 陈孝, 周俊芳, 刘俊秀, 孙芳华. 不同小麦组合与玉米杂交产生单倍体的差异. 作物学报, 1996, 22(4): 437-441.
CHEN X M, LAI G X, CHEN X, ZHOU J F, LIU J X, SUN F H. Difference of haploid production in crosses between different wheat f1and maize. Acta Agronomica Sinica, 1996, 22(4): 437-441. (in Chinese)
(责任编辑 李莉)
Effect of Chemical Hybridization Agent SQ-1 and Arabinogalactan Proteins on the Embryos Obtaining in Wheat Intervarietal and Wild Crosses
WANG Kun-yang1, ZHANG Wei1, ZHANG Shuang-xi2, LIU Hong-wei1, WANG Ke1, DU Li-pu1, LIN Zhi-shan1, YE Xing-guo1
(1Institute of Crop Science, Chinese Academy of Agricultural Sciences/National Key Facility for Gene Resources and Genetic Improvement, Beijing 100081;2Crop Research Institute, Ningxia Academy of Agricultural-Forestry Sciences, Yinchuan 750105)
【Objective】The aims of this study are to clarify the effect of SQ-1 on the embryo formation in the hybridization among wheat varieties and between wheat and its relative or wild species as well as the effect of AGP on haploid embryo production and haploid plant production in the cross of wheat and maize. The findings in this study will be potentially useful to the efficientlyconduction of wheat hybridization breeding and haploid breeding.【Method】In this study, the effectiveness of SQ-1 on the seed-setting after wheat varieties are crossed with other wheat varieties, rye, and maize, and AGP on haploid wheat induction in the cross between wheat and maize were investigated by spraying wheat plants with SQ-1 at booting stage, pollinating the sterile spikes with wheat, rye or maize pollens at flowering period, and treating the wheat spikes pollinated maize pollens with an AGP containing solution, respectively. In addition, in vitro culture was used to rescue the haploid wheat embryos from wheat and maize crossing. Florets pollinated, caryopses formed, grains obtained, embryos cultured, embryos germinated, and plantlets obtained were counted to calculate, caryopses formation rate, setting rate, haploid embryos induction rate, haploid embryos induction rate, and haploid production rate. All the data were analyzed for significant difference evaluation. 【Result】It was found that seed setting rate for the crossing among wheat varieties was 19.8%-83.3% from SQ-1 treatment, and 69.4%-93.0% from artificial emasculation treatment. But, different wheat varieties as female parent showed different responses to SQ-1, and Fielder displayed the most sensitivity to SQ-1. For the wild crossing between a wheat line Chinese Spring (CS) and a rye line Lanzhou Heimai, the seed setting rate was 65.5% from SQ-1 treatment, and 78.8% from artificial emasculation method. All the F1hybrids from the two treatments had 28 chromosomes. For the wild crossing between wheat and maize, wheat haploid embryo induction rate was 1.11%-1.41% from SQ-1 treatment, and 2.38%-14.29% from artificial emasculation method. Compared with the control treatment, application of 0.5-2.0 g·L-1AGP in the treating solution assisted the wheat haploid embryo production rate to be improved to 17.0% from 11.5%. Besides, in the wheat haploid embryos induced by maize pollen, it was found that 13.07% of the embryos developed 2-6 seedlings. Under a microscope, more than one original embryonic axis were observed on the haploid wheat embryos induced by maize pollen when they were rescued by in vitro culture on medium. Cytological examination revealed that the in vitro culture wheat plants had 21 chromosomes. 【Conclusion】The above results indicated that SQ-1 application reduced not only seed setting in the cross among different wheat varieties and between wheat and rye, but also haploid wheat embryo induction rate in the cross between wheat and maize. AGP application improved haploid wheat embryo induction, germination, and plantlets obtaining rates between the hybridization of wheat and maize.
common wheat; chemical hybridization agent (CHA)SQ-1; arabinogalactan proteins (AGP); hybridization among wheat varieties; wide crosses; haploid embryos
2016-06-23;接受日期:2016-08-24
国家自然科学基金(31371621)、中国农业科学院创新工程、宁夏农林科学院先导基金
联系方式:王坤杨,Tel:010-82105173;E-mail:857996802@qq.com。通信作者叶兴国,Tel:010-82105173;E-mail:yexingguo@caas.cn

