丹参酮ⅡA对大鼠脑缺血再灌注损伤的作用及机制研究
刘月秋 刘 辉
(中国人民解放军第210医院,辽宁 大连 116021)
·实验报告·
丹参酮ⅡA对大鼠脑缺血再灌注损伤的作用及机制研究
刘月秋 刘 辉△
(中国人民解放军第210医院,辽宁 大连 116021)
目的探索丹参酮ⅡA对大鼠脑缺血再灌注损伤的作用及机制。方法 30只SD大鼠随机分为假手术组、脑缺血再灌注损伤组和丹参酮ⅡA组,每组10只。采用线栓法构建大鼠大及至中动脉局灶所血再灌注损伤模型。术后2 h拔除栓线,制备缺血2 h再灌注损伤模型。假手术组仅分离颈总动脉,不夹闭。丹参酮ⅡA组在术前15 min腹腔注射丹参酮ⅡA剂量(1 mL/kg),脑所血再灌注损伤组和假手术组术前15 min腹腔注射等量0.9%氯化钠注射液,术后24 h断头处死动物,观察大鼠脑组织病理形态学改变以及肿瘤坏死因子α(TNF-α)、白介素-1β(IL-1β)、白介素-6(IL-6)、Wnt、β-catenin、cyclin D1、survivin、p53、Bax和BCL-2的表达,评价丹参酮ⅡA对大鼠脑缺血再灌注损伤的作用。结果与假手术组相比较,脑缺血再灌注损伤组脑组织损伤评分明显升高 (P<0.05),Wnt、β-catenin、cyclin D1、survivin、p53以及Bax的mRNA和蛋白水平上升(P<0.05),BCL-2的mRNA和蛋白水平下降 (P<0.05),TNF-α、IL-1β和IL-6的mRNA表达和血清水平上升(P<0.05);与脑缺血再灌注损伤组相比较,丹参酮ⅡA组上述指标均显著改善(P<0.05)。结论丹参酮ⅡA可减轻脑缺血再灌注损伤,其机制可能与其可抑制Wnt/β-catenin/p53信号途径介导的炎症和凋亡相关。
丹参酮ⅡA 大鼠 脑缺血再灌注损伤 炎症 凋亡 Wnt/β-catenin/p53
脑缺血再灌注损伤是脑供血中断后,重新恢复脑血供导致脑损伤反而加重的临床危相,是导致人类致死和致残的重要原因,仅次于心脏疾病和癌症。因此减轻脑缺血再灌注损伤对临床具有重要的现实意义[1-2]。丹参酮ⅡA是传统中药丹参的一种成分,研究发现其具有抗凋亡,抗炎,抗肿瘤等生物学活性[3-4],而凋亡和炎症是导致脑缺血再灌注损伤重要原因[5-6]。因此本实验以大鼠为研究对象,探讨丹参酮ⅡA对脑缺血再灌注损伤的作用及机制。现报告如下。
1 材料与方法
1.1 动物及试剂 雄性SD大鼠30只,体质量(220± 20)g,由武汉大学实验动物中心提供(合格证号SCXK鄂2014-0007)。均提前2周购入,放置在SPF级动物饲养室内喂养。丹参酮ⅡA磺酸钠(上海第一生化药业有限公司,国药准字Z20026249),质量分数为98%;白介素-6(IL-6),肿瘤坏死因子-α(TNF-α)、白介素-8(IL-8)ELISA检测盒 (Ebioscience,USA),β-actin(abgent,USA),BCL-2、Bax、Wnt、β-catenin、cyclin D1、survivin以及p53(CST,USA)。
1.2 分组与造模 30只SD大鼠随机分为假手术组(Sham),脑缺血再灌注损伤组(IRI)和丹参酮ⅡA组(TSN),每组10只。参照Liu GD等[7]方法,采用线栓法构建大鼠大脑中动脉局灶缺血再灌注损伤模型,术后2 h拔除栓线,制备缺血2 h再灌注损伤模型。假手术组仅分离颈总动脉,不夹闭。丹参酮ⅡA组在术前15 min腹腔注射丹参酮ⅡA剂量(1 mL/kg),脑缺血再灌注损伤组和假手术组术前15 min腹腔注射等量0.9%氯化钠注射液,术后24 h断头处死动物。
1.3 观察项目 1)脑组织病理组织学检查。脑组织置于4%多聚甲醛液4℃后固定1周。依次脱水、透明、浸蜡及包埋,行厚8 μm冠状切片、常规HE染色、封片,光镜下观察,损伤评分参考文献[6]。2)RT-PCR检测。RT-PCR法检测各组脑组织Wnt,β-catenin,cyclin D1,survivin,p53,Bax,BCL-2,IL-6,TNF-α和IL-8的表达水平,具体方法参考文献[7]。3)ELISA检测。按照ELISA试剂盒说明书操作步骤检测血清中IL-6,TNF-α和IL-8表达水平。4)Western blotting检测脑组织Wnt,β-catenin,cyclin D1,survivin,p53,Bax 以 及BCL-2等蛋白水平的表达。取各组脑组织50 mg,采用westernbloting方法检测脑组织Wnt,β-catenin,cyclin D1,survivin,p53,Bax以及BCL-2的表达,具体步骤参考文献[7]。

表1 实时定量PCR检测的引物序列
1.4 统计学处理 应用SPSS18.0统计软件分析。计量资料以(s)表示,计数资料采用χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1 各组脑组织病理改变的比较 见图1,表2。与Sham组相比,IRI组神经元细胞损伤,固缩核和神经元染色明显增加(P<0.05),而TSN组神经元细胞损伤,固缩核和神经元染色明显降低(P<0.05),提示TSN预处理可明显脑缺血再灌注损伤导致的脑损害。

图1 各组脑组织病理学改变的比较(HE染色,200倍)
表2 各组脑组织损伤评分比较(分,s)

表2 各组脑组织损伤评分比较(分,s)
与Sham组比较,*P<0.05,**P<0.01;与TSN组比较,△P<0.05。下同。
?
2.2 各组脑组织Wnt/β-catenin/p53信号通路关键因子表达的比较 见图2,表3~4。与Sham组相比,IRI组Wnt,β-catenin和p53 mRNA表达和蛋白表达水平均明显增加(P<0.05),而TSN组与IRI组相比Wnt,β-catenin和p53 mRNA表达和蛋白表达水平均明显减少(P<0.05)。

图2 各组脑组织Wnt,β-catenin和p53蛋白表达水平比较
表3 各组脑组织促炎症细胞因子Wnt,β-catenin和p53 mRNA表达水平比较(s)
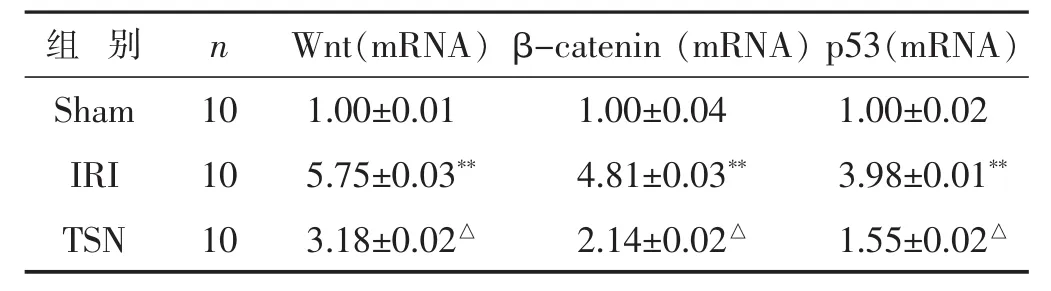
表3 各组脑组织促炎症细胞因子Wnt,β-catenin和p53 mRNA表达水平比较(s)
?
表4 各组脑组织促炎症细胞因子Wnt,β-catenin和p53蛋白表达水平比较(s)

表4 各组脑组织促炎症细胞因子Wnt,β-catenin和p53蛋白表达水平比较(s)
2.3 各组脑组织cyclin D1和survivin的表达比较见图3,表5~6。与Sham组相比,IRI组cyclin D1和survivin mRNA表达和蛋白表达明显增加 (P<0.05),而TSN组与IRI组相比cyclin D1和survivin mRNA表达和蛋白表达均明显减少(P<0.05)。

图3 各组脑组织cyclin D1和survivin蛋白表达的比较
表5 各组脑组织cyclin D1和survivin mRNA表达水平比较(s)

表5 各组脑组织cyclin D1和survivin mRNA表达水平比较(s)
表6 各组脑组织cyclin D1和survivin mRNA蛋白表达比较(s)

表6 各组脑组织cyclin D1和survivin mRNA蛋白表达比较(s)
?
2.4 各组促炎症细胞因子TNF-α,IL-6和IL-8表达的比较 见表7、8。与Sham组相比,IRI组TNF-α,IL-6和IL-1β脑组织mRNA的表达和血清水平均明显增加(P<0.05)。而TSN组与IRI组相比,促炎症细胞因子TNF-α,IL-6和IL-1β表达明显减少(P<0.05)。
表7 各组脑组织促炎症细胞因子TNF-α,IL-6和IL-1 mRNA表达水平比较(s)

表7 各组脑组织促炎症细胞因子TNF-α,IL-6和IL-1 mRNA表达水平比较(s)
组 别 n TNF-α(mRNA) IL-6(mRNA)IL-1(mRNA)Sham 10 IRI 10 1.00±0.01 1.00±0.02 0.98±0.09 12.13±1.20**5.33±0.24*7.52±0.75*TSN 105.20±0.31△1.52±0.25△2.52±0.42△
表8 各组血清促炎症细胞因子TNF-α,IL-6和IL-1分泌水平比较(s)

表8 各组血清促炎症细胞因子TNF-α,IL-6和IL-1分泌水平比较(s)
组别 n TNF-α IL-6 IL-1 Sham 10 IRI 10 98.67±10.23 110.62±21.02 100.89±23.35 1528.45±212.67**646.85±52.79*956.79±54.43*TSN 10452.33±143.91△221.46±32.54△455.15±42.40△
2.5 各组脑组织Bax和BCL-2的表达比较 见图4,表9~表10。与Sham组相比,IRI组Bax mRNA表达和蛋白表达均明显增加(P<0.05),BCL-2 mRNA表达和蛋白表达均明显减少(P<0.05),而TSN组与IRI组相比,Bax mRNA表达和蛋白表达均明显减少(P<0.05),而BCL-2 mRNA表达和蛋白表达均明显增加 (P<0.05)。

图4 各组脑组织Bax和Bcl-2蛋白表达的比较
表9 各组脑组织Bax和BCL-2 mRNA表达水平比较(s)

表9 各组脑组织Bax和BCL-2 mRNA表达水平比较(s)
组 别 n Bax(mRNA) BCL-2(mRNA)Sham 10 IRI 10 1.00±0.10 1.00±0.05 3.94±0.32*0.44±0.05*TSN 101.85±0.12△0.78±0.04△
3 讨 论
脑缺血再灌注损伤是脑组织供血中断后,重新恢复脑组织血流灌注导致脑组织损伤反而进一步加重的临床危象[1-2]。其往往好发于脑外伤,心脏体外大循环手术,心脏移植和休克等。其发病率高,预后奇差[3-4]。如何预防以减轻脑缺血再灌注损伤成为临床迫切要解决的紧迫问题。最近研究发现,脑组织缺血可诱发机体细胞缺血缺氧,从而导致机体ATP合成减少,引发炎症反应和促凋亡信号途径激活,但脑组织血流灌注恢复后,反而进一步加剧炎症反应和促凋亡信号途径激活,这导致大量神经元细胞凋亡,坏死,进一步加剧脑组织损伤[5-6]。因此削弱炎症反应和促凋亡信号通路激活是减轻脑缺血再灌注损伤的有效干预措施。
表10 各组脑组织Bax和Bcl-2蛋白表达比较(s)

表10 各组脑组织Bax和Bcl-2蛋白表达比较(s)
组 别 n Bax/β-actin BCL-2/β-actin Sham 10 IRI 10 0.21±0.02 0.38±0.03 0.44±0.01*0.10±0.02*TSN 100.25±0.02△0.21±0.03△
《吴普本草》有记载传统中药丹参具有活血化瘀、凉血通经之效,在临床上被用于心脑血管等疾病的治疗[4],丹参酮ⅡA是其的有效成分之一,进来研究发现丹参酮ⅡA有抗炎、抗凋亡、调节免疫、抗肿瘤及抗氧化应激等生物学活性[8-9],而炎症和凋亡在诱发加剧脑缺血再灌注损伤起重要作用[5-6]。实验结果显示丹参酮ⅡA预处理可以明显减轻脑缺血再灌注损伤诱发经元细胞损伤,固缩核和神经元染色明显增加,这提示丹参酮ⅡA可减轻脑缺血再灌注导致的脑组织病理结构改变。对丹参酮ⅡA减轻脑损伤的机制中探究发现,丹参酮ⅡA可减轻促炎症细胞因子TNF-α,IL-6和IL-1表达,促凋亡分子Bax的减少和抗凋亡分子BCL-2的增加,这提示丹参酮ⅡA预处理可通过抑制炎症和促凋亡信号通路的激活,进而减轻脑缺血再灌注损伤。但丹参酮ⅡA在脑缺血再灌注损伤中抑制炎症和凋亡信号途径的具体机制不清。
凋亡是脑缺血再灌注损伤的重要机制,p53为一重要的肿瘤凋亡抑制蛋白,与DNA修复,细胞周期调控及细胞凋亡有。p53可通过调控下游的Bax/BCL-2蛋白发挥其促凋亡的活性,并通过促进p21和Bax调控细胞周期和细胞凋亡。最近研究发现,其除具有调节凋亡的活性外,还具有抗炎的功效[10-12]。实验结果显示丹参酮ⅡA可抑制缺血再灌注损伤诱导的p53表达增加。Wnt/β-catenin信号途径是一经典细胞信号通路,可介导细胞生长、细胞凋亡、细胞分化、代谢等[13-15]。cyclin D1和survivin是Wnt/β-catenin信号途径激活的定向靶向基因[14]。最近研究显示Wnt//β-catenin/p53信号通路在脑缺血再灌注损伤起重要作用,发现Wnt/ β-catenin信号通路激活可调节p53表达[13-14]。实验结果显示丹参酮ⅡA可以减少Wnt/β-catenin激活,和减少Wnt/β-catenin定向靶向基因cyclin D1和survivin的表达。
综上所述,笔者可推测丹参酮ⅡA可通过抑制炎症和凋亡而减轻脑缺血再灌注损伤,其与抑制Wnt/βcatenin/p53信号通路激活相关。但丹参酮ⅡA除抑制Wnt/β-catenin/p53信号通路外,是否还有其他信号途径涉及丹参酮ⅡA减轻脑缺血再灌注损伤,尚需进一步研究。
[1] 邓江,王义为,张洁,等.杜仲提取物对大鼠脑缺血再灌注损伤的保护作用及其机制研究[J].药物评价研究,2014,37(6):498-501.
[2] 张耀东,赵红岗,李东亮,等.缺氧预处理对缺氧缺血性脑损伤新生大鼠神经干细胞增殖的影响[J].中国临床研究,2014,27(3):263-265.
[3] 闫俊,冯娟,杨雪,等.丹参酮ⅡA的药理作用及疾病治疗的最新进展[J].实用药物与临床,2015,18(8):972-977.
[4] 舒菁菁,李菲,董雅芬,等.丹参素药理作用及机制的研究进展[J].药学实践杂志,2012,30(4):266.
[5] 武彩霞,刘睿,杜冠华.内质网应激与脑缺血/再灌注损伤[J].中国药理学通报,2013,29(5):601-605.
[6] 陈素辉,孙华,徐虹.针刺、中药对脑缺血炎症相关因子表达的影响[J].针灸临床杂志,2011,27(5):69-72.
[7] Liu G,Wang T,Wang T,et al.Effects of apoptosis-related proteins caspase-3,Bax and Bcl-2 on cerebral ischemia rats[J].Biomed Rep,2013,1(6):861-867.
[8] 卢乙众,李合华,卢奕帆.丹参酮Ⅱ联合骨髓间充质干细胞移植促进脑梗死后的神经再生[J].中国组织工程研究,2016,20(23):3425-3431.
[9] 黎洪展,吕永恒,陈琪,等.丹参酮ⅡA对大鼠局灶性脑缺血再灌注损伤的保护作用及其机制[J].中国综合临床,2012,28(1):55-57.
[10]Amelio I,Melino G.The p53 family and the hypoxia-inducible factors(HIFs):determinantsofcancerprogression[J]. Trends Biochem Sci,2015,40(8):425-434.
[11]Lin HY,Glinsky GV,Mousa SA.Thyroid hormone and antiapoptosis in tumor cells[J].Oncotarget,2015,6(17):14735-14743.
[12]de Oliveira GA,Rangel LP,Costa DC,et al.Misfolding,Aggregation,and disordered segments in c-Abl and p53 in human cancer[J].Front Oncol,2015,5:97.
[13]Zhang X,Lou Y,Zheng X,et al.Wnt blockers inhibit the proliferation of lung cancer stem cells[J].Drug Des Devel Ther,2015,9(6):2399-2407.
[14]Yin X,Wang X,Hu X,et al.ERβ Induces the differentiation of cultured osteoblasts by both Wnt/β-catenin signaling pathway and estrogen signaling pathways[J].Exp Cell Res,2015;335(1):107-114.
[15]Shan BE,Wang MX,Li RQ,et al.Quercetin inhibit human SW480 colon cancer growth in association with inhibition of cyclin DI andsurviuin expressin through Wnt/beta-catenin signaling pathway[J].Cancer Invest,2009,27(6):644-612.
R285.5
A
1004-745X(2016)12-2283-04
10.3969/j.issn.1004-745X.2016.12.022
2016-07-05)
△通信作者(电子邮箱:zhouqian89f@163.com)

