马尔尼菲青霉菌鉴定要点及该菌酵母相体外药敏分析
谢良伊,王 娟,张 景,程振波,李 浩,梁 剑,郑淑娟,曾 玲,邓中华
(湖南省人民医院,湖南 长沙 410005)
马尔尼菲青霉菌鉴定要点及该菌酵母相体外药敏分析
谢良伊,王 娟,张 景,程振波,李 浩,梁 剑,郑淑娟,曾 玲,邓中华
(湖南省人民医院,湖南 长沙 410005)
目的 了解马尔尼菲青霉菌(PM)鉴定要点及该菌酵母相体外药敏结果,以指导临床合理用药。方法收集某院2009—2016年23例PM感染患者血或骨髓的分离株,观察其菌落形态,采用E-test法分析酵母相PM对伊曲康唑、伏立康唑、两性霉素B、氟康唑的药物敏感性。结果PM形态:组织标本瑞氏染色直接镜检,可见典型卵圆形或圆形有明显横隔的孢子,常位于巨噬细胞内;血培养标本革兰染色镜检,可见菌体两端钝圆略弯曲呈腊肠样,偶有分枝状,可见有横隔。PM为双相型真菌,28°C为菌丝相,产生红色色素扩散入培养基中;35°C为酵母相,并有各自典型的菌落形态特征。伊曲康唑、伏立康唑、两性霉素B、氟康唑对酵母相(35°C)PM的最低抑菌浓度(MIC)范围分别为0.002~0.016、0.012~0.125、0.002~0.500、0.500~16.000 μg/mL。结论PM的特征性菌落形态,以及骨髓和外周血发现的真菌孢子对该菌有诊断价值。该菌对伊曲康唑敏感性最强,其次是伏立康唑、两性霉素B,而氟康唑敏感性相对较弱。
马尔尼菲青霉病; 马尔尼菲青霉菌; 双相型; 抗药性,微生物; 耐药性; 真菌
[Chin J Infect Control,2016,15(12):934-938]
马尔尼菲青霉菌(Penicilliummarneffei,PM)属于青霉菌属,是青霉菌属中唯一的温度依赖性双相菌[1-2],既能像大多数真菌一样在常温(30℃以下)腐物寄生,也能在较高温度(35℃)环境中生长。马尔尼菲青霉病(Penicilliosis marneffei,PSM)病情发展快,若不及时治疗,病死率极高。随着人类免疫缺陷病毒(HIV)感染者日益增多,PSM的发病率也逐渐增高,医务人员应对本病提高认识,做到早诊断、早治疗。为防止PM漏检,临床上出现不明原因发热及肝脾、淋巴结大时,应考虑PM感染,并及时留取标本进行涂片检查和真菌培养。近年来,一些抗原抗体检测及聚合酶链反应(PCR)等快速诊断PM感染的方法相继兴起,但因特异性差,且缺乏大样本研究,还未能进行临床推广应用,诊断仍以PM培养为金标准。美国临床实验室标准化协会(Clinical and Laboratory Standards Institute,CLSI)推荐应用E-test法对双相真菌进行药物敏感试验,该方法操作简便,可反映不同抗真菌药物对双相PM的体外抗菌活性。但由于国际上无双相型真菌的药敏试验标准,建立一个简便、准确及重复性好的药敏试验显得尤为重要。本研究分析某院分离的PM,观察其菌落形态,分析酵母相PM的体外药敏结果,以指导临床合理用药。
1 材料与方法
1.1 材料
1.1.1 菌株来源 来自某院2009—2016年23例PM感染患者血或骨髓的分离株。
1.1.2 培养基 沙保罗琼脂平板购自杭州天和微生物试剂有限公司,真菌药敏培养基购自江门市凯林贸易有限公司。
1.1.3 试验药物 E-test抗真菌试纸条购自郑州安图生物工程股份有限公司,包括伊曲康唑(itraconazole,It)、伏立康唑 (voriconazole,Vo)、两性霉素B(amphotericin,Ap)、氟康唑(fluconazole,Fl)4种药物,除氟康唑起始浓度为256 μg/mL外,其余3种药物均为32 μg/mL。终末浓度均为0.002 μg/mL。
1.1.4 仪器 BacT/ALERT 3D血培养仪、麦氏比浊仪均为法国生物梅里埃公司产品。
1.2 方法
1.2.1 样本采集 采集患者血5~10 mL或骨髓2~3mL接种于与BacT/ALERT 3D血培养仪配套的BacT/ALERT血培养瓶进行血培养。
1.2.2 涂片镜检 取患者组织或骨髓直接涂片,标本血培养报阳后菌液涂片,镜检并分别进行瑞氏染色及革兰染色,显微镜下观察菌体的形态特征。
1.2.3 真菌学检查 血培养报阳后,分别接种2个沙保罗琼脂平板,分别置于28℃和35℃培养,观察各培养物在不同温度下的菌落形态特点。
1.2.4 PM鉴定标准 (1)温度依赖性双相菌,28℃培养呈菌丝相,35℃培养呈酵母相。(2)在沙保罗培养基上,28℃培养第2天可见较小菌落,并在培养基中可见水溶性红色色素,第3天菌落较大并出现白色绒毛状,培养基中可见明显的水溶性玫瑰红色,第5天整个平皿均呈玫瑰红色,菌落较大呈黄褐色、白色绒毛状;35℃培养于第3天出现酵母样菌落,无色素及绒毛状,5 d后较成熟菌落有脑回样皱褶。(3)28℃涂片革兰染色呈典型的帚状枝;35℃涂片革兰染色呈长形酵母样孢子,孢子中间可见分隔为腊肠型细胞,可见少量的菌丝。PM的孢子与组织胞浆菌孢子容易混淆,但PM常有横隔,不出芽。
1.2.5 药敏试验
1.2.5.1 菌液制备 用无菌棉拭子蘸取35℃培养的PM菌落置于加有1mL生理盐水的无菌试管中,在麦氏比浊仪上,以0.5麦氏单位为标准,调整菌液浊度。
1.2.5.2 E-test法 无菌操作下,用无菌棉拭子将制备好的菌悬液均匀涂布至真菌药敏培养基上,待平板表面干后,用无菌镊子将上述4种E-test抗真菌试纸条分别置于培养基平板上,置于35℃温箱培养。
1.2.5.3 最低抑菌浓度(minimum inhibitory concentration,MIC)判定 按CLSI推荐的方法,于接种后每24 h观察1次,其中伊曲康唑、伏立康唑、氟康唑48 h读取结果,两性霉素B 24 h或48 h读取结果均可。
1.2.5.4 药敏折点[3-5]伊曲康唑(S:MIC≤0.125 μg/mL;R:MIC≥1 μg/mL);伏立康唑(S:MIC≤1 μg/mL);两性霉素B(S:MIC≤1 μg/mL;R:MIC≥4 μg/mL);氟康唑(S:MIC≤8 μg/mL;R:MIC≥64 μg/mL)。
1.2.6 试验质控 近平滑假丝酵母菌(Candidaparapsilosis,Cp)ATCC 22019为质控菌株[6],购于Mecconti公司(卢森堡)。质控结果伊曲康唑为0.12 μg/mL(允许范围0.064~0.25 μg/mL);伏立康唑为0.064 μg/mL(允许范围0.06~0.25 μg/mL);两性霉素B为0.5 μg/mL (允许范围0.25~1.00 μg/mL);氟康唑为4 μg/mL(允许范围2.0~8.0 μg/mL)。
2 结果
2.1 组织及外周血(骨髓)中PM形态 组织标本瑞氏染色直接镜检,可见典型卵圆形或圆形有明显横隔的孢子,常位于巨噬细胞内。血培养标本革兰染色镜检,可见菌体两端钝圆略弯曲呈腊肠样,偶有分枝状,可见有横隔。见图1~2。
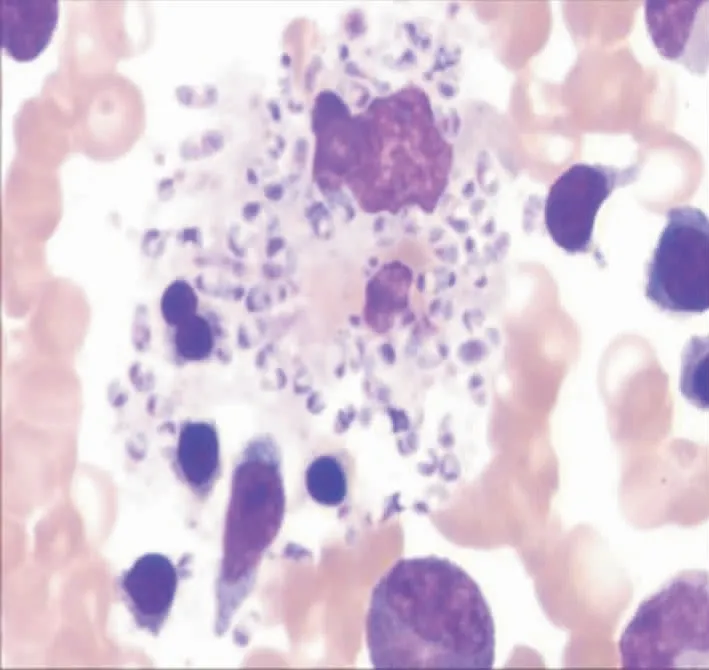
图1 组织直接镜检PM形态 (瑞氏染色,100×)
Figure 1 Direct microscopic observation for morphology of PM from tissue (Wright’s staining, 100×)

图2 血培养镜检PM形态(革兰染色,100×)
Figure 2 Microscopic observation of morphology of PM from blood culture(Gram staining,100×)
2.2 真菌培养特征
2.2.1 菌落特征 28℃培养呈菌丝相,沙保罗培养基上2~3 d产生菌落,呈淡灰褐色膜样或淡黄色绒状,直径约5 mm,并产生红色色素,扩散入培养基中;5~7 d变为浅黄色绒状,可见菌落表面干燥粗糙,中央区隆起,随着时间的延长,色素进一步加深,可弥散到整个培养基。见图3。35℃沙保罗培养基上呈酵母相生长,生长较28℃缓慢,3~4 d可见圆形、灰白色、表面光滑湿润、边缘整齐的酵母样菌落,无色素生成;6~8 d菌落直径约3~5 mm,呈淡灰褐色或奶酪色模样,继续培养后菌落明显增大,边缘可出现褶皱,中心较湿润,表面光滑。有些菌落可从酵母样向菌丝相转变,可出现灰白色绒毛状菌落及产生红色色素。见图4。

图3 28°C培养PM菌落特征

图4 35°C培养PM菌落特征
2.2.2 显微镜下菌体特征 挑取28℃培养菌落,涂片置于高倍镜下观察,镜下可见有分枝、分隔无色透明的菌丝, 可见帚状枝,双轮或单轮生,梗基上有3~6个瓶梗,分生孢子卵圆形或圆形,直径2~3 μm,有明显的孢子间连体。见图5。35℃培养菌落显微镜下可见圆形或卵圆形、大小轻度不一,直径约3 μm的酵母样菌体,混有少许短菌丝,菌体表面光滑,无色透明。有些菌体处在增殖活跃期,可见菌体变长,两端钝圆略弯曲呈腊肠样,少数可见有横隔。见图6。

图5 28°C PM培养物镜下特点(棉兰染色,100×)
Figure 5 Microscopic characteristics of PM cultured at 28°C(Medan staining,100×)

图6 35°C PM培养物镜下特点 (棉兰染色,100×)
Figure 6 Microscopic characteristics of PM cultured at 35°C(Medan staining,100×)
2.3 药敏结果 参照酵母相真菌的药敏折点,对伊曲康唑、伏立康唑、两性霉素B均敏感,敏感率达100%,对氟康唑有5株为中介,敏感率为78.26%。4种抗真菌药物中,以伊曲康唑MIC最低,其次是伏立康唑、两性霉素B,而氟康唑敏感性相对较弱。4种药物对各菌株的MIC见表1。
3 讨论
对于发热时间较长且原因不明,肝脾淋巴结大,有坏死性丘疹的患者,尤其有广东、广西、湖南等地居住史的患者,应警惕PSM。由于PM侵犯部位广泛,临床表现复杂多样,无特异性,常伴发于其他疾病,因此可能被更严重疾病的症状所掩盖,其中病变局限于肺者,临床表现似肺结核,极易误诊,本研究即有病例为此类情况。23例患者中,16例确诊为艾滋病未报告PM就已出院;1例结核感染并免疫缺陷患儿在使用两性霉素B后发热症状有所控制,但最终因严重脓毒血症而抢救无效死亡;1例免疫缺陷患儿在培养出PM时使用氟康唑后体温较前降低,因重度免疫缺陷治疗2 d后要求出院;3例怀疑为真菌感染的患者最初使用伏立康唑治疗时感染控制,待最终确诊为艾滋病并培养出PM时已转院;1例培养出PM后使用两性霉素B的患者治疗效果佳,但出现消化道不良反应,确诊艾滋病后即转院治疗;1例怀疑为HIV并真菌感染的患者使用氟康唑时感染控制,但未报告培养出PM就已转院。使用了伏立康唑、两性霉素B及氟康唑的患者感染发热症状得到控制,最终治疗有效,但最终因原发病转院或者死亡。
表1 4种药物对23株酵母相(35℃)PM的MIC(μg/mL)
Table 1 MICs of four kinds of antifungal agents to 23 isolates of PM in yeast phase(35°C) (μg/mL)

菌株编号伊曲康唑伏立康唑两性霉素B氟康唑10.0080.0230.5002.00020.0080.0120.0161.00030.0020.0230.04816.00040.0160.1250.0328.00050.0030.0120.0648.00060.0040.0230.0024.00070.0020.0230.0508.00080.0040.1250.0323.00090.0020.0230.0321.500100.0020.0120.0161.000110.0060.0160.06416.000120.0160.0230.0648.000130.0040.1250.0020.500140.0160.0230.5008.000150.0060.0160.06416.000160.0040.0230.0324.000170.0040.0160.0504.000180.0080.0160.0328.000190.0060.0160.06416.000200.0040.1250.0323.000210.0020.0230.0508.000220.0020.0120.0161.000230.0060.0160.06416.000
PSM诊断较困难,需经标本直接涂片染色(除本文中用到的革兰和瑞氏染色外还可以结合HE、PAS和PASM染色)以及分离培养出PM方能确诊[7]。PM为深部条件致病菌,因菌株间的个体差异以及耐药性等因素,其对各种抗真菌药物的敏感性不一致,因而进行体外抗真菌药敏试验是必需的。由于人体温度一般为37℃左右,对35℃酵母相PM进行体外药敏试验更有利于为临床感染PM患者的用药提供参考。若有可能,可以对PM 25℃菌丝相进行体外药敏试验,并比较两种不同温度相之间是否存在差异。本研究根据CLSI制定的M27-A3方案,采用E-test法对35℃酵母相PM进行药敏测试。目前认为,E-test法可以作为标准化液基稀释法的一种替代方法[8-9],国外有文献[3]报道该法与微量稀释法具有良好的一致性。《桑福德抗微生物治疗指南》(第44版)指出,PSM抗菌药物治疗首选两性霉素B,后续伊曲康唑口服治疗,HIV感染者需长期使用。目前,临床多采用两性霉素B控制症状后改用伊曲康唑继续治疗的联合用药方法[10-12]。M27-A2[13]和M38-A[14]中受试的抗真菌药物在原有两性霉素B、5-氟胞嘧啶、伊曲康唑、氟康唑基础上增加了伏立康唑、泊沙康唑、雷夫康唑。本研究选用伊曲康唑、伏立康唑、两性霉素B、氟康唑4种临床较常用的抗酵母样真菌药物,发现在酵母相PM抗真菌药敏检测中,以伊曲康唑敏感性最强,其次是伏立康唑、两性霉素B,而氟康唑敏感性相对较弱,结论与国内文献[15-18]报道基本一致,其中本研究伊曲康唑敏感性稍高于伏立康唑,与韦高等[15]报道不一致,可能系地区差异所致。临床上发现对于酵母样真菌,两性霉素B的敏感性高于伊曲康唑及伏立康唑,与我们所做体外药敏试验有所不同,可能与两性霉素B副作用较大,临床使用较伊曲康唑及伏立康唑少有关。
目前,实施双相性真菌的标准化药敏试验较困难,各实验室均在积极探索能被广泛接受的方法。本研究采用E-test法测试双相性真菌药物敏感性试验,操作相对简便,结果易于判读,可以作为实验室的常规方法。实验室进行抗真菌药物敏感试验能为临床合理使用抗真菌药物提供参考依据,所以我们应不断寻求更有效、更科学的方法。
[1] Singh PN, Ranjana K, Singh YJ, et a1. Indigenous disseminatedPenicilliummarneffeiinfection in the state of Manipur, India: report of four autochthonous cases [J]. J Clin Microbio1, 1999, 37(8):2699-2702.
[2] 陈万山,唐小平,卢业成.5种抗真菌药物对马尔尼菲青霉菌的体外抗菌活性观察[J].中华传染病杂志,2008,26(3):143-145.
[3] Colombo AL, Barchiesi F, McGough DA, et a1. Comparison of Etest and National Committee for Clinical Laboratory Standards broth macrodilution method for azole antifungal susceptibility testing [J].J Clin Microbiol, 1995, 33(3):535-540.
[4] 刘锦燕,项明洁.抗真菌药物敏感性试验方法研究进展[J].检验医学,2009,24(12):927-931.
[5] 孙哲,邹桂玲,杜雪飞,等.酵母样真菌的培养鉴定及药敏试验分析[J].中国实验诊断学, 2014,18(6):1011-1012.
[6] Capponi MP, Segretain G, Sureau G. Penicillosis from Rhizomys sinensis [J]. Bull Soc Pathol Exot Filiales, 1956, 49(3):418-421.
[7] Dialvo A, Fickling A, Ajello. Infection caused byPenicilliummarneffei: description of first natural infection in man[J]. Am J Clin Pathol, 1973, 60 (2): 259-263.
[8] 杨敬劳,李维红,杨红申.马尔尼菲青霉菌病的研究进展[J].国外医学临床生物化学与检验学分册, 2004,25(1):45-47.
[9] 李安生,吴绍熙.体外抗真菌药物敏感性试验的方法学进展[J].国外医学皮肤性病学分册, 1997, 23(5):265-269.
[10] 于金龙,孙淑娟.酵母菌体外药物敏感性试验方法研究进展[J].齐鲁药事,2007,26(4):234-236.
[11] 孙哲,邹桂玲,杜雪飞.酵母样真菌的培养鉴定及药敏试验分析[J].中国实验诊断学, 2014,18(6):1011-1012.
[12] 王建中,邹文珏,孟琳.酵母样真菌鉴定和药敏试验的临床应用分析[J].中华医院感染学杂志,2014,24(5):1298-1300.
[13] National Committee for Clinical Laboratory Standards. Reference method for broth dilution antifungal susceptibility testing of yeasts[S]. M27-A2, NCCLS, 2002.
[14] National Committee for Clinical Laboratory Standards. Reference method for broth dilution antifungal susceptibility testing of Filamentous fungi[S]. M38-A, NCCLS, 2002.
[15] 韦高,汤露露,曹存巍,等.两种方法测定马尔尼菲青霉酵母相体外药敏试验的一致性研究[J].临床皮肤科杂志,2015,40(11):694-696.
[16] 韦高,吴易,李菊裳.4种抗真菌药物对马尔尼菲青霉感染体外药敏试验与临床疗效相关性研究[J].临床皮肤科杂志,2005,34(9):577-579.
[17] 陈蕊.4种抗真菌药物对马尔尼菲青霉感染体外药敏试验与临床疗效[J].河南医学研究,2013,22(4):538-539.
[18] 刘栋华,谭升顺,粱伶,等.马尔尼菲青霉菌酵母相生化及药敏分析[J].中国麻风皮肤病杂志, 2006,22(7):552-554.
(本文编辑:左双燕)
Identification and in vitro antifungal susceptibility of Penicillium marneffei in yeast phase
XIELiang-yi,WANGJuan,ZHANGJing,CHENGZhen-bo,LIHao,LIANGJian,ZHENGShu-juan,ZENGLing,DENGZhong-hua
(HunanProvincialPeople’sHospital,Changsha410005,China)
Objective To understand the identification and in vitro antifungal susceptibility ofPenicilliummarneffei(PM) in yeast phase, and guide clinic antifungal application.Methods Strains isolated from blood and bone marrow of 23 patients infected with PM in a hospital between 2009 and 2016 were collected, colony morphology of PM in yeast phase was observed, susceptibility to itraconazole, voriconazole, amphotericin B, and fluconazole were detected with E-test method.Results Colony morphology of PM were as follows: direct microscopic examination of Wright’s staining of tissue specimens found visible oval or round spore with apparent septum, and mainly located in macrophage; Gram staining of blood culture specimens found that strains were with bulbous and slightly curved ends, occasionally branched and with septum. PM was dimorphic fungi, presented mycelium at 28°C, produced red pigment and diffused into medium; PM presented yeast form at 35°C, there were typical colony morphology. Minimum inhibitory concentrations (MICs) of itraconazole, voriconazole, amphotericin B, and fluconazole to PM in yeast phase were 0.002-0.016, 0.012-0.125, 0.002-0.500, and 0.500-16.000 μg/mL respectively.Conclusion Typical colony morphology and fungal spore of PM in bone marrow and peripheral blood are important features for identification. PM is most susceptible to itraconazole, followed by voriconazole and amphotericin B, while fluconazole is less susceptible.
Penicilliosis marneffei;Penicilliummarneffei; dimorphic fungus; drug resistance, microbial; fungus
10.3969/j.issn.1671-9638.2016.12.009
2016-09-15
湖南省人民医院仁术基金资助项目(2011年)
谢良伊(1978-),女(汉族),湖南省娄底市人,副主任技师,主要从事临床病原菌实验室诊断、耐药机制及分子流行病学研究。
谢良伊 E-mail:47830778@qq.com
R379.9 R512.91
A
1671-9638(2016)12-0934-05

