肿瘤相关巨噬细胞在肿瘤微环境中的相互作用研究进展
贺璐璐,张红新,陈奎
1. 郑州大学 第一附属医院 病理科,郑州 450052; 2. 河南省肿瘤病理重点实验室,郑州 450052; 3. 中美(河南)荷美尔肿瘤研究院,郑州 450052
肿瘤相关巨噬细胞在肿瘤微环境中的相互作用研究进展
1. 郑州大学 第一附属医院 病理科,郑州 450052; 2. 河南省肿瘤病理重点实验室,郑州 450052; 3. 中美(河南)荷美尔肿瘤研究院,郑州 450052
在大多数恶性肿瘤中,肿瘤相关巨噬细胞(TAMs) 作为肿瘤微环境的重要组成成分,可被肿瘤微环境中特异性信号因子所调控,且参与肿瘤细胞发生、发展、浸润及转移的整个过程。本文就TAMs的起源分化、TAMs与肿瘤微环境的相互作用及机制、基于TAMs的肿瘤治疗进展进行综述,以期为肿瘤患者的临床治疗及预后提供新的理论基础与思路。
肿瘤微环境;肿瘤相关巨噬细胞;肿瘤治疗
肿瘤微环境(Tumor Microenvironment, TME)是肿瘤细胞所处的内环境,与肿瘤的发生和转移有着密切的关系。肿瘤微环境中,免疫细胞的浸润活化是大多数恶性肿瘤一种重要的标志,在免疫系统和肿瘤细胞相互作用中发挥着至关重要的作用。肿瘤相关巨噬细胞 (Tumor-Associated Macrophages, TAMs)是众多肿瘤浸润免疫细胞中重要的一个亚群,参与了肿瘤发生演进的整个过程。在大多数恶性肿瘤组织中有大量的TAMs的浸润及相关细胞因子的富集,而TAMs的浸润与肿瘤的特异性病理特征(如免疫抑制、血管淋巴管生成、侵袭转移、耐药性等)密切相关。因此,TAMs可能具有调控肿瘤发展的作用,并且是一个潜在的临床预后标志。本文主要总结在肿瘤免疫微环境中不同分子表型巨噬细胞与肿瘤细胞的相互作用及其机制,旨在筛选出新的肿瘤治疗靶点,以期为肿瘤患者的临床治疗及预后提供新的思路与理论基础。
1 肿瘤相关巨噬细胞(TAMs)
TAMs作为肿瘤微环境的重要组成成分,通过参与肿瘤血管淋巴管生成、移除细胞碎片、组织重塑、免疫抑制等过程,在肿瘤的发生、发展和转移中发挥重要的作用。
1.1 TAMs的起源及组成
TAMs主要有两种来源:起源于骨髓的血液单核细胞(Monocyte-Derived Macrophages, MDMs)或起源于卵黄囊并在特定组织定植的巨噬细胞(Tissue-Resident Macrophage, TRMs)。大多数情况下,TAMs主要来源于循环血单核细胞并通过趋化因子CCL2聚集到肿瘤组织周围。
MDMs寿命较短,通过干细胞被持续替换,而TRMs可以在相当长时间内在特定器官独立存活及再生。虽然TRMs和MDMs在肿瘤组织中均普遍存在,但在不同肿瘤组织模型中所占比例有明显差别。Franklin等在小鼠乳腺癌模型研究中发现MDMs(CCR2+)单核细胞是肿瘤组织中巨噬细胞主要来源,随着肿瘤组织体积增大,MDMs所占比例由最初的15%上升到40%,而TRMs由最初的10%下降到1%,且与TRMs有明显的表型差异[1]。TRMs和MDMs在肿瘤微环境中发挥的作用也不同。有研究报道,脑部肿瘤(如神经胶质瘤、髓母细胞瘤等)小神经胶质细胞(TRMs)首先与增殖的恶性肿瘤细胞相互作用,受肿瘤细胞分泌的细胞因子调控促进肿瘤的生长与侵袭;而MDMs则透过血脑屏障调控肿瘤细胞增殖,进行组织修复。另有研究报道,在中枢神经系统炎症模型中,MDMs与脱髓鞘的发生密切相关,小神经胶质细胞(TRMs)则发挥清除细胞碎片的作用[2]。
1.2 MDMs的成熟分化
循环单核细胞聚集到肿瘤组织之后通常会发生表面标志物的改变。Ly6C+单核细胞进入炎症组织,细胞形态发生变化,体积不断增大,单核细胞不断取代组织中卵黄囊巨噬细胞,发展成为MHCⅡ+巨噬细胞,此过程也是单核细胞分化成熟过程,称之为“瀑布效应”[3](如图1)。这种现象最初来源于肠中单核细胞研究,并可能延伸到肿瘤组织,为描述肿瘤组织中单核细胞终末分化提供基础模型。然而,肿瘤组织中不同成熟阶段TAMs的分布受肿瘤发生部位、类型、分期及大小的影响,并且不同成熟阶段TAMs在肿瘤发展过程中发挥特定作用,如MCHⅡ+TAMs提呈抗原、启动免疫应答、有效杀伤肿瘤细胞。因此,需进一步研究、证实单核细胞成熟过程中特异性信号因子的识别,以及介导巨噬细胞形成的潜在下游通路。
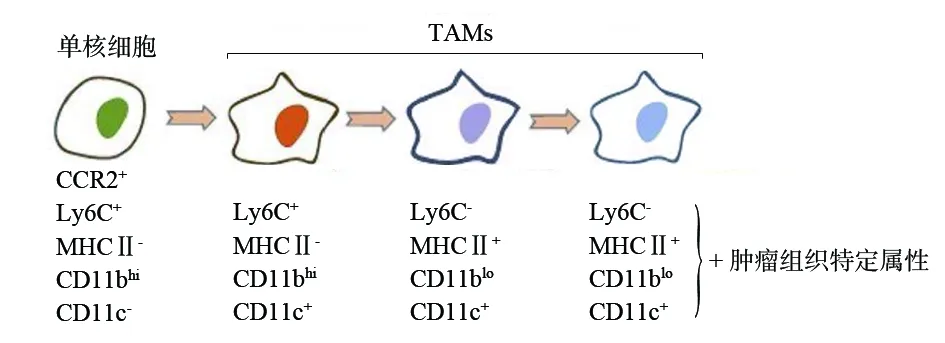
图1 单核细胞成熟过程
1.3 肿瘤相关巨噬细胞(TAMs)分型的重新思考
传统分型中,巨噬细胞大多被分为两种类型:(1)脂质体(LPS)、干扰素γ(IFN-γ)刺激单核细胞,使其分化为M1型巨噬细胞,其可产生大量促炎细胞因子,杀伤吞噬微生物和肿瘤细胞,参与Th1型免疫应答,其标志物主要有Nos2、IL12b、Ciita;(2)白介素-4(IL-4)诱导单核细胞分化为M2型巨噬细胞,具有抗炎作用并且促进淋巴管血管生成、组织重构和创伤修复,其标志物主要有Arg1、Retnla、Chi3l3。
然而,仅通过数个M1/M2标志物辨别不同活化状态的巨噬细胞过于简单且缺少有力证据,可能会影响TAMs体外分离诱导及其功能的判断。El Kasmi等在研究[4-5]中发现Arg1基因也可由LPS和IFNγ等诱导因子刺激产生,说明Arg1在M1或M2型巨噬细胞控制的炎症反应均中发挥重要作用。亦有研究证明,在小鼠乳腺癌模型中TAMs表达“M1标志基因”的同时弱表达“M2标志基因”,如Mrc1、Retnla、Chi3l3,并且后者不是由IL-4诱导产生[1]。同样,肾细胞癌患者体内的单核细胞同时表达TNF、IL-1A等促炎基因和VEGFA、MMP9、CXCR4等促癌基因[6]。此外,在其他多种类型的肿瘤中也存在类似混合基因表型的表达。由于TAMs的表型在不同类型肿瘤中甚至在同一肿瘤的不同部位有显著差异,且受体内复杂微环境影响,故传统二分法并不能完全清晰地区分TAMs的极化状态,具有一定误导性。因此,在给TAM亚群进行分型时应考虑多种参数的影响。
我们应该更客观地从多层面来定义巨噬细胞不同的活化状态,而不仅仅是M1/M2极化状态(如 Box1)。参考Murray等提议的分型方法,将不同诱导因素刺激的巨噬细胞分为M(LPS)、M(IFNγ)及M(IL-4)[7]。
2 肿瘤微环境对巨噬细胞的调控机制
肿瘤生长是正常组织发生的异常分化。在这个过程中,增生细胞和死亡细胞在低氧和酸性环境中共存并产生大量有害细胞因子,造成了肿瘤的血管异常以及特殊的代谢特征。肿瘤免疫微环境中,免疫细胞间及其与其他基质细胞间也存在着复杂的调控关系。肿瘤微环境可调控包括TAMs在内的免疫应答,导致肿瘤发生免疫逃逸或者免疫耐受。
2.1 免疫诱导的信号调控
免疫细胞浸润肿瘤原发部位并产生信号因子,如IL-10、IL-4、IL-13和TGFβ等,调控TAMs分子表型,进而影响巨噬细胞的活化及功能(如图2)。Andreu P等[8]在鼠鳞状细胞癌模型中研究发现,癌前病变皮肤中有B细胞衍生的免疫球蛋白聚集,并且通过Fcγ受体激活骨髓细胞进而刺激巨噬细胞活化,使其分化为促癌基因表型,促进恶性肿瘤发生、发展。这些研究结果表明体液免疫可通过调控TAMs发挥肿瘤促进作用,故B淋巴细胞可以作为治疗B细胞大量浸润为特征的鳞状细胞癌(外阴及头颈部)的特异性靶标。而这类肿瘤患者体内产生的特异性抗体可抑制具有抑癌基因表型的巨噬细胞生成,且与肿瘤的不良预后有关。Affara NI等[9]在研究中发现,肿瘤发生之前优先消除小鼠体内的B淋巴细胞,可以减少免疫球蛋白及TAMs的聚集,进而抑制鳞状细胞癌的发展进程。

图2 肿瘤微环境信号对TAMs的表型调控
免疫细胞可分泌多种细胞因子,诱导具有促癌表型的TAMs生成。骨髓细胞中具有免疫抑制活性的细胞亚型,如TAMs、树突状细胞(DCs)、髓系抑制性细胞(MDSCs)等,可通过分泌IFNγ增强免疫抑制酶NOS2及IDO的表达。有研究表明,人乳腺癌组织中,IFNγ浓度显著升高,从而发挥潜在肿瘤促进作用。另一研究[6]表明,在肾细胞癌患者体内细胞因子IL1-β能刺激单核细胞产生促癌分子表型,故在肾细胞癌移植瘤模型中阻断IL-1/IL-1R信号,能够明显下调TAMs促癌基因的表达,进而延缓肿瘤的生长。
2.2 死亡肿瘤细胞的信号调控
在肿瘤微环境中,浸润的免疫细胞(包括TAMs)可感知自发或由抗肿瘤治疗诱导产生的肿瘤细胞死亡危险信号,即死亡肿瘤细胞表面暴露的钙网织蛋白、释放的ATP以及非组染色质蛋白HMGB1,通过产生炎症复合物或激活TLR4通路,继而产生抗肿瘤炎症反应(如图2)。这种“免疫原性细胞死亡”可能为抗癌药物及放射治疗提供新的思路。Woo SR等[10-13]研究发现,死亡肿瘤细胞释放到细胞外的DNA激发保护性免疫反应来对抗免疫原性肿瘤以及放疗后的免疫抑制。巨噬细胞通过胞浆DNA感受器干扰素刺激基因(STING)识别肿瘤细胞DNA,继而招募TBK1激活IRF3并产生IFNβ产物,引发T细胞产生免疫反应。亦有研究[14]表明,由STING通路产生的细胞因子可以调控由化学性致癌物(如二羟甲基丁酸、顺铂、依托泊苷等)引发的肿瘤的进展。综上所述,STING在免疫反应与肿瘤的相互作用中发挥重要的作用,IFNβ产物也在化疗药物(如莫环霉素)引起的抗肿瘤免疫反应中扮演重要的角色。
2.3 肿瘤细胞循环代谢产物的信号调控
肿瘤微环境与人体正常内环境有着明显的差异,尤其是缺氧及大量酸性物质的蓄积。健康细胞依靠线粒体氧化糖类分子释放出ATP,而肿瘤微环境中高浓度乳酸产生特殊的Warburg效应:无限增值的肿瘤细胞能量代谢发生变化,即使在有氧环境中也利用糖酵解取代有氧循环(有氧糖酵解)。该过程通过新陈代谢中间产物作为生物合成通路的前体物质支持细胞生长。在LPS诱导的巨噬细胞中也观察到了类似的代谢改变,说明M(LPS)进行了短暂的代谢调整来供给能量的需要。已有研究显示,肿瘤中Warburg效应的代谢信号直接调控TAMs的分子表型与功能。
乳酸可以促进促癌基因Vegf和Arg1在巨噬细胞的表达。Vegf在肿瘤组织的表达通常受HIF1α调控,这种组织诱导因子即使在低氧环境中也可稳定发挥效应。亦有研究[15]报道,骨髓细胞中Arg1的缺失可明显降低皮下移植瘤的生长速度,由此推测Arg1在TAMs的表达可以促进肿瘤生长。Sears CL等研究[16]发现,胃肠道肿瘤中微生物群分泌的细胞因子及细菌代谢产物(如丁酸盐或丙酸盐)也有可能调控肠道中TAMs的表型与功能。
3 TAMs在肿瘤微环境中的作用
肿瘤组织中的TAMs具有特异的临床病理特征。多种人类肿瘤及动物肿瘤模型的研究中发现,在稳定的内环境中由于巨噬细胞对机体的正常生理功能进行再利用,导致致瘤因素的产生。巨噬细胞启动一系列自愈机制尝试着“修复”癌组织,包括血管及淋巴管新生、迁移细胞碎片、产生营养信号因子、组织重组、免疫抑制等。
3.1 TAMs促进肿瘤血管及淋巴管形成
在肿瘤发展的各个阶段,TAMs表达不同的分子表型。肿瘤早期或者衰退阶段,TAMs表达抑癌表型并且抑制血管再生;相反,在肿瘤生长发育阶段,TAMs表达促癌表型促进肿瘤的生长及肿瘤血管新生。同时,巨噬细胞向促血管新生表型分化,受低氧内环境、肿瘤细胞和间质细胞分泌的信号因子等多种因素调控。TAMs分泌多种促血管生成因子,刺激肿瘤血管再生,如成纤维细胞生长因子、胸苷磷酸化酶、尿激酶纤溶酶原激活物(uPA)、肾上腺髓质素(ADM)等。有研究[17]报道,黑色素瘤中TAMs产生ADM,继而通过激活内皮氮氧合酶,增强内皮细胞的增殖和成管能力,说明TAMs分泌的ADM具有促进血管再生的功能。肿瘤组织无血管区域低氧环境中,TAMs释放促血管生成因子VEGF-A促进肿瘤血管生成。Bingle等[18]研究发现,实体瘤中巨噬细胞分泌的VEGF-A启动肿瘤血管新生,而抑制巨噬细胞活性血管再生将会延迟。在缺氧肿瘤内环境中TAMs分泌缺氧诱导蛋白水解酶MMP-1和MMP-7,CD45+单核细胞聚集并且分泌MMP-9。这些基质金属蛋白酶通过降解细胞外基质释放VEGF,从而增加内皮细胞的迁移,促进肿瘤血管再生。
巨噬细胞也可以通过多种信号传导通路调控淋巴管形成。TAMs分泌多种细胞因子,促进淋巴管内皮细胞生长增殖,并可重构已经形成的淋巴管。Schoppmann SF等[19]研究发现,宫颈癌癌周炎症反应以及TAMs产生的VEGF-C对淋巴管的形成有重要的促进作用。生长因子VEGF家族(如VEGF-A、VEGF-C/-D)与淋巴管内皮细胞(LEC)表面相应的特异性VEGFR-2和VEGFR-3受体结合,诱导病理性淋巴管生成。在转移性黑色素瘤周围LYVE-1+巨噬细胞和LECs毗邻存在并且癌周巨噬细胞中VEGF-C高表达,由此可见TAMs可以促进肿瘤淋巴管的形成、吞噬肿瘤细胞碎片以及形成肿瘤相关的免疫复合物。
3.2 TAMs促进肿瘤的侵袭及转移
通过对肿瘤微环境的调控,TAMs可直接或间接影响肿瘤细胞的浸润与转移过程。Wyckoff等应用实时成像技术观察到乳腺癌中肿瘤细胞侵入血管的过程与TAMs有密切的联系,从而说明TAMs可促进肿瘤细胞转移。在肿瘤细胞分泌CSF-1刺激巨噬细胞的迁移同时,巨噬细胞分泌内皮生长因子(EGF)促进肿瘤细胞侵袭;下调或者沉默CSF-1、EGF的表达则会降低这两种细胞的转移能力。多功能蛋白聚糖,在恶性肿瘤中高表达并且具有活化巨噬细胞的功能,与肿瘤的进展密切相关。Mantovani等[20]研究发现, Lewis肺癌肿瘤组织中产生大量的多功能聚糖蛋白,这种聚糖蛋白通过TLR-2/TLR-6受体激活巨噬细胞增强肿瘤的转移及生长。巨噬细胞还可以分泌多种蛋白水解酶,如组织蛋白酶、MMPs、丝氨酸蛋白酶等,这些巨噬细胞源性的蛋白酶降解周围的细胞外基质,从而使肿瘤细胞突破屏障发生侵袭。有研究证实,消除TAMs衍生的组织蛋白酶B和组织蛋白酶S,肿瘤细胞的侵袭能力将会显著降低,可见TAMs在肿瘤的侵袭与迁移中发挥重要的作用。
3.3 TAMs的免疫抑制作用
TAMs可促进肿瘤发生、发展的另一个原因是其抗肿瘤免疫反应被抑制。促炎细胞因子IL-12可以触发NK细胞杀伤肿瘤细胞,同时促进CD4+T细胞产生细胞毒性产物,而抑制TAMs分泌IL-12可抑制抗肿瘤免疫应答。除此之外,TAMs可分泌免疫抑制因子IL-10、TGFβ、PGE2等,这些免疫抑制因子通过趋化因子CCL22将TREG转运到肿瘤组织中,进而抑制T细胞介导的免疫应答。TAMs分泌的IL-10对骨髓细胞分泌的IL-12起负向调节作用,促进TH2细胞的分化,释放大量的IL-4和IL-13促进TAMs向促癌表型分化。已有研究[21]显示,IL-10抑制化疗药物的抗肿瘤免疫反应从而显著降低抗癌治疗效果。TAMs也可以通过激活特殊酶类来抑制T细胞免疫应答,如分解精氨酸L的水解酶ARG1,此水解酶由多种肿瘤相关信号(IL-4、IL-10、缺氧等)诱导产,通过降解半必需氨基酸——精氨酸L,影响T细胞的免疫应答[22-24]。巨噬细胞通常在炎性环境的刺激下产生NOS2,并且对病原体产生毒性作用,但是肿瘤组织中的NOS2通过产生NO产物抑制T细胞的免疫应答。TAMs亦可促进T细胞的凋亡,活化的单核细胞促进程序性细胞死亡配体1(PD-L1)的自分泌,抑制T细胞抗肿瘤免疫反应。
4 以TAMs为靶标的肿瘤治疗进展
越来越多研究[25]证实,TAMs在肿瘤微环境中可调控肿瘤的发生发展进程,因此,TAMs正成为抗肿瘤治疗的新靶点。目前,针对TAMs进行的肿瘤治疗主要包括以下三个方面。
4.1 抑制 TAMs存活
通过抑制TAMs的活性来提高肿瘤的治疗效果已经得到大多数学者的认可。应用化疗药物或者合成的中药有效成分直接诱导TAMs的凋亡,是一种有效的途径。如曲贝替定(ET-743),一种治疗软组织肉瘤和复发性铂类敏感卵巢癌的DNA损伤药物,可以杀伤TAMs、发挥抗癌效应。有研究[26]报道,在耐药性移植瘤小鼠模型中,曲贝替定可以显著抑制肿瘤的生长,同时其肿瘤微环境中TAMs的密度显著降低。由于曲贝替定不仅对TAMs产生作用,而且影响单核/巨噬细胞介导的宿主防御,因此需进一步研究特异性的抗TAM药物,减少对正常生理功能的影响。另有研究[27]表明,Cieslewicz等发现了一种特异性结合TAMs的特殊多肽M2pep,其携带一种促凋亡肽类,选择性地杀伤TAMs并且提高荷瘤小鼠的存活率。此外,多烯紫杉醇亦可以清除免疫抑制的TAMs,同时发挥抗肿瘤骨髓细胞增殖效应[28]。
4.2 抑制巨噬细胞癌周富集
肿瘤和间质细胞分泌的趋化因子可促进巨噬细胞向肿瘤组织周围聚集。通过对趋化因子进行调控从而限制巨噬细胞的富集,可能会成为有效的抗肿瘤靶点。有研究[29]表明,用特异性单克隆抗体选择性地抑制VEGFR2,可显著减少巨噬细胞的浸润与肿瘤的增长。另一研究[30]表明,宾达利对趋化因子CCL2发挥药物抑制作用,可以减少巨噬细胞的聚集,从而有效抑制肿瘤的生长。
以细胞集落刺激因子1受体(CSF1-R)为靶点的治疗或许成为另一种抑制巨噬细胞富集的方法。有研究[31]表明,在弥漫性巨细胞瘤患者体内,人来源的单克隆抗体RG7155可有效抑制CSF1-R二聚体的形成,继而明显减少CSF-1R+CD163+巨噬细胞亚群在肿瘤组织中的浸润。CSF1-R的酪氨酸激酶抑制剂PLX3397,通过减少巨噬细胞富集,同时促进肿瘤组织中淋巴细胞的浸润,可以提高肿瘤免疫治疗的效果[32]。
4.3 诱导巨噬细胞向抗肿瘤表型转化
在不同的诱导因子作用下,巨噬细胞可以向不同的表型分化,因此使具有促癌表型的巨噬细胞向抑癌表型转化,似乎成为一种更好的治疗肿瘤的潜在手段。有研究[33]发现,在荷瘤小鼠模型中,活化的TLR3/Toll-IL-1受体通过Poly(I:C)导致大量促炎因子产生,继而促进巨噬细胞向抑癌表型转化,发挥杀伤肿瘤细胞的作用。另一研究[34]表明,治疗恶性肿瘤的临床药物唑来膦酸,可以通过诱导促肿瘤巨噬细胞向抗肿瘤表型转化,抑制乳腺癌的发生发展。此外,组氨酸糖蛋白的富集(HRG)可下调胎盘生长因子(PIGF)的表达,诱导巨噬细胞向抑癌表型转化以及血管的重构,从而抑制肿瘤的生长和新血管的形成[35]。Zhang等人[36]研究发现,由促癌表型向抗肿瘤表型转化而来的巨噬细胞,可以显著抑制乳腺癌的生长以及肿瘤血管的再生。
5 结论
TAMs作为肿瘤微环境的重要组成成分,与肿瘤的发生、发展、浸润、转移有着密切的关系。巨噬细胞在不同诱导因子影响下表达不同分子表型,并且在肿瘤组织所占比例有明显差别,在肿瘤微环境中发挥的作用也不相同。在肿瘤发生、发展过程中,微环境中多种因素影响TAMs的分子表型及其功能。巨噬细胞启动一系列自愈机制尝试着“修复”癌组织:促进肿瘤血管及淋巴管形成、促进肿瘤细胞的侵袭及转移、抗肿瘤免疫应答等。因此,越来越多的研究证实,通过调控TAMs可以达到抗癌的效果。然而,多数实验研究数据是从小鼠体内中得到的。尽管小鼠是获得大多理论与机制的重要的模型,我们依然应该意识到广泛的种属特异性差异也许会对TAMs的调控机制产生显著的影响。相信,随着研究的深入以及更加完善的模型设计,针对TAMs的靶向治疗的分子机制将会更加明确,治疗方案将会更加成熟。
[1] Franklin R A, Liao W, Sarkar A, et al. The cellular and molecular origin of tumor-associated macrophages [J]. Science, 2014, 344(6186):921-925.
[2] Yamasaki R, Lu H, Butovsky O, et al. Differential roles of microglia and monocytes in the inflamed central nervous system [J]. J Exp Med, 2014, 211(8):1533-1549.
[3] Bain C C, Bravo-Blas A, Scott C L, et al. Constant replenishment from circulating monocytes maintains the macrophage pool in the intestine of adult mice [J]. Nat Immunol, 2014, 15(10):929-937.
[4] El Kasmi K C, Qualls J E, Pesce J T, et al. Toll-like receptor-induced arginase 1 in macrophages thwarts effective immunity against intracellular pathogens [J]. Nat Immunol, 2008, 9(12):1399-1406.
[5] Pesce J T, Ramalingam T R, Wilson M S, et al. Retnla (relmalpha/fizz1) suppresses helminth-induced Th2-type immunity [J]. PLoS Pathog, 2009, 5(4):e1000393.
[6] Chittezhath M, Dhillon M K, Lim J Y, et al. Molecular profiling reveals a tumor-promoting phenotype of monocytes and macrophages in human cancer progression [J]. Immunity, 2014, 41(5):815-829.
[7] Murray P J, Allen J E, Biswas S K, et al. Macrophage activation and polarization: nomenclature and experimental guidelines [J]. Immunity, 2014, 41(1):14-20.
[8] Andreu P, Johansson M, Affara N I, et al. FcRgamma activation regulates inflammation-associated squamous carcinogenesis [J]. Cancer Cell, 2010, 17(2):121-134.
[9] Affara N I, Ruffell B, Medler T R, et al. B cells regulate macrophage phenotype and response to chemotherapy in squamous carcinomas [J]. Cancer Cell, 2014, 25(6):809-821.
[10] Woo S R, Fuertes M B, Corrales L, et al. STING-dependent cytosolic DNA sensing mediates innate immune recognition of immunogenic tumors [J]. Immunity, 2014, 41(5):830-842.
[11] Deng L, Liang H, Xu M, et al. STING-Dependent Cytosolic DNA Sensing Promotes Radiation-Induced Type I Interferon-Dependent Antitumor Immunity in Immunogenic Tumors [J]. Immunity, 2014, 41(5):843-852.
[12] Ablasser A, Goldeck M, Cavlar T, et al. cGAS produces a 2'-5'-linked cyclic dinucleotide second messenger that activates STING [J]. Nature, 2013, 498(7454):380-384.
[13] Wu J, Sun L, Chen X, et al. Cyclic GMP-AMP is an endogenous second messenger in innate immune signaling by cytosolic DNA [J]. Science, 2013, 339(6121):826-830.
[14] Ahn J, Xia T, Konno H, et al. Inflammation-driven carcinogenesis is mediated through STING [J]. Nat Commun, 2014, 5:5166.
[15] Colegio O R, Chu N Q, Szabo A L, et al. Functional polarization of tumour-associated macrophages by tumour-derived lactic acid [J]. Nature, 2014, 513(7519):559-563.
[16] Sears C L, Garrett W S. Microbes, microbiota, and colon cancer [J]. Cell Host Microbe, 2014, 15(3):317-328.
[17] Chen P, Huang Y, Bong R, et al. Tumor-associated macrophages promote angiogenesis and melanoma growth via adrenomedullin in a paracrine and autocrine manner [J]. Clin Cancer Res, 2011, 17(23):7230-7239.
[18] Bingle L, Lewis C E, Corke K P, et al. Macrophages promote angiogenesis in human breast tumour spheroids in vivo [J]. Br J Cancer, 2006, 94(1):101-107.
[19] Schoppmann S F, Birner P, Stöckl J, et al. Tumor-associated macrophages express lymphatic endothelial growth factors and are related to peritumoral lymphangiogenesis [J]. Am J Pathol, 2002, 161(3):947-956.
[20] Kim S, Takahashi H, Lin W W, et al. Carcinoma-produced factors activate myeloid cells through TLR2 to stimulate metastasis [J]. Nature, 2009, 457(7225):102-106.
[21] Ruffell B, Chang-Strachan D, Chan V, et al. Macrophage IL-10 blocks CD8+T cell-dependent responses to chemotherapy by suppressing IL-12 expression in intratumoral dendritic cells [J]. Cancer Cell, 2014, 26(5):623-637.
[22] Doedens A L, Stockmann C, Rubinstein M P, et al. Macrophage expression of hypoxia-inducible factor-1 alpha suppresses T-cell function and promotes tumor progression [J]. Cancer Res, 2010, 70(19):7465-7475.
[23] Hesse M, Modolell M, La Flamme A C, et al. Differential regulation of nitric oxide synthase-2 and arginase-1 by type 1/type 2 cytokines in vivo: granulomatous pathology is shaped by the pattern of L-arginine metabolism [J]. J Immunol, 2001, 167(11):6533-6544.
[24] Rodriguez P C, Quiceno D G, Zabaleta J, et al. Arginase I production in the tumor microenvironment by mature myeloid cells inhibits T-cell receptor expression and antigen-specific T-cell responses [J]. Cancer Res, 2004, 64(16):5839-5849.
[25] De Palma M, Lewis C E. Macrophage regulation of tumor responses to anticancer therapies [J]. Cancer Cell, 2013, 23(3):277-286.
[26] Germano G, Frapolli R, Belgiovine C, et al. Role of macrophage targeting in the antitumor activity of trabectedin [J]. Cancer Cell, 2013, 23(2):249-262.
[27] Cieslewicz M, Tang J, Yu J L, et al. Targeted delivery of proapoptotic peptides to tumor-associated macrophages improves survival [J]. Proc Natl Acad Sci, 2013, 110(40):15919-15924.
[28] Kodumudi K N, Woan K, Gilvary D L, et al. A novel chemoimmunomodulating property of docetaxel: suppression of myeloid-derived suppressor cells in tumor bearers [J]. Clin Cancer Res, 2010, 16(18):4583-4594.
[29] Dineen S P, Lynn K D, Holloway S E, et al. Vascular endothelial growth factor receptor 2 mediates macrophage infiltration into orthotopic pancreatic tumors in mice [J]. Cancer Res, 2008, 68(11):4340-4346.
[30] Gazzaniga S, Bravo A I, Guglielmotti A, et al. Targeting tumor-associated macrophages and inhibition of MCP-1 reduce angiogenesis and tumor growth in a human melanoma xenograft [J]. J Invest Dermatol, 2007, 127(8):2031-2041.
[31] Ries C H, Cannarile M A, Hoves S, et al. Targeting tumor-associated macrophages with anti-CSF-1R antibody reveals a strategy for cancer therapy [J]. Cancer Cell, 2014, 25(6):846-859.
[32] Mok S, Koya R C, Tsui C, et al. Inhibition of CSF-1 receptor improves the antitumor efficacy of adoptive cell transfer immunotherapy [J]. Cancer Res, 2014, 74(1):153-161.
[33] Shime H, Matsumoto M, Oshiumi H, et al. Toll-like receptor 3 signaling converts tumor-supporting myeloid cells to tumoricidal effectors [J]. Proc Natl Acad Sci, 2012, 109(6):2066-2071.
[34] Coscia M, Quaglino E, Iezzi M, et al. Zoledronic acid repolarizes tumour-associated macrophages and inhibits mammary carcinogenesis by targeting the mevalonate pathway [J]. J Cell Mol Med, 2010, 14(12):2803-2815.
[35] Rolny C, Mazzone M, Tugues S, et al. HRG inhibits tumor growth and metastasis by inducing macrophage polarization and vessel normalization through downregulation of PlGF [J]. Cancer Cell, 2011, 19(1):31-44.
[36] Zhang X, Tian W, Cai X, et al. Hydrazinocurcumin Encapsuled nanoparticles “re-educate” tumor-associated macrophages and exhibit anti-tumor effects on breast cancer following STAT3 suppression [J]. PLoS One, 2013, 8(6):e65896.
[责任编辑 李麦产]
Interaction between tumor-associated macrophages and tumor microenvironment
1. Department of Pathology, The First Affiliated Hospital of Zhengzhou University, Zhengzhou 450052, China; 2. Henan Laboratory for Tumor Pathology, Zhengzhou 450052, China; 3. China-US (Henan) Hormel Cancer Institute, Zhengzhou 450052, China
AS the key components of the tumor microenvironment, tumor associated macrophages (TAMs) can be regulated by tumorderived signals and have been linked with neoplastic cell growth, progression, metastasis in most malignant tumors. In this review, we outlinet the origin and differentiation of macrophages, and the mechanism between TAMs and tumor microenvironment as well as TAM-targeting therapy.This paper provide new ideas and theoretical basis for treatment and prognosis of cancer patients.
tumor microenvironment; tumor-associated macrophage; oncotherapy
1672-7606(2016)04-0294-07
2016-09-25
国家自然科学基金(81272370)
贺璐璐(1989-),女,河南南阳人,硕士生,从事恶性肿瘤的浸润转移机制研究工作。
陈奎生(1964-),男,河南长葛人,博士,教授,主要从事脑瘤病理相关研究。
R737
A

