桃叶珊瑚苷抗皮肤光老化作用机制研究
胡倩影,丁艳,田己鑫,梁晓炜,李 钦
河南大学 药学院,河南 开封 475004
桃叶珊瑚苷抗皮肤光老化作用机制研究
河南大学 药学院,河南 开封 475004
〔目的〕探索桃叶珊瑚苷 (aucubin,AU) 抗皮肤光老化作用机制。 〔方法〕 采用UVA+UVB光源照射小鼠背部皮肤,建立小鼠皮肤光老化模型。将60只昆明种小鼠随机分为6组,即正常组、模型组、维生素E阳性对照组 (VE组,10 mg/100 mL)、AU高 (10 mg/100 mL)、中 (5 mg/100 mL)、低(0.5 mg/100 mL)剂量组。除正常组外,其余各组每日均采用UVA+UVB紫外线照射并皮肤涂布给药,连续8周,第9周将小鼠断颈处死,取小鼠光照部位皮肤,HE染色,观察皮肤组织结构变化;比色法检测小鼠皮肤中超氧化物歧化酶(SOD)、丙二醛(MDA)活性和总抗氧化能力(T-AOC);氨基酸分析法测定小鼠皮肤中羟脯氨酸(HYP)含量;ELISA法测定胶原蛋白Ι (Collagen I) 含量。〔结果〕 与模型组比较,AU高剂量组小鼠皮肤组织结构受损程度明显减轻,结构比较完整、厚薄均一,细胞分层清晰,真皮层可见丰富的胶原纤维组织,分布均匀、排列有序;SOD、MDA、T-AOC含量变化不明显;小鼠皮肤中HYP、Collagen I和总氨基酸(AA)的含量明显升高,几乎接近正常健康小鼠的水平。〔结论〕桃叶珊瑚苷具有抗皮肤光老化的作用,其作用机制与促进胶原蛋白的合成有关。
桃叶珊瑚苷;抗皮肤光老化;胶原蛋白
皮肤老化主要分为自然老化和光老化两种形式。皮肤光老化主要是因环境引起的,光老化能够导致严重的皮肤问题,并与多种皮肤病的发生、发展有着密切的关系,因而近年来皮肤光老化的问题受到了很多研究学者的关注。光老化皮肤表现为皮肤表皮增厚,真表皮连接变平,表皮细胞极性消失,形态不典型。真皮成纤维细胞增大、增多,大量炎症细胞浸润,弹性纤维增多、增粗、排列紊乱,而胶原纤维变少。皮肤中75%由胶原蛋白组成,胶原蛋白维持着皮肤的弹性和水润[1-3],因此,皮肤中胶原蛋白的含量是皮肤衰老的重要指标。皮肤中的羟脯氨酸含量相对稳定,约占胶原蛋白总量的13%,可直接反应真皮内胶原纤维的含量变化,从而能够反应真皮衰老的程度,所以其含量变化也可以作为判定皮肤衰老程度的一个敏感指标[4]。
课题组前期研究[5]表明,在光老化模型小鼠中,杜仲环烯醚萜类提取物,能够明显改善小鼠皮肤的皮肤组织的光老化形态,减轻小鼠皮肤皱纹,改善皮肤的结构,提高真皮层胶原纤维的含量;提高小鼠皮肤的含水量;提高小鼠皮肤组织中SOD活力和T-AOC能力,减少脂质过氧化产物MDA的堆积,有效地清除自由基及活性氧。我们实验在前期体活性部位筛选的基础上,选择了杜仲中含量较大的环烯醚萜类化合物-桃叶珊瑚苷,进行抗皮肤光老化实验,探讨桃叶珊瑚苷抗皮肤光老化的作用机制。
1 材料与方法
1.1 实验用动物
昆明种小鼠60只(批号:1019052,合格证号:SCXK(豫)2010-0002),体重(18~22)g,雌雄各半,购于河南省实验动物中心。环境温度控制在(25 ± 2)℃,光照时间12 h,动物自由摄食饮水。
1.2 试剂与药品
桃叶珊瑚苷实验室自制(纯度>98%),维生素 E 标准品(上海源叶生物科技有限公司),苏木素染液(苏宁食药监械),中性胶(国药集团化学试剂有限公司),SOD、MDA和T-AOC试剂盒(南京建成生物工程研究所),小鼠皮肤胶原蛋白Ι试剂盒(南京森贝伽生物科技有限公司)。
1.3 主要仪器及设备
氨基酸分析仪(A3100,德国曼默波尔公司),生物显微镜(BA410,厦门 MOTIC公司),全波长酶标仪(Power Wave XS sn208527,美国Bio-Tek公司)。
1.4 实验方法
1.4.1 动物分组与给药 将60只小鼠随机分为6组,每组10只,分别为:正常组(不做任何处理),模型对照组(涂抹体积分数30%甘油水溶液,每次涂抹体积为0.5 mL),阳性对照组(维生素E),桃叶珊瑚苷高、中、低剂量组。自由饮水、进食,饲养1周适应实验室环境后开始进行实验。
1.4.2 小鼠皮肤光老化模型的建立 UVB 灯管1根(光谱集中在320 nm),UVA 灯管1根(光谱集中在340 nm),并列穿插安装到自制模拟日光箱中。每只小鼠均用脱毛膏脱出小鼠背部2.0 cm×2.0 cm区域内毛发(实验过程中隔日脱毛1次)。除正常组外,其他各组鼠笼笼盖移除后,放入自制照射箱中,距离光源30 cm 处。第1周开始每天照射20 min,第2~4周每天照射30 min,第5~8周每天照射40 min。照射以5 d为1个周期,间隔2 d,再开始下一个周期,至8周结束后终止UV暴露。造模过程中每天观察动物背部皮肤有无水疱或糜烂等情况,如果出现上述症状,立即停止照射2~3 d,至上述症状消失后再继续照射,直至造模成功。
1.4.3 取材 第8周结束后,全部小鼠断颈处死,取下背部脱毛区皮肤(不含皮下脂肪组织),用冰生理盐水漂洗干净,去除血液,滤纸拭干,称重,-80 ℃保存备用。
1.4.4 小鼠背部皮肤的宏观评价 观察小鼠皮毛光泽,皮肤硬度和皱纹。
1.4.5 皮肤组织学观察 将皮肤组织切片固定于体积分数为10%的中性甲醛 24 h后进行常规石蜡包埋,制成5 μm的组织切片。对切片分别经HE染色后,光学显微镜下观察和拍照。
1.4.6 组织匀浆的制备 每个小鼠皮肤组织标本取0.3 g,用手术剪将皮肤组织块剪碎后倒入玻璃匀浆管中,量取1.2 mL冷生理盐水,倒入匀浆器中使组织匀浆化,匀浆液4 000 r/min,离心15 min,取上清液。

1.5 统计处理

2 结果
2.1 AU对UV照射小鼠皮肤宏观表现的影响
正常组小鼠实验全程皮肤无明显改变,皮毛有光泽,活泼喜动,食欲佳,食量正常,体重平稳增加。模型组小鼠在8周实验结束时,皮毛光泽度下降,皮肤颜色加深,表皮增厚,干燥粗糙,弹性丧失,皮肤纹理增宽加深。与模型组小鼠比较,AU高剂量组能明显改善小鼠背部皮肤颜色,表皮增厚和皱纹加深现象也得到改善。VE组虽然也能改善上述症状,但效果不明显。结果见图1。

图1 小鼠皮肤一般形态观察
2.2 AU对UV照射小鼠皮肤组织结构的影响
常规HE染色后,正常组小鼠,皮肤表皮组织结构完整、细胞分层清晰、厚度正常、具有明显的表皮突及真皮乳头;真皮层可见纤维组织、分布均匀、排列有序、疏密有致、细胞成分及数量适中。与正常组小鼠相比,模型组小鼠的表皮组织结构不完整,分层不清楚;因真皮层成纤维组织发生变性,导致真皮组织排列紊乱、分布不均匀。与模型组相比,AU高剂量组小鼠表皮组织结构受损程度明显减轻,结构比较完整、厚薄均一、细胞分层比较清晰;真皮层可见纤维组织,且分布较为均匀、排列有序,胶原纤维比较丰富。作为阳性对照的VE组,小鼠皮肤胶原纤维增加不明显。结果见图2。

图2 小鼠皮肤病理切片
2.3 AU对小鼠各生化指标的影响
2.3.1 AU对UV照射小鼠皮肤含水量的影响 用水分测定仪分别测量小鼠背部皮肤含水量,每次间隔4周。结果如表1。为避免仪器和操作带来的误差,每只小鼠测量3次,取3次测量平均值进行数据统计。第一次测定时间为造模前,各组小鼠皮肤含水量无显著性差异(P>0.05);第二次测定时间为紫外照射4周后,发现各组小鼠皮肤水分与照射前相比均有明显下降,且差异具有显著性(P<0.01),说明紫外线照射能降低小鼠皮肤的水分,但是在第8周第三次测定(实验结束)时,发现AU高剂量组水分值几乎恢复到了造模前,VE组水分值也有所恢复,而模型组含水量却持续降低。将AU高剂量组水分值和模型组小鼠皮肤水分值对比发现,AU高剂量组的水分明显高于模型组小鼠的皮肤含水量,且差异具有显著性(P<0.01),VE组和模型组比较也有显著性差异(P<0.01)。同时比较模型组和空白组小鼠的皮肤水分含量,虽然发现模型组和正常组皮肤含水量在整个实验过程中均持续降低,但是模型组的水分值明显低于正常组,且差异具有显著性(P<0.05)。结果见图3。
2.3.2 小鼠皮肤中抗氧化活性(SOD、MDA和T-AOC)检测 模型组小鼠皮肤中SOD和T-AOC活力比正常组低,MDA含量升高,且差异显著,说明紫外线照射能引起小鼠皮肤氧化性损伤。VE组和模型组相比,SOD,T-AOC活力升高,MDA含量降低,具有极显著性差异(P<0.01)。说明VE能抵抗紫外线引起的小鼠皮肤氧化性损伤。AU各剂量组和模型组的抗氧化能力相比,虽有提高但不具有统计学意义(P>0.05),说明化合物AU的抗氧化活性不显著。
2.3.3 小鼠皮肤中HYP和AA含量测定 经过8周实验后,模型组和正常组相比HYP和AA的含量均有所降低,且差异极显著(P<0.01),说明紫外线照射能明显减少小鼠皮肤细胞羟脯氨酸的分泌。与模型组相比,AU高、中剂量组及阳性对照VE组,小鼠皮肤HYP和AA含量明显增加,差异极显著(P<0.01)。结果见表2。
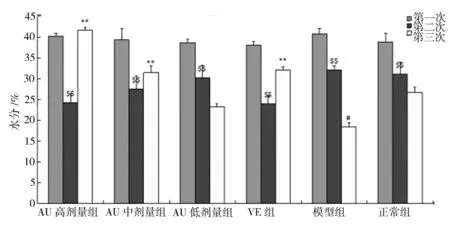
图3 各组小鼠皮肤水分3次测定结果比较注:$$表示与第一次水分测定值比较有极显著性差异(P<0.01),#表示与正常组比较有显著性差异(P<0.05),**表示与模型组比较有极显著性差异(P<0.01)

组别动物/只SOD(nmoL/mgProt)MDA(nmoL/mg)T⁃AOC(nmoL/mgProt)正常组1037.71±6.392.8±0.0827.93±0.84模型组1032.77±1.84#3.54±0.1#22.63±0.95#VE组1042.97±2.15∗∗1.22±0.12∗∗28.42±1.08∗∗AU高剂量组1034.29±3.851.26±0.0925.65±1.76AU中剂量组1034.05±2.922.02±0.0717.95±2.01AU低剂量组1023.63±3.783.38±0.1315.29±2.45
注:#表示与正常组比较有显著性差异(P<0.05),**表示与模型组比较有极显著性差异(P<0.01)。
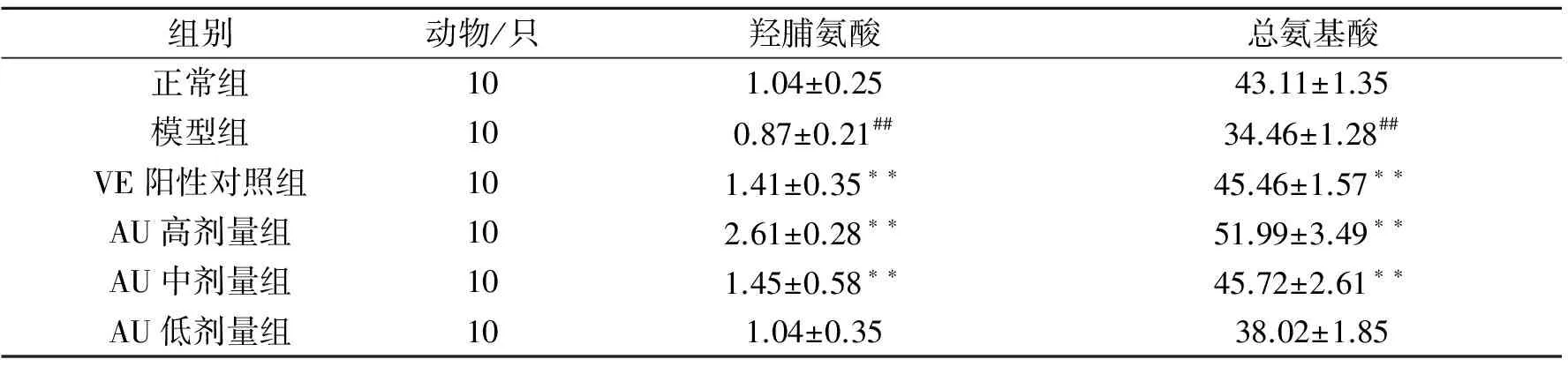
表2 小鼠皮肤中羟脯氨酸及总氨基酸的含量(μg/100 g)
注:##表示与正常组比较有极显著性差异(P<0.01),**表示与模型组比较有极显著性差异 (P<0.01)。
2.3.4 小鼠皮肤Collagen I含量测定 经8周实验后,模型组小鼠皮肤Collagen I含量明显下降,与空白组比较有显著性差异(P<0.05),说明紫外线照射能减少小鼠皮肤中胶原蛋白的合成。与模型组相比,AU高剂量组小鼠皮肤Collagen I含量明显增加,且具有显著性差异(P<0.01)。中、低剂量组小鼠皮肤Collagen I含量增加不显著。VE组对小鼠皮肤Collagen I有促进作用(P<0.05),但不及AU高剂量组显著。结果见表3。

表3 小鼠皮肤中胶原蛋白 Ι 的含量(μg/100 g)
注:#表示与正常组比较有显著性差异(P<0.05),*表示与模型组比较有显著性差异 (P<0.05),**表示与模型组比较有极显著性差异(P<0.01)。
3 讨论
引起皮肤衰老的原因可能有多种,我们实验从影响衰老最主要的4个方面,即皮肤的状态;皮肤保持水分的能力;机体的抗氧化、清除自由基的能力;皮肤胶原蛋白的含量,比较AU对光老化模型小鼠皮肤衰老的影响。
皮肤的状态往往作为估价机体年龄的第一个指标[6]。我们实验中,紫外线照射可使小鼠皮肤表皮增厚,出现真表皮连接变平,表皮细胞极性消失,形态不典型。弹性纤维增多、增粗、排列紊乱,胶原纤维变少,分布异常,使小鼠皮肤出现光老化的典型特征。AU高剂量组能明显改善小鼠皮肤的上述症状。皮肤水分大量丢失,导致皮肤干燥,萎瘪,缺乏弹性,出现皱纹,皮肤老化,因此皮肤含水量与皮肤衰老密切相关。通过测定皮肤水分的含量,也可间接反映皮肤衰老的程度[7]。 紫外线照射后,模型组小鼠的皮肤水分含量持续降低,而AU高剂量组使小鼠皮肤水分含量先降后升,达到抗小鼠皮肤光老化的作用。
现代研究[8-10]表明SOD、MDA 和脂褐素(LPf) 等是直接关系生物体内“氧化”损害与“抗氧化”的相关指标,而它们有可能是引起或延缓诸如皮肤衰老、皮肤褐斑的关键因素。经紫外线照射8周后,小鼠皮肤组织中SOD、T-AOC活性下降,MDA含量升高,说明小鼠皮肤发生了光老化。AU高剂量组可对抗紫外线造成的皮肤光损伤,使小鼠皮肤组织中的SOD,T-AOC活力略有提高,MDA含量略有降低,具有一定的抗氧化损伤作用,因此能在一定程度预防小鼠皮肤的光老化,但是抗氧化活性效果远不及同浓度的VE组。
胶原蛋白是皮肤蛋白的主要成分,约占总蛋白的60%左右,皮肤的生长、营养和修复都离不开胶原蛋白。随着年龄增长,皮肤胶原产物减少,因此检测胶原蛋白的变化可反映皮肤衰老的状况[11]。HYP 是皮肤胶原蛋白中一种主要且相对恒定的非必需氨基酸,其量已成为检测机体胶原代谢的重要指标,也是衡量皮肤衰老的指标之一[12]。我们实验结果表明,紫外线照射后,模型组小鼠皮肤组织中HYP、AA和Collagen I含量与正常组相比明显降低,具有显著性差异(P<0.05),说明紫外线照射能明显减少小鼠皮肤成纤维细胞分泌胶原蛋白的含量。AU高剂量组能明显提高小鼠皮肤中HYP、AA和Collagen I含量,且具有极显著性差异(P<0.01),说明AU高剂量组能促进小鼠皮肤胶原蛋白的合成,增加羟脯氨酸的含量,达到抗皮肤光老化的作用。
我们通过组织学和小鼠皮肤系列生化指标的测定,说明一定剂量的桃叶珊瑚苷能增加光老化模型小鼠皮肤胶原的厚度,使胶原纤维的排列更为致密,提高皮肤的含水量,增加胶原蛋白的含量,但是其抗氧化能力作用较弱。初步证实了桃叶珊瑚苷可能是通过刺激皮肤胶原蛋白的合成达到抗皮肤光老化的作用。
[1] Kerry Hughes. Functional Proteins and hydrolysates [J]. Prepared Foods, 2005,174(4):123-129.
[2] Martinez A W, Caves J M, Naik N, et al. Microablation of collagen-based substrates for soft tissue engineering [J]. Biomedical Materials, 2014,9(1):1-9.
[3] Rongtian Ma, Zhouyi Guo, Zhiming liu, et al. Raman spectroscopic study on the influence of ultraviolet-A radiation on collagen I [J]. Spectroscopy and Spectral Analysis. 2012,32(2):383-385.
[4] Yaobin Zou, Enmin Song, Renchao Jin. Age-dependent changes in skin surface assessed by a novel two-dimensional image analysis [J]. Skin Res. Technol, 2009,15(4):399-406.
[5] 郭洋静. 杜仲雄花中抗皮肤光老化活性成分的研究[D]. 开封,河南大学,2014.
[6] 刘承惶. 皮肤病理生理学[M]. 北京:中国医药科技出版社,2000:183.
[7] 赵华,广丰. 抗衰老化妆品的功效性[J].中国化妆品,2006,12:86-87.
[8] Peng X B,Li Q,Ou L N, et al.GC-MS, FT-IR analysis of black fungus polysaccharides and its inhibition against skin aging in mice [J]. Int J Biol Macromol, 2010,47(2):304-307.
[9] Tian Y,Zou B,Yang L,et al. High molecular weight Persimmon tannin ameliorates cognition deficits and attenuates oxidative damage in senescent mice induced by d-galactose[J]. Food Chem Toxicol,2011,49(8):1728-1736.
[10] Peterszegi G,Andres E,Molinari J. Effect of cellular aging on collagen biosynthesis:I. Methodological considerations and Pharmacological aPPlications [J].Arch Gerontol Geriatr,2008,47(3):356-367.
[11] 郭鲁义,李春雨,张宁,等. 实用光老化动物模型建立方法的探讨[J].中国美容医学 2008,17(2):235-237.
[12] 朱彦君,孟宇宏,冯光珍,等. 紫外线照射后无毛鼠皮肤胶原的变化及其定量分析 [J].中华医学美学美容杂 2005,11(3):159-162.
[责任编辑 李武营]
Study on the mechanism of anti-skin photoaging of aucubin
Henan University College Pharmacy, Henan Kaifeng 475004, China
〔Objective〕The anti-skin photoaging effects of aucubin(AU) were investigated in this paper.〔Methods〕 The anti-photoaging effects of AU were investigated using a skin photoaging model, which was prepared using an ultraviolet UVA and UVB light source to irradiate the back skin of mice. Sixty rats were randomly divided into the following groups: normal, model, vitamin E (VE), high (10 mg/100 mL), middle (5 mg/100 mL), and low (0.5 mg/100 mL) dose of AU . Except the normal group, each group was irradiated with UVA and UVB light to simulate skin photoaging, and was administered medicine externally daily for 8 weeks. After 8 weeks, these animals were sacrificed, and the back skin tissue was removed. Dermal structure was observed using skin staining with hematoxylin and eosin (HE), and examined by light microscopy (100 magnification). Superoxide dismutase (SOD) activity, total antioxidant capacity (T-AOC), and malondialdehyde (MDA) content were detected by colorimetric assay. Finally, the hydroxyproline (HYP) content and the content of collagen I was detected by amino acid analyzer and enzyme-linkedimmunosorbent assay (ELISA), respectively.〔Results〕Compared with model group, the epidermal structure of high doses of AU groups were complete, and the cell layer was relatively clear. The contents of collagen fiber was abundantly and arranged appropriately in dermis; Compared with model group, the activities of SOD、T-AOC and MDA in AU groups was not significantly different, the content of HYP、Collagen I and total amino acids of the high dose AU groups significantly increased, even nearly recovered to the normal level.〔Conclusion〕AU can ameliorate skin photoaging by promoting the synthesis of collagen.
aucubin; anti-skin photoaging; collagen I
1672-7606(2016)04-0244-05
2016-10-11
河南省教育厅科学技术研究重点项目(15A360013)
胡倩影(1989-),女,河南许昌人,研究生,从事中药延缓衰老作用研究工作。
丁艳霞(1974-),女,河南开封人,从事中药延缓衰老作用研究工作。
R285.5
A

