ATRP法均相改性纤维素的研究进展
卢生昌, 巫龙辉, 林新兴, 吴 慧, 黄六莲, 陈礼辉*
(福建农林大学 材料工程学院,福州 350002)
ATRP法均相改性纤维素的研究进展
卢生昌, 巫龙辉, 林新兴, 吴 慧, 黄六莲, 陈礼辉*
(福建农林大学 材料工程学院,福州 350002)
综述了均相条件下基于原子转移自由基聚合(ATRP)法对纤维素接枝不同聚合物单体的研究进展。重点介绍了纤维素接枝共聚物的制备方法和分子结构,同时详细阐述了其分子自组装行为、温度和pH敏感性、抗菌性等性能,以及其在化学、生物和医药等方面的应用。
ATRP;纤维素;均相改性
纤维素是世界上蕴藏量最丰富的天然高分子化合物,具有生物可降解性、高强度和高热稳定性,对纤维素进行物理或者化学改性,可以赋予其良好的溶解性、耐折皱性、温敏性、pH响应性、热塑性和抗菌性等,制备出新颖性能的纤维素基材料[1-4]。近些年来,通过原子转移自由基聚合(Atom Transfer Radical Polymerization, ATRP)法(图1)对纤维素的接枝改性引起了科研工作者很大的兴趣[5],一方面该方法可实现对聚合反应的控制,另一方面,随着水相反应介质的研究和开发、新型AGET-ATRP技术的日趋改善及可见光―有机催化ATRP的发展,ATRP成为一种“绿色”的环境友好型聚合技术[6-8]。
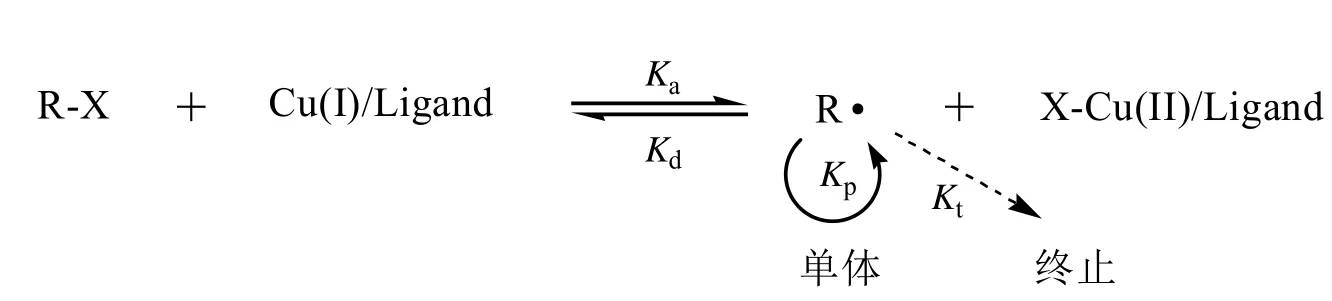
图1 ATRP原理示意图
1995年王锦山等[5]提出ATRP技术后,有大量工作对纤维素进行了均相和非均相接枝改性研究。非均相改性一般是溶剂或者反应试剂不能溶解纤维素,反应试剂只对纸[9]、纤维素膜[10]、纳米晶纤维素[11]等纤维素基材的表面进行改性。而对于均相改性而言,纤维素溶解在NMMO、LiCl/DMAc或者离子液体等溶剂中,与反应试剂进行分子级别的接触,不仅可以制备多官能团的新颖纤维素衍生物,也可以帮助我们更好的理解纤维素的性质以及溶剂与大分子的相互作用[12]。
本文以纤维素接枝不同类型的聚合物单体分类,概述了均相条件下基于ATRP法对纤维素改性的研究。
1 丙烯酸酯类
丙烯酸酯类单体是一类重要的有机化工原料。近些年来,使用该类单体基于ATRP法均相改性纤维素被广泛研究和应用,制备的纤维素接枝聚合物具有良好热稳定性、pH值响应性以及新奇自组装形貌,在生物、药物传送释放等方面具有潜在应用。
1-烯丙基-3-甲基咪唑氯盐(AMIMCl)、1-丁基-3-甲基咪唑氯盐(BMIMCl)等离子液体能很好的溶解纤维素[13]。该绿色溶剂丰富了均相改性纤维素溶剂的种类,为均相改性纤维素开辟了新的途径。Lin等[14]报道了以离子液体BMIMCl为反应溶剂,使用氯乙酰氯制备取代度(DS)为1.8的Cell-Cl大分子引发剂。将甲基丙烯酸甲酯(MMA)与纤维素大分子引发剂进行接枝反应,制备了分子量分布指数(DM)为
1.5~1.8的接枝聚合物Cell-g-PMMA。随后Xin等[15]以离子液体AMIMCl作为反应溶剂,在均相条件下与2-溴异丁酰溴(BrBiB)反应制备大分子引发剂Cell-BiB(DSBr=0.7),将MMA与其接枝反应制备了单体转化率高达37.8%的Cell-g-PMMA(DM=1.4~1.65)。所得到的接枝共聚物Cell-g-PMMA表现出良好的热稳定性,并且在丙酮中聚集自组装成直径为100 nm的球形颗粒。Zhong等[16]采用AGET-ATRP的方法,以四甲基乙二胺(TEMED)作为配体和溴化铜(CuBr2)为催化剂,抗坏血酸(VC)为还原剂,成功制备聚合物Cell-g-PMMA(DM=1.4~1.6)。
由于纤维素很难溶于普通溶剂中,可以首先对纤维素进行改性,得到醋酸纤维素(CA)、羟丙基纤维素(HPC)、乙基纤维素(EC)或者羟乙基纤维素(HEC)等,使其能够溶于一般溶剂中,实现对纤维素在普通溶剂中的接枝聚合。Shen等[17]报道在均相条件下通过ATRP方法对二醋酸纤维素(CDA)进行改性。他们以吡啶作为缚酸剂,THF作为溶剂,将CDA和BrBiB合成大分子引发剂CDA-Br(DSBr=0.43),然后利用N,N,N’,N’,N”-五甲基二亚乙基三胺(PMDETA)作为配体和溴化亚铜(CuBr)为催化剂,1,4-二氧六环作为溶剂,将MMA与CDA接枝聚合制备了CDA-g-PMMA,其实验路线如图2所示。动力学研究表明该聚合反应是可控的,PMMA侧链具有较低的多分散性(DM=1.37~1.45)。Yamanaka等[18]采用ATRP法将醋酸纤维素(CA)与MMA聚合,制备了共聚物CA-g-PMMA,该共聚物制备的膜材料经力学拉伸后会产生光学各向异性现象。

图2 ATRP法合成CDA-g-PMMA示意图[17]
鉴于羟丙基纤维素(HPC)具有良好的生物相容性且树枝状的结构特征,在生物技术的应用方面有着很大的潜力[19]。Ostmark等[20]通过ATRP法,首先用2-溴异丁酰二酸酐与HPC反应制备大分子引发剂,然后以PMDETA和CuBr为催化体系,甲苯作为溶剂,将MMA与HPC接枝聚合制备了共聚物HPC-g-PMMA(图3),研究发现纳米梳状共聚物的树枝化程度对其流变特性具有一定的影响。

图3 ATRP法合成HPC-g-PMMA示意图[20]
由于接枝密度和侧链长度的影响,纤维素接枝共聚物可以在溶液中自组装形成新奇的形貌。Kang等[21]以甲苯/环己酮为溶剂体系,将丙烯酸叔丁酯(t-BA)接枝到乙基纤维素上,成功制备了EC-g-PtBA,该接枝共聚物经水解可以得到两亲性接枝共聚物EC-g-PAA,研究表明该水解产物在浓度为1.0 mg/mL的水溶液(pH=10)中可自组装为直径5~10 nm的胶束或颗粒。随后,Liu等[22]通过激光散射仪(LLS)和原子力显微镜(AFM)又进一步研究了接枝密度和侧链长度对EC-g-PAA分子构象的影响。从图4可以看出,接枝密度较大的共聚物链通过棒状构象产生棒状聚集体,而相对稀疏的共聚物链通过线圈状构象产生盘状聚集体。

图4 EC-g-PA的分子构象和单链结构[22]
相比于使用单体MMA及t-BA制备的纤维素接枝共聚物具有新奇形貌,PDMAEMA接枝的纤维素共聚物具有pH响应行为。Sui等[23]以2,2-联吡啶(bpy)和CuBr为催化体系,DMF作为溶剂体系,将甲基丙烯酸二甲氨基乙酯(DMAEMA)与纤维素接枝制备了共聚物Cell-g-PDMAEMA。该接枝共聚物可以完全溶解在pH=2的酸性溶液中,但在pH=12的碱性溶液中由于胺基的去质子化而从溶液中沉淀出来。Cell-g-PDMAEMA在生物医学和生物技术中具有很大的应用潜力。鉴于单体DMAEMA难以溶解在AMIMCl中,Tang等[24]在AMIMCl中加入一定量的乙醇以改善其溶解性,以PMDETA/CuBr为催化体系,成功制备具有pH响应行为的接枝共聚物Cell-g-PDMAEMA。随后,Wang等[25]将DMAEMA与EC反应制备了对pH值在6~6.9敏感的接枝共聚物EC-g-PDMAEMA。如图5所示,当pH<6时,胶束外壳的PDEAEMA链质子化,胶束的形貌不随pH值变化;在pH为6~6.9范围内,PDEAEMA侧链去质子化,胶束半径减少;当pH>6.9时,胶束出现聚集现象。并且载有利福平(RIF)的EC-g-PDMAEMA胶束在药物传输释放方面具有良好的可控性和pH值响应性。r
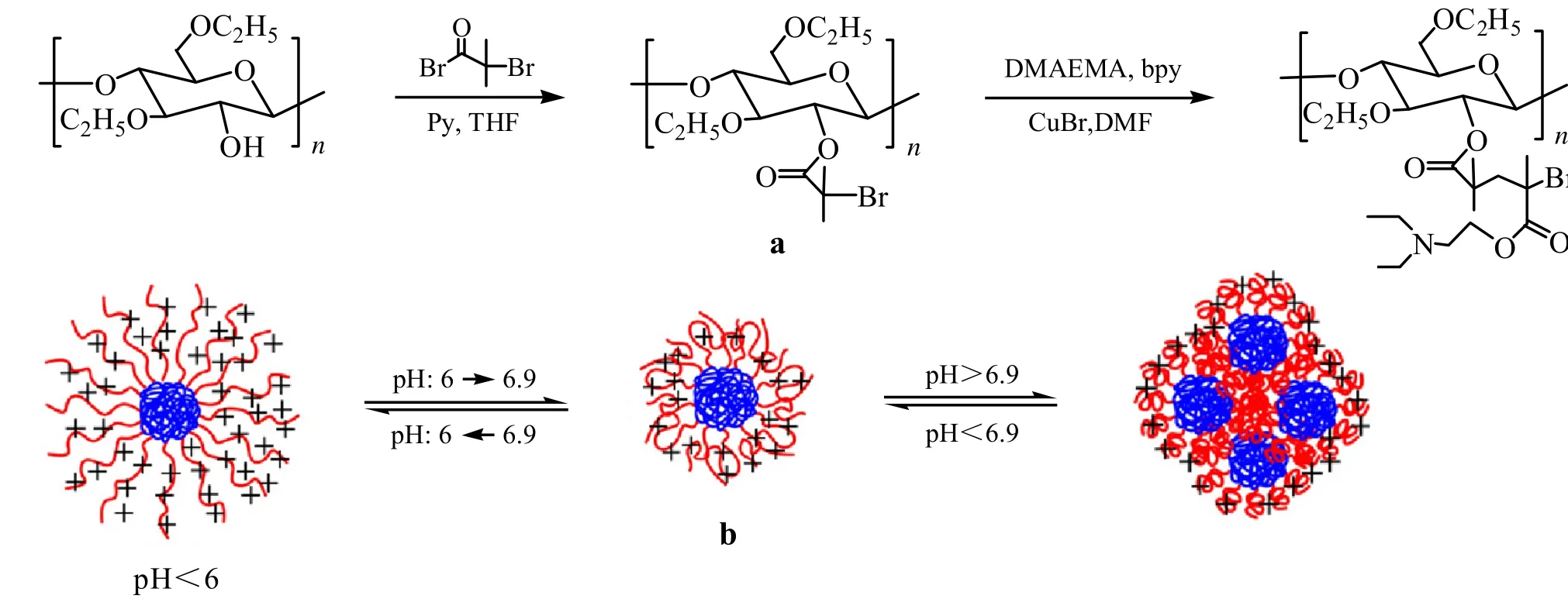
图5 (a)共聚物EC-g-PDMAEMA的合成,(b)胶束的pH响应示意图[25]
2 丙烯酰胺类
将丙烯酰胺类单体接枝于纤维素,可得到对DNA和蛋白质具有分离性能和温敏性的接枝共聚物。
羟乙基纤维素(HEC)和线性聚丙烯酰胺(L-PAM)对DNA片段有着良好筛分功能。Yang等[26]采用ATRP的方法,以DMF/THF为溶剂体系,CuBr/CuBr2/四氮杂十四元大环冠醚配体(Me6[14]aneN4)作为催化体系,在均相条件下对HEC改性,制备了分子量可控的接枝共聚物HEC-g-PAM。该共聚物的HEC链能够稳定地吸附于石英毛细管壁(图6a),很好地消除电渗流,可对双链DNA片段进行分离。随着HEC-g-PAM浓度的增加分离效果更佳;0.5%(w/V)浓度的共聚物溶液只能分离10个片段(图6b);当浓度增加到1.5%(w/V)时,含271和281个碱基对(bp)的DNA小片段被很明显地分开,并且成功分离出11个片段(图6c)。由于HEC-g-PAM具有良好的流变行为及抑制电渗流的能力,该接枝共聚物在毛细管电泳方面(如生物分子的分离)具有应用前景。
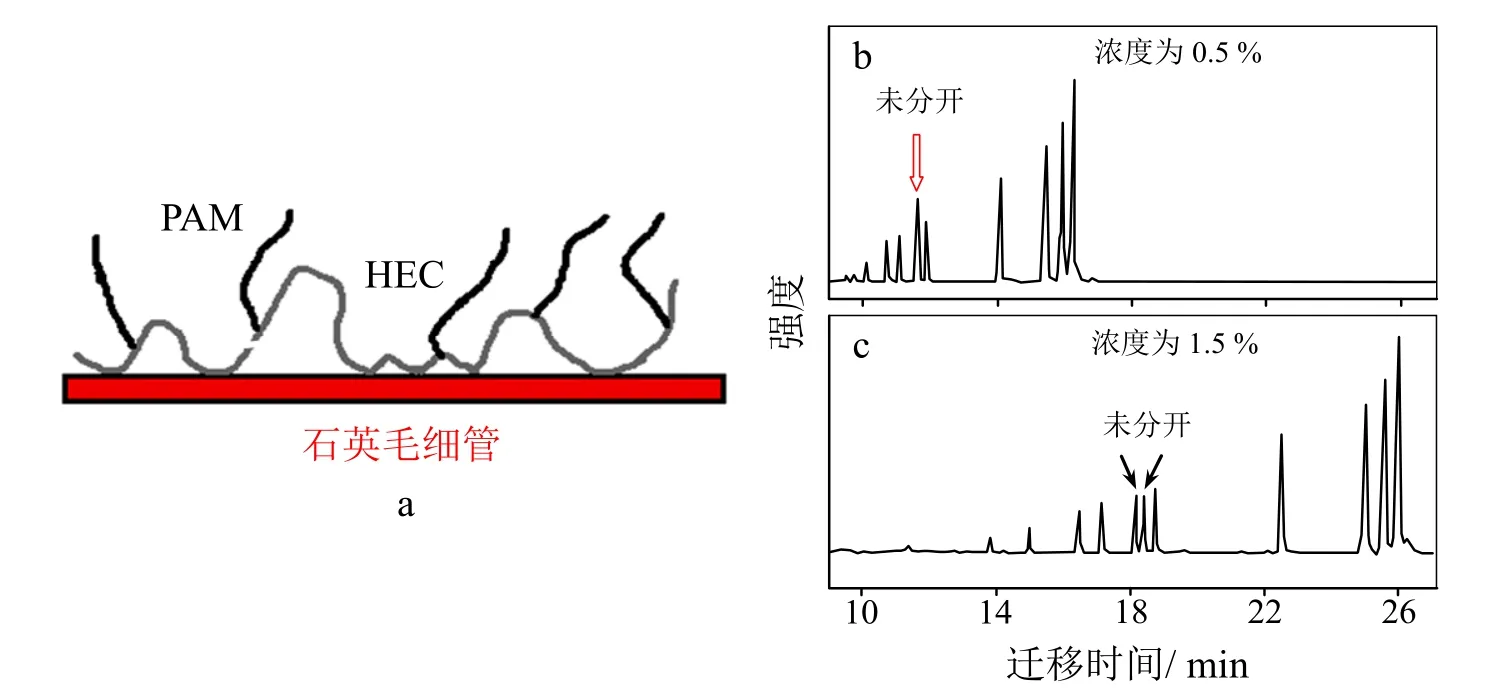
图6 HEC-g-PAM吸附于毛细管壁的示意图(a)及不同浓度的HEC-g-PAM溶液对DNA片段的分离[26]
随后,Yang等[27]以DMF/甲苯为溶剂体系,CuBr/CuBr2/三(2-二甲氨基乙基)胺(Me6TREN)作为催化体系,将N,N-二甲基丙烯酰胺(DMA)与HEC反应,成功制备了HEC-g-PDMA。尽管该接枝共聚物的分子量分布指数DM略大、可控性欠佳,但具有HEC-g-PDMA涂层的毛细管,在pH=2.2~6.0区间内对蛋白质具有极高分离效率,在蛋白质组学的应用领域有着巨大潜力。
聚N-异丙基丙烯酰胺(PNIPAM)在水中的最低临界相转变温度(LCST)为32℃,是一种研究较多的温敏型聚合物[28-29]。Ifuku等[30]首次采用ATRP法对纤维素进行选择性改性。通过使用4-甲氧基三苯基氯甲烷对C-6位的羟基进行保护,然后再将其还原为羟基,成功的在C-6位置上接枝PNIPAM。从图7中Cell-6-O-PNIPAM的13C核磁图谱和相变情况可以看出,在42.3和42.5 ppm处的尖峰表明接枝位置具有特定选择性,同时Cell-6-O-PNIPAM也表现出很好的温敏特性。
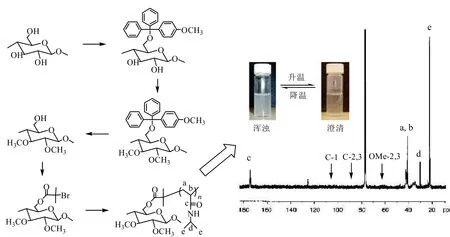
图7 共聚物Cell-6-O-PNIPAM的合成、13C核磁及其水溶液随温度相变图片[30]
鉴于羟丙基纤维素(HPC)的LCST一般在40~47℃温度区间内[31],NIPAM的LCST为32℃,Xu等[32]通过ATRP法将NIPAM与HPC接枝聚合,制备了LCST可调的HPC-g-PNIPAM。通过控制反应时间,可以合成不同接枝密度HPC-g-PNIPAM(图8)。该梳齿状的接枝共聚物的LCST具有可控性,可调节其低于人体温度。并且噻唑蓝(MTT,一种黄颜色的染料)比色实验表明HPC-g-PNIPAM可降低HEK293细胞株的毒性。HPC-g-PNIPAM与HPC交联的水凝胶(HPN)比单一的HPC水凝胶具有更好的孔隙结构和更高的肿胀率,在37℃条件下可以长期持续释放大分子药物,LCST可控的多孔智能水凝胶在生物医学领域具有潜在应用。随后,Cui等[33]利用ATRP技术,以DMF/H2O为溶剂,CuCl/Me6TREN为催化体系,将NIPAM与纤维素接枝共聚,制备了Cell-g-PNIPAM。该共聚物与Eu3+螯合之后表现出很好的温敏性和荧光性,可进一步拓展纤维素材料应用领域。

图8 HPN水凝胶的形成示意图[32]
3 苯乙烯单体
苯乙烯单体(S)与纤维素接枝共聚,得到的共聚物可以自组装成不同形貌的聚集体。2005年,Huang等[34]首次采用ATRP法将苯乙烯(S)与EC接枝共聚。该研究以甲苯为溶剂,PMDETA和CuBr为催化体系,制备了分子量分布指数DM为1.35的共聚物EC-g-PS,其动力学研究表明接枝聚合可控。由于在甲苯溶液中PS侧链之间的排斥力较强,从而导致EC骨架的扩展,可形成如图9a所示的刚性结构。随后,Huang等[35-36]经过进一步研究,制备了不同侧链长度的共聚物EC-g-PS。该共聚物在低浓度丙酮溶液中分散成为单分子颗粒,在较高浓度中则自组装成为胶束。通过TEM观察,在高浓度丙酮溶液(2.5×10-5g/g)中EC-g-PS胶束的直径为200~300 nm(图9b),并且具有核―壳结构(图9c),壳的厚度约为30 nm。由于丙酮是EC的良溶剂而是聚苯乙烯的劣溶剂,因此在胶束中EC主链形成外壳,而PS侧链形成内核。

图9 EC-g-PS在0.01%的甲苯溶液的AFM图像(a)和EC-g-PS在浓度为2.5×10-5g/g的丙酮溶液形成核―壳球体的TEM图像(b, c)[34-36]
Yagi等[37]选取不同聚合度(DP=20、50、250)的纤维素为原材料,将氯乙酰胺(CAA)引入纤维素的还原性末端制备大分子引发剂,然后以LiCl/DMAc为溶剂,PMDETA和CuBr为催化体系,与苯乙烯(S)聚合制备了Cell-g-PS。色谱及动力学分析表明,该方法较适合于高分子量纤维素制备分子量分布较窄的聚合物Cell-g-PS。
4 4-乙烯基吡啶单体
4-乙烯基吡啶单体(4VP)与纤维素接枝的共聚物,具有pH响应性能。聚4-乙烯基吡啶(P4VP)在pH<5的质子化状态下呈亲水性,在pH>5的去质子化状态下呈疏水性并从溶液中沉淀析出[38],可将其用于纤维素的改性,制备pH敏感材料[39]。
Ma等[40]通过ATRP法,以THF为溶剂,CuCl/Me6TREN为催化体系,将4VP与HPC接枝共聚,制备了具有pH和温度敏感特性的共聚物HPC-g-P4VP。研究发现,当pH升至P4VP侧链的pKa(~5)时,侧链折叠形成胶束的内核;而HPC形成外壳,起稳定胶束的作用。当加热至47℃时,HPC骨架折叠到内芯而P4VP侧链形成外壳。HPC-g-P4VP共聚物在水溶液中的浊点取决于侧链的长度和接枝密度;侧链越长,有较高亲水性的P4VP使其浊点更高。对于较短侧链的共聚物,浊点还取决于pH值,即较低pH值时具有更高的浊点(图10)。
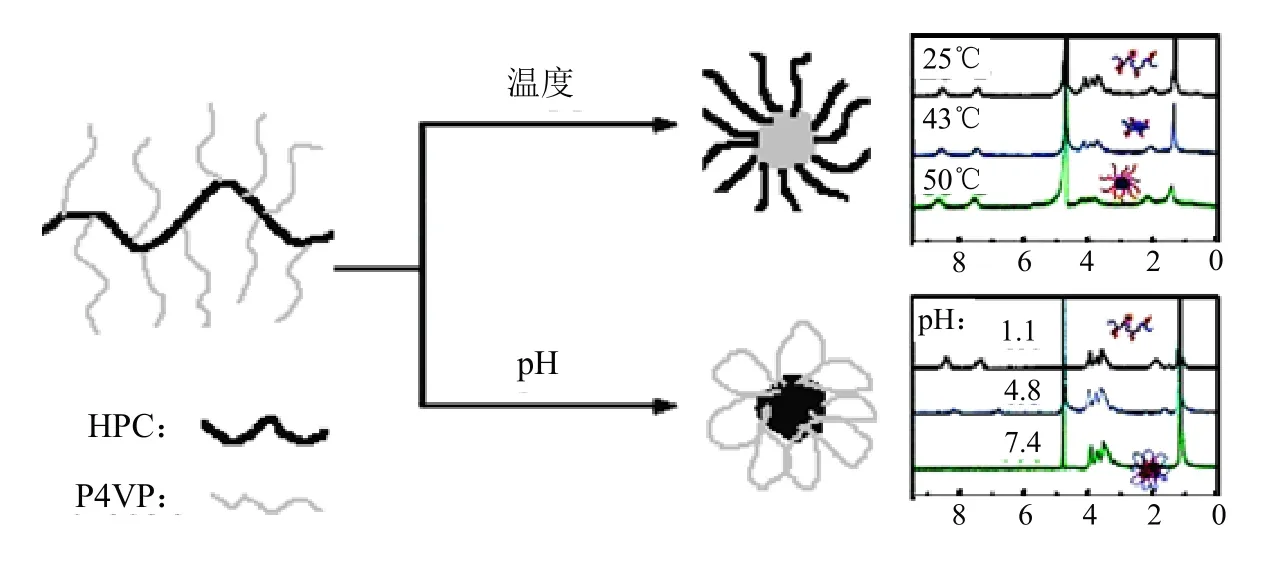
图10 HPC-g-P4VP的温度和pH响应示意图[40]
5 异戊二烯单体
采用ATRP技术,均相条件下将纤维素和异戊二烯单体(Ⅰ)进行反应可制备具有一定疏水性能的共聚物Cell-g-PI[41]。随着PI侧链的增长,接触角可达102.5°。该共聚物可在水中自组装形成直径为200 nm的核―壳结构的纳米粒子(图11),在药物释放等生物医学领域有着潜在应用。
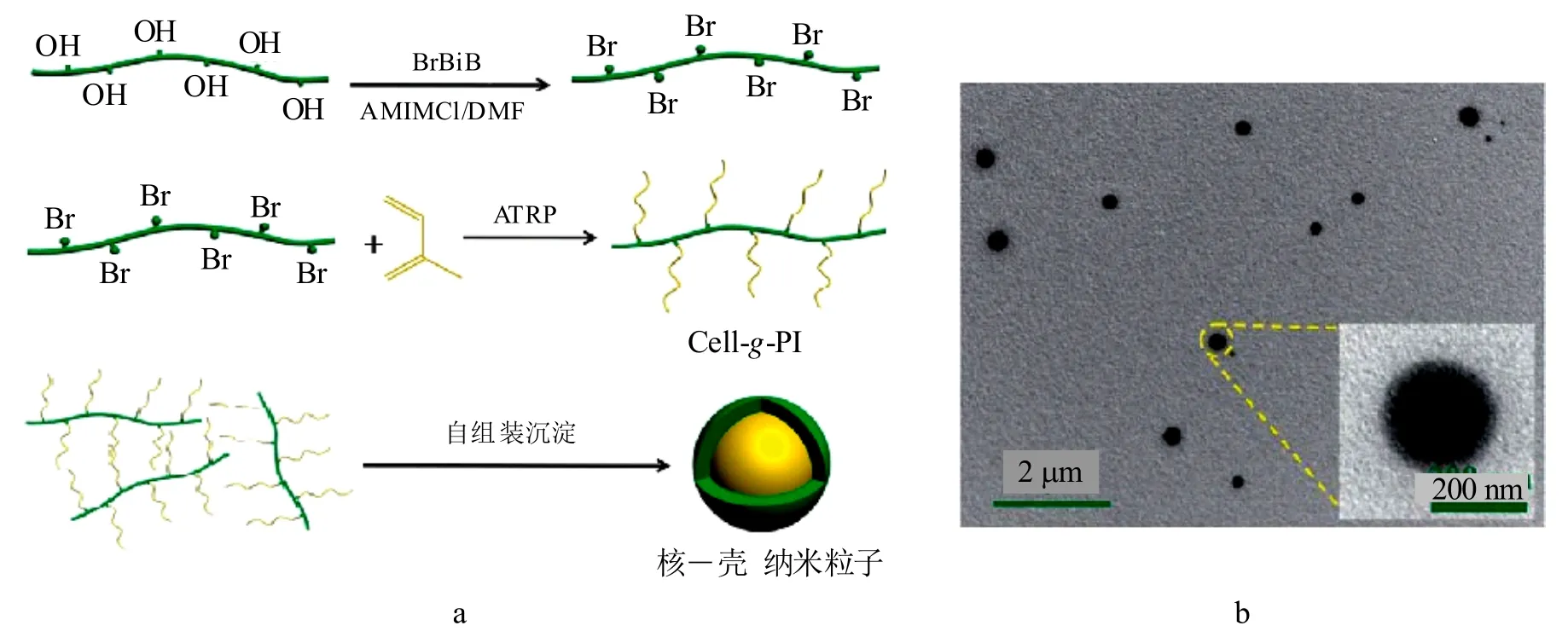
图11 共聚物Cell-g-PI的合成、自组装核-壳纳米粒子的示意图(a)及其TEM图像(b)[41]
6 多种单体
随着ATRP技术的发展,接枝单体的种类日趋丰富。除了上述丙烯酸酯(AE)、丙烯酰胺(AM)、苯乙烯(S)、4-乙烯基吡啶(4VP)、异戊二烯(Ⅰ)等单一单体,多种单体也用来与纤维素进行接枝共聚,得到新颖的接枝嵌段共聚物,进一步拓宽了其应用领域。
Yan等[42]结合ATRP和开环聚合法(ROP)将ε- 己内酯(CL)和DMAEMA接枝于EC上,制备了共聚物EC-g-PDMAEMA-g-PCL。不同于其他的梳状共聚物,EC-g-PDMAEMA-g-PCL具有独特的拓扑结构,使其具有独特的物化性质和功能。如图12所示,这些具有生物相容性的共聚物可以在水溶液中的自组装成为胶束,随着体系pH值的变化单一胶束可以转化为聚集胶束。在水性介质中的微胶粒可以作为优异的药物载体来可控药物释放。
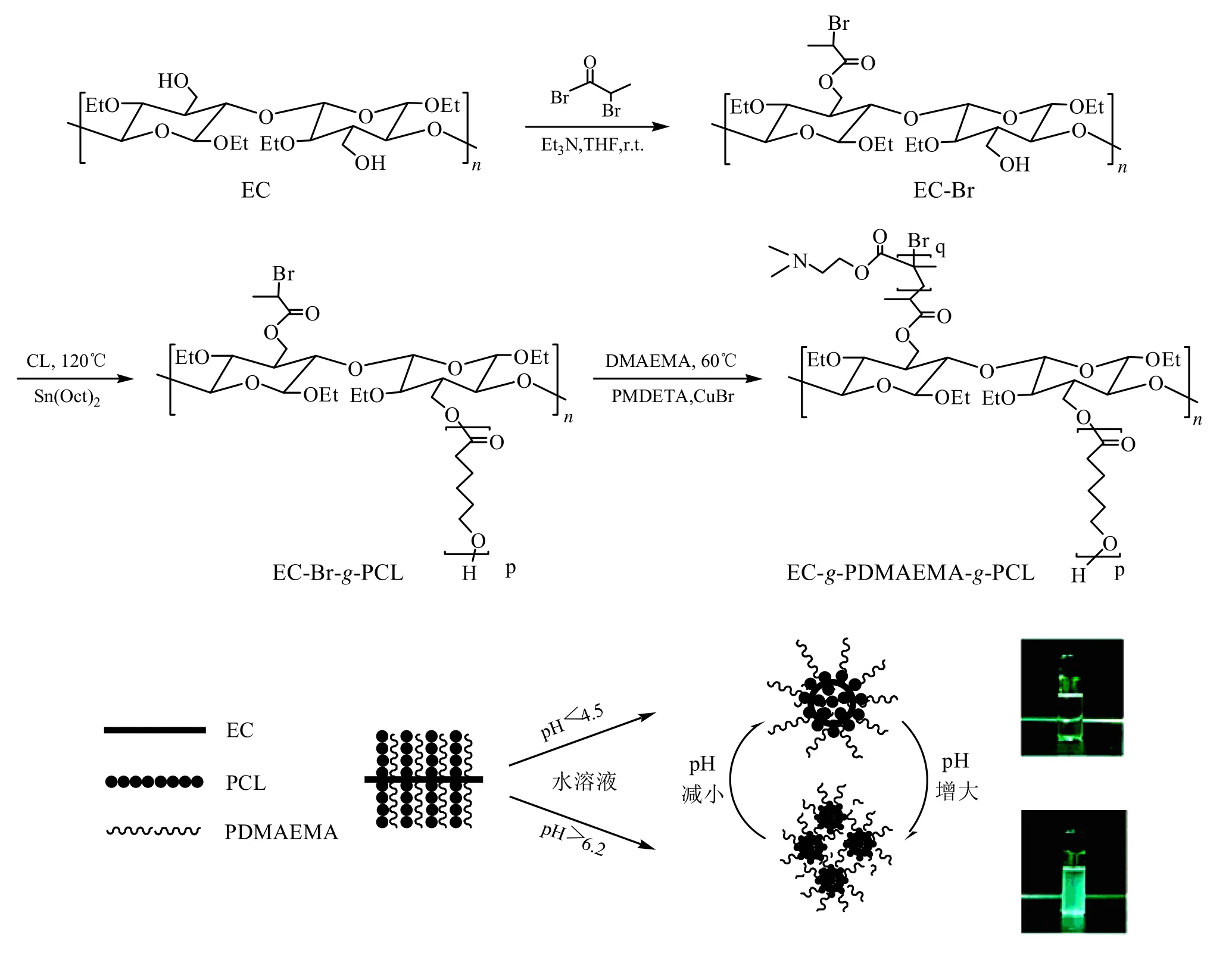
图12 通过ATRP和开环聚合法合成两亲性分子刷EC-g-PDMAEMA-g-PCL和pH诱导单胶束形成和多胶束聚集过程的示意图[42]
Berthier等[43]同样采用开环聚合和ATRP结合的方法,制备了具有核―壳结构两亲性的梳状共聚物。首先利用三甲基硅烷基对HPC的部分羟基进行保护,游离的羟基用来引发与L-丙交酯(LLA)进行开环聚合,然后具有疏水性的PLLA端链经溴取代后与丙烯酸叔丁酯(t-BA)进行反应产生HPC-g-PLLA-b-PtBA。该共聚物的PtBA端基可水解为亲水性的PAA基团,得到两亲性的共聚物HPC-g-PLLA-b-PAA。用其制备的HPC-g-PLLA-b-PAA颗粒在ROMASCONE(一种香料)的溶液中会出现出明显的膨胀,有效降低ROMASCONE的挥发速率。因此可将其应用于高乙醇含量的香水中,有效的控制香味的释放。
Yuan等[44]采用ATRP法,以无水甲苯为溶剂,CuBr/PMDETA为催化体系,将2-(甲氧基乙氧基)乙酯(MEO2MA)和DMAEMA接枝于EC上,制备了两亲性共聚物EC-g-P(MEO2MA-co-DMAEMA)。该共聚物自组装形成的胶束对温度和CO2具有双重响应性能(图13)。在药物控制释放方面,通过改变温度和通入溶液中CO2或Ar气的量,该共聚物胶束可以有效控制阿霉素(DOX)的释放。
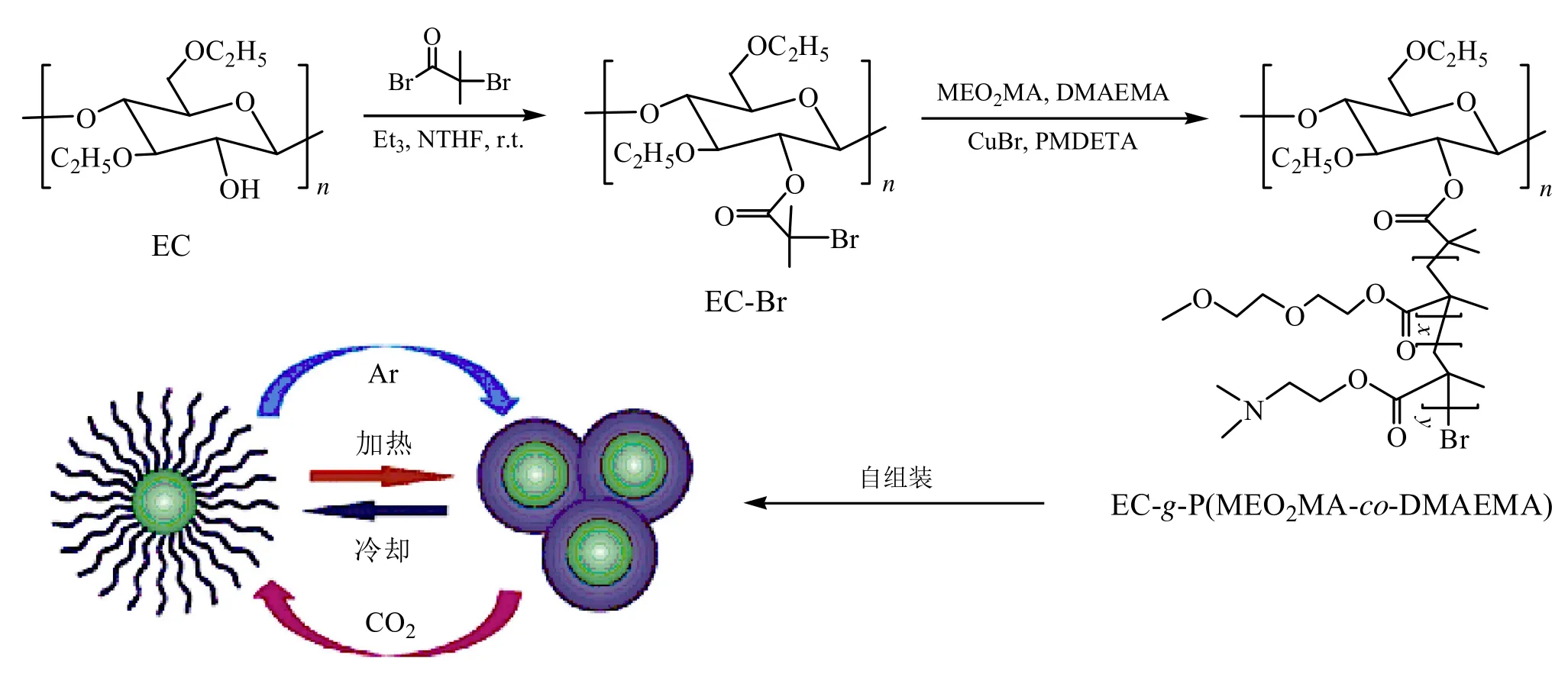
图13 ATRP法合成的共聚物EC-g-P(MEO2MA-co-DMAEMA)及其自组装胶束对热、CO2和Ar气的响应示意图[44]
4 展望
纤维素接枝共聚物材料由于具有抗菌、温敏、pH敏等功能特性,在化学、生物制药及基因工程等领域具有潜在应用前景。鉴于ATRP反应可控等优点,近十年以来采用ATRP法对纤维素进行接枝改性得到了迅猛发展。尽管用于ATRP法接枝的单体非常广泛,但目前仍存在一些挑战,诸如与(甲基)丙烯酸、4-乙烯基苯甲酸、磺酸等酸性单体及强配位的单体聚合,需要开发亲卤性更强的催化剂激化卤化物链端。同时,由于ATRP对无氧和过渡金属离子条件的限制,目前研究还主要在实验室开发阶段,工业化还需时日。随着ATRP技术的优化和成熟,如水相反应介质的开发[6]和应用及新型AGET-ATRP[7]和可见光―有机催化ATRP技术[8]的日趋改善,使得该技术更加环境友好,反应条件更加简便温和,应用领域更广阔。基于ATRP法合成的新型纤维素功能性材料将有望实现大规模工业化生产和应用[45]。
[1] Habibi Y. Key advances in the chemical modification of nanocelluloses[J]. Chemical Society Reviews, 2014, 43(5): 1519-1542.
[2] Joubert F, Musa O M, Hodgson D R W, et al. The preparation of graft copolymers of cellulose and cellulose derivatives using ATRP under homogeneous reaction conditions[J]. Chemical Society Reviews, 2014, 43(20): 7217-7235.
[3] Lin X, Ma W, Wu H, et al. Superhydrophobic magnetic poly(DOPAm-co-PFOEA)/Fe3O4/cellulose microspheres for stable liquid marbles[J]. Chemical Communications, 2016, 52(9): 1895-1898.
[4] Zhou X, Lin X, White K L, et al. Effect of the degree of substitution on the hydrophobicity of acetylated cellulose for production of liquid marbles[J]. Cellulose, 2016, 23(1): 811-821.
[5] Wang J-S, Matyjaszewski K. Controlled/“living” radical polymerization. Atom transfer radical polymerization in the presence of transition-metal complexes[J]. Journal of the American Chemical Society, 1995, 117(20): 5614-5615.
[6] Tsarevsky N V, Matyjaszewski K. “Green” atom transfer radical polymerization: From process design to preparation of well-defined environmentally friendly polymeric materials[J]. Chemical Reviews, 2007, 107(6): 2270-2299.
[7] Bai L, Zhang L, Cheng Z, et al. Activators generated by electron transfer for atom transfer radical polymerization: Recent advances in catalyst and polymer chemistry[J]. Polymer Chemistry, 2012, 3(10): 2685-2697.
[8] Theriot J C, Lim C-H, Yang H, et al. Organocatalyzed atom transfer radical polymerization driven by visible light[J]. Science, 2016, 352(6289): 1082-1086.
[9] Larsson E, Pendergraph S A, Kaldeus T, et al. Cellulose grafting by photoinduced controlled radical polymerisation[J]. Polymer Chemistry, 2015, 6(10): 1865-1874.
[10] Liu Z, Du H, Wickramasinghe S R, et al. Membrane surface engineering for protein separations: Experiments and simulations[J]. Langmuir, 2014, 30(35): 10651-10660.
[11] Zoppe J O, Xu X, Känel C, et al. Effect of surface charge on surface-initiated atom transfer radical polymerization from cellulose nanocrystals in aqueous media[J]. Biomacromolecules, 2016, 17(4): 1404-1413.
[12] 周金平, 甘蔚萍, 张俐娜. 均相体系中纤维素化学改性研究概述[J]. 中国科学:化学, 2012, 42(5): 591-605.
[13] Swatloski R P, Spear S K, Holbrey J D, et al. Dissolution of cellose with ionic liquids[J]. Journal of the American Chemical Society, 2002, 124(18): 4974-4975.
[14] Lin C X, Zhan H Y, Liu M H, et al. Preparation of cellulose graft poly(methyl methacrylate) copolymers by atom transfer radical polymerization in an ionic liquid[J]. Carbohydrate Polymers, 2009, 78(3): 432-438.
[15] Xin T T, Yuan T, Xiao S, et al. Synthesis of cellulose-graft-poly(methyl methacrylate) via homogeneous ATRP[J]. Bioresources, 2011, 6(3): 2941-2953.
[16] Zhong J F, Chai X S, Fu S Y. Homogeneous grafting poly(methyl methacrylate) on cellulose by atom transfer radical polymerization[J]. Carbohydrate Polymers, 2012, 87(2): 1869-1873.
[17] Shen D W, Yong H. The synthesis of CDA-g-PMMA copolymers through atom transfer radical polymerization[J]. Polymer, 2004, 45(21): 7091-7097.
[18] Yamanaka H, Teramoto Y, Nishio Y. Orientation and birefringence compensation of trunk and graft chains in drawn films of cellulose acetate-graft-PMMA synthesized by ATRP[J]. Macromolecules, 2013, 46(8): 3074-3083.
[19] Roy D, Semsarilar M, Guthrie J T, et al. Cellulose modification by polymer grafting: A review[J]. Chemical Society Reviews, 2009, 38(7): 2046-2064.
[20] Ostmark E, Harrisson S, Wooley K L, et al. Comb polymers prepared by ATRP from hydroxypropyl cellulose[J]. Biomacromolecules, 2007, 8(4): 1138-1148.
[21] Kang H, Liu W, He B, et al. Synthesis of amphiphilic ethyl cellulose grafting poly(acrylic acid) copolymers and their self-assembly morphologies in water[J]. Polymer, 2006, 47(23): 7927-7934.
[22] Liu W, Liu Y, Zeng G, et al. Coil-to-rod conformational transition and single chain structure of graft copolymer by tuning the graft density[J]. Polymer, 2012, 53(4): 1005-1014.
[23] Sui X, Yuan J, Zhou M, et al. Synthesis of cellulose-graft-poly(N,N-dimethylamino-2-ethyl methacrylate) copolymers via homogeneous ATRP and their aggregates in aqueous media[J]. Biomacromolecules, 2008, 9(10): 2615-2620.
[24] Tang E, Du K, Feng X, et al. Controlled synthesis of cellulose-graft-poly 2-(diethylamino)-ethyl methacrylate by ATRP in ionic liquid AMIM Cl and its pH-responsive property[J]. European Polymer Journal, 2015, 66: 228-235.
[25] Wang D, Tan J, Kang H, et al. Synthesis, self-assembly and drug release behaviors of pH-responsive copolymers ethyl cellulose-graft-PDEAEMA through ATRP[J]. Carbohydrate Polymers, 2011, 84(1): 195-202.
[26] Yang R, Wang Y, Zhou D. Novel hydroxyethylcellulose-graft-poly acrylamide copolymer for separation of double-stranded DNA fragments by CE[J]. Electrophoresis, 2007, 28(18): 3223-3231.
[27] Yang R, Liu Y, Zheng C. Synthesis of hydroxyethylcellulose-graft-poly(N,N-dimethylacrylamide) copolymer by ATRP and as dynamic coating in capillary electrophoresis[J]. Journal of Applied Polymer Science, 2010, 116(6): 3468-3472.
[28] Schild H G. Poly(N-isopropylacrylamide): Experiment, theory and application[J]. Progress in Polymer Science, 1992, 17(2): 163-249.
[29] Lutz J-F, Akdemir O, Hoth A. Point by point comparison of two thermosensitive polymers exhibiting a similar LCST: Is the age of poly(NIPAM) over?[J]. Journal of the American Chemical Society, 2006, 128(40): 13046-13047.
[30] Ifuku S, Kadla J F. Preparation of a thermosensitive highly regioselective cellulose/N-isopropylacrylamide copolymer through atom transfer radical polymerization[J]. Biomacromolecules, 2008, 9(11): 3308-3313.
[31] Schagerlof H, Richardson S, Momcilovic D, et al. Characterization of chemical substitution of hydroxypropyl cellulose using enzymatic degradation[J]. Biomacromolecules, 2006, 7(1): 80-85.
[32] Xu F J, Zhu Y, Liu F S. Comb-shaped conjugates comprising hydroxypropyl cellulose backbones and low-molecular-weight poly(N-isopropylacryamide) side chains for smart hydrogels: Synthesis, characterization, and biomedical applications[J]. Bioconjugate Chemistry, 2010, 21(3): 456-464.
[33] Cui G, Li Y, Shi T, et al. Synthesis and characterization of Eu(Ⅲ) complexes of modified cellulose and poly(N-isopropylacrylamide)[J]. Carbohydrate Polymers, 2013, 94(1): 77-81.
[34] Shen D, Yu H, Huang Y. Densely grafting copolymers of ethyl cellulose through atom transfer radical polymerization[J]. Journal of Polymer Science Part A Polymer Chemistry, 2005, 43(18): 4099-4108.
[35] Shen D, Yu H, Huang Y. Synthesis of graft copolymer of ethyl cellulose through living polymerization and its self-assembly[J]. Cellulose, 2006, 13(3): 235-244.
[36] Liu W, Liu R, Li Y, et al. Self-assembly of ethyl cellulose-graft-polystyrene copolymers in acetone[J]. Polymer, 2009, 50(1): 211-217.
[37] Yagi S, Kasuya N, Fukuda K. Synthesis and characterization of cellulose-b-polystyrene[J]. Polymer Journal, 2010, 42(4): 342-348.
[38] Shen H, Zhang L, Eisenberg A. Multiple ph-induced morphological changes in aggregates of polystyrene-block-poly (4-vinylpyridine) in DMF/H2O mixtures[J]. Journal of the American Chemical Society, 1999, 121(12): 2728-2740.
[39] Kan K H, Li J, Wijesekera K, et al. Polymer-grafted cellulose nanocrystals as pH-responsive reversible flocculants[J]. Biomacromolecules, 2013, 14(9): 3130-3139.
[40] Ma L, Kang H, Liu R, et al. Smart assembly behaviors of hydroxypropylcellulose-graft-poly(4-vinyl pyridine) copolymers in aqueous solution by thermo and pH stimuli[J]. Langmuir, 2010, 26(23): 18519-18525.
[41] Wang Z, Zhang Y, Jiang F, et al. Synthesis and characterization of designed cellulose-graft-polyisoprene copolymers[J]. Polym Chem, 2014, 5(10): 3379-3388.
[42] Yan Q, Yuan J, Zhang F, et al. Cellulose-based dual graft molecular brushes as potential drug nanocarriers: Stimulus-responsive micelles, self-assembled phase transition behavior, and tunable crystalline morphologies[J]. Biomacromolecules, 2009, 10(8): 2033-2042.
[43] Berthier D L, Herrmann A, Ouali L. Synthesis of hydroxypropyl cellulose derivatives modified with amphiphilic diblock copolymer side-chains for the slow release of volatile molecules[J]. Polym Chem, 2011, 9(9): 2093-2101.
[44] Yuan W, Zou H, Shen J. Amphiphilic graft copolymers with ethyl cellulose backbone: Synthesis, self-assembly and tunable temperature-CO2response[J]. Carbohydrate Polymers, 2016, 136: 216-223.
[45] Matyjaszewski K, Tsarevsky N V. Macromolecular engineering by atom transfer radical polymerization[J]. Journal of the American Chemical Society, 2014, 136(30): 6513-6533.
Progress in Cellulose Modification under Homogeneous Reaction Condition via ATRP
LU Sheng-chang, WU Long-hui, LIN Xin-xing, WU Hui, HUANG Liu-liang, CHEN Li-hui*
(College of Material Engineering, Fujian Agriculture and Forestry University, Fuzhou 350002, China)
The progress in cellulose modification using various monomers under homogenenous conditions via atom transfer radical polymerization (ATRP) was reviewed in this paper. The preparation, structure, properties of self-assembly, temperature or pH-response, and antibacterial, as well as applications of cellulose-based materials in chemicals, medicine, and biology was summarized.
ATRP; cellulose; homogeneous modification
O636.11
A
1004-8405(2016)04-0056-12
10.16561/j.cnki.xws.2016.04.07
2016-06-03
国家自然科学基金资助项目(31470598);闽江学者奖励计划(KXNAD002A);福建农林大学校杰出青年科研人才培养专项基金项目(xjq201421)。
卢生昌(1990~),男,硕士研究生;研究方向:纤维素功能化改性研究。
* 通讯作者:陈礼辉(1966~),博士,教授,博士生导师;研究方向:植物资源化学与新材料。wuhui@fafu.edu.cn

